石墨相氮化碳的红外辅助微波法制备及光催化固氮性能
2016-12-21曹宇辉佟宇飞李法云范志平胡绍争
曹宇辉, 佟宇飞, 张 健, 李法云, 范志平, 白 金, 毛 微, 胡绍争
(辽宁石油化工大学化学化工与环境学部, 抚顺 113001)
石墨相氮化碳的红外辅助微波法制备及光催化固氮性能
曹宇辉, 佟宇飞, 张 健, 李法云, 范志平, 白 金, 毛 微, 胡绍争
(辽宁石油化工大学化学化工与环境学部, 抚顺 113001)
采用红外辅助微波法制备了可见光下具有优越固氮性能的石墨相氮化碳催化剂(g-C3N4). 采用X射线衍射(XRD)、 扫描电子显微镜(SEM)、 透射电子显微镜(TEM)、 氮气吸附、 紫外-可见光谱(UV-Vis)、 荧光光谱(PL)、 N2-程序升温脱附(TPD)和电子顺磁共振谱(EPR)等对催化剂进行了表征. 结果表明, 微波处理在催化剂表面形成许多孔状结构, 增大了催化剂的比表面积, 抑制了催化剂光生电子-空穴的复合; 微波处理还会产生大量氮空穴, 这些氮空穴一方面可以吸附并活化氮气分子, 另一方面可提升电荷从催化剂到氮气分子的界面转移能力, 显著提高催化剂的光催化固氮性能. 采用红外辅助微波法制备的g-C3N4催化剂比采用单纯微波法制备的催化剂具有更多的氮空穴, 表现出更高的光催化固氮性能.
红外辅助微波法; 石墨相氮化碳; 固氮; 氮空穴; 光催化

近年来, 石墨型氮化碳(g-C3N4)由于具有优异的化学稳定性和独特的电子能带结构而被广泛应用于光催化[7]、 燃料电池[8]、 有机合成[9]和储气[10]等领域. 通常, 双氰胺或三聚氰胺等原料在500~550 ℃下发生缩聚反应能得到g-C3N4. 此高温焙烧过程导致生成的g-C3N4团聚严重, 比表面积较低, 而比表面积的大小对催化剂性能将起到至关重要的作用. 微波加热依靠物体吸收微波能并将其转换成热能,不须任何热传导过程就能使物料内外部同时升温. 本文采用红外辅助微波法制备了g-C3N4催化剂. 结果表明, 微波处理会在催化剂表面形成许多孔状结构, 显著提高了催化剂的比表面积; 此外, 微波处理会在催化剂表面产生大量氮空穴. 本文还探讨了氮空穴对催化剂结构性质、 光学性质以及光催化固氮性能的影响.
1 实验部分
1.1 试剂与仪器
所用试剂均为分析纯, 购自天津化学试剂厂. 所有水溶液均用去离子水配制.
XRD-7000 X型射线衍射仪(日本岛津公司), 辐射源CuKα1, 工作电压40 kV, 工作电流30 mA; ASAP 2010型物理吸附仪(美国Micrometrics公司), 测试前, 样品先于350 ℃下真空脱气处理10 h, 样品的比表面积通过Brunauer-Emmett-Teller(BET)方法求得; JSM 5600LV型扫描电子显微镜(SEM, 日本电子有限公司); Philips Tecnai G220型高倍透射电子显微镜(HRTEM, 美国FEI公司); EMX-220型电子顺磁共振仪(EPR, 美国Bruker公司); CHEMBET-3000程序升温脱附仪(TPD, 美国康塔仪器公司); Elan6100DRC型ICP-MS电感耦合等离子体质谱仪(ICP, 美国Perkin Elmer公司); UV-550型紫外-可见光谱仪(UV-Vis, 日本JASCA公司); FP-6300型荧光分光光度计(日本分光公司), 以Xe灯为激发光源; CHI 618C型电化学分析仪(上海辰华仪器有限公司), 以500 W氙灯为光源, 铂片为对电极, Ag/AgCl为参比电极, 1.0 mol/L Na2SO4为电解液.
1.2 催化剂的制备
将6 g硫脲用研钵研磨30 min后转入25 mL坩埚中. 将此坩埚放入200 mL大坩埚中, 并用微波吸收材料CuO粉末填满大坩埚. 将大坩埚放入微波炉(格兰仕 G70D20CN1P-D2)中, 红外辅助微波处理20~40 min(输入功率0.8 kW/h), 得到的催化剂命名为IM-CN(x),x表示微波处理时间(min). 重复上述操作, 在单纯微波下处理15~30 min, 输入功率1.0 kW/h, 得到的催化剂命名为M-CN(x),x表示微波处理时间(min). 此外, 采用传统焙烧法将硫脲直接在520 ℃下焙烧2 h, 升温速率5 ℃/min, 得到的催化剂命名为CN520.
1.3 催化活性评价
根据文献[6]报道的方法评价催化剂的光催化固氮性能. 以250 W高压钠灯(主波长400~800 nm)为可见光光源, 以0.5 mol/L的亚硝酸钠水溶液为钠灯冷却循环水滤去光源中紫外光部分(流速0.5 L/min); 以0.789 g/L的乙醇为空穴捕获剂. 将0.2 g催化剂加入到500 mL乙醇水溶液中, 搅拌0.5 h以充分分散; 搅拌条件下将溶液放在光源下进行照射, 同时鼓入空气(30 ℃, 标准大气压). 每隔1 h取5 mL悬浮液置于离心管中, 在3000 r/min转速下离心15 min后取上层清液, 利用紫外-可见分光光度计, 采用纳氏试剂法分析产物中铵离子浓度(JB7478-87)[6,11], 具体方法如下: 取10 mL待测样品放入25 mL容量瓶中定容到25 mL. 滴加0.5 mL酒石酸钾钠溶液(2.17 mol/L)和0.75 mL纳氏试剂, 静置10 min后, 利用紫外-可见分光光度计测试样品在420 nm波长处的吸光度. 铵离子浓度(mg/L)采用标准曲线换算得到, 换算公式为: 铵离子浓度=(样品吸光度-纯水吸光度)×5.642.
2 结果与讨论
2.1 光催化固氮性能评价

Fig.1 Nitrogen photofixation ability of catalysts prepared by different microwave treating time(A) and photocatalytic stability of IM-CN(30)(B)

Fig.2 Effect of NaNO2 concentration(a) and flow rate(b) on N2 photofixation ability over as-prepared IM-CN(30)

2.2 XRD分析
由图3可见, CN520有2个特征衍射峰, 分别位于2θ=13.1°和27.5°处, 其中27.5°处的衍射峰为芳香物层间堆积特征峰, 归属于(002)晶面; 13.1°处的衍射峰是Melon类结构的特征峰, 归属于(100)晶面[12,13]. 单纯微波处理15 min和红外辅助微波处理20 min的催化剂显示出g-C3N4的特征峰, 说明微波法能在短时间内制备出g-C3N4催化剂. 但M-CN(15)和IM-CN(20)的XRD谱图中有很多杂峰, 说明其结构还很不完整. 当单纯微波处理时间和红外辅助微波处理时间分别延长至20 min及25 min时, 得到的催化剂显示出完整的g-C3N4晶体结构. 由图3还可看出, 微波处理制备的g-C3N4催化剂的衍射峰位置与CN520相比均向低角度方向位移0.3°. 这可能是由于微波处理法制备的g-C3N4催化剂存在晶格缺陷导致的. 由ICP结果得到的CN520的C/N原子比为0.74, 与其理论值非常相近. M-CN(20)和IM-CN(30)的C/N原子比分别为0.78和0.82, 高于CN520的C/N原子比. 结合XRD结果, 微波处理法制备的g-C3N4催化剂中存在的晶格缺陷应为氮空穴. 红外辅助微波处理制备的IM-CN(30)催化剂的C/N原子比高于单纯微波处理得到的M-CN(20)应具有更多的氮空穴位. 此外, ICP结果显示催化剂中不含硫元素, 与文献[14]结果一致.

Fig.3 XRD patterns of as-prepared catalysts under microwave(A) and infrared ray assisted microwave(B) treatment
2.3 SEM与HRTEM分析
如图4(A)所示, CN520催化剂具有光滑的层状结构; 微波处理得到的M-CN(20)催化剂也显示出类似的层状结构[图4(B)], 但其表面有很多无规则的小孔; IM-CN(30)的形貌与M-CN(20)没有明显差别[图4(C)], 说明红外照射对催化剂形貌没有产生显著影响. 图4(D)为IM-CN(30)的HRTEM照片, 从图中可以清楚地看出IM-CN(30)具有规整的晶格结构. 其晶格间距为0.330 nm, 与g-C3N4的(002)晶面间距一致[15~17], 证实采用红外辅助微波法制备了g-C3N4催化剂.

Fig.4 SEM images of as-prepared CN520(A), M-CN(20)(B), IM-CN(30)(C) and HRTEM image of IM-CN(30)(D)
2.4 氮气吸附-脱附分析
催化剂的比表面积对其催化性能有至关重要的影响[18]. 图5为CN520, M-CN(20)和IM-CN(30)的N2吸附-脱附等温线. 可以看出, 3个催化剂都呈现出典型的Ⅳ型等温线, 表明三者均具有介孔结构. 采用BET法计算CN520的比表面积(SBET)为9.4 m2/g, 与文献[18,19]的结果相近; 而M-CN(20)和IM-CN(30)的SBET分别为45.6和47.2 m2/g, 与CN520相比有显著提高, 这是由于M-CN(20)和IM-CN(30)表面存在许多不规则的孔结构导致的. M-CN(20)和IM-CN(30)两者的SBET没有显著差异, 说明比表面积不是导致二者固氮性能差异的主要原因.
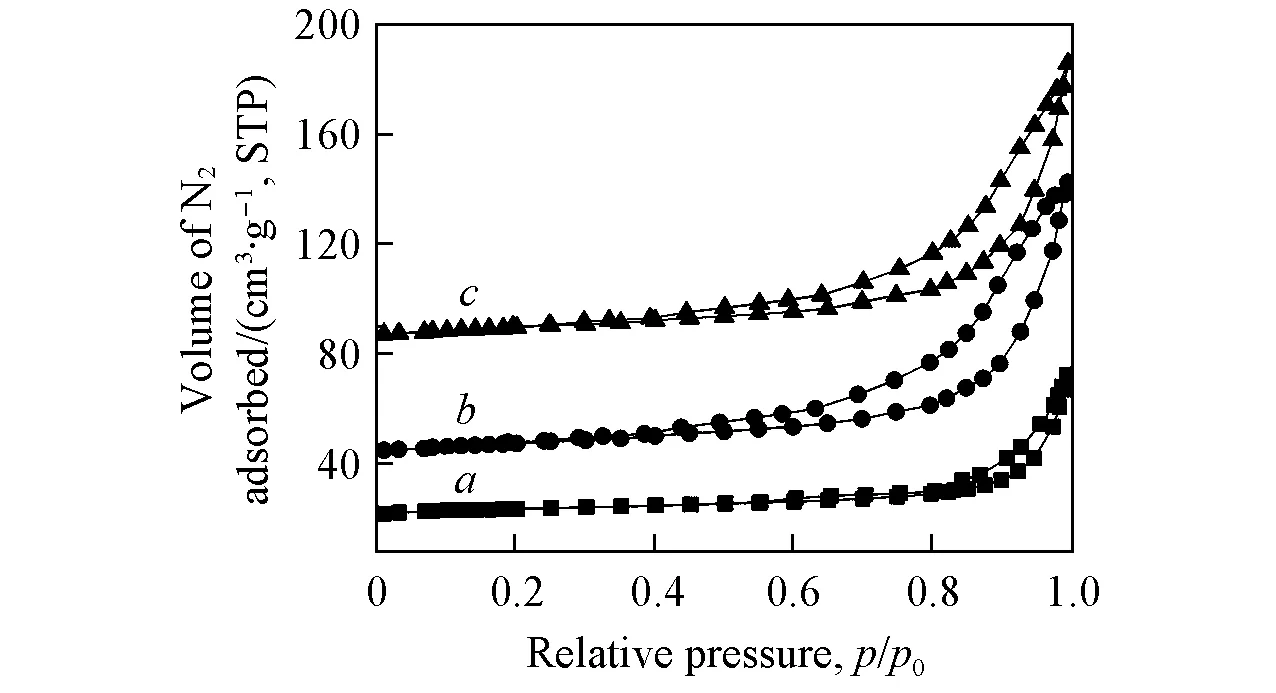
Fig.5 Nitrogen adsorption-desorption isotherms of CN520(a), M-CN(20)(b) and IM-CN(30)(c)

Fig.6 UV-Vis spectra of CN520(a), M-CN(20)(b) and IM-CN(30)(c)
2.5 UV-Vis光谱分析
由UV-Vis光谱图(图6)可见, CN520的吸收边界(λg)为460 nm, 利用公式Eg=1240/λg计算出其带隙能Eg为2.70 eV. M-CN(20)和IM-CN(30)表现出明显的吸收边界蓝移现象, 吸收边界分别位于450和432 nm, 带隙能分别为2.76和2.87 eV. ICP结果显示催化剂中无硫元素, 排除了硫掺杂改变能带的可能性, 由此推断能带结构的变化可能是由于催化剂中存在氮空穴引起的. 此外, 从图6中还可以看出微波处理所得催化剂与CN520的显著区别, M-CN(20)和IM-CN(30)对波长450~700 nm的可见光出现普遍吸收现象, 这是由于微波处理所得催化剂中存在氮空穴引起的[20].
2.6 EPR和N2-TPD分析
EPR谱能提供催化剂表面存在缺陷态的直接证据, 如氧空穴、 氮空穴等[21,22]. 如图7所示, CN520的EPR谱图中没有信号峰, 说明CN520不存在未配对单电子. 而M-CN(20)和IM-CN(30)的EPR谱图中在g=2.003处出现了明显的信号峰, 说明这2个催化剂存在未配对单电子. 此未配对单电子是由于M-CN(20)和IM-CN(30)催化剂上存在氮空穴产生的[21,22]. 此外, IM-CN(30)的EPR信号峰强度明显强于M-CN(20), 说明其表面的氮空穴含量大于M-CN(20).

Fig.7 EPR spectra of CN520(a), M-CN(20)(b)and IM-CN(30)(c)
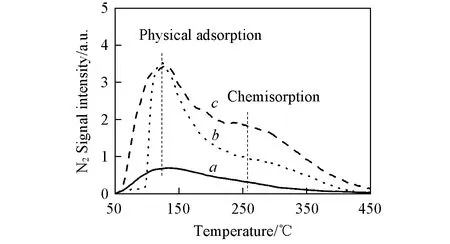
Fig.8 N2-TPD curves of as-prepared CN520(a), M-CN(20)(b) and IM-CN(30)(c)
反应物在催化剂表面的化学吸附过程通常被认为是反应物活化过程, 对催化剂的性能起到至关重要的作用. 由催化剂的N2-TPD结果(图8)可以看出, CN520表面只存在一种吸附的氮气物种, 其脱附温度约为120 ℃, 应为物理吸附. 微波处理得到的催化剂M-CN(20)和IM-CN(30)表面存在2种吸附的氮气物种, 脱附温度分别为120和260 ℃, 表明M-CN(20)和IM-CN(30)除了对氮气存在物理吸附作用外, 还存在化学吸附作用, 这可能是由于M-CN(20)和IM-CN(30)表面存在的氮空穴充当了氮气分子的化学吸附位, 这些氮空穴具有与氮原子相似的尺寸与形貌, 因此能吸附并活化氮气分子, 使催化剂的光催化固氮性能显著提高. 此外, 从图8中可以看出, IM-CN(30)表面化学吸附的氮气物种多于M-CN(20), 说明IM-CN(30)表面的氮空穴位多于M-CN(20), 这与上述表征结果一致. 更多的氮空穴能同时活化更多氮气分子, 因此IM-CN(30)的光催化固氮性能优于M-CN(20).
2.7 PL光谱分析


Fig.9 PL spectra of as-prepared CN520(a), M-CN(20)(b) and IM-CN(30)(c) under N2 atmosphere(A) and comparison of PL intensity of the samples under Ar or N2 atmospheres(B)
2.8 光电流测试
从图10(A)可以看出, 在氮气气氛下, M-CN(20)和IM-CN(30)的光电流强度明显强于CN520, 再次证实了微波法制备催化剂的电子-空穴分离效率优于焙烧得到的CN520. 此外, M-CN(20)和IM-CN(30)的光电流强度在开灯初始时有随光照时间延长而逐渐衰减的趋势, 衰减到一定程度后基本保持稳定. IM-CN(30)的衰减幅度大于M-CN(20), 这可能是由于M-CN(20)和IM-CN(30)表面的光电子转移至化学吸附的氮气分子所致. 而CN520则没有发生类似的电子转移现象, 因此没有光电流的衰减. 由于IM-CN(30)表面的氮空穴多于M-CN(20), 导致更多化学吸附的氮气分子捕获了更多的光电子, 所以其光电流衰减幅度大于M-CN(20). Li等[11]也发现了类似的结果. 图10(B)对比了CN520和IM-CN(30)在氮气和氩气气氛下的光电流强度. CN520在2种气氛下的光电流强度基本一致, 而IM-CN(30)在氩气气氛下的光电流没有发生衰减情况, 说明氮气气氛是电流衰减的必要条件. 由此进一步证实了IM-CN(30)表面的氮空穴有利于光电子在催化剂与吸附的氮气间的转移.
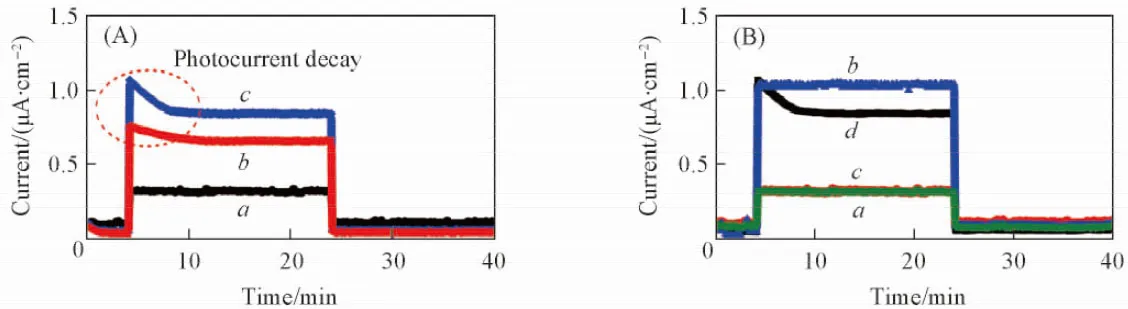
Fig.10 Photocurrent response of as-prepared catalysts under N2 or Ar atmospheres

综上所述, 采用红外辅助微波法制备了可见光下具有优越固氮性能的g-C3N4催化剂. 研究结果表明, 微波处理在催化剂表面形成许多不规则的小孔, 增大了催化剂的比表面积; 另外, 微波处理会产生大量氮空穴, 这些氮空穴一方面可以吸附并活化氮气分子, 另一方面提升了光电子从催化剂到氮气分子的界面转移能力, 抑制了催化剂光生电子-空穴的复合, 显著提高了催化剂的光催化固氮性能. 红外辅助微波法制备的g-C3N4催化剂与单纯微波法制备的催化剂相比具有更多的氮空穴, 表现出更高的光催化固氮性能.
[1] Schrauzer G. N., Guth T. D.,J.Am.Chem.Soc., 1977, 99(22), 7189—7193
[2] Ranjit K. T., Varadarajan T. K., Viswanathan B.,J.Photochem.Photobiol.A:Chem., 1996, 96(1—3), 181—185
[3] Rusina O., Linnik O., Eremenko A., Kisch H.,Chem.Eur.J., 2003, 9(2), 561—565
[4] Hoshino K.,Chem.Eur.J., 2001, 7(13), 2727—2731
[5] Hoshino K., Inui M., Kitamura T., Kokado H.,Angew.Chem.Int.Ed., 2000, 39(39), 2509—2512
[6] Zhao W. R., Zhang J., Zhu X., Zhang M., Tang J., Tan M., Wang Y.,Appl.Catal.B:Environ., 2014, 144(1), 468—477
[7] Hu S. Z., Ma L., You J. G., Li F. Y., Fan Z. P., Lu G., Liu D., Gui J. Z.,Appl.Surf.Sci., 2014, 311(1), 164—171
[8] Zheng Y., Liu J., Liang J., Jaroniec M., Qiao S.,EnergyEnviron.Sci., 2012, 5(5), 6717—6731
[9] Xu J., Wu H. T., Wang X., Xue B., Li Y. X., Cao Y.,Phys.Chem.Chem.Phys., 2013, 15(13), 4510—4517
[10] Park S. S., Chu S. W., Xue C., Zhao D., Ha C. S.,J.Mater.Chem., 2011, 21(29), 10801—10807
[11] Li H., Shang J., Ai Z. H., Zhang L. Z.,J.Am.Chem.Soc., 2015, 137(19), 6393—6399
[12] Wang Y., Wang X. C., Antonietti M.,Angew.Chem.Int.Ed., 2012, 51(1), 68—89
[13] Zhang Q., Hu S. Z., Li F. Y., Fan Z. P., Wang Q., Wang F., Li W., Liu D. S.,Chem.J.ChineseUniversities, 2016, 37(3), 521—528(张倩, 胡绍争, 李法云, 范志平, 王琼, 王菲, 李薇, 刘道胜. 高等学校化学学报, 2016, 37(3), 521—528)
[14] Zhang G. G., Zhang J. S., Zhang M. W., Wang X. C.,J.Mater.Chem., 2012, 22(16), 8083—8091
[15] Sun M., Yan T., Yan Q., Liu H. Y., Yan L. G., Zhang Y. F., Du B.,RSCAdv., 2014, 4(1), 19980—19986
[16] Yuan B., Chu Z. Y., Li G. Y., Jiang Z. H., Hu T. J., Wang Q. H., Wang C. H.,J.Mater.Chem.C, 2014, 2(1), 8212—8215
[17] Sun M., Yan Q., Yan T., Li M. M., Wei D., Wang Z. P., Wei Q., Du B.,RSCAdv., 2014, 4(1), 31019—31027
[18] Hu S. Z., Ma L., Wang H. Y., Zhang L., Zhao Y. F., Wu G.,RSCAdv., 2015, 5(1), 31947—31953
[19] Hu S. Z., Ma L., Xie Y., Li F. Y., Fan Z. P., Wang F., Wang Q., Wang Y. J., Kang X. X., Wu G.,DaltonTrans., 2015, 44(1), 20889—20897
[20] Li Y. X., Xu H., Ouyang S. X., Lu D., Wang X., Wang D. F., Ye J. H.,J.Mater.Chem.A, 2016, 4(1), 2943—2950
[21] Hong Z. H., Shen B., Chen Y. L., Lin B. Z., Gao B. F.,J.Mater.Chem.A, 2013, 1(1), 11754—11761
[22] Yang R. C., Lu X. J., Huang X., Chen Z. M., Zhang X., Xu M. D., Song Q. W., Zhu L. T.,Appl.Catal.B:Environ., 2015, 170/171(1), 225—232
[23] Zhang Q. K., Yao B. H., Lu Y. P., Pang Y. B., Xiong Y. M.,Chem.J.ChineseUniversities, 2015, 36(9), 1794—1800(张钦库, 姚秉华, 鲁盼, 庞波, 熊敏. 高等学校化学学报, 2015, 36(9), 1794—1800)
[24] Li F., Wang G. Y., Zhang Y., Li H. R.,Chem.J.ChineseUniversities, 2015, 36(7), 1351—1357(李锋, 王桂燕, 张岩, 李洪仁. 高等学校化学学报, 2015, 36(7), 1351—1357)
(Ed.: S, Z, M)
Infrared Ray Assisted Microwave Synthesis of Graphitic Carbon Nitride and Its Nitrogen Photofixation Ability†
† Supported by the National Natural Science Foundation of China(No.41571464) and the Education Department of Liaoning Province, China(No.L2014145).
CAO Yuhui, TONG Yufei, ZHANG Jian*, LI Fayun, FAN Zhiping,BAI Jin, MAO Wei, HU Shaozheng*
(CollegeofChemistry,ChemicalEngineering,andEnvironmentalEngineering,LiaoningShihuaUniversity,Fushun113001,China)
A convenient infrared ray assisted microwave method was used to synthesize graphitic carbon nitride(g-C3N4) with outstanding nitrogen photofixation ability under visible light. X-ray diffraction(XRD), N2adsorption, UV-Vis spectroscopy, scanning electron microscopy(SEM), transmission electron microscopy(TEM), N2-temperature programmed desorption(TPD), electron paramagnetic resonance(EPR), photoluminescence spectroscopy(PL) and photocurrent measurements were used to characterize the prepared catalysts. The results indicate that microwave treatment can form many irregular pores in the as-prepared g-C3N4, which causes the increased surface area. More importantly, microwave treatment causes the formation of many nitrogen vacancies in the as-prepared g-C3N4. These nitrogen vacancies not only serve as active sites to adsorb and activate N2molecules but also promote the interfacial charge transfer from catalysts to N2molecules and the separation rate of electrons-hole pairs, thus significantly improving the nitrogen photofixation ability. The higher nitrogen vacancy concentration of g-C3N4prepared by infrared ray assisted microwave treatment causes the more chemisorption sites, leading to the higher nitrogen photofixation performance. This method is simple and convenient, and is suitable for large-scale production of g-C3N4catalyst.
Infrared ray assisted microwave method; Graphitic carbon nitride(g-C3N4); N2photofixation; Nitrogen vacancy; Photocatalysis
2016-03-14.
日期: 2016-06-27.
国家自然科学基金(批准号: 41571464)和辽宁省教育厅一般项目(批准号: L2014145)资助.
10.7503/cjcu20160148
O644
A
联系人简介: 胡绍争, 男, 博士, 副教授, 主要从事新型光催化材料研究. E-mail: hushaozhenglnpu@163.com
张 健, 男, 博士, 副教授, 主要从事多相催化及催化氧化方面的研究. E-mail: zhangjianlnpu@163.com
