低抗凝肝素寡糖的制备、结构表征及免疫活性评价
2016-12-21单鑫迪赵小亮李国云王小江郝杰杰于广利
张 晓, 单鑫迪, 赵小亮, 李国云, 王小江, 蔡 超, 郝杰杰, 于广利
(山东省糖科学与糖工程重点实验室, 海洋药物教育部重点实验室,中国海洋大学医药学院, 青岛 266003)
低抗凝肝素寡糖的制备、结构表征及免疫活性评价
张 晓, 单鑫迪, 赵小亮, 李国云, 王小江, 蔡 超, 郝杰杰, 于广利
(山东省糖科学与糖工程重点实验室, 海洋药物教育部重点实验室,中国海洋大学医药学院, 青岛 266003)
以猪肠黏膜来源低抗凝肝素为原料, 采用苄酯碱水解法制备了寡糖. 通过聚丙烯酰胺凝胶电泳(PAGE)、 高效凝胶渗透色谱(HPGPC)-多角激光光散射法(MALLs)联用、 核磁共振波谱(NMR)和液相色谱-质谱(LC-MS)联用技术对所制备寡糖的分子量分布及化学结构进行了表征. 以该寡糖对活化X因子(FXa)及人凝血酶(FⅡa)活性的抑制作用评价了其抗凝血活性, 并通过测定其对RAW264.7巨噬细胞吞噬能力及NO释放量的影响评价其免疫活性. 结果表明, 所制备寡糖的聚合度分布于2~22之间, 平均分子质量为5300, 无明显的抗凝血活性, 但具有显著的免疫增强活性.
低抗凝肝素寡糖; 苄酯碱水解; 液相色谱-质谱联用; 免疫增强活性
药用级肝素除了具有抗凝血作用外, 还具有调整血脂浓度、 抗炎及抗过敏等多种功能[1,2]. 由于肝素临床应用时存在导致出血、 血小板减少、 高钾血症及骨质疏松等副作用, 使其在抗炎、 降血脂等方面的临床应用受到限制. 依诺肝素钠是采用苄酯碱水解法制备的一种低分子肝素的钠盐, 与普通肝素钠相比, 依诺肝素钠具有临床适应症广、 生物利用度高、 半衰期长和副作用较小等优点[3], 但仍存在出血等风险[4,5]. 低抗凝肝素因具有不与血小板因子-4(PF-4)结合, 甚至可在肝素活化PF-4的浓度下抑制血小板的活化[6]等优点, 从而成为研究热点.
目前, 研究最多的低抗凝肝素有2类: 一类是部分脱去硫酸基, 尤其是脱去2-O-和3-O-硫酸基团的肝素(PDH)[7]; 另一类是经高碘酸盐氧化获得的肝素(POH)[8]. 对这2类低抗凝肝素的研究主要集中于增强免疫及抗炎活性方面. PDH能显著减弱蛋白酶活化受体1(PQT-1)被凝血酶活化, 故可预防如急性肺损伤和急性呼吸窘迫综合征等疾病中由凝血酶引起的人肺内皮细胞渗透率增加、 RhoA活化及细胞内钙离子增加等不良反应[7,9]. POH能干扰细胞聚集与黏附, 已作为抗恶性疟疾的辅助治疗药物通过了Ⅰ期临床评估[10,11].
本文从猪肠黏膜粗品肝素中分离得到一种低抗凝肝素, 采用苄酯碱水解法(β-消除法)制备了低抗凝肝素寡糖, 运用色谱、 波谱和质谱等技术对其结构进行了表征; 并进一步对其抗凝血和免疫活性进行了评价, 以期为天然低抗凝肝素及其寡糖的开发利用提供参考.
1 实验部分
1.1 试剂与仪器
低抗凝肝素(LAH), 来源于猪小肠黏膜肝素加工废弃物, 经盐酸酸沉、 强阴离子交换色谱分离及软骨素酶ABC处理纯化制得, 抗凝效价为25 U/mg, 重均分子量为10200, 平均每个二糖单元包含2.11个硫酸基; USP依诺肝素钠(ES)对照标准品(抗Xa效价为160 U/mg, 抗Ⅱa效价为49 U/mg)、 猪小肠黏膜来源硫酸乙酰肝素(HS, 11 U/mg)、 肝素(HP, 180 U/mg)、 脂多糖(LPS)和阿利新蓝8GX(美国Sigma公司); 乙腈(德国Merck公司); 醋酸铵(色谱级, 美国Sigma公司); 肝素酶Ⅱ(5 U/μL, 北京思清源生物科技有限公司); 抗凝血酶Ⅲ(ATⅢ)、 活化X因子(FXa)、 人凝血酶(FⅡa)、 发色底物S-2765和S-2238(法国Hyphen biomed公司); DMEM高糖培养基、 胎牛血清(FBS)和胰酶-EDTA(2.5 g/L, 美国Gibco公司); 其它试剂均为国产分析纯.
Sephadex G10型凝胶色谱填料(美国GE Health公司); Shodex Ohpak SB HQ 802.5/804型色谱柱(8.0 mm×300 mm, 6 μm, 日本昭和电工株式会社); Luna HILIC 色谱柱(2.0 mm×150 mm和2.0 mm×50 mm, 20 nm, 美国Phenomenex公司).
3000Xi型电泳仪(美国Bio-Rad公司); Elx808型酶标仪(美国Bio-Tek公司); BIO-CAPT200M凝胶分析系统(美国SIM公司); Agilent1260型高效液相色谱仪(美国Agilent公司); DAWN HELEOSⅡ型多角激光光散射仪、 WTREX Optilab T-rEX型DNDC示差折射仪(美国Wyatt公司); Bruker AVANCE Ⅲ 600型核磁共振波谱仪(瑞士Bruker公司); LTQ Obitrap XL质谱仪(美国Thermo Fisher公司).
1.2 实验过程
1.2.1 低抗凝肝素寡糖的苄酯碱降解法制备 取低抗凝肝素30 mg溶于2 mL H2O中, 缓慢加入150 μL苄索氯铵溶液(150 mg/mL), 搅拌1 h后静置, 离心, 沉淀真空干燥得低抗凝肝素-苄索氯铵盐. 将低抗凝肝素-苄索氯铵盐溶于1 mL二氯甲烷中, 缓慢加入20 μL氯化苄, 于37 ℃搅拌24 h后, 加入4倍体积的100 g/L乙酸钠的甲醇溶液, 静置30 min后离心, 将沉淀溶于100 g/L NaCl水溶液中, 加入4倍体积甲醇, 离心收集沉淀, 经真空干燥得低抗凝肝素苄酯. 将低抗凝肝素苄酯配制成50 mg/mL的水溶液, 加入100 μL NaOH溶液(0.6 mol/L), 于60 ℃搅拌反应1.5 h后, 用盐酸(1 mol/L)调节pH至6.5, 加入4倍体积的乙醇, 沉淀溶解后经Sephadex G10柱脱盐, 冷冻干燥得到低抗凝肝素寡糖BE-LAH.
1.2.2 分子量测定及分子量分布分析 采用聚丙烯酰胺凝胶电泳(PAGE)分析寡糖聚合度[12]: 分离胶浓度为50 g/L , 浓缩胶浓度为220 g/L ; 100 V预电泳10 min, 200 V电泳1.5 h; 2 g/L阿利新蓝染色液染色15 min, 20 g/L醋酸溶液洗涤至底色无色.
采用高效凝胶渗透色谱(HPGPC)-多角激光光散射仪(MALLs)联用法测定BE-LAH的分子量及其分子量分布[13]: 将HQ SB804色谱柱与HQ SB802.5色谱柱串联, 示差检测器与多角激光光散射仪串联进行在线检测; 用Astra 5.3.4.20工作软件计算分子量及其分布.
1.3 BE-LAH的寡糖组成分析
采用亲水作用色谱-傅里叶变换质谱联用仪(HILIC-FTMS)分析经肝素酶Ⅱ彻底降解得到的寡糖混合物[14]. Luna HILIC色谱柱(2.0 mm×150 mm, 20 nm); 流动相A为醋酸铵(5 mmol/L)水溶液, 流动相B为醋酸铵(5 mmol/L)乙腈(体积分数98%)水溶液; 洗脱程序: 8%~40%A(体积分数), 0~58 min; 流速150 μL/min. 所得数据经去卷积化软件Decon2LS自动分析后, 通过GlycResoft分析进行匹配归属及定量[15], 对归属后寡糖的丰度进行归一化处理.
1.4 3-O-硫酸基四糖的HILIC-FTMS分析
将400 μg样品溶于90 μL酶解缓冲液(0.05 mol/L乙酸铵+2 mmol/L氯化钙)中, 加入80 mU的肝素酶Ⅱ, 混匀后于35 ℃反应10 h, 彻底酶解释放3-O-硫酸基四糖. 于100 ℃加热将酶灭活, 离心取上层清液. 采用HILIC-FTMS分析经肝素酶Ⅱ彻底降解得到的寡糖组分[16]. Luna HILIC色谱柱(2.0 mm×50 mm, 20 nm); 流动相、 检测器和质谱条件同1.3节; 洗脱程序: 8%~22%A(体积分数), 0~17 min; 22%~40%A, 17~25 min; 70%A, 25.01~30 min; 流速: 150 μL/min.
1.5 核磁共振波谱(NMR)分析
取50 mg BE-LAH溶于500 μL重水(D2O)中, 减压真空浓缩重水交换3次, 用500 μL 重水溶解后转移至核磁管中, 以氘代丙酮为内标, 在25 ℃下进行1H NMR,13C NMR和1H-13C HSQC分析.
1.6 活性评价
1.6.1 抗凝活性评价 按照AG00-01试剂盒(法国Hyphen biomed公司)所示步骤测定各样品对FXa和FⅡa活性的抑制作用[17]. 将20 μL抗凝血酶Ⅲ(ATⅢ)[18]和20 μL样品溶液于37 ℃孵育1 min; 加入40 μL FXa或FⅡa, 于37 ℃孵育1 min; 再加入100 μL FXa或FⅡa的底物, 于37 ℃孵育4 min; 最后加入100 μL终止液, 于405 nm测定吸光值. Anti-Xa与Anti-Ⅱa活性根据不同浓度的美国药典肝素标准品(0~1 U/mL)平行实验曲线计算得到.
1.6.2 免疫活性评价 将RAW264.7细胞于37 ℃解冻后, 加入适量的培养液并摇匀, 置于37 ℃, 5%(体积分数)CO2培养箱中培养, 用2.5 g/L胰酶消化传代.
采用中性红法测定样品作用于RAW264.7细胞后对其吞噬能力的影响[19]. 用不同浓度的样品和标准品培养细胞24 h后, 将培养液吸出, 向各孔中加入中性红染色液进行染色, 摇匀后继续培养30 min, 将中性红染色液吸出, 加入PBS缓冲溶液清洗至无中性红染色液残留. 加入细胞裂解液[V(乙醇)∶V(冰醋酸)=1∶1], 摇匀后于540 nm测定吸光值, 计算公式如下:
采用S0021试剂盒(碧云天生物技术有限公司)检测样品作用于RAW264.7细胞后NO释放量的改变. 用不同浓度的样品和标准品培养细胞24 h, 取出50 μL上层清液置于另一96孔板, 每孔依次加入50 μL Griess Reagent Ⅰ及等量Griess Reagent Ⅱ, 于540 nm测定吸光值. 绘制标准曲线, 计算NO释放量.
2 结果与讨论
2.1 分子量及分子量分布分析
通过苄酯碱降解LAH制得25 mg低抗凝肝素寡糖BE-LAH, 收率为83.3%. 以ES及肝素四糖标准品为对照, 用PAGE分析寡糖混合物的聚合度范围. 结果表明, BE-LAH与ES的电泳行为相似, 含有系列分布均匀的寡糖, 聚合度(dp)为2~22, 且以dp 3~18为主, 表明LAH经苄酯碱降解程度适中, 降解条件适合寡糖的制备.

Fig.1 Determination of molecular weight and its distribution of BE-LAH by HPGPC-MALLs
经DNDC示差折射仪测得BE-LAH的dn/dc值为0.125. 采用HPGPC-MALLs法测得的BE-LAH分子量结果如图1所示. 激光与示差检测信号一致性好且峰形对称, 分布范围窄, 表明不含杂质且分子量分布集中. 平均分子量为5300, 其中Mw<2000, 2000
2.2 BE-LAH的寡糖组成
由HILIC-FTMS分析(图2)可知, BE-LAH中聚合度为3~12的寡糖丰度较高(二糖含量很低), 而聚合度为13~22的寡糖丰度较低, 这是由于寡糖分子量越大在质谱中的离子化效率越低所致. 苄酯碱水解制备低分子肝素会生成1,6-脱水衍生物, 其含量的高低在一定程度上影响低分子肝素的抗凝血活性[20], 测定其含量通常需将ES样品用肝素酶Ⅰ/Ⅱ/Ⅲ彻底酶解再通过二糖组成分析测定[21], 分析方法繁琐. 本文直接对寡糖进行LC-MS分析, 计算可知BE-LAH中1,6-脱水衍生物所占的比例为16.52%, 符合美国USP第35版对ES中1,6-脱水衍生物的含量为15%~25%的规定. 此外, 质谱分析结果还表明, BE-LAH中含有奇数和偶数寡糖, 而利用相同苄酯碱水解制备的高抗凝肝素寡糖则主要为偶数寡糖, 该现象与低抗凝肝素中的糖醛酸主要是艾杜糖醛酸(IdoA)而高抗凝肝素中主要是2-硫酸-艾杜糖醛酸(IdoA2S)且与硫酸化程度较高有关[22,23].
2.3 3-O-硫酸基四糖的含量分析
HP在肝素酶Ⅱ作用时会产生罕见的3-O-硫酸基四糖, 该四糖来自于肝素核心五糖. 研究表明, 3-O-硫酸基四糖的含量与其抗凝活性呈正相关[24]. 据文献[22]报道, HP经肝素酶Ⅱ彻底降解后产生4种主要的3-O-硫酸基四糖: △UA-GlcNAc-GlcA-GlcNS3S, △UA-GlcNAc6S-GlcA-GlcNS3S, △UA-GlcNAc6S-GlcA-GlcNS3S6S和△UA-GlcNS6S-GlcA-GlcNS3S6S. 依据该方法测定样品中3-O-硫酸基四糖的含量, 数据列于表1. 可见, 在BE-LAH和HS标准品中未检测到3-O-硫酸基四糖, 而LAH含有0.57%的3-O-硫酸基四糖, 远低于ES(5.82%)与HP(6.20%), 说明LAH抗凝活性低而BE-LAH无抗凝血活性.

Table 1 Compositional analysis of BE-LAH, LAH and standard HP, HS, ES*
2.4 BE-LAH的NMR解析
一维核磁共振波谱(图3)显示, BE-LAH和ES标准品有相似的波谱特征[25~28].δ5.55, 4.65, 4.35, 6.03, 5.17和5.81处分别为BE-LAH非还原端不饱和糖醛酸△UA2S的H1, H2, H3和H4信号及△UA的H1和H4信号;δ5.28, 4.40, 4.27, 4.14, 4.83和5.07处分别为IdoA2S的H1, H2, H3, H4和H5及IdoA的H1信号. 由1H NMR谱图[图3(A)]可见, BE-LAH中△UA2S的信号明显低于ES, 而△UA和IdoA的信号则高于ES, 表明BE-LAH中IdoA/IdoA2S比例高于ES. 约δ5.53处未检测到ANS3S的H1信号, 预示其无抗凝血活性[25].δ3.15和3.46处分别为还原端1,6-脱水衍生物1,6-an.A和1,6-an.M的H2信号.13C NMR[图3(B)]和1H-13C HSQC数据(图4)进一步证实了上述结论.

Fig.3 1H NMR(A), 13C NMR(B) of BE-LAH(a) and USP ES(b)
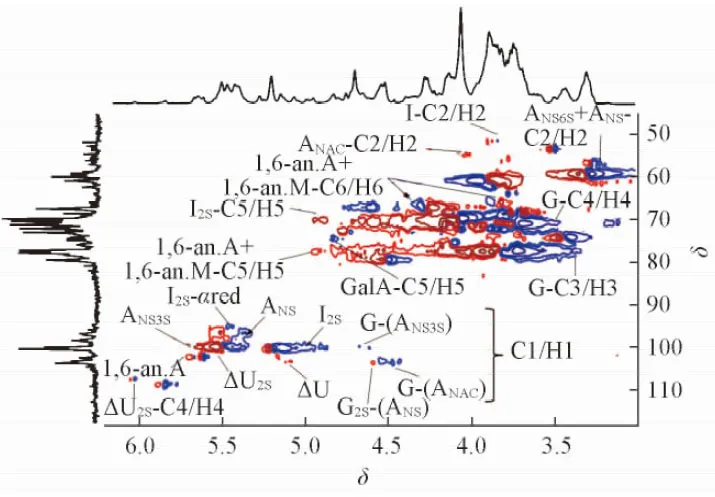
Fig.4 1H-13C HSQC spectrum of BE-LAH
2.5 活性评价
2.5.1 抗凝血活性评价 通过测定抗FXa或FⅡa的活力单位评价了LAH和BE-LAH的抗凝血活性, 结果列于表2. 可见, BE-LAH的抗凝血活性与HS标准品相近, 无明显的抗凝活性; 虽然LAH抗凝活性高于HS标准品, 但远低于ES和HP标准品. 抗凝活性实验结果与HILIC-FTMS测定的3-O-硫酸基四糖含量的结果一致, 表明LAH为一种新型的低抗凝肝素, 尤其经过苄酯碱降解得到的BE-LAH几乎无抗凝血活性, 这为进一步开发低抗凝肝素的其它生物活性提供了结构依据.
2.5.2 免疫活性评价 采用中性红法评价了样品对巨噬细胞吞噬能力的影响, 结果如图5(A)所示, 可见不同浓度的样品对RAW264.7细胞的吞噬能力均有一定的促进作用, 且呈浓度依赖性. HP和LAH对RAW264.7细胞的吞噬能力的促进作用相对较强, 在100 μg/mL时其促进作用比空白分别提高了49%(P<0.01,n=3)和37%(P<0.01,n=3), 且呈现出促进效果优于LPS的趋势; BE-LAH在100 μg/mL时促进作用比空白提高了33%(P<0.01,n=3), 且呈现出促进效果优于ES的趋势; HS的促进作用相对较弱.

Table 2 Anti-Xa and anti-Ⅱa activities of samples
采用S0021试剂盒检测样品作用于RAW264.7细胞后NO释放量的改变, 结果如图5(B)所示, 可见阳性对照LPS作用于细胞后NO释放量为11.31 μmol/L, 空白对照为4.36 μmol/L. 不同浓度的样品均能提高RAW264.7细胞的NO释放量, 在中高剂量时(HS除外, 仅在较高浓度200 μg/mL时)的促进作用更加显著(P<0.01,n=3); BE-LAH在50 μg/mL时NO的释放量达6.86 μmol/L, 可显著促进RAW264.7细胞NO的释放(P<0.05,n=3).

Fig.5 Effects of different doses of GAGs on the phagocytosis index(A) and NO release(B) of the mouse macrophage cell line RAW 264.7
3 结 论
以猪肠黏膜来源的低抗凝肝素为原料, 采用苄酯碱水解法制得聚合度分布于2~22之间, 平均分子量为5300的低抗凝肝素寡糖; 活性评价结果表明, 其具有显著的免疫增强活性, 但无明显的抗凝血活性, 不会产生出血、 血小板减少等副作用, 具有良好的临床应用前景. 本文为天然来源的低抗凝肝素及其寡糖在免疫调节等方面的开发利用提供了参考.
[1] Lindahl U., Bäckström G., Thunberg L., Leder I. G.,Proc.Natl.Acad.Sci.USA, 1980, 77(11), 6551—6555
[2] Ishihara M., Guo Y., Wei Z., Yang Z., Swiedler S. J., Orellana A., Hirschberg C. B.,J.Biol.Chem., 1993, 268(27), 20091—20095
[3] Linhardt R. J.,J.Med.Chem., 2003, 46(13), 2551—2564
[4] Spinler S. A., Inverso S. M., Cohen M., Goodman S. G., Stringer K. A., Antman E. M.,Am.HeartJ., 2003, 146(1), 33—41
[5] Büller H. R., Davidson B. L., Decousus H., Gallus A., Gent M., Piovella F., Prins M. H., Raskob G., Segers A. E., Cariou R., Leeuwenkamp O., Lensing A. W.,Ann.Intern.Med., 2004, 140(11), 867—873
[6] Rao N. V., Argyle B., Xu X., Reynolds P. R., Walenga J. M., Prechel M., Prestwich G. D., MacArthur R. B., Walters B. B., Hoidal J. R., Kennedy T. P.,Am.J.Physiol.Cell.Physiol., 2010, 299(1), C97—C110
[7] Fryer A., Huang Y. C., Rao G., Jacoby D., Mancilla E., Whorton R., Piantadosi C. A., Kennedy T., Hoidal J.,J.Pharmacol.Exp.Ther., 1997, 282(1), 208—219
[8] Fransson L. A., Nieduszynski L. A., Sheehan J. K.,Biochim.Biophys.Acta, 1980, 630(2), 287—230
[9] Gonzales J. N., Kim K. M., Zemskova M. A., Rafikov R., Heeke B., Varn M. N., Black S., Kennedy T. P., Verin A. D., Zemskov E. A.,Vascular.Pharmacology, 2014, 62(2), 63—71
[10] Vogt A. M., Pettersson F., Moll K., Jonsson C., Normark J., Ribacke U., Egwang T. G., Ekre H. P., Spillmann D., Chen Q., Wahlgren M.,PLoS.Pathog., 2006, 2(9), e100
[11] Leitgeb A. M., Blomqvist K., Cho-Ngwa F., Samje M., Nde P., Titanji V., Wahlgren M.,Am.J.Trop.Med.Hyg., 2011, 84(3), 390—396
[12] Balazs E. A., Berntsen K. O., Karossa J., Swann D. A.,Anal.Biochem., 1965, 12(3), 547—558
[13] Hintze V., Miron A., Möller S., Schnabelrauch M., Heinemann S., Worch H., Scharnweber D.,J.Tissue.Eng.Regen.Med., 2014, 8(4), 314—324
[14] Li L., Zhang F., Zaia J., Linhardt R. J.,Anal.Chem., 2012, 84(20), 8822—8829
[15] Maxwell E., Tan Y., Tan Y., Hu H., Benson G., Aizikov K., Conley S., Staples G. O., Slysz G. W., Smith R. D., Zaia J.,PLoS.One, 2012, 7(9), e45474
[16] Li G., Steppich J., Wang Z., Sun Y., Xue C., Linhardt R. J., Li L.,Anal.Chem., 2014, 86(13), 6626—6632
[17] Fu L., Zhang F., Li G., Onishi A., Bhaskar U., Sun P., Linhardt R. J.,J.Pharm.Sci., 2014, 103(5), 1375—1383
[18] Zhao Y. X., Shangguan L. H., Zhao R., Liu G. Q.,Chem.J.ChineseUniversities, 2002, 23(2), 203—206(赵莹歆, 上官隶华, 赵睿, 刘国诠. 高等学校化学学报, 2002, 23(2), 203—206)
[19] Wang J. H., Zha X. Q., Pan L. H., Luo J. P.,Chem.J.ChineseUniversities, 2013, 34(4), 881—885(王军辉, 查学强, 潘利华, 罗建平. 高等学校化学学报, 2013, 34(4), 881—885)
[20] Jeske W. P., Neville B., Ma Q., Hoppensteadt D. A., Fareed J.,Blood(ASHAnnualMeetingAbstracts), 2004, 104, 1868
[21] Galeotti F., Volpi N.,J.Chromatogr.A., 2013, 1284(1), 141—147
[22] Li G., Cai C., Li L., Fu L., Chang Y., Zhang F., Toida T., Xue C., Linhardt R. J.,Anal.Chem., 2014, 86(1), 326—330
[23] Vismara E., Pierini M., Guglieri S., Liverani L., Mascellani G., Torri G.,Semin.Thromb.Hemost., 2007, 33(5), 466—477
[24] Guerrini M., Guglieri S., Naggi A., Sasisekharan R., Torri G.,Semin.Thromb.Hemost., 2007, 33(5), 478—487
[25] Limtiaco J. F., Jones C. J., Larive C. K.,Anal.Chem., 2009, 81(24), 10116—10123
[26] Keire D. A., Trehy M. L., Reepmeyer J. C., Kolinski R. E., Ye W., Dunn J., Westenberger B. J., Buhse L. F.,J.Pharm.Biomed.Anal., 2010, 51(4), 921—926
[27] Sudo M., Sato K., Chaidedgumjorn A., Toyoda H., Toida T., Imanari T.,Anal.Biochem., 2001, 297(1), 42—51
[28] Bianchini P., Liverani L., Spelta F., Mascellani G., Parma B.,Semin.Thromb.Hemost., 2007, 33(5), 496—502
(Ed.: P, H, V, K)
Preparation, Characterization and Immunological Activity Evaluation of Low Anticoagulant Heparin Oligosaccharides†
† Supported by the National Science and Technology Support Program of China(No.2013BAB01B02) and the National Natural Science Foundation of China-Shandong Joint Fund(No.U1406402).
ZHANG Xiao, SHAN Xindi, ZHAO Xiaoliang, LI Guoyun,WANG Xiaojiang, CAI Chao, HAO Jiejie, YU Guangli*
(ShandongProvincialKeyLaboratoryofGlycoscienceandGlycotechnology,KeyLaboratoryofMarineDrugs,MinistryofEducation,SchoolofMedicineandPharmacy,OceanUniversityofChina,Qingdao266003,China)
Anticoagulant activities limit applications of heparin and enoxaparin sodium in immune-promoting activity. A novel and natural low anticoagulant heparin(LAH) was purified from crude porcine intestinal. In this work, oligosaccharide of LAH(BE-LAH) was prepared by benzyl ester alkaline hydrolysis. The molecular distribution and chemical structure of BE-LAH were determined based on combination technologies including polyacrylamide gel electrophoresis(PAGE), high performance gel permeation chromatography(HPGPC)-multi angel laser light scattering(MALLs), nuclear magnetic resonance(NMR) and liquid chromatography-mass spectrum(LC-MS). Meanwhile, the anticoagulant activities were evaluated by measuring the inhibitory activities on coagulation factor Xa(FXa) and thrombin(FⅡa), while the immunological activities were evaluated by its modulation effects on phagocytic ability and NO release of RAW 264.7 cells. The results demonstrated that BE-LAH was composed of fragments from dp2 to dp22 with an average molecular weight of 5300. Expectedly, BE-LAH showed no anticoagulant activity, but remarkable immune-promoting activity. A low anticoagulant heparin oligosaccharide was prepared and promised as an excellent immunoenhancer.
Low anticoagulant heparin oligosaccharide; Benzyl ester alkaline hydrolysis; Liquid chromatography-mass spectrum; Immune-promoting activity
2015-11-11.
日期: 2016-06-06.
国家科技支撑计划项目(批准号: 2013BAB01B02)和国家自然科学基金-山东省政府联合基金(批准号: U1406402)资助.
10.7503/cjcu20150863
O629.1
A
联系人简介: 于广利, 男, 博士, 教授, 博士生导师, 主要从事糖化学和糖药物学研究. E-mail: glyu@ouc.edu.cn
