氨基己酸为配基的新型弱阳离子交换/疏水双功能色谱固定相对蛋白质的分离纯化
2016-12-14王建山夏红军万广平刘家玮
王建山, 夏红军, 万广平, 刘家玮, 白 泉
(西北大学合成与天然功能分子化学教育部重点实验室, 西北大学现代分离科学研究所,现代分离科学陕西省重点实验室, 陕西 西安 710069)
氨基己酸为配基的新型弱阳离子交换/疏水双功能色谱固定相对蛋白质的分离纯化
王建山, 夏红军, 万广平, 刘家玮, 白 泉*
(西北大学合成与天然功能分子化学教育部重点实验室, 西北大学现代分离科学研究所,现代分离科学陕西省重点实验室, 陕西 西安 710069)
以硅胶为基质、氨基己酸为配基制备了一种新型弱阳离子交换/疏水(WCX/HIC)双功能混合模式色谱固定相。该固定相配基具有一定的疏水性且含有羧基,在高盐浓度下表现为HIC的性质,可作为HIC固定相使用;在低盐浓度条件下表现为离子交换的性质,可作为WCX固定相使用。分别考察了该介质在WCX和HIC两种模式下对标准蛋白质的分离性能,并与商品柱进行比较。结果表明,所合成的WCX/HIC双功能固定相在WCX和HIC两种模式下对蛋白质均有较高的分离度和选择性,且分离能力与商品柱相当,两种模式下标准蛋白质的质量和活性回收率均大于93%,表明该柱具有“一柱二用”的功能,适于生物大分子的分离纯化。基于此双功能色谱柱构建的在线单柱二维液相色谱(2DLC-1C)可在60 min内实现8种蛋白质的快速分离。在70 min内完成了对蛋清中溶菌酶的二维纯化,纯度可达到98.3%。该技术中一根色谱柱可当作两根色谱柱使用,对蛋白质组学研究和重组蛋白药物的生产具有重要的应用价值。
固定相;混合模式色谱;离子交换色谱;疏水色谱;二维液相色谱
液相色谱是蛋白质分离纯化的有效工具[1-3],二维液相色谱(2DLC)已成为蛋白质组学等复杂样品分离分析的关键技术[4,5]。一根色谱柱通常只能利用一种分离模式对蛋白质进行分离纯化,其特征是“一柱一用”,所以目前2DLC的构建就需要两根分离模式正交的色谱柱。同时,样品如何在两根色谱柱之间进行切换以及两种模式流动相之间的兼容性问题一直是限制2DLC发展的瓶颈[6]。混合模式色谱(mixed mode chromatography,MMC)[7]是利用蛋白质与固定相配基之间多种相互作用进行分离的色谱模式。在合成MMC填料时,在配基中合理地引入多个作用位点,使固定相和蛋白质之间存在多种相互作用,以提高固定相的选择性和柱效。与传统的单一模式色谱相比,MMC具有高选择性、高负载量等优点。虽然MMC已有反相/离子交换色谱(RPLC/IEC)、反相/亲水色谱(RPLC/HILIC)、亲水/离子交换色谱(HILIC/IEC)和离子交换/疏水色谱(IEC/HIC)等类型,而且IEC/HIC MMC色谱柱已商品化,如美国GE Healthcare公司的Capto MMC和Capto adhere, Pall Life Sciences公司的HEA、PPA和MEP HyperCel耐盐层析介质。然而这些MMC柱仍是以一种色谱分离模式为主,而伴随的其他模式只起着强化主分离模式的辅助作用。
IEC和HIC所用的流动相都是盐水体系,接近生理条件,能很好地保持蛋白质的生物活性,是最适合分离活性蛋白质的色谱模式。Asenjo等[8]曾经指出,纯化活性蛋白质的最佳色谱模式是先经过IEC分离,再用HIC纯化。因此很多研究者围绕着这两种模式展开研究,专门设计用于HIC/IEC混合模式下分离生物活性样品的配基。Liu等[9]和Sun等[10]分别报道了IEC固定相普遍存在疏水作用。最近本课题组设计合成出了一类同时具有IEC和HIC性能的新型双功能高效色谱分离介质[11-13]。该介质在高盐浓度下表现为HIC的性质,可作为HIC固定相使用;而在低盐浓度条件下表现为IEC的性质,可作为IEC固定相使用,用一根色谱柱就可实现在IEC和HIC两种模式下对蛋白质的高效分离,具有“一柱二用”的功能,称之为“2D色谱柱”。以此为基础,利用阀切换技术,采用一根双功能色谱柱构建了在线二维液相色谱分离系统,称之为单柱二维液相色谱(2DLC-1C)[14]。与常规的2DLC不同的是,可在一根色谱柱上完成HIC/IEC或IEC/HIC二维色谱分离,建立了用一根该色谱柱代替两根常用的IEC和HIC色谱柱快速分离蛋白质的新方法,并成功地应用于牛胰腺中细胞色素C[15]、包涵体中γ-干扰素[16]及蛋清中3种活性蛋白质[17]的快速分离纯化。2DLC-1C技术的发展无疑给传统的2DLC技术带来了一场技术革新。但是该技术还刚刚起步,其发展主要依赖双功能色谱填料的开发与制备。因此,本文以氨基己酸为配基制备了一种同时具有弱阳离子交换(WCX)和HIC双功能的新型MMC固定相,其配基既含有羧基又有一定的疏水性,可分别在WCX和HIC两种模式下对蛋白质进行高效分离,实现“一柱二用”的功能。
1 实验部分
1.1 仪器与试剂
LC-20AVP高效液相色谱系统包括2台LC-20AVP高压泵、1台SCL-20AVP系统控制器、1个7725i进样阀、1台SPD-10AVP紫外可见检测器、1台CLASS-VP色谱工作站,UV-1601PC紫外可见分光光度计(日本Shimadzu公司); Cascada LS超纯水系统(美国Pall公司)。TSKgel Ether-5PW色谱柱(75 mm×7.5 mm)、TSKgel CM-5PW色谱柱(75 mm×7.5 mm)(日本Tosoh公司)。
色谱专家(ChromatoExpert)仪器包括:LC-10AVP高压泵(日本Shimadzu公司)、7725i二位六通进样阀(美国Rheodyne公司)、C5-2004四通切换阀、C5-2006六通切换阀、C5H-2008八通切换阀、C5H-2000十通切换阀、Z10M1十通、Z8M1八通(均购自瑞士VICI公司)[14]。
γ-缩水甘油醚氧基丙基三甲氧基硅烷购自上海阿拉丁生化科技股份有限公司;碳酸钠、氯化钠、磷酸二氢钾均购自天津科密欧化学试剂公司;硫酸铵购自成都市科龙化工试剂厂;氨基己酸购自中国预防医学科学院劳卫所,以上试剂均为分析纯。全多孔硅胶(粒径5 μm,比表面积180 m2/g,孔径22 nm)购自中科院兰州化学物理研究所。溶菌酶(lysozyme,纯度≥96%,蛋清)、核糖核酸酶A(RNase A,纯度≥98%,牛胰脏)、细胞色素C(cytochrome C,纯度≥97%,马心)、核糖核酸酶B(RNase B,纯度≥98%,牛胰脏)、α-糜蛋白酶原A(α-chymotrypsingen A,纯度≥96%,牛胰脏)、肌红蛋白(myoglobin,纯度≥98%,马心)、胰岛素(insulin,纯度≥95%,牛胰脏)、卵白蛋白(ovalbumin,纯度≥98%,蛋清),牛血清白蛋白(bovine serum albumin,纯度≥97%,牛血清),α-乳白蛋白(α-lactalbumin,纯度≥95%,牛奶)、α-淀粉酶(α-amylase,纯度≥98%,枯草杆菌)、考马斯亮亮G-250(纯度≥95%)均购自美国Sigma公司。
1.2 实验部分
1.2.1 固定相的制备
以氨基己酸为配基的色谱固定相制备过程如图1所示。取1.67 g氨基己酸溶于100 mL水中,然后加入5.3 g Na2CO3溶解,用NaOH调节pH值为11.5,冰浴下搅拌,缓慢滴加2.0 mLγ-缩水甘油醚氧基丙基三甲氧基硅烷。滴加完毕搅拌10 min后升温至62 ℃,反应24 h。用冰乙酸调反应液pH值为5.5,过滤。在滤液中加入2.0 g活化后的硅胶,90 ℃下反应2 h,过滤,依次用500 mL水、100 mL甲醇、100 mL丙酮充分洗涤填料,50 ℃下真空干燥4 h。采用匀浆法将上述填料装填入尺寸为50 mm×4.6 mm的不锈钢柱内。

图 1 以氨基己酸为配基的WCX/HIC双功能色谱固定相的合成Fig. 1 Synthetic procedures of weak cation exchange chromatography/hydrophobic interaction chromatography (WCX/HIC) dual-function stationary phase with aminocaproic acid as the ligand
1.2.2 色谱条件
HIC模式:流动相A为3.0 mol/L (NH4)2SO4+20 mmol/L KH2PO4,pH 7.0;流动相B为20 mmol/L KH2PO4, pH 7.0。WCX模式:流动相A为20 mmol/L KH2PO4, pH 6.5;流动相B为20 mmol/L KH2PO4+1.0 mol/L NaCl,pH 6.5。所有流动相经0.45 μm微孔滤膜过滤后使用。流速:1.0 mL/min;线性梯度洗脱:0~100%B,30 min;检测波长:280 nm。
1.2.3 溶菌酶的活性测定方法
参照文献[18]用溶壁球菌为底物测定溶菌酶的活性:取50 mg溶壁球菌溶于100 mL磷酸盐缓冲溶液(pH=7.0)中,25 ℃恒温搅拌混合5 min,用磷酸盐缓冲液将其250 nm处的吸光度值调至0.6~0.8,移取3.0 mL溶壁球菌菌液于比色皿中,在450 nm处以磷酸盐缓冲溶液做参比测定吸光度,加入10 μL溶菌酶溶液,每隔30 s测一次吸光度值,共读3 min,以吸光度对时间作图,取最初线性部分,其斜率即为吸光度值的变化率。以吸光度值的变化率对加入标准蛋白质的质量作图。用同样的方法测定样品吸光度值的变化率,依据标准曲线求得蛋白质的浓度,与同时测定的标准蛋白质浓度比较便可计算出活性回收率。
1.2.4 蛋白质含量的测定
采用Bradford法[19]测定蛋白质含量:取7个5 mL离心管,每个加入2 mL考马斯亮蓝溶液。在1~6号管分别加入质量浓度为0.2 g/L的标准牛血清白蛋白溶液0、20、40、80、100、120 μL, 7号管中加入适量样品溶液。加入0.15 mol/L NaCl溶液至溶液总体积为2.12 mL,混合均匀,在595 nm处测定标准曲线的吸光度值和样品溶液的吸光度值,据测定的蛋白质质量浓度计算相应蛋白质的质量。
1.2.5 蛋白质回收率的测定
在WCX和HIC模式下分别测定蛋白质的质量回收率。配制质量浓度为5 g/L的蛋白质溶液,在WCX和HIC模式下分别进样,每次进样50 μL,收集样品峰蛋白质,采用Bradford法测定样品峰的蛋白质质量浓度,据测定的蛋白质质量浓度计算相应蛋白质的质量回收率。质量回收率(%)=(回收蛋白质质量/进样蛋白质质量)×100%。
1.2.6 静态吸附量的测定
分别考察了WCX和HIC缓冲体系中溶菌酶的吸附平衡。向离心管中加入10 mg合成的双功能色谱填料,然后加入5 mL现配的0.5 g/L溶菌酶溶液(溶菌酶溶于20 mmol/L KH2PO4, pH 6.5),置于25 ℃恒温摇床中振荡,每隔1 h取出离心管,以10 000 r/min的速度离心10 min,取上清液,迅速进行蛋白质含量测定,参比液为不含蛋白质的空白缓冲液,用紫外分光光度计在595 nm下测定20 mmol/L KH2PO4(pH=6.5)和2 mol/L (NH4)2SO4+20 mmol/L KH2PO4(pH=7.0)的缓冲体系吸附蛋白质后的吸光度值,直至吸附量不变为止。
2 结果与讨论
2.1 氨基己酸为配基的WCX/HIC双功能固定相对蛋白质的分离
如图1所示,氨基己酸通过氨基与γ-缩水甘油醚氧基丙基三甲氧基硅烷的环氧基团反应后,再与活化后硅胶反应,将氨基己酸修饰到硅胶表面。所合成的固定相配基中含有羧基,在低盐浓度条件下可表现出WCX的性质;同时,该配基具有一定的疏水性,在高盐浓度条件下可表现出HIC的性质。因此,分别考察了该MMC固定相在WCX和HIC两种模式下对蛋白质的分离效果,结果如图2所示。
在HIC模式下,考察了细胞色素C、肌红蛋白、核糖核酸酶A、溶菌酶、α-淀粉酶和胰岛素6种疏水性不同的蛋白质在此WCX/HIC双功能色谱柱上的色谱行为,并与最常用的HIC商品柱TSKgel Ether-5PW进行了对比。如图2a和2c所示,该色谱固定相在HIC模式下可使6种标准蛋白质完全分离,其分离能力与HIC商品柱相当。
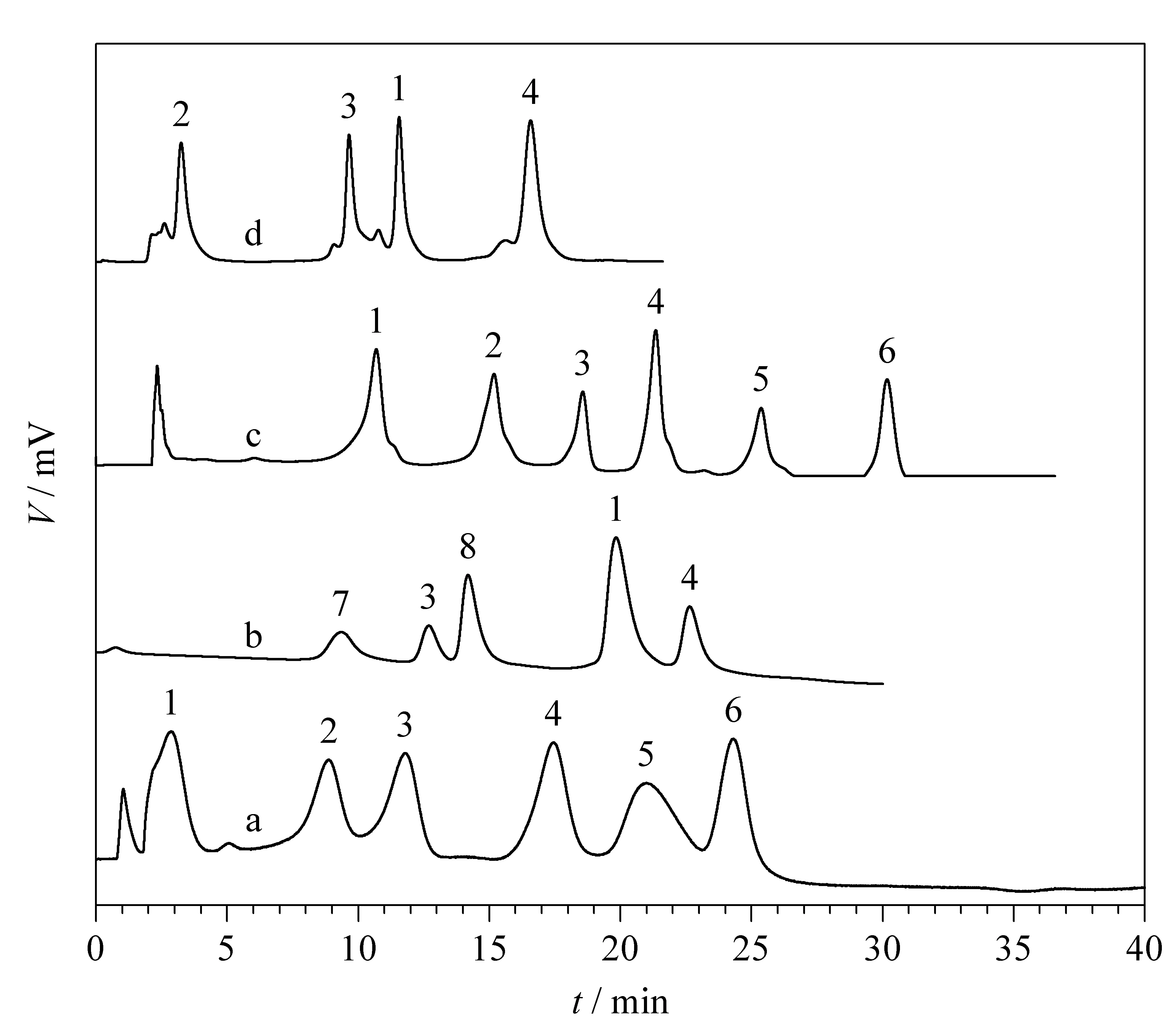
图 2 WCX/HIC双功能色谱柱及两根商品柱 对蛋白质分离的比较Fig. 2 Chromatograms of the proteins separated by WCX/HIC dual-function mixed mode chromatography (MMC) column and comparison with two commercially available columns a. HIC mode of dual-function MMC column; b. WCX mode of dual-function MMC column; c. HIC mode of TSKgel Ether-5PW; d. WCX mode of TSKgel CM-5PW. The size of the TSK column was 75 mm×7.5 mm. The size of the dual-function column was 50 mm×4.6 mm. Mobile phases in the HIC mode: solution A was 3.0 mol/L (NH4)2SO4+0.02 mol/L KH2PO4 (pH 7.0) and solution B was 0.02 mol/L KH2PO4 (pH 7.0). Mobile phases in the WCX mode: solution A was 0.02 mol/L KH2PO4 (pH 6.5) and solution B was 0.02 mol/L KH2PO4+1.0 mol/L NaCl (pH 6.5). Flow rate: 1.0 mL/min; linear gradient elution: 30 min, 0-100% mobile phase B; detection wavelength: 280 nm. Peaks: 1. cytochrome C (30 μg); 2. myoglobin (50 μg); 3. RNase A (50 μg); 4. lysozyme (15 μg); 5. α-amylase (40 μg); 6. insulin (50 μg); 7. RNase B (50 μg); 8. α-chymotrypsingen A (25 μg).
在WCX模式下,考察了卵白蛋白(pI4.7)、牛血清白蛋白(pI4.98)、α-乳清蛋白(pI5.2)、胰岛素(pI5.35)和α-淀粉酶(pI6.0)5种酸性蛋白质以及核糖核酸酶B(pI8.8),核糖核酸酶A(pI9.4)、α-糜蛋白酶原A(pI9.2)、细胞色素C(pI10.6)和溶菌酶(pI11.0)等5种碱性蛋白质在该WCX/HIC双功能固定相上的色谱行为,结果表明,上述5种酸性蛋白质均未在该色谱柱上保留,5种碱性蛋白质达到基线分离(见图2b)。在TSKgel CM-5PW柱上核糖核酸酶B与核糖核酸酶A、细胞色素C与α-糜蛋白酶原A色谱峰完全重叠,无法分离,只有4种碱性蛋白质可达到基线分离(见图2d)。表明所合成的双功能色谱固定相在WCX模式下对蛋白质的分离能力优于商品柱TSKgel CM-5PW。上述结果表明,这种双功能固定相在两种模式下对蛋白质均表现出较高的分离度和选择性,其分离能力可与商品柱相媲美,在一根双功能色谱柱上实现了“一柱二用”的功能。
2.2 质量回收率、活性回收率和静态吸附量
蛋白质的质量回收率和活性回收率是衡量色谱柱优劣的重要指标。选择了4种在WCX和HIC模式下均保留的蛋白质,分别测定了两种模式下它们的质量回收率和活性回收率,结果如表1所示。在WCX和HIC两种分离模式下,蛋白质的质量回收率均不低于95%,表明该双功能固定相对蛋白质的不可逆吸附很小。溶菌酶在WCX和HIC模式下的活性回收率分别为93.5%和95.3%。在WCX(20mmol/L KH2PO4)和HIC(20 mmol/L KH2PO4+2.0 mol/L (NH4)2SO4)模式下测定的溶菌酶静态吸附量分别为145.2 mg/g和98.3 mg/g。

表 1 WCX和HIC模式下蛋白质的质量回收率(n=5)
所合成的氨基己酸为配基的WCX/HIC双功能色谱固定相在IEC和HIC模式下对蛋白质的分离能力与相应的商品柱相当,且具有高的质量回收率、活性回收率和负载量,适于生物大分子的分离。
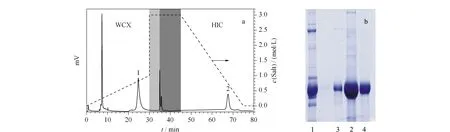
图 4 在线单柱二维液相色谱法对蛋清中溶菌酶纯化的(a)色谱图和(b)SDS-PAGE图Fig. 4 (a) Chromatogram and (b) sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) analysis of egg white separated by 2DLC-1C (a) chromatogarphic conditions were the same as those in Fig. 3. Peaks in (a): 1. lysozyme purified with WCX mode; 2. lysozyme separated by the second dimensional with HIC mode. Lanes in (b): 1. egg white; 2. fraction of peak 1; 3. fraction of peak 2; 4. lysozyme.

图 3 在线单柱二维液相色谱法对8种蛋白质的分离色谱图Fig. 3 Chromatogram of eight proteins separated by on-line two-dimensional liquid chromatography with a single column (2DLC-1C) Mobile phases in the HIC mode: solution A was 3.0 mol/L (NH4)2SO4+0.02 mol/L KH2PO4 (pH 7.0) and solution B was 0.02 mol/L KH2PO4 (pH 7.0). Mobile phases in the WCX mode: solution A was 0.02 mol/L KH2PO4 (pH 7.0) and solution B was 1.0 mol/L (NH4)2SO4+0.02 mol/L KH2PO4 (pH 7.0). Flow rate: 1.0 mL/min. The gradient elution program is represented by the dashed line in the chromatogram. The blue shaded area represents the column equilibrium process with solution A for 5 min, and the yellow shaded area represents the second dimensional online sample injection process. Peaks: 1. RNase B; 2. RNase A; 3. α-chymotrypsin A; 4. cytochrome C; 5. lysozyme; 6. bovine serum albumin; 7. ovalbumin; 8. insulin.
2.3 在线单柱二维液相色谱对蛋白质的分离
如前所述,氨基己酸为配基的双功能色谱柱在WCX和HIC两种模式下对蛋白质均有较高的分离能力和选择性,可替代两根相应单模式色谱柱。由于WCX和HIC的分离机理是正交的,结合阀切换技术,采用一根该双功能色谱柱构建了在线2DLC-1C分离系统,并用于标准蛋白质的分离,结果如图3所示。8种标准蛋白质经过第一维WCX分离后,5种碱性蛋白质完全分离,牛血清白蛋白、卵白蛋白和胰岛素3种酸性蛋白质不保留而随溶剂峰直接流出,收集其馏分于样品环Ⅰ中。当第一维WCX模式梯度洗脱完成后,用3.0 mol/L (NH4)2SO4溶液平衡色谱柱5 min,以使其转换为HIC模式,对第一维未分离馏分进行第二维HIC分离。经过HIC分离后,牛血清白蛋白、卵白蛋白和胰岛素这3种酸性蛋白质也被完全分离。所以,利用一根WCX/HIC功能色谱柱所构建的在线2DLC-1C在60 min内完成了8种蛋白质的快速分离纯化。
2.4 在线单柱二维液相色谱对蛋清中溶菌酶的纯化
为进一步验证所合成的WCX/HIC双功能色谱固定相对蛋白质样品的分离能力,利用图3建立的在线单柱二维液相色谱法对蛋清中的溶菌酶进行纯化。图4a为以鸡蛋清处理液为样品,进样量为500 μL的色谱图。经第一维WCX分离,将溶菌酶同其他杂质分离,收集溶菌酶样品峰1。对系统进行重新平衡,转换为HIC模式后,将第一维收集的溶菌酶馏分重新进样进行第二维HIC精纯化,收集各步溶菌酶的样品峰,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定,并进行纯度扫描,电泳结果见图4b,纯度结果见表2。结果表明,本试验成功地利用在线2DLC-1C将鸡蛋清中溶菌酶的纯度由30.3%提高到98.3%。

表 2 在线2DLC-1C对鸡蛋清中溶菌酶分离纯化后的纯度
3 结论
以硅胶为基质、氨基己酸为配基合成了一种新型WCX/HIC双功能色谱固定相,该介质可分别在WCX和HIC模式下对蛋白质进行分离,具有较高的分离度和选择性,分离能力与相应的单模式商品柱相当,具有“一柱二用”功能,可替代两根单模式的HIC和WCX色谱柱使用。基于此构建的在线2DLC-1C可在60 min内实现8种蛋白质的快速分离,且成功地纯化了鸡蛋清中的溶菌酶,纯度达98.3%。两种模式共用相同的盐水体系流动相,不仅克服了传统2DLC流动相不兼容的难题,而且一根色谱柱可当作两根色谱柱使用,可大大降低分离介质的用量,降低生产成本,对蛋白质组学研究及重组蛋白药物的生产具有重要的应用价值。
[1] Dong Y, Yu Z M, Li H Y, et al. Chinese Journal of Chromatography, 2016, 34(8): 811
董宇, 俞忠明, 李洪玉, 等. 色谱, 2016, 34(8): 811
[2] Hu Z T, Xiao Z, Zhou X, et al. Chinese Journal of Chromatography, 2015, 33(6): 628
胡朝暾, 肖震, 周熙, 等. 色谱, 2015, 33(6): 628
[3] Zhang Q Q, Zhang L, Gao X D, et al. Chinese Journal of Chromatography, 2014, 32(11): 1271
张权青, 张磊, 高小迪, 等. 色谱, 2014, 32(11): 1271
[4] Zhang Y H, Qibule H, Jin Y, et al. Chinese Journal of Chromatography, 2015, 33(3): 291
张艳海, 其布勒哈斯, 金燕, 等. 色谱, 2015, 33(3): 291
[5] Huang Z, Hong G F, Gao M X, et al. Chinese Journal of Chromatography, 2014, 32(4): 343
黄志, 洪广峰, 高明霞, 等. 色谱, 2014, 32(4): 343
[6] Zhu G J, Liang Z, Zhang L H, et al. Chinese Journal of Chromatography, 2009, 27(5): 518
朱贵杰, 梁振, 张丽华, 等. 色谱, 2009, 27(5): 518
[7] McLaughlin L W. Chem Rev, 1989, 89(2): 309
[8] Asenjo J A, Andrews B A. J Mol Recognit, 2004, 17(3): 236
[9] Liu P, Yang H Y, Geng X D. J Chromatogr A, 2009, 1216: 7497
[10] Sun X, Yang Y, Geng X D. Journal of Analytical Science, 2010, 26(1): 6
孙萱, 杨云, 耿信笃. 分析科学学报, 2010, 26 (1): 6
[11] Zhao K L, Yang L, Wang X J, et al. Talanta, 2012, 98: 86
[12] Song C, Wang J S, Zhao K L, et al. Biomed Chromatogr, 2013, 27(12): 1741
[13] Zhao K L, Yang F, Xia H J, et al. J Sep Sci, 2015, 38(5): 703
[14] Geng X D, Ke C Y, Chen G, et al. J Chromatogr A, 2009, 1216(16): 3553
[15] Yang X M, Yu Y, Geng X D. Scientia Sinica Chimica, 2013, 43(5): 599
杨晓明, 余炜, 耿信笃. 中国科学: 化学, 2013, 43(5): 599
[16] Yang F, Bai Q, Zhao K L, et al. Anal Bioanal Chem, 2015, 407(6): 1721
[17] Wang J S, Xia H J, Wan G P, et al. Acta Chimica Sinica, 2016, 74(3): 265
王建山, 夏红军, 万广平, 等. 化学学报, 2016, 74(3): 265
[18] Goldberg M E, Rudolph R, Jaenicke R. Biochemistry-US, 1991, 30(11): 2790
[19] Bradford M M. Anal Biochem, 1976, 72(1): 248
A novel dual-function weak cation exchange/hydrophobic interaction chromatography stationary phase with aminocaproic acid as the ligand for protein separation
WANG Jianshan, XIA Hongjun, WAN Guangping, LIU Jiawei, BAI Quan*
(KeyLaboratoryofSyntheticandNaturalFunctionalMoleculeChemistryofMinistryofEducationofChina,InstituteofModernSeparationScience,NorthwestUniversity,ProvincialKeyLaboratoryofModernSeparationScienceofShaanxi,Xi’an710069,China)
A novel dual-function mixed-mode stationary phase based on silica gel functionalized with aminocaproic acid as the ligand was prepared. Because of the ligand with hydrophobicity and containing carboxyl function groups, it could display hydrophobic interaction chromatography (HIC) character in a high salt concentration mobile phase and weak cation exchange chromatography (WCX) character in a low salt concentration mobile phase. As a result, it could be employed to separate proteins with both WCX and HIC modes. The resolution and selectivity of the stationary phase were evaluated under both HIC and WCX modes with protein standards. In comparison with the conventional WCX and HIC columns, the results were satisfactory and acceptable. Protein mass and bioactivity recoveries of more than 93% could be achieved in both WCX and HIC mode using this column. The results indicated that the novel dual-function mixed-mode column in many cases could replace the use of two individual WCX and HIC columns. Based on this two-dimensional (2D) column, a new two-dimensional liquid chromatography (2DLC) technology with a single column (2DLC-1C) was developed. Eight kinds of protein standards could be separated completely with online 2DLC-1C within 60 min. It was also applied to purify lysozyme from egg white successfully with a purity of 98.3%. It is important to proteome research and recombinant protein drug production for saving column expense and simplifying the process in biotechnology.
stationary phase; mixed-mode chromatography (MMC); ion-exchange chromatography (IEC); hydrophobic interaction chromatography (HIC); two-dimensional liquid chromatography (2DLC)
10.3724/SP.J.1123.2016.08019
2016-08-18
国家自然科学基金项目(21545007);陕西省科技统筹创新工程计划项目(2013SZS18-K01);陕西省重点实验室重点科研项目(2010JS103,11JS097,14JS098,15JS115).
Foundation item: National Natural Science Foundation of China (No. 21545007); Shaanxi Provincial Science and Technology Co-ordinating Innovation Projects (No. 2013SZS18-K01); Key Research Program of Shaanxi Province Key Laboratory (Nos. 2010JS103, 11JS097, 14JS098, 15JS115).
O658
A
1000-8713(2016)12-1228-06
邹汉法研究员纪念专辑(上)·研究论文
* 通讯联系人. E-mail:baiquan@nwu.edu.cn.
