多孔整体材料在固相微萃取中的应用研究进展
2016-12-14黄晓佳
梅 萌, 黄晓佳
(厦门大学环境与生态学院, 滨海湿地生态系统教育部重点实验室, 福建 厦门 361005)
多孔整体材料在固相微萃取中的应用研究进展
梅 萌, 黄晓佳*
(厦门大学环境与生态学院, 滨海湿地生态系统教育部重点实验室, 福建 厦门 361005)
作为新型的样品前处理技术,固相微萃取由于具有操作简便、使用灵活、样品用量少、环境友好以及便于与分析仪器联用等优点而受到人们的广泛青睐。多孔整体材料具有通透性好、传质速度快、制备简单和易于改性等优点,目前被广泛用于包括样品前处理在内的诸多领域。文章结合作者的研究工作,对近几年整体材料在固相微萃取中的应用研究进行综述,并对其发展方向进行了展望。
固相微萃取;整体材料;吸附剂;综述
实际样品基底和组成复杂、干扰物质多、目标物含量较低,因此难以直接对其进行分析检测。为了减少样品基底的干扰和提高分析检测灵敏度,在进行分离分析前必须进行合适的样品前处理。由于传统的样品前处理技术如离心、蒸馏、过滤、液-液萃取等方法存在劳动强度大、操作时间长、步骤繁琐、使用有机溶剂量大等缺点,因此发展简便、有效和绿色环保的前处理技术成为人们关注的研究热点之一。
1990年,加拿大滑铁卢大学的Pawliszyn等[1]首次提出了固相微萃取技术(solid-phase microextraction, SPME),其在一根熔融石英纤维的表面涂渍一层固定相(吸附剂)作为萃取涂层,利用扩散作用,将溶液中的目标物吸附在涂层上,当吸附达到平衡后,将石英纤维插入专门的热解吸装置进行脱附,目标物随后进入气相色谱(GC)进行分离检测。SPME集富集、净化和进样于一体,克服了传统前处理技术的不足,具有操作方便灵活、萃取速度快、环境友好和易于与分析仪器进行在线联用等优点。
近年来,为了满足分析的需要以及绿色化学的要求,除了传统的纤维固相微萃取(fiber-based solid-phase microextraction, FBSPME)[2-5]外,还出现了各种新型的SPME模式,主要包括纤维束固相微萃取(multiple fibers solid-phase microextraction, MF-SPME)[6,7]、管内固相微萃取(in-tube solid-phase microextraction, IT-SPME)[8,9]、搅拌棒吸附萃取(stir bar sorptive extraction, SBSE)[10,11]、芯片微萃取(chip-based microextraction, CBME)[12,13]、针尖微萃取(tip-based microextraction, TBME)[14,15]。上述不同的微萃取模式虽然具有不同的特点和适用范围,但它们最核心的部分都是萃取介质(吸附剂),它决定了萃取的选择性、容量和萃取速度,从而影响整个分析方法的灵敏度、准确度和适用范围。理想的SPME萃取介质不仅应该具有较好的热和化学稳定性、较高的机械强度,而且需对特定的一种或一类目标物有较高的选择性和萃取容量。目前商品化的SPME涂层种类较少,主要为聚二甲基硅氧烷(polydimethylsiloxane, PDMS)、聚丙烯酸酯(polyacrylate, PA)、二乙烯基苯(divinylbenzene, DVB)及它们的复合体,这些吸附剂虽然得到了较广泛的使用,但也存在诸如萃取选择性和机械稳定性差、对极性化合物萃取效率低、成本高等缺点[16]。因此发展具有高萃取效率和萃取选择性、良好的热和化学稳定性、低成本的萃取介质成为SPME的研究热点。
1989年,Hjertén研究小组[17]利用“原位”聚合的方法在空管柱中聚合生成高交联的聚丙烯酰胺凝胶整体材料并称之为“连续床”。Svec等[18]则利用甲基丙烯酸缩水甘油酯和乙二醇二甲基丙烯酸酯“原位”聚合得到一种渗透性能良好的多孔整体材料,并将其用于蛋白质的快速分离。随后Tanaka、Frechet以及邹汉法等[19-21]在多孔整体材料的合成和应用方面也开展了大量的研究工作,进一步推动了相关研究的发展。按照基质不同,整体材料可分为无机整体材料和有机聚合物整体材料。无机整体材料可通过溶胶-凝胶等方法得到,这类整体材料具有理想的机械强度,比表面积大,其缺点是抗溶剂性能差,适用的pH范围小。而有机聚合物整体材料可通过单体、交联剂和致孔剂的聚合溶液在紫外光引发或热引发条件下“原位”聚合得到,虽然该类整体材料的溶胀和机械性能不及无机整体材料,但其具有选材范围广、制备简单、pH适用范围宽等独特优势。目前,整体材料已被广泛用作HPLC[22]、毛细管液相色谱[23]和毛细管电色谱[24]的固定相,被称为第四代分离介质。基于整体材料高吸附容量和高通透性能等优点,近几年来人们开始将其用于样品前处理特别是SPME的萃取介质。为此,本文结合作者自己的研究工作,对近几年整体材料在SPME中的应用进行阐述。
1 纤维固相微萃取
FBSPME是较早发展的SPME萃取模式,萃取介质主要通过物理涂覆或化学键合在基体支撑物如石英毛细管、金属丝等载体上。目前,除了商品化的SPME涂层外,整体材料也被人们引入到FBSPME涂层制备中。Li等[25]以甲基丙烯酸作为功能单体、乙二醇二甲基丙烯酸酯作为交联剂合成整体材料并将其作为SPME萃取涂层,他们将聚合溶液以及预处理过的石英纤维转移至玻璃毛细管模具中,在热引发作用下聚合得到涂层厚度均匀且厚度为30 μm的SPME萃取纤维。研究表明,所合成的整体纤维对2,3,4,6-四氯酚和五氯酚萃取效果优于商品化的PA纤维。同时,该纤维具有良好的热稳定性和使用寿命。
为了提高FBSPME的萃取选择性,人们发展了基于分子印迹聚合物(molecularly imprinted polymers, MIPs)的FBSPME。胡梅等[26]以双酚A为模板分子,α-甲基丙烯酸为功能单体,在内径为530 μm的毛细管中采用微波聚合的方式快速制备得到双酚A分子印迹固相微萃取头,将其与高效液相色谱法结合成功用于饮料中双酚A的检测,所建立的方法具有简便、分析快速、检出限低等特点。Qiu等[27]以睾酮为模板分子,在石英纤维上合成了厚度为3.1 μm的MIP涂层,将合成的MIP纤维用来萃取环境水样和人体尿液中的类固醇类激素,萃取后将纤维直接转移至GC-MS的进样口进行热脱附并分离测定。通过比较,该方法制备的SPME萃取纤维对类固醇类激素的萃取效果远远优于商品化的PDMS涂层纤维。Djozan等[28]为了解决石英纤维易折断的问题,首次使用铝丝作为基体,制备出了可对三嗪类目标物进行选择性萃取的莠灭净MIP涂层。该方法预先将铝丝经过阳极氧化和硅烷化处理,然后采用实验室自制的气压喷雾器将聚合溶液喷洒在铝丝上,在紫外光的引发下快速聚合,涂层厚度则通过喷洒聚合溶液以及聚合的次数来控制。Mirzajani等[29]则以不锈钢丝作为基体,制备出了厚度为20 μm的环丙沙星MIP萃取涂层,该萃取涂层能对环丙沙星及其类似物进行选择性地识别和萃取。与非印迹涂层相比,MIP萃取纤维对氟喹诺酮抗生素的萃取效率得到明显提高。
涂覆于基底支撑体的萃取介质,在使用过程中有时会从支撑体上脱落而影响FBSPME的使用寿命。为了解决该问题,2007年,Djozan等[30]和Turiel等[31]几乎同时报道出了一种基于MIPs整体材料的无基体萃取纤维的制备方法。他们均以玻璃毛细管作为模具,将含有模板分子的聚合溶液注入毛细管中,然后用橡胶塞住毛细管两端,在一定温度下“原位”聚合一段时间,聚合后,除去毛细管磨具即可得到无基体萃取纤维。Shi等[32]采用聚合-碳化的方法,以苯乙烯和二乙烯基苯为前驱体、月桂醇为致孔剂在内径为250 μm的石英毛细管内聚合得到整体材料,经过高温碳化之后制备得到了一种多孔碳整体纤维,再将其胶合在商品化的SPME萃取头上即可得到无支撑体SPME萃取纤维。该萃取纤维具有较高的比表面积,对苯酚类目标物有理想的萃取效果。本研究小组也利用整体材料的“原位”聚合特性制备了无支撑体SPME萃取纤维并用于氯代酚[3]和苏丹红染料[33]的萃取。
已有的研究表明,整体材料可作为FBSPME的理想萃取介质,针对不同类型污染物,发展基于整体材料,具有高通透性、高萃取选择性和良好使用寿命的FBSPME涂层仍值得深入研究。
2 纤维束固相微萃取
通常FBSPME的涂层较薄,萃取容量较低,为了提高萃取容量势必要增加涂层的厚度,但这将会导致萃取时间的延长。因此,发展在较短时间内实现对目标物高容量萃取的纤维具有重要的实际意义。为此,我们在2014年提出了基于整体材料的纤维束固相微萃取技术(multiple monolithic fibers solid-phase microextraction, MMF-SPME)[7]。该方法首先将含有单体、交联剂、致孔剂和引发剂的聚合溶液注入内径为0.53 mm的玻璃毛细管,使其在热引发条件下发生“原位”聚合,反应完后将外层玻璃毛细管除去,得到直径为0.5 mm、长度为2 cm的单根细整体纤维;然后将4根细纤维捆绑在一起即可得到基于整体材料的微萃取纤维束。研究以氯代苯酚为目标物,将制备得到的纤维束与直径为1 mm、长度为2 cm的单根粗纤维(其所含吸附剂的质量与纤维束所含吸附剂的总质量相等)的萃取性能进行了比较。结果表明,在MMF-SPME中,由于玻璃毛细管壁的存在,使得纤维束的单根纤维之间存在着空隙(见图1a),这使得样品溶液在萃取过程中能形成有效的对流,加快萃取和解吸速度。同时,与传统的涂层纤维相比,由于纤维束所含的萃取介质较多,因此对目标物有更高的萃取容量。图1b为纤维束实物照片图。

图 1 纤维束的(a)3D示意图和(b)实物图[7]Fig. 1 (a) 3D schematic diagram and (b) photo of multiple monolithic fibers[7]
随后,我们以1-烯丙基-3-甲基咪唑双(三氟甲烷磺酰)亚胺盐离子液体为功能单体[6,34,35],采用同样的方法制备了基于离子液体的整体材料微萃取纤维束。将MMF-SPME与液相解吸技术结合,并与HPLC-二极管阵列检测器(DAD)联用,成功用于环境水样中的硝基苯酚[6]以及牛奶和人体尿液中雌激素[34,35]的测定。MMF-SPME的萃取介质使用灵活,可根据目标化合物的性质进行合成。为了有效萃取环境水样中苯甲酰脲类农药以及果汁中有机酸类防腐剂,我们分别以甲基丙烯酸[36]和乙烯基咪唑[37]等作为功能单体合成纤维束,对目标物均取得了满意的萃取效果。
相比单根萃取纤维的FBSPME, MMF-SPME具有高萃取容量和快速萃取的优点。但本组已有研究均采用离线的液相解吸模式,目前还无法实现与分析仪器的在线联用。
3 管内固相微萃取
IT-SPME通常以石英毛细管柱作为萃取介质的载体,在管内壁涂上固定相或者在管内部填充介质,故又称毛细管固相微萃取,是由Eisert和Pawlisyzn[38]在1997年首次提出。由于该萃取模式容易实现与分析仪器的在线联用,有利于缩短分析时间,提高分析结果的准确度和精密度,所以一经问世便得到快速的发展。按照固定相的存在形式,IT-SPME可分为开管柱内固相微萃取、填充柱内固相微萃取以及整体柱内固相微萃取。与前面两种相比,整体柱内固相微萃取利用整体材料作为IT-SPME的萃取介质,具有制备简单、萃取效率高、通透性好和重现性好等诸多优点。
Feng的研究小组合成了一系列有机聚合物整体毛细管柱,主要包括聚(甲基丙烯酸-乙二醇二甲基丙烯酸酯)[39]、聚(丙烯酰胺-乙烯基吡啶-N,N′-亚甲基双丙烯酰胺)[40]、聚(甲基丙烯酸缩水甘油酯-乙二醇二甲基丙烯酸酯)[41]、聚(N-异丙基丙烯酰胺-乙二醇二甲基丙烯酸酯)[42]、聚(4-乙烯基吡啶-乙二醇二甲基丙烯酸酯)[43]整体柱,他们将这些整体微柱作为IT-SPME的萃取柱,与HPLC-UV[39-42]、HPLC-MS[43]等进行了在线联用,在实际应用中取得了预期的效果。
为了进一步提高整体毛细管柱的萃取效果,人们将纳米材料掺杂到有机整体柱中,利用纳米材料粒径小、比表面积大等特殊性质来改性聚合物整体柱。Tong等[44]用氧化石墨烯(graphene oxide, GO)对整体柱进行改性,首先采用“原位”聚合的方法制备聚(甲基丙烯酸缩水甘油酯-乙二醇二甲基丙烯酸酯)整体柱,随后用乙二胺对整体柱改性以引入氨基,再通过氨基与GO表面的羧基发生脱水缩合反应将GO键合到整体柱上得到GO改性整体柱,若将其进一步还原则可得到石墨烯纳米片改性整体柱。他们将得到的GO改性整体毛细管柱与LC-MS/MS联用,成功应用于尿液中肌氨酸的测定。但是,该方法中整体毛细管柱的改性过程较为繁琐。Wang等[45]则直接将单壁碳纳米管加入到甲基丙烯酸和乙二醇二甲基丙烯酸酯的聚合溶液中,“原位”聚合得到一种新型整体柱,首次实现了IT-SPME与实时分析质谱(DART-MS)的在线联用。研究表明,与未引入单壁碳纳米管的整体柱相比,新型整体柱具有更大的比表面积。该整体柱对三嗪类的萃取效果是未引入单壁碳纳米管整体柱萃取效果的2.1~4.2倍,有效地提高了分析方法的灵敏度和准确度,并成功用于湖水和果汁中三嗪类杀虫剂的测定。最近,我们发展了一种基于整体材料的磁增强管内固相微萃取技术(magnetism-enhanced monolith-based in-tube solid phase microextraction, ME-MB/IT-SPME)[46]。该技术通过在聚合溶液中加入改性后的Fe3O4纳米颗粒,“原位”聚合得到掺杂磁性纳米粒子的整体毛细管萃取柱。然后在整体柱外缠绕磁线圈,通过外加电源诱导Fe3O4在整体材料中产生磁场,利用有机分子的反磁性原理,可明显提高萃取效率。已取得的结果表明,萃取柱对6种雌激素的萃取效率由未施加磁场时的30%~65%(见图2a)提高至加磁场时的70%~100%(见图2b),故ME-MB/IT-SPME是提升IT-SPME对有机物萃取效率的有效途径,值得进行更深入的研究。
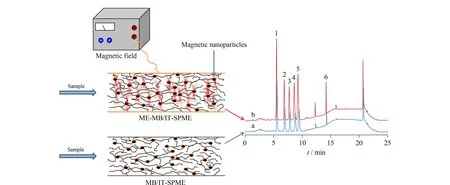
图 2 基于整体材料的磁增强管内固相微萃取技术对6种雌激素的萃取[46]Fig. 2 Magnetism-enhanced monolith-based in-tube solid phase microextraction (ME-MB/IT-SPME) for the extraction of the six estrogens[46]a. treated with MB/IT-SPME; b. treated with ME-MB/IT-SPME.Analytes: 1. bisphenol A; 2. ethinylestradiol; 3. estrone; 4. diethylstilbestrol; 5. dienestrol; 6. nonylphenol.
为了提高IT-SPME的选择性,分子印迹技术也被应用到整体毛细管柱的制备中。Zhang等[47]以鸟嘌呤核苷作为模板分子合成分子印迹整体毛细管柱,将MIP/IT-SPME与HPLC-UV联用,对人尿中的8-羟基脱氧鸟苷进行分析。研究表明,该MIP整体柱对模板分子有较高的富集选择性,富集倍数高达76倍,所建立的方法只需15 min便可完成对目标物的测定和分析,具有简单快速、灵敏度高等优点。
4 搅拌棒固相萃取
SBSE是在1999年由Baltussen等[48]首次提出并由Gerstel公司商品化的一种新型固相微萃取模式。与FBSPME相比,SBSE的萃取涂层体积更大,因此具有更高的萃取容量。SBSE由内封磁芯的玻璃管和玻璃管上涂敷的萃取介质两部分组成,萃取时,直接将搅拌棒浸入样品溶液中,在自身搅拌的同时完成对目标物的萃取,可消除搅拌磁子的竞争吸附。吸附完成后,可通过热脱附或溶剂解吸将目标物从SBSE上解吸出来,然后再进行GC或HPLC分析检测。
在SBSE技术中,萃取介质无疑是最核心的部分,目前商品化的SBSE涂层主要有3种,即PDMS、由PDMS改性得到的乙二醇-硅氧烷共聚物(ethylene glycol-silicone, EG-Silicone)以及PA。以PDMS为涂层的搅拌棒对中性或者弱极性的化合物有较好的萃取效果,而对于极性化合物的萃取效果较差,要实现对极性化合物的萃取,一般需要通过衍生步骤将其衍生为疏水性化合物,然后再进行萃取,衍生过程繁琐且衍生试剂会对涂层造成损伤。EG-Silicone和PA对极性有机物具有一定的萃取效果,但对于强极性的化合物,其应用仍受到限制。Gilart等[49]对比考察了这3种商品化搅拌棒对不同极性的药品及个人护理品(pharmaceuticals and personal care products, PPCPs)的萃取效果。结果表明,PDMS对弱极性的PPCPs有较好的萃取效果,但对极性PPCPs的萃取效果较差;而EG-Silicone和PA对极性和弱极性的PPCPs均有一定的萃取效果,且EG-Silicone的萃取效果好于PA的效果,但是对于对乙酰氨基酚(logKo/w=0.5)、安替比林(logKo/w=1.4)等强极性的化合物,EG-Silicon的萃取效果仍然不理想(回收率<3%)。以上种种原因使得商品化SBSE的使用受到了限制。因此,发展新型的特别是可对极性化合物进行直接有效萃取的涂层成为SBSE的主要研究方向。
本研究小组首次将整体材料引入到SBSE萃取涂层的合成中[50],分别以甲基丙烯酸十八烷基酯[51]、乙烯基吡啶[52]、乙烯基吡咯烷酮[53]、乙烯基咪唑[54]和N-乙烯基邻苯亚胺[55]等单体制备了一系列基于整体材料的疏水型[51]、亲水型[52-55]、混合型[56]和离子交换型[57]SBSE,并成功用于环境水样中极性苯酚类化合物[53]、硝基呋喃类药物[54]、喹诺酮类化合物[56]、尿液中的类固醇激素[51,52]以及食品中苯并咪唑类[55]的分析检测。除此之外,Huang等[57]还分别以甲基丙烯酰乙基三甲基氯化铵和丙烯酸[58]为单体制备了阴离子交换和阳离子交换型SBSE,并成功用于无机阴离子和Ca2+、Mg2+、K+等阳离子的富集,该研究扩大了SBSE的应用范围。
以MIPs作为萃取涂层可提高SBSE的萃取选择性。Hu等[59]合成了基于MIPs整体材料的SBSE涂层。该方法以特丁津为模板分子,将事先经过预处理的直径为1 mm、长度为15 mm的玻璃毛细管的一端用丙烷火焰烧结密封,然后将其放入装有预聚合溶液的玻璃管中,在60 ℃水浴条件下聚合反应90 min,聚合反应结束之后将磁铁插入玻璃毛细管中,最后再用丙烷火焰烧结密封即可得到类似哑铃形状的搅拌棒。他们将MIP/SBSE与HPLC-UV联用,对9种三嗪类除草剂进行分析,检出限为0.04~0.12 μg/L,可直接用于大米、苹果、生菜和土壤中三嗪类除草剂的检测。Zhu等[60]以三聚氰胺为模板分子,采用类似的方法合成了MIP涂层,研究表明,与非分子印迹涂层相比,所合成的MIP涂层对模板分子有更好的萃取效果,将其与HPLC联用,探讨其对奶粉中三聚氰胺的萃取性能,取得了比较理想的结果。
SBSE虽使用简便,但由于使用过程中,萃取介质不断与玻璃容器进行接触,因此易对涂层造成磨损,甚至导致涂层的脱落。
5 芯片微萃取
微流控芯片技术,又称“芯片实验室”或“微全分析系统”,最先是应用于分离检测。它把样品制备、反应、分离、检测等基本操作单元集成在一块微米尺度的芯片上,自动完成分析全过程,其在药物筛选、疾病监测和精细化工分析等方面有很好的应用前景。但是,由于芯片上样体积及检测区域太小而导致检测灵敏度不尽如人意。因此在微流控芯片上对目标物进行预富集成为提高灵敏度的有效手段之一。CBME就是基于这种思路发展起来的样品前处理方法,具有快速高效、样品和试剂用量少等优点。
Yu等[61]在2001年首次将整体材料引入CBME中。他们在改性后的石英芯片通道中用紫外光引发“原位”聚合的方法合成了多孔整体材料。通过不同组成和配比的聚合溶液,可以获得表面性质、孔径大小等不同的整体材料。他们将CBME应用于富集香豆素519和绿色荧光蛋白,富集因子分别可达1 650和103。在此之后,基于整体材料的CBME被广泛应用于生物大分子的分析过程中。Liu等[62]制备了一种聚甲基丙烯酸酯材料的微萃取集成芯片,该芯片主要由长度分别为5 mm和15 cm的富集净化通道和分离通道组成(见图3)。他们将其与LC泵连接,建立了可对荧光标记的多肽和牛血清白蛋白进行在线富集净化的分离检测系统。Nge等[63]则在环烯烃共聚物塑料芯片通道内注入以甲基丙烯酸丁酯作为单体的聚合溶液,在紫外光条件下聚合得到疏水性的多孔整体微萃取芯片。他们将保留在芯片上的氨基酸和蛋白质进行荧光标记,建立了可在芯片上对生物大分子同时进行富集净化和荧光标记的微型分析系统。Kumar等[64]设计得到了一种集芯片微萃取和芯片电泳于一体的具有多层结构的微流体集成芯片,他们在长2 mm、深25 μm的芯片通道中合成C8整体材料,然后用蠕动泵以及气动阀来控制溶液流动,目标物在芯片上进行富集之后直接进行电泳分离。该装置对荧光标记后的铁蛋白的富集倍数达到80倍,为各种疾病的生物标志物的分析奠定了基础。
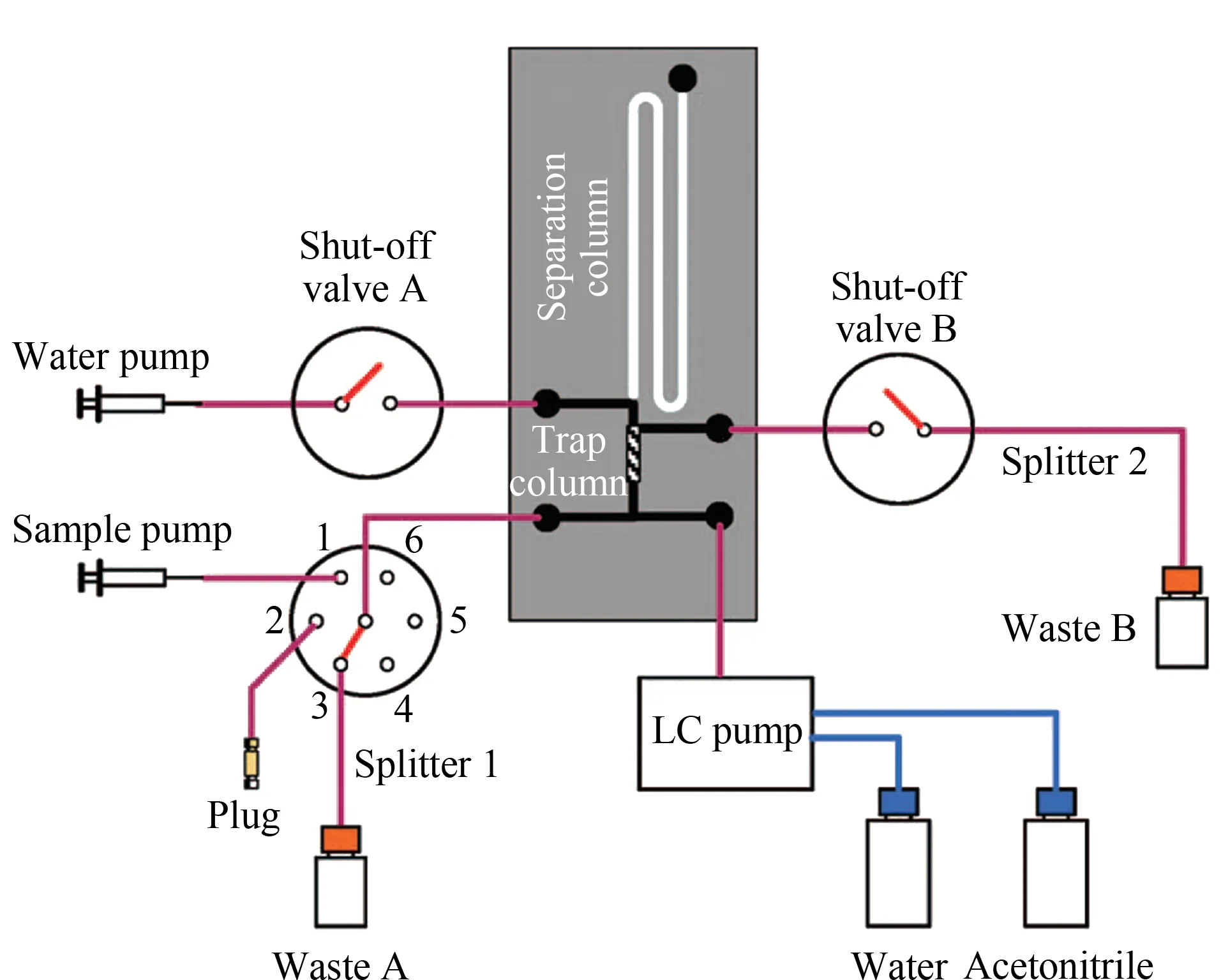
图 3 基于集成芯片的样品在线富集和分离系统[62]Fig. 3 Experimental system for online sample enrichment and separation based on integrated chip[62]
除了有机整体材料外,基于无机硅胶的整体材料也被用作CBME的萃取介质。Alzahrani等[65]采用溶胶-凝胶法制备硅胶整体材料,再用二甲基十八烷基氯硅烷对其进行改性,将改性后的整体材料用作微CBME萃取介质。该方法为蛋白质组学中蛋白质的富集提供了新的思路。
目前,CBME不仅用于生物大分子的分析,也被应用到小分子以及重金属的分析中。Cakal等[66]采用光引发聚合得到了一种具有硼酸功能基团的硼亲和整体材料萃取芯片,对儿茶酚胺类的富集倍数达到100倍。该芯片也可以通过硼亲和作用对含有顺式二醇结构的化合物进行富集。Zhang等[67]在尺寸为2.5 cm×500 μm×50 μm的PDMS通道内聚合得到聚(甲基丙烯酸缩水甘油酯-三羟甲基丙烷三丙烯酸酯)整体材料微萃取芯片,再用乙二胺对其改性以引入氨基官能团。他们将该芯片与电感耦合等离子体质谱(ICP-MS)联用,对HepG2细胞中的重金属铋及其存在形态进行分析。所建立的方法具有样品和试剂用量少、萃取效率高、重复性好、抗干扰能力强等优点。
CBME所需的样品及解吸溶剂用量很少,绿色环保,但芯片的加工及萃取的操作较为困难,需要良好的操作技能。
6 针尖微萃取
TBME是近年来发展起来的微萃取技术,它通过在微量吸液管的管尖处填装吸附剂形成萃取吸头,然后用微量移液器反复抽吸样品溶液实现对目标物的吸附。如果将该萃取吸头与带有机械臂的96孔萃取装置联用则可实现分析过程的自动化,大大缩短总分析时间[68]。
目前商品化的萃取吸头包括ZipTip (美国Millipore公司)、NuTip (美国Glygen公司)、HyperSep Tip (美国Thermo Fisher Scientific公司)、StageTip (丹麦Proxeon Biosystems公司)和MonoTip C18 tip (日本GL Sciences公司),这些商品化的萃取吸头以硅胶整体材料作为吸附剂,已经成功用于生物样品中痕量药物残留的分析[69-71]以及蛋白质和多肽的除盐和富集[72]。Hasegawa等[69]采用MonoTip C18 tip萃取吸头对人体血浆中的镇咳药二甲啡烷残留进行富集,用GC-MS进行测定,检出限为1.25 μg/L。MonoTip C18 tip也被用于人体血浆中的四环类抗抑郁药[70]和吩噻嗪衍生物[71]的富集。Wang等[73]用ZipTip萃取吸头来对细胞色素C、肌红蛋白和α-乳清蛋白进行富集,能有效去除蛋白质溶液中NaCl以及十二烷基硫酸钠等盐类的干扰。
除了硅胶整体材料外,有机整体材料也被用作TBME吸附剂。Abdel-Rehim等[74]在96孔萃取盘中制备了基于丙烯酸甲酯整体材料的TBME微柱,将TBME与LC-MS联用实现了对人体血浆中的吲哚洛尔和美托洛尔的高灵敏检测。研究所消耗的样品量少,而且整个样品前处理过程在2 min内就可以完成。与商品化的萃取吸头相比,用该方法制备的萃取吸头对样品进行处理,精密度更好。Krenkova等[75]在200 μL的移液枪枪头内合成了氧化铁纳米粒子改性整体材料和羟基磷灰石纳米粒子改性整体材料,成功用于磷酸化肽的选择性富集。
为了提高萃取选择性,Zhang等[72]将MIPs与TBME结合,以黄连素为模板分子,分别以丙烯酰胺、乙二醇二甲基丙烯酸酯、二甲基亚砜和偶氮二异丁腈为功能单体、交联剂、致孔剂和引发剂,将含有模板分子的聚合溶液转移至微量吸液管尖端,在60 ℃水浴条件下聚合3 h得到基于黄连素的MIP整体材料萃取吸头,将该吸头与注射器连接,用注射泵来控制上样过程。研究以3种生物碱为目标物,详细考察了制备条件,优化了样品流速、样品体积等萃取条件,最后将MIP-TBME应用于人体血浆和尿液中生物碱的测定,能有效排除样品中其他杂质的干扰。Du等[76]以灭多威作为模板分子,制备了MIP-TBME,并与HPLC-DAD联用,用于环境水样中灭多威的选择性分析测定。所建立方法的线性范围为0.6~1 000.0 μg/L,检出限为0.2 μg/L,实际环境水样的加标回收率为84.9%~105.1%,具有选择性高、有机溶剂用量少、萃取效率高和重复性好等优点。
TBME操作简便,但需保证整体材料具有良好的通透性能以提高萃取速度,因此需要对聚合条件及聚合溶液的各组分比例进行优化。
7 总结与展望
由于多孔整体材料具有制备简单、通透性好、传质速度快、原材料来源丰富和易于改性等优点,因此是SPME的理想萃取介质,迄今已在复杂环境样品、食品以及生物样品中目标物的分析中得到了广泛应用。笔者认为,多孔整体材料作为SPME的吸附剂以后可以朝以下几方面发展:(1)继续发展基于整体材料的新型吸附剂,随着各式各样的新兴污染物的出现,应根据目标物的分子结构特点,利用计算机模拟技术发展具备特异性萃取性能的吸附材料。MIP整体材料虽具有较好的萃取选择性,但其在水样中的合成及应用仍受到限制;另外,还需解决模板分子泄露的问题。(2)应扩大整体材料的萃取对象,目前以整体材料作为吸附剂的SPME主要用于萃取有机化合物,只有极少数研究涉及无机污染物如阴阳离子和重金属的萃取。因此应发展具有特殊基团如阴阳离子交换基团、螯合基团的新型整体材料,以扩大整体材料的萃取对象。(3)根据整体材料的“原位”聚合特性,可发展新型萃取模式,如可研制基于多孔整体膜的膜萃取,以期实现对目标物的快速和高通量富集。(4)目前基于整体材料的FBSPME、MMF-SPME还未能实现萃取与仪器分析检测的在线联用,因此研制相关萃取解吸装置,实现萃取与不同分析仪器在线联用和萃取、富集、进样、分析检测的自动化,将更好地发挥多孔整体材料在样品预处理中的作用。
[1] Arthur C L, Pawliszyn J. Anal Chem, 1990, 62(19): 2145
[2] Groenewold G S, Scott J R, Rae C. Anal Chim Acta, 2011, 697(1/2): 38
[3] Huang X J, Zhang Y, Mei M, et al. J Sep Sci, 2014, 37(9/10): 1185
[4] Zeng J B, Chen J M, Wang Y R, et al. J Chromatogr A, 2008(1/2), 1208: 34
[5] Zhang X, Zang X H, Zhang G J, et al. J Sep Sci, 2015, 38(16): 2880
[6] Mei M, Huang X J, Yu J, et al. Talanta, 2015, 134: 89
[7] Mei M, Huang X J, Yuan D X. J Chromatogr A, 2014, 1345: 29
[8] Mizuno K, Kataoka H. J Pharm Biomed Anal, 2015, 112: 36
[9] Zheng M M, Wang S T, Hu W K, et al. J Chromatogr A, 2010, 1217(48): 7493
[10] Huang X J, Chen L L, Yuan D X. Anal Bioanal Chem, 2013, 405(21): 6885
[11] Maggi L, Carmona M, Campo C P, et al. J Chromatogr A, 2008, 1209(1/2): 55
[12] Wang H, Wu Z K, Chen B B, et al. Analyst, 2015, 140(16): 5619
[13] Chen L D, Hoff S J, Koziel J A, et al. Bioresour Technol, 2008, 99(16): 7767
[14] Du T, Cheng J, Wu M, et al. J Chromatogr B, 2014, 951/952: 104
[15] Li H, Li D. J Pharm Biomed Anal, 2015, 115: 330
[16] Chen J M, Zeng J B, Chen W F, et al. Progress in Chemistry, 2009, 21(9): 1922
陈金美, 曾景斌, 陈文峰, 等. 化学进展, 2009, 21(9): 1922
[17] Hjertén S, Liao J L, Zhang R. J Chromatogr A, 1989, 473: 273
[18] Tennikova T B, Blagodatskikh I V, Svec F, et al. J Chromatogr A, 1990, 509(1): 233
[19] Minakuchi H, Nakanishi K, Soga N, et al. Anal Chem, 1996, 68(19): 3498
[20] Qiu J J, Feng S, Dong J, et al. Anal Chem, 2007, 79(2): 639
[21] Svec F, Frechet J M F. Anal Chem, 1992, 64(7): 820
[22] Zhong J, Hao M B, Li R, et al. J Chromatogr A, 2014, 1333: 79
[23] Moravcová D, Carrasco-Correa E J, Planeta J, et al. J Chromatogr A, 2015, 1402: 27
[24] Zhao H Y, Wang Y C, Cheng H Y. J Chromatogr A, 2016, 1452: 27
[25] Li Y Q, Li W C, Wang Y H, et al. J Sep Sci, 2013, 36(13): 2121
[26] Hu M, Zhang Y J, Yang J H, et al. Chinese Journal of Chromatography, 2015, 33(2): 123
胡梅, 张毅军, 杨靖华, 等. 色谱, 2015, 33(2): 123
[27] Qiu L J, Liu W, Huang M, et al. J Chromatogr A, 2010, 1217(48): 7461
[28] Djozan D, Ebrahimi B, Mahkam M, et al. Anal Chim Acta, 2010, 674(1): 40
[29] Mirzajani R, Kardani F. J Pharm Biomed Anal, 2016, 122: 98
[30] Djozan D, Baheri T. J Chromatogr A, 2007, 1166(1): 16
[31] Turiel E, Tadeo J L, Martin-Esteban A. Anal Chem, 2007, 79(8): 3099
[32] Shi Z G, Chen F, Xing J, et al. J Chromatogr A, 2009, 1216(28): 5333
[33] Wang Y L, Mei M, Huang X J, et al. Anal Methods, 2015, 7(2): 551
[34] Liao K R, Mei M, Li H N, et al. J Sep Sci, 2016, 39(3): 566
[35] Mei M, Yu J, Huang X J, et al. J Chromatogr A, 2015, 1385: 12
[36] Mei M, Huang X J, Liao K R, et al. Anal Chim Acta, 2015, 860: 29
[37] Pei M, Huang X J. Anal Methods, 2016, 8(18): 3831
[38] Eisert R, Pawliszyn J. Anal Chem, 1997, 69(16): 3140
[39] Fan Y, Feng Y Q, Zhang J T, et al. J Chromatogr A, 2005, 1074(1/2): 9
[40] Fan Y, Zhang M, Feng Y Q. J Chromatogr A, 2005, 1099(1/2): 84
[41] Wen Y, Feng Y Q. J Chromatogr A, 2007, 1160(1/2): 90
[42] Ma Q, Chen M, Shi Z G, et al. J Sep Sci, 2009, 32: 2592
[43] Yu Q W, Wang X, Ma Q, et al. Anal Methods, 2012, 4(6): 1538
[44] Tong S S, Zhou X, Zhou C H, et al. Analyst, 2013, 138(5): 1549
[45] Wang X, Li X J, Li Z, et al. Anal Chem, 2014, 86(10): 4739
[46] Mei M, Huang X J, Luo Q, et al. Anal Chem, 2016, 88(3): 1900
[47] Zhang S W, Xing J, Cai L S, et al. Anal Bioanal Chem, 2009, 395(2): 479
[48] Baltussen E, Sandra P, David F, et al. J Microcolumn Sep, 1999, 11(10): 737
[49] Gilart N, Miralles N, Marcé R M, et al. Anal Chim Acta, 2013, 774: 51
[50] Huang X J, Yuan D X. J Chromatogr A, 2007, 1154(1/2): 152
[51] Huang X J, Yuan D X, Huang B L. Talanta, 2008, 75(1): 172
[52] Huang X J, Lin J B, Yuan D X, et al. J Chromatogr A, 2009, 1216(16): 3508
[53] Huang X J, Qiu N N, Yuan D X. J Sep Sci, 2009, 32(9): 1407
[54] Zhang Y, Mei M, Huang X J, et al. Chinese Journal of Chromatography, 2014, 32(4): 402
张咏, 梅萌, 黄晓佳, 等. 色谱, 2014, 32(4): 402
[55] Huang X J, Chen L L, Yuan D X, et al. J Sep Sci, 2011, 34(23): 3418
[56] Huang X J, Qiu N N, Yuan D X, et al. J Chromatogr A, 2010, 1217(16): 2667
[57] Huang X J, Lin J B, Yuan D X. J Chromatogr A, 2010, 1217(30): 4898
[58] Huang X J, Lin J B, Yuan D X. Analyst, 2011, 136(20): 4289
[59] Hu Y L, Li J W, Hu Y F, et al. Talanta, 2010, 82(2): 464
[60] Zhu L, Xu G H, Wei F D, et al. J Colloid Interface Sci, 2015, 454: 8
[61] Yu C, Davey M H, Svec F, et al. Anal Chem, 2001, 73(21): 5088
[62] Liu J, Chen C F, Tsao C W, et al. Anal Chem, 2009, 81(7): 2545
[63] Nge P N, Pagaduan J V, Yu M, et al. J Chromatogr A, 2012, 1261: 129
[64] Kumar S, Sahore V, Rogers C I, et al. Analyst, 2016, 141(5): 1660
[65] Alzahrani E, Welham K. Analyst, 2012, 137(20): 4751
[66] Cakal C, Ferrance J P, Landers J P, et al. Anal Chim Acta, 2011, 690(1): 94
[67] Zhang J, Chen B B, Wang H, et al. J Anal At Spectrom, 2016, 31: 1391
[68] Vuckovic D. TrAC-Trends Anal Chem, 2013, 45: 136
[69] Hasegawa C, Kumazawa T, Terada M, et al. Legal Med, 2012, 14(5): 267
[70] Hayashi D, Kumazawa T, Hasegawa C, et al. Forensic Toxicol, 2012, 30(2): 98
[71] Kumazawa T, Hasegawa T, Uchigasaki S, et al. J Chromatogr A, 2011, 1218(18): 2521
[72] Zhang W P, Chen Z L. Talanta, 2013, 103: 103
[73] Wang H, So P K, Ng T T, et al. Anal Chim Acta, 2014, 844: 1
[74] Abdel-Rehim M, Persson C, Altun Z, et al. J Chromatogr A, 2008, 1196/1197: 23
[75] Krenkova J, Foret F. Anal Bioanal Chem, 2013, 405(7): 2175
[76] Du T, Chen J, Wu M, et al. Anal Methods, 2014, 6(16): 6375
Advances in the application of porous monoliths in solid-phase microextraction
MEI Meng, HUANG Xiaojia*
(KeyLaboratoryoftheMinistryofEducationforCostalandWetlandEcosystem,CollegeoftheEnvironmentandEcology,XiamenUniversity,Xiamen361005,China)
As a novel sample pretreatment technique, solid-phase microextraction (SPME) has obtained wide attention due to the advantages of simple in operation, flexible in use, less sample consumption, environment-friendly and easy to be coupled to analytical instruments and so on. Owing to the good permeability, fast mass transfer property, ease of preparation and modification, porous monoliths have been widely used in many fields including sample pretreatment. Based on our research, the applications of porous monoliths in SPME in recent years are reviewed, and a development prospect is discussed.
solid-phase microextraction (SPME); monoliths; adsorbent; review
10.3724/SP.J.1123.2016.08011
2016-08-10
国家自然科学基金项目(21377105,21577111).
Foundation item: National Natural Science Foundation of China (Nos. 21377105, 21577111).
O658
A
1000-8713(2016)12-1168-08
邹汉法研究员纪念专辑(上)·专论与综述
* 通讯联系人.Tel:(0592)2189278,E-mail:hxj@xmu.edu.cn.
