外泌体分离及其蛋白质组学分析的研究进展
2016-12-14翁叶靖随志刚张丽华张玉奎
翁叶靖, 随志刚, 张丽华*, 张玉奎
(1. 中国科学院大连化学物理研究所, 中国科学院分离分析化学重点实验室,辽宁 大连 116023; 2. 中国科学院大学, 北京 100049)
外泌体分离及其蛋白质组学分析的研究进展
翁叶靖1,2, 随志刚1, 张丽华1*, 张玉奎1
(1. 中国科学院大连化学物理研究所, 中国科学院分离分析化学重点实验室,辽宁 大连 116023; 2. 中国科学院大学, 北京 100049)
外泌体是一种由细胞分泌的膜性囊泡小体,直径通常为30~100 nm,密度为1.10~1.18 kg/L。外泌体广泛存在于各种体液中,可携带脂类、蛋白质、信使RNAs(mRNAs)、microRNAs(miRNAs)、非编码RNAs(ncRNAs)等多种重要的生物功能分子。许多证据表明,外泌体形成了一种特殊的细胞间信息传递系统,不仅影响细胞的生理状态,而且与多种疾病的发生与发展密切相关。该文简要综述了近年来在外泌体的分离和纯化方面取得的研究进展,并对蛋白质组学技术在外泌体分析中的应用进行了概述。此外,还对外泌体蛋白质组学研究的发展前景进行了展望。
外泌体;分离纯化;蛋白质组学;定量分析;综述;综述
在20世纪60、70年代,研究人员在细胞外的软骨[1]、血液[2]和细胞培养液[3,4]中发现了许多膜包被的囊泡小体。起初,人们认为这类囊泡是通过细胞质膜向外出芽或脱落的方式进行释放,直到80年代,人们才发现一种更为复杂的囊泡分泌方式(见图1)。细胞形成多泡小体并通过质膜融合的方式将其中包含的囊泡释放到细胞外,最终完成囊泡的分泌[5,6]。Johnstone等[7]详细地研究了这类囊泡分泌形式,并首次将这一类囊泡命名为外泌体(exosomes)。然而,由于研究手段的匮乏,人们一度认为外泌体只是细胞向外运输物质的“清洁工”,这导致外泌体研究沉寂了将近20年。2007年,Valadi等[8]首次发现外泌体中包含信使RNAs(mRNAs)和microRNAs(miRNAs)等核酸类物质。这意味着外泌体可以作为遗传信息的传递者参与细胞间基因的转移和表达。这一发现赋予了外泌体新的功能,并翻开了外泌体研究的新篇章。此后,有关外泌体的相关研究在各个领域不断涌现,而对外泌体的分析中,分离和纯化的步骤尤为重要。因此,本文对近年来报道的有关外泌体的分离、纯化手段及其蛋白质组学研究进行了总结和展望。
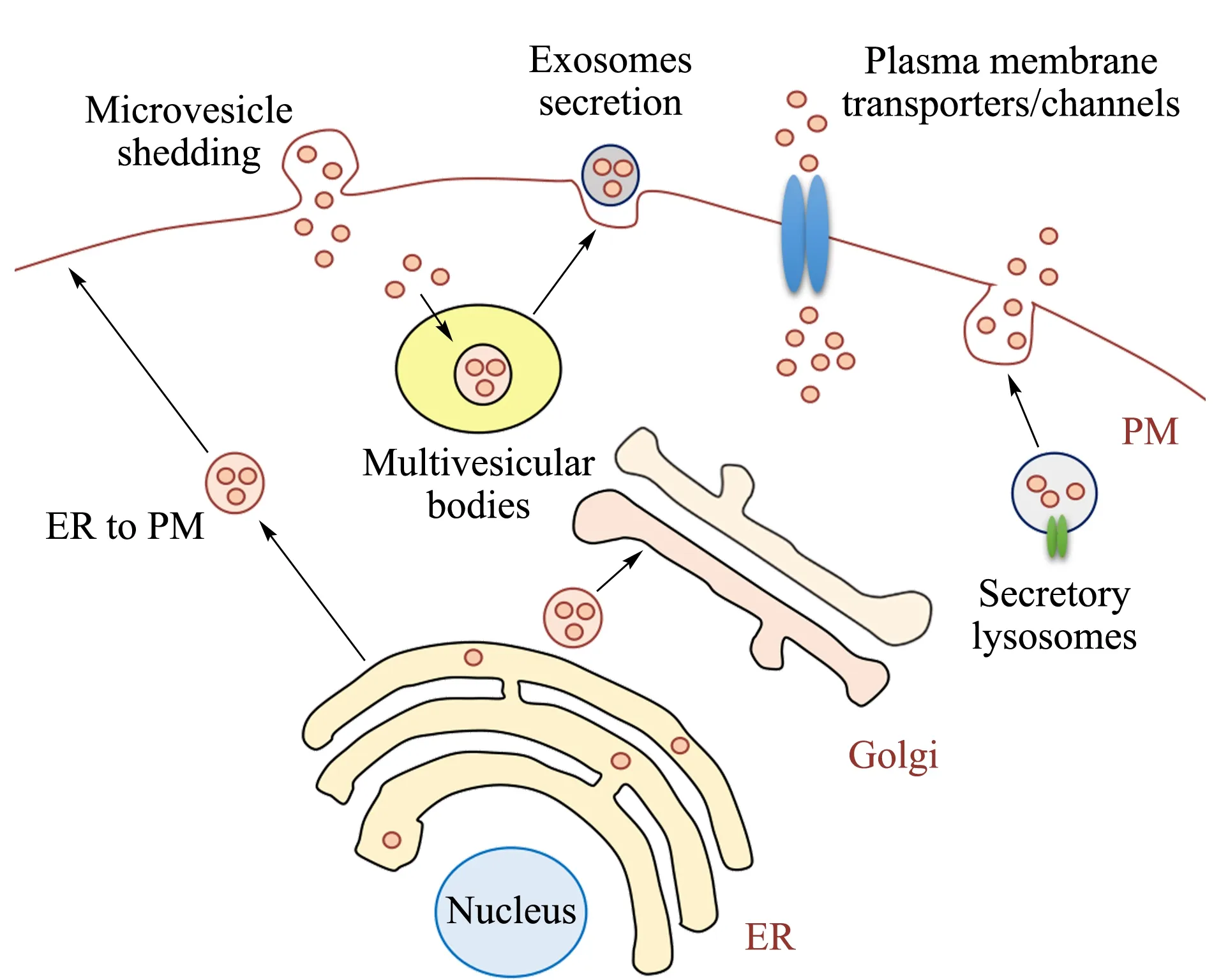
图 1 真核细胞分泌膜性囊泡示意图Fig. 1 Schematic of the different types of membrane vesicles released by eukaryotic cells ER: endoplasmic reticulum; PM: plasma membrane.
1 外泌体的分离、纯化
外泌体是一种由细胞分泌的膜性囊泡,广泛存在于各种生物体液和细胞培养液中。这些生物样品中存在复杂的背景干扰,如细胞碎片、细胞囊泡和蛋白质聚集体等。因此,通过发展分离和纯化方法获得高纯度的外泌体对于开展后续相关的生物分析至关重要。
外泌体具有独特的物理化学性质:①外泌体(30~100 nm)具有较小的尺寸,不同于核外颗粒体(ectosome, 150~1 000 nm)、脱落小泡(shedding vesicle, 150~1 000 nm)和凋亡小体(apoptosis body, 100~5 000 nm)等其他类型的囊泡;②外泌体具有磷脂双分子层膜状结构,该膜状结构会导致外泌体沉降系数与蛋白质聚集体有较大差异;③外泌体膜表面存在与其形成密切相关的特异性多跨膜区的蛋白质,如CD9、CD63和CD81等。科研工作者可利用这些独特的物理化学性质,实现外泌体的分离和纯化。
1.1 差速离心法
Johnstone等[7]最初发展了差速离心法用于网织红细胞组织培养液中外泌体的分离;Théry等[9]对该方法进行了优化,并详述了改进后的方法(见图2)。以300 g、2 000 g和10 000 g离心,分别去除细胞、死细胞和细胞碎片;利用超高速离心(>100 000 g)得到外泌体的粗提取物;重复操作2次,以去除污染蛋白质,从而得到外泌体。该方法被广泛应用于各类生物样品(如血液[10]、细胞培养液[11]、尿液[12]、唾液[13]和脑脊液[14]等)的外泌体分析,是目前应用最为广泛的外泌体分离方法。Wang等[15]采用差速离心法结合多维蛋白质鉴定技术(MudPIT)对尿液中的外泌体蛋白质进行了分析,一共鉴定得到3 280个蛋白质,其中1 788个未见报道。此外,他们还利用该方法从25 mL尿液的外泌体中鉴定得到超过1 000个蛋白质,是当时报道的最大的人尿蛋白质数据集。Kislinger等[16]利用差速离心法对4种卵巢癌细胞系(OVCAR3、OVCAR433、OVCAR5和SKOV)的外泌体展开了深度的蛋白质组学分析,鉴定得到3 096个蛋白质。
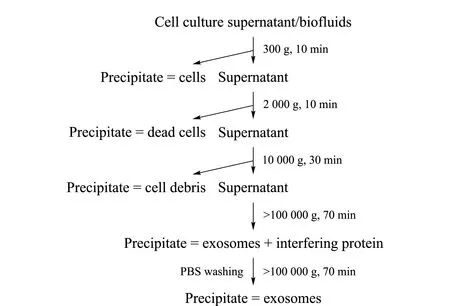
图 2 基于差速离心法的外泌体分离纯化流程图Fig. 2 Flow chart of the exosomes purification procedure based on differential velocity centrifugation PBS: phosphate buffer saline.
由于细胞分泌囊泡的不均一性,采用超高速离心得到的沉淀中常包含其他类型的分泌囊泡和蛋白质聚集体,导致外泌体的纯度降低。此外,差速离心法在后续外泌体的蛋白质组学分析中也存在不足:1)重复的超高速离心步骤会造成外泌体的破坏,降低样品的回收率;2)通常需要大量的初始样品量(>150 mL的细胞培养液),不适合微量样品和珍贵样品的蛋白质组学分析[17]。
1.2 蔗糖梯度离心法
针对差速离心法获得外泌体纯度不高的问题,人们又发展了蔗糖梯度离心法[18,19]。将两种浓度的蔗糖溶液(如2.5 mol/L和0.25 mol/L)配制成连续梯度体系后,置于超速离心管中,再将样本铺在蔗糖溶液上,以100 000 g离心数小时,蛋白质聚集体会沉降于离心管底部,而含脂类结构的外泌体会沉降到等密度区(1.10~1.18 kg/L),从而获得较高纯度的外泌体。Hogan等[20]采用蔗糖梯度离心法对人尿液中外泌体的蛋白质组进行鉴定。从患肾小球疾病的患者的尿液样品中鉴定得到5 657个蛋白质。然而,蔗糖梯度离心法的前期准备工作十分繁杂,不适合后续大规模的蛋白质组的分析。
1.3 基于聚合物的外泌体富集方法
近些年,Systems Biosciences和Life Technologies等公司发展了基于体积排阻聚合物分离细胞外囊泡的方法,并申请了相关专利[21,22]。一般认为聚合物沉淀外泌体的机理是体积排阻的聚合物通过“劫持”水分子,从而造成外泌体溶解度的降低,进而在低速离心条件下发生沉降[17],不过该机理还值得进一步研究。许多公司先后开发了一系列针对不同样品来源(血样、细胞培养液、尿样等)的外泌体提取试剂盒,实现了外泌体的快速分离和纯化[23-25]。这些商品化的试剂盒往往价格昂贵,如用于细胞培养液中外泌体分离的ExoQuickTM、PureExoTM、Total Exosome IsolationTM等产品,每处理10 mL培养液所用试剂盒的价格高达50~100美元,而针对血液样品的外泌体试剂盒则更加昂贵,因此不适合较大规模的样品处理。此外,人们还发现商品化试剂盒获得的外泌体中常伴随较多的干扰蛋白质,如血液外泌体中的白蛋白和免疫球蛋白等,这主要是蛋白质聚沉以及清洗不充分所致。后续应用方面,由于富集的外泌体中常伴随聚合物,因此外泌体的电镜分析难度较大;如果不去除聚合物,同样会对后续的质谱分析产生严重的离子干扰,因此基于聚合物沉淀机理的商品化试剂盒的方法开发还值得进一步优化和提高。
早在40多年前,人们就发现聚乙二醇(PEG)可以作为沉淀剂用于病毒的分离,并具有良好的效果[26,27]。考虑到外泌体与病毒具有相似的尺寸结构和物质组成,Meckes等[28]提出了一种基于PEG的外泌体分离纯化方法(ExtraPEG)。采用0.08 kg/L的PEG(数均分子量为6 000)与培养液进行孵育后,低速离心获得粗外泌体,再采用超高速离心进一步清洗,以得到外泌体。该方法获得的外泌体具有较高的回收率和纯度,适用于后续蛋白质组学和测序分析。通过分析人宫颈癌(HeLa)细胞培养液中的外泌体,共鉴定得到517个蛋白质,其中492个蛋白质能与ExoCarta数据库中的外泌体蛋白质相匹配。Zhang等[29]通过优化PEG的相对分子质量、含量和盐浓度等参数,确定了最佳的外泌体富集条件。取0.1 kg/L的PEG(重均分子量为10 000)进行2次PEG沉淀,以进一步去除血清蛋白质的干扰。通过高分辨率的电镜分析,PEG能形成聚合物膜,从而将数十至上百个外泌体包裹在一起,显著提高了外泌体聚集体的沉降系数,使外泌体得以在低转速下获得分离。将该策略用于HeLa细胞培养液中外泌体的蛋白质组学分析,3次生物学重复共鉴定得到6 299个蛋白质,对应5 120个基因,包含ExoCarta数据库中100种外泌体标志蛋白质的97%。通过进一步分析外泌体蛋白质N端肽段可以发现,相比于细胞蛋白质,外泌体蛋白质具有较高程度的蛋白质N端水解,表明外泌体在积累和转运蛋白质降解中间体方面具有潜在功能。
PEG沉淀法可以实现低成本、高效快速的外泌体分离和纯化,利用超滤膜设备可以排除聚合物的干扰,并兼容后续的蛋白质组学分析。然而,生物样品中常包含大量的蛋白质,PEG沉淀的产物中不可避免地会存在蛋白质的共沉淀,因此后续的清洗步骤对于外泌体蛋白质的可靠鉴定十分重要。此外,可利用细胞培养稳定同位素标记技术(SILAC)区分鉴定结果中的细胞外泌体蛋白质和血清蛋白质,以提高鉴定结果的可信度。
1.4 尺寸排阻法
由于外泌体的尺寸通常为30~100 nm,因此尺寸排阻法也非常适用于外泌体的分离与纯化。Cheruvanky等[30]利用超滤法从尿液中成功纯化得到外泌体,样品预处理过程简单且无需特殊设备。Lim等[31]利用截留不同相对分子质量的滤膜(1 000、500、300和100 kDa)实现了人间充质干细胞培养液中外泌体的分离,为后续的生物学分析提供了良好基础。但该方法需要利用特殊的装置,限制了其应用。Bioo Scientific公司也开发了基于超滤膜的ExoMirTM商品化设备,可用于外泌体的分离和纯化(http://www.biooscientific.com)。该设备有2~3层滤膜,利用离心力分别截留细胞及直径较大的囊泡物质,以获得不同尺寸的囊泡。结合RNA提取试剂,可以获得活性RNA类物质且具有较高的回收率,特别适合于mRNA以及miRNA的分析。Izon Science公司推出了qEVTM凝胶渗透色谱柱,用于外泌体的分离和纯化(http://www.izon.com)。外泌体的粒径较蛋白质和脂类物质大,能够快速通过分离柱;而蛋白质和脂类物质与填料间的相互作用力较大,通过色谱柱的速度较慢,从而实现外泌体与杂质的高效分离,以得到纯度较高的外泌体。该技术操作简单、使用方便、富集效率高。然而,该色谱柱对于上样量有严格的要求,一般在0.5 mL以内,否则会降低外泌体的分离效率。此外,由于蛋白质和脂类的严重污染,该色谱柱无法多次重复使用(<3次),限制了该产品的应用。
1.5 亲和富集法
外泌体表面带有特殊的膜蛋白质,如CD63、CD81、CD82、CD9、ALIX、Annexin、EpCAM和Rab5等,利用抗体与这些蛋白质间的特异性相互作用,可以实现外泌体的亲和富集。抗体通常被固载于磁性颗粒[32]、色谱固定相[33]和微流控装置[34]等基质上,以实现对外泌体的特异性富集。最近,Wako公司开发了基于膜表面磷脂酰丝氨酸(PS)的亲和纯化试剂盒MagCaptureTM,利用中性pH的金属螯合试剂进行竞争性洗脱,可获得较高纯度的外泌体,并适用于后续的生物学分析。然而,这些基质的非特异性吸附会导致获得的外泌体中存在干扰蛋白质。此外,亲和富集法存在成本高、使用和保存条件苛刻等问题。
2 外泌体的蛋白质组学分析
近些年,基于色谱-质谱联用的蛋白质组学技术为生物学的发展提供了强有力的技术支持。在外泌体蛋白质分析领域,定量蛋白质组学技术的发展推动着外泌体蛋白质组学研究的不断进步,以及外泌体中新功能蛋白质的不断发现。外泌体存在于各种体液当中,可作为细胞间信息传递的载体在细胞交流中发挥着重要作用,特别是在疾病标志物筛查领域具有重要的作用。据报道,不同体液中外泌体的组成具有高度的特异性[35,36],通过分离和纯化体液中的外泌体,可以精准地获得外泌体中的蛋白质信息。
分析尿液中的外泌体可以获得丰富的尿液外泌体蛋白质信息,有助于泌尿系统疾病的早期诊断。2014年,Ward等[37]利用无标记定量蛋白质组学技术研究了常染色体显性多囊肾病(ADPKD)中PKD1突变(由PC1编码)患者和健康志愿者的尿液外泌体蛋白质组,定量得到9个具有显著性表达的蛋白质,其中TMEM2在实验组低表达,且在发现队列中PC1/TMEM2的比值与高度调整后总肾容积(ht-TKV)呈负相关。结果显示,PC1/TMEM2的定量比值可用于监测和诊断多囊性肾病。2015年,Llorente等[38]通过考察多例健康志愿者和前列腺癌患者的尿液外泌体蛋白质组,定量得到246个表达发生显著变化的蛋白质,其中221个蛋白质在前列腺癌患者的尿液外泌体中高表达。通过进一步筛选,发现2个高灵敏的个体生物标志物TM256和LAMTOR1,同时应用TM256和LAMTOR1可提高前列腺癌的检测灵敏性,表明尿液外泌体在前列腺癌诊断方面具有较大潜力。
近年来,血清外泌体作为疾病标志物的重要来源,也获得了普遍关注[39-42]。2015年,来自MD安德森癌症中心的Kalluri等[39]利用定量蛋白质组学技术筛选出GPC1这类在乳腺癌和胰腺癌中高表达的膜锚定蛋白质,并利用免疫印迹技术和流式细胞术等方法对GPC1外泌体的来源和定位进行了验证。同时,他们发现早期胰腺癌患者的血清外泌体中GPC1的丰度显著高于正常人群,并证明了可以通过鉴定血清外泌体中的GPC1来诊断早期胰腺癌。不同于循环肿瘤细胞(CTC)研究中需要大量的新鲜血液,该技术甚至可以利用30年前保存的血液样品进行分析;相比于血液中胰腺癌的生物标志物CA 19-9, GPC1和循环外泌体的组合被证明是一种更为可靠的筛查工具。
除了在疾病标志物筛查这一主要应用领域,蛋白质组学技术也逐渐被应用于外泌体蛋白质组的翻译后修饰分析[43,44]、基于选择反应监控(SRM/MRM)的特定外泌体蛋白质分析[45,46]中,以进一步挖掘相关疾病的分子机理。
2014年,Renkonen等[43]首次对尿液外泌体中的N-糖蛋白质组进行了系统分析,共鉴定到来源于51个N-糖基化位点的126条N-糖肽,并获得了对应的糖链组成信息。结果表明,外泌体的糖蛋白质组具有较高丰度的岩藻糖(50%的复合型糖链具有岩藻糖),可能与癌症的发生和炎性反应密切相关。2016年,Wang和He等[47]对人结肠癌SW620细胞系外泌体中的磷酸化蛋白质进行了详细的蛋白质组研究,鉴定得到313个磷酸化蛋白质和1 091个磷酸化位点,包括202个新鉴定的磷酸化位点。进一步研究发现,外泌体磷酸化蛋白质显著分布于染色体11q12.1~13.5区域,酪氨酸磷酸化蛋白质丰度较高(6.4%),并与肝配蛋白信号通路介导的细胞骨架重构功能相关。
2015年,来自康奈尔大学的Lyden等[48]在Nature上发表了针对外泌体的研究论文,加深了人们对肿瘤转移的认识。他们发现肿瘤细胞会在转移前先行释放外泌体,外泌体到达预期转移器官后会被相应的细胞摄取,从而改变这些靶细胞的状态,营造适宜转移和肿瘤生长的微环境。利用定量蛋白质组学技术发现外泌体表面的整合素类蛋白质在转移过程中发挥着重要的作用,并决定着靶器官的特异性,例如整合素α6β4和α6β1与肺部的转移有关,整合素αvβ5则与肝脏的转移相关。上述发现进一步印证了癌症的“种子”和“土壤”学说,为抑制肿瘤的器官性转移提供了新思路。
3 结论和展望
随着研究的深入,外泌体的新功能不断被揭示,对人们加深机体生理、病理等过程的认识至关重要。目前已知的外泌体分离纯化方法中,尚没有一种策略能够实现外泌体的高纯度、高回收率富集。本研究组[29]开发的PEG二次沉淀方法虽然可以实现外泌体的高效富集,却不可避免地引入了血清蛋白质。后续实验将引入细胞蛋白同位素标签以提高外泌体蛋白质归属的准确性。此外,外泌体具有磷脂双分子层,这区别于所有干扰蛋白质的特点,开发与磷脂双分子层具有特异性亲和力的富集材料,可能是提高外泌体纯度和富集效率的有效方案。
蛋白质组学技术作为表征外泌体蛋白质组的强大工具,为其定性、定量分析提供了坚实的基础,也为后续的生物学探索指明了道路。然而,外泌体的蛋白质组分析尚存在几点不足:1)难以确定外泌体蛋白质的来源,如无法区分鉴定得到的蛋白质来源于血清蛋白质还是血清外泌体;2)难以获得某些组织分泌的外泌体,如脑、肝脏等组织;3)外泌体样品预处理的分析时间长、通量低,不能满足临床体液样品的高通量检测;4)由于外泌体的封闭性,难以开展外泌体蛋白质的后续功能研究。因此,后续工作中应进一步拓展外泌体的分析范围、挖掘外泌体蛋白质的翻译后修饰和潜在功能、提高外泌体蛋白质组的分析灵敏度和分析通量。
近期,本研究组也发展了相关方法以提高微量样品中外泌体蛋白质组分析的灵敏度,同时开发了针对临床体液样本(如血液、尿液)中外泌体的高通量蛋白质组学分析方法。另外,由于外泌体中miRNA的作用逐渐被人们所认识,相关的交叉研究也是未来研究的焦点。
总体来说,蛋白质组学和相关学科的进步,会加深人们对外泌体的全面认识,特别是高灵敏度、高通量的蛋白质组分析,将会为全面诠释外泌体蛋白质的结构和功能发挥重要作用。
[1] Anderson H C. J Cell Biol, 1969, 41(1): 59
[2] Crawford N. Brit J Haematol, 1971, 21(1): 53
[3] Trams E G, Lauter C J, Salem J N, et al. BBA-Biomembranes, 1981, 645(1): 63
[4] Dvorak H F, Quay S C, Orenstein N S, et al. Science, 1981, 212(4497): 923
[5] Harding C, Heuser J, Stahl P. J Cell Biol, 1983, 97(2): 329
[6] Pan B-T, Johnstone R M. Cell, 1983, 33(3): 967
[7] Johnstone R M, Adam M, Hammond J R, et al. J Biol Chem, 1987, 262(19): 9412
[8] Valadi H, Ekstrom K, Bossios A, et al. Nat Cell Biol, 2007, 9(6): 654
[9] Théry C, Amigorena S, Raposo G, et al. Curr Protoc Cell Biol. New York: John Wiley & Sons Inc., 2006
[10] Kalra H, Adda C G, Liem M, et al. Proteomics, 2013, 13(22): 3354
[11] Jeppesen D K, Nawrocki A, Jensen S G, et al. Proteomics, 2014, 14(6): 699
[12] Wang D Q, Sun W. Proteomics, 2014, 14(16): 1922
[13] Palanisamy V, Sharma S, Deshpande A, et al. PLoS One, 2010, 5(1): 8577
[14] Chiasserini D, van Weering J R T, Piersma S R, et al. J Proteomics, 2014, 106(25): 191
[15] Wang Z, Hill S, Luther J M, et al. Proteomics, 2012, 12(2): 329
[16] Sinha A, Ignatchenko V, Ignatchenko A, et al. Biochem Biophys Res Commun, 2014, 445(4): 694
[17] Zeringer E, Barta T, Li M, et al. Cold Spring Harb Protoc, 2015: 319
[18] Escola J M, Kleijmeer M J, Stoorvogel W, et al. J Biol Chem, 1998, 273(32): 20121
[19] Raposo G, Nijman H W, Stoorvogel W, et al. J Exp Med, 1996, 183(3): 1161
[20] Hogan M C, Johnson K L, Zenka R M, et al. Kidney Int, 2014, 85(5): 1225
[21] Vlassov A, Li M, Zeringer E, et al. US Patent, US8901284B2. 2014-12-02
[22] Antes T J, Kwei K. US Patent, US20130337440A1. 2013-12-19
[23] Amarnath S, Foley J E, Farthing D E, et al. Stem Cells, 2015, 33(4): 1200
[24] Beer L, Zimmermann M, Mitterbauer A, et al. Sci Rep, 2015, 5: 16662
[25] Vaidyanathan R, Naghibosadat M, Rauf S, et al. Anal Chem, 2014, 86(22): 11125
[26] Yamamoto K R, Alberts B M, Benzinger R, et al. Virology, 1970, 40(3): 734
[27] Lewis G D, Metcalf T G. Appl Environ Microbiol, 1988, 54(8): 1983
[28] Rider M A, Hurwitz S N, Meckes Jr D G. Sci Rep, 2016, 6: 23978
[29] Weng Y J, Sui Z G, Shan Y C, et al. Analyst, 2016, 141: 4640
[30] Cheruvanky A, Zhou H, Pisitkun T, et al. Am J Physiol Renal Physiol, 2007, 292(5): F1657
[31] Lai R C, Arslan F, Lee M M, et al. Stem Cell Res, 2010, 4(3): 214
[32] Clayton A, Court J, Navabi H, et al. J Immunol Methods, 2001, 247(1): 163
[33] Ueda K, Ishikawa N, Tatsuguchi A, et al. Sci Rep, 2014, 4: 6232
[34] He M, Crow J, Roth M, et al. Lab Chip, 2014, 14(19): 3773
[35] Nilsson J, Skog J, Nordstrand A, et al. Br J Cancer, 2009, 100(10): 1603
[36] Takata K, Matsuzaki T, Tajika Y, et al. Histochem Cell Biol, 2008, 130(2): 197
[37] Hogan M C, Bakeberg J L, Gainullin V G, et al. J Am Soc Nephrol, 2015, 26(7): 1661
[38] Overbye A, Skotland T, Koehler C J, et al. Oncotarget, 2015, 6(30): 30357
[39] Melo S A, Luecke L B, Kahlert C, et al. Nature, 2015, 523(7559): 177
[40] Sugimachi K, Matsumura T, Hirata H, et al. Br J Cancer, 2015, 112(3): 532
[41] Gallo A, Tandon M, Alevizos I, et al. PLoS One, 2012, 7(3): 30679
[42] Kahlert C, Melo S A, Protopopov A, et al. J Biol Chem, 2014, 289(7): 3869
[43] Saraswat M, Joenvaara S, Musante L, et al. Mol Cell Proteomics, 2015, 14(2): 263
[44] Smith V L, Jackson L, Schorey J S. J Immunol, 2015, 195(6): 2722
[45] Zubiri I, Posada-Ayala M, Benito-Martin A, et al. Transl Res, 2015, 166(5): 474
[46] Mermelekas G, Vlahou A, Zoidakis J. Expert Rev Mol Diagn, 2015, 15(11): 1441
[47] Guo J H, Cui Y Z, Yan Z Q, et al. J Proteome Res, 2016, 15(11): 4060
[48] Hoshino A, Costa-Silva B, Shen T-L, et al. Nature, 2015, 527(7578): 329
Recent advances on exosomes isolation methods and proteomic analysis
WENG Yejing1,2, SUI Zhigang1, ZHANG Lihua1*, ZHANG Yukui1
(1.CASKeyLaboratoryofSeparationSciencesforAnalyticalChemistry,DalianInstituteofChemicalPhysics,ChineseAcademyofSciences,Dalian116023,China;2.UniversityofChineseAcademyofSciences,Beijing100049,China)
Exosomes are membrane-bound vesicles secreted by cells with the diameter of 30-100 nm and the density of 1.10-1.18 kg/L. Exosomes exist widely in almost all kinds of biofluids and contain a series of biologically important molecules, such as lipids, proteins, mRNAs, miRNAs and ncRNAs. Emerging evidence shows that exosomes could establish an intercellular information transfer system, thereby affecting the physiological status of cells and involving in various pathological processes. Herein, the recent advances on exosome isolation and purification methods are reviewed. In the meantime, the proteomic analysis of exosomes is briefly introduced. Finally, the future of exosome proteomic research is discussed.
exosomes; isolation and purification; proteomic; quantitative analysis; review
10.3724/SP.J.1123.2016.08036
2016-08-30
国家自然科学基金(21305140);国家重大科学仪器设备开发专项(2012YQ120044-8).
Foundation item: National Natural Science Foundation of China (No. 21305140); National Important Project on Science Instrument (No. 2012YQ120044-8).
O658
A
1000-8713(2016)12-1131-06
邹汉法研究员纪念专辑(上)·专论与综述
* 通讯联系人.Tel:(0411)84379720,E-mail:lihuazhang@dicp.ac.cn.
