水牛bbu-miR-103-1在泌乳期与非泌乳期表达模式及靶向基因的初步研究
2016-12-13蔡小艳陈秋萍刘庆友石德顺
蔡小艳,李 胜,陈秋萍,王 萍,邓 凯,刘庆友* ,石德顺*
(1.广西大学,亚热带农业生物资源保护与利用国家重点实验室,南宁 530004; 2.广西壮族自治区畜牧研究所,南宁 530001)
水牛bbu-miR-103-1在泌乳期与非泌乳期表达模式及靶向基因的初步研究
蔡小艳1,2,李 胜1,陈秋萍1,王 萍1,邓 凯1,刘庆友1*,石德顺1*
(1.广西大学,亚热带农业生物资源保护与利用国家重点实验室,南宁 530004; 2.广西壮族自治区畜牧研究所,南宁 530001)
旨在探讨bbu-miR-103-1在水牛泌乳期和非泌乳期的差异表达模式,并预测其靶向调控基因及功能。本研究应用qRT-PCR检测bbu-miR-103-1,在水牛泌乳期和非泌乳期的差异表达。构建bbu-miR-103-1前体表达质粒LpEZX-pre-miR-103-1,并在293T细胞中包装高滴度的慢病毒颗粒,用于感染水牛乳腺上皮细胞实现过表达bbu-miR-103-1,同时应用化学合成的bbu-miR-103-1抑制剂转染水牛上皮细胞实现抑制表达bbu-miR-103-1,研究bbu-miR-103-1对PANK3及乳脂代谢相关基因表达的影响。结果表明,水牛泌乳期bbu-miR-103-1的相对表达量为非泌乳期的5.29倍(P<0.01);成功构建的慢病毒载体LpEZX-pre-miR-103-1包装获得了感染滴度为3.47×106PFU·mL-1的慢病毒颗粒;过表达和抑制表达bbu-miR-103-1分别极显著下调和上调了水牛乳腺上皮细胞PANK3基因的相对表达量(P<0.01);过表达bbu-miR-103-1极显著提高了ACACA、GPAM、DGAT1和PDK4基因的表达(P<0.01),对SREBP1c、ADFP、CD36、ACSS1等基因产生了显著的上调作用(P<0.05)。过表达bbu-miR-103-1通过下调PANK3的表达,反馈提高了SREBP1c的mRNA水平,促进了以ACACA开头的脂肪酸从头合成。表明bbu-miR-103-1对水牛乳脂肪合成有十分重要的促进作用,为揭示水牛高乳脂形成和调控机理提供了分子依据。
水牛;bbu-miR-103-1;表达模式;PANK3
小的非编码RNA分子miRNA,大小为18~25 nt个核苷酸,由生物体自身的基因转录而成,在转录后和转录前水平上参与基因表达的调控[1-3]。据估算,miRNA可能对所有哺乳动物的2%~5%的基因负责,调节多达60%的蛋白编码基因[4]。miRNA通过与靶mRNA的碱基互补配对,使靶mRNA降解或者沉默从而起到调控基因表达的作用。miRNA在细胞增殖、分化和凋亡等发育和特殊生物过程中发挥关键作用[5]。在乳腺细胞中已经鉴定出miRNA[6-7],乳腺细胞有自己专有的miRNAs,在小鼠和人类乳腺组织都发现特别的miRNAome表达型,人类乳腺特异信号以23miR为主要特征,而小鼠的特异信号是以miR-let-7a等9个miR为主要特征[8]。大多数已发现的miRNA在哺乳期的表达模式中发生变化,对泌乳性能产生影响[9]。56个miRNAs在泌乳期和干乳期存在差异表达, 相比泌乳高峰期,干乳期只有34%的miRNA表达,相对于干乳期而言有165个miRNAs在泌乳高峰期下调表达[10],这些在干乳期和泌乳高峰期发生变化的miRNA对泌乳的乳脂、乳蛋白等通路起到重要的作用。bta-miR-103是一个目前研究较多的乳腺miRNA, 它包括bta-miR-103-1 和bta-miR-103-2,具有相同的成熟序列,由不同染色体加工而来,miR-103-1由20号染色体的189857-189928 [-]sense ENSBTAT00000015780位点PANK3-201(Pantothenate Kinase 3)第5个内含子转录而来,据报道miR-103-1通过作用靶基因PANK3主要对小鼠和奶山羊的乳脂代谢起重要作用[11-12],本试验室Solexa高通量测序结果表明,bbu-miR-103-1存在于水牛乳腺细胞,而且在泌乳和非泌乳期差异表达,因此选择miR-103-1进行了深入研究。奶样自动分析仪分析乳汁成分显示,水牛乳脂率((6.70±0.72)%)含量为荷斯坦奶牛((3.02±0.17)%)的2.22倍,极显著高于荷斯坦奶牛的乳脂率。
为了探索水牛miR-103-1在泌乳期和非泌乳期表达模式、靶基因及对水牛高乳脂是否有作用,本研究通过构建慢病毒质粒感染水牛乳腺上皮细胞实现过表达bbu-miR-103-1,化学合成抑制剂抑制bbu-miR-103-1表达,对miR-103-1的功能进行了初步研究。
1 材料与方法
1.1 试验材料
1.1.1 所用细胞 试验所用泌乳期和非泌乳期乳腺组织取自南宁屠宰场。感受态细胞、293T细胞为本实验室保存,水牛乳腺上皮细胞为本试验培养。
1.1.2 仪器设备 CO2培养箱(Thermo)、低温离心机(Beckman)、荧光定量PCR仪(Life Technology)、超净工作台(苏州净化)、体视显微镜(尼康)、荧光显微镜(奥林巴斯)、倒置显微镜(尼康)、ChemiDoc 凝胶成像系统(BIO-RAD)、激光共聚焦显微镜(尼康)。
1.1.3 主要试剂 DMEM培养基、FBS、Lipo2000转染试剂等均购自Life Technology 公司,荧光定量SYBR Green Master、 Mix罗氏转染试剂购自Roche公司,一步快速反转试剂盒购自TaKaRa宝生物公司,引物合成由上海生物工程有限公司完成。
1.2 试验方法
1.2.1 基因引物设计 根据miR-103-1序列和NCBI数据库中已有基因序列,利用OLigo 6.0 引物设计软件进行设计,由上海生工进行合成,bbu-miR-103-1的反转录引物Loop-RT-miR-103-1为:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCATAG-3′,bbu-miR-103-1的定量引物为5′-GGAGCAGCATTGTACAGGGC-3′,内参基因为U6的反转录引物为:5′-CGCTTCACGAATTTGCGTGTCAT,U6的定量引物:5′-CTCGCTTCGGCAGCACA-3′。
表1 基因的Q-PCR引物
Table 1 Gene Q-PCR primers
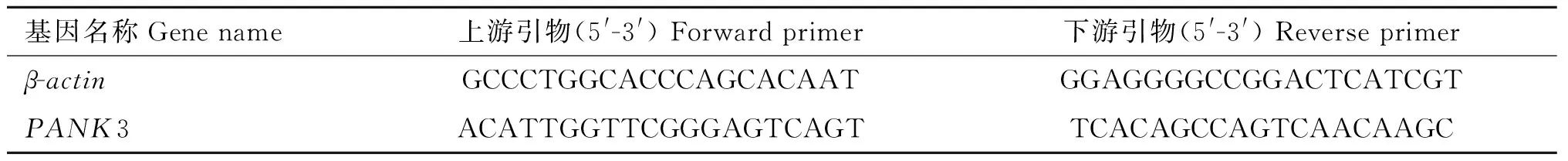
基因名称Genename上游引物(5'-3')Forwardprimer下游引物(5'-3')Reverseprimerβ-actinGCCCTGGCACCCAGCACAATGGAGGGGCCGGACTCATCGTPANK3ACATTGGTTCGGGAGTCAGTTCACAGCCAGTCAACAAGC
1.2.2 乳腺组织采集、RNA提取及QRT-PCR 凌晨02:00~04:00去屠宰场随机选取刚屠宰的不同水牛的乳腺组织,仔细观察不用挤压就有白色乳汁不断渗出的乳腺组织为泌乳期样本,用力挤压也无白色乳汁渗出的乳腺组织为非泌乳期样本,泌乳期和非泌乳期乳腺组织各取3个个体样本重复,生理盐水冲洗后,迅速用眼科手术剪从组织深处剪取1~2 g,放于2 mL EP管,马上放入液氮罐带回实验室,-80 ℃冰箱保存,然后用剪刀取冷冻的水牛乳腺组织大约100 mg,用Trizol法提取总RNA,利用TaKaRa 的AMV试剂盒特异性反转cDNA。
1.2.2.1 cDNA第一链的合成和PCR(RT-PCR)[13]:10 μL体系:2 μg乳腺总RNA,1 μL RRT,1 μL DNase I,1 μL 10×Buffer,RNA free H2O补足至10 μL。将上述混合物混匀并瞬时离心后,放入预热好的PCR仪,37 ℃作用40 min,之后加入EDTA 1 μL,放入PCR仪,65 ℃作用10 min,终止DNase I消化;分别加入以下试剂:1 μL miRNA特异性引物(10 mmol·L-1),1 μL内参U6特异性引物(10 mmol·L-1),4 μL AMV 反转录酶,2 μL AMV 5× Buffer,1 μL dNTP(10 mmol·L-1)。将上述混合物轻轻混匀之后放入已经预热好的PCR仪,按照以下程序进行反转录:25 ℃ 10 min,42 ℃ 60 min,95 ℃ 5 min,4 ℃终止反应。最后用ddH2O稀释至80~100 ng·μL-1,用于RT-PCR或者定量试验。
1.2.2.2 荧光定量PCR:将制备得到的cDNA用无RNase水稀释终浓度为100 ng· mL-1,反应体系为20 μL:1 μL cDNA,10 μL荧光定量试剂,0.6 μL上下游引物(10 μmol·L-1),8.4 μL无RNA酶水。反应条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃或者55 ℃ 1 min,此步骤进行荧光收集,40个循环。每个样品进行3次重复,运用2-△△Ct的方法计算目的基因的相对表达量。U6作为miR-103-1内参,β-actin作为基因对照,检测分析PANK3等基因的表达情况。
1.2.3 水牛乳腺上皮细胞培养 选取屠宰的新鲜的泌乳期水牛乳腺组织块,浸泡在生理盐水中带回实验室,用生理盐水冲洗3次,随后用眼科剪在组织深处选取乳腺组织的腺泡部分,用75%酒精喷洒消毒,转移入高抗PBS液中,再放进超净工作台的培养皿中,然后用高抗PBS和低抗PBS分别清洗至液体基本澄清,再用75%酒精消毒30 s,然后转移至2×PBS中重复清洗2遍,转移到15 mL管中,剪碎到1~2 mm的小块,最后用培养液润洗,用小镊子和枪头将组织块平铺在培养皿的底部,随后倒置于37 ℃的饱和培养箱中培养4 h,再将培养皿正置并补加1 mL的细胞培养液没过组织块,过夜后再补加2 mL培养液继续培养, 2~3 d换液1次。7 d左右成纤维细胞从组织块游离生长出来,12 d左右乳腺上皮细胞逐渐长出,然后运用胰蛋白酶差异消化法结合细胞贴壁速度的不同分离乳腺上皮细胞和成纤维细胞,将混合生长至汇合的细胞用PBS洗3遍,加入0.25%胰蛋白酶,37 ℃消化3 min,随后用含血清的培养液终止消化,轻轻将变圆或漂起的细胞洗下,随后用胰蛋白酶继续消化,将消化得到的细胞培养2~3 h后,收集细胞培养液,将没有贴壁的乳腺上皮细胞转移到另外一个培养皿继续培养,经过2~3次纯化后,得到较为纯净的乳腺上皮细胞作为转染细胞使用[14]。
1.2.4 慢病毒载体骨架及质粒构建 miRNAs由Pre-miRNA剪切加工而来,pre-miRNA具有茎环结构,可以保证miRNA的稳定性。因此构建包含目的miRNA-103-1前体miExpressTMPrecursor 的miRNA慢病毒表达质粒LpEZX-pre-miR-103-1和空质粒LpEZX-miR-NC,然后将该质粒转入感受态细菌体内,从而使得miRNA-103-1随细菌的增加而扩增。连接转化等操作步骤见参考文献(图1)[12]。
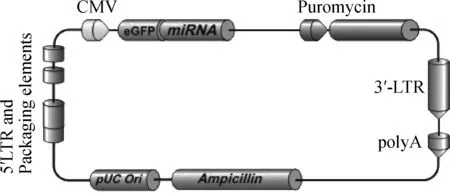
图1 慢病毒载体骨架的结构Fig.1 The structure of lentivirus vector
1.2.5 慢病毒质粒 LpEZX-pre-miR-103-1在293T细胞中的包装和扩繁 复苏的293T细胞传代后,用Poly赖氨酸铺皿用于转染试验,然后运用罗氏法包装和扩繁慢病毒质粒。转染后48 h开始观察细胞的绿色荧光蛋白表达情况,72 h后待大多数细胞呈圆形、且出现明显的葡萄串状结构时收集病毒并测定病毒滴度。
1.2.6 病毒颗粒感染乳腺上皮细胞 于60 mm培养皿中加入病毒液1 mL,以正常水牛乳腺上皮细胞为对照,48 h后观察绿色荧光蛋白表达情况,72 h后收集细胞,用于RNA提取及反转录,并进行定量分析。
1.2.7 miR-103-1抑制剂及转染 化学合成miR-103-1抑制剂,序列:5′-TCGTCGTUUCUTGTCCCGUTUCT-3′,用于乳腺细胞的转染试验,参照Lipo-2000试剂说明进行转染。
1.2.8 统计分析 所有QRT-PCR结果采用2-△△Ct法进行数据统计,结果重复3次,利用SPSS19.0软件进行数据处理,分析差异显著性。
2 结 果
2.1 水牛bbu-miR-103-1在泌乳期和非泌乳期乳腺组织中的表达模式
本实验室Solexa高通量测序结果表明,bbu-miR-103-1在泌乳期总序列标签为8456705,在非泌乳期总序列标签为7665749,重叠转录区(Overlapping transcripts)都在内含子,其中bbu-miR-103-1在chr20_2864127_2864198_+上,编码基因是ENSbtaG00000011895,前体序列为5′-CTGC-CCTCGGCTTCTTTACAGTGCTGCCTTGTTGCATA-TGGATCAAGCAGCATTGTACAGGGCTATGAAGGC-3′,结合自由能为-119.72 kJ·mol-1;bbu-miR-103-2,在chr13_51838778_51838853_-上,编码基因是ENSbtaG00000007920,前体序列为5′-TTGTGC-TTTCAGCTTCTTTACAGTGCTGCCTTGTAG-CATTCAGGTCAAGCAGCATTGTACAGGGCT-ATGAAAGAAC-3′,茎环自由能为-115.12 kJ·mol-1, 其成熟序列都为:5′-AGCAGCAUUGUACAGGGCUAUGA-3′,bbu-miR-103表达有极显著差异。
因此分析了水牛bbu-miR-103-1序列,设计了特异性茎环反转录引物Loop-RT-miR-103-1和定量引物,在乳腺组织上反复和重复筛选到反转特异性较好的Loop-RT-miR-103-1引物和单峰且熔解温度在80℃左右的熔解曲线QRT-PCR引物,用验证过的引物进行后续QRT-PCR。结果显示,水牛bbu-miR-103-1的相对表达量在泌乳期为非泌乳期的5.29倍,差异极显著(P<0.01, 图2),说明bbu-miR-103-1在乳腺组织中表达模式是动态变化的,推测bbu-miR-103-1表达的改变可能对泌乳发挥重要调控作用。
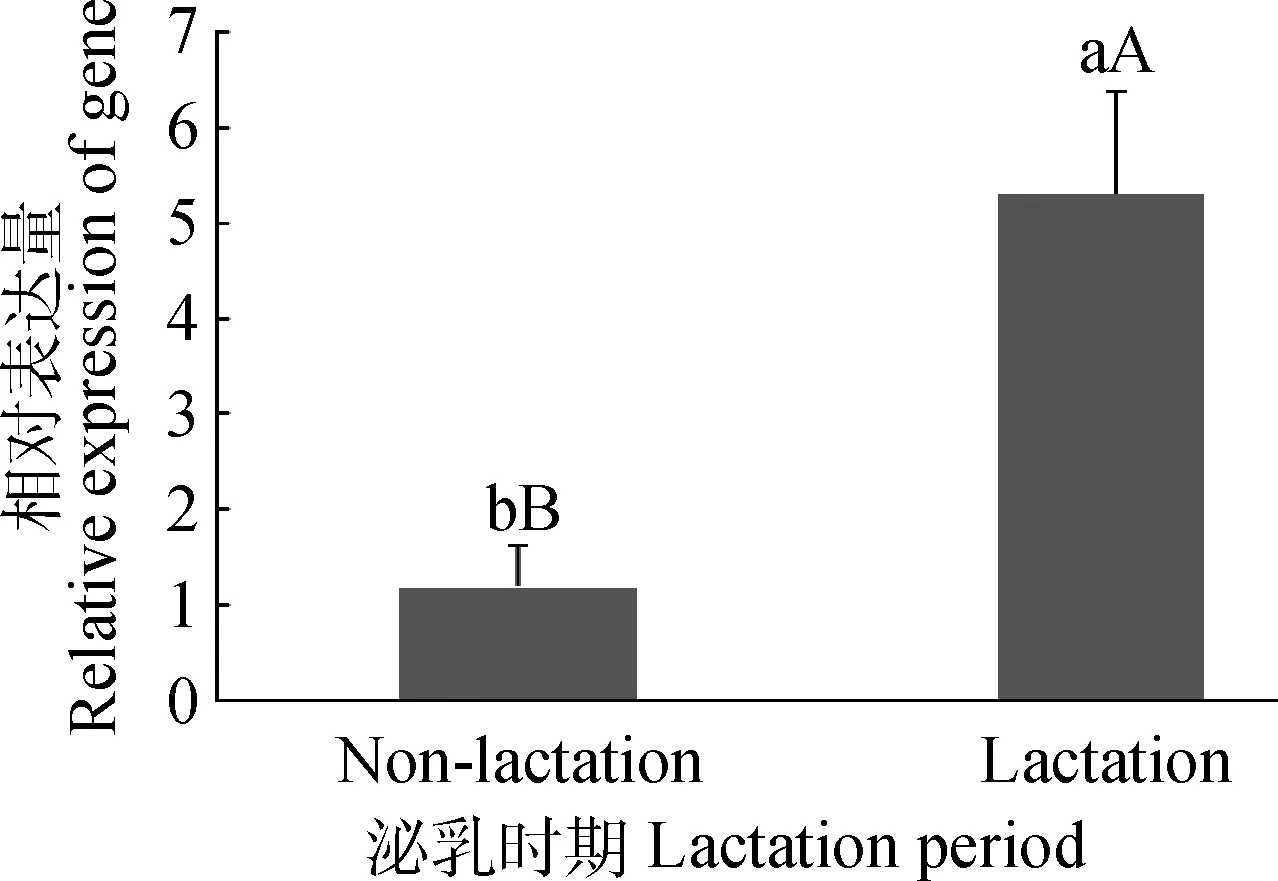
图中所标字母相异表示差异显著(P<0.05或P<0.01),所标字母相同表示差异不显著(P>0.05);大写和小写字母分别表示0.01和0.05水平。图8同Different letters means significant difference between the groups(P<0.05 or P<0.01),and same letters means no significant difference between the groups(P>0.05);Capital letters and lowercase letters means 0.01 and 0.05 levels, respectively. The same as Figure 8图2 bbu-miR-103-1在泌乳期和非泌乳期的相对表达量Fig.2 The relative expression of bbu-miR-103-1 in lactation and non-lactation periods
2.2 慢病毒表达载体的成功构建与包装
2.2.1 慢病毒载体的构建 基于人免疫缺陷慢病毒系统的载体骨架,构建了携带 bbu-miR-103-1前体序列5′-CTGCCCTCGGCTTCTTTACAGTGCTGCCTTGTTGCATATGGATCAAGCAGCA-TTGTACAGGGCTATGAAGGC-3′的前体表达克隆质粒 LpEZX-pre-miR-103-1,大小为8 219 bp,图3为质粒提取后电泳鉴定结果,略大于8 023 bp,说明构建的质粒是正确的。
2.2.2 bbu-miR-103-1慢病毒质粒的包装和扩繁 LpEZX-pre-miR-103-1 与空质粒 LpEZX-miR-NC分别与NRF(Packaging plasmid)和VSV-G(Envelop plasmid encoding the vesicular stomatitis virus-G glycoprotein)在293T细胞中进行包装,12 h后换液,48 h观察绿色荧光蛋白发光情况。结果显示,转染空质粒和miR-103-1组都有绿色荧光表达,说明病毒包装成功。与正常细胞的形态相比,感染后细胞形态变圆、变大,并伴有典型的葡萄串状病变结构(图4)。
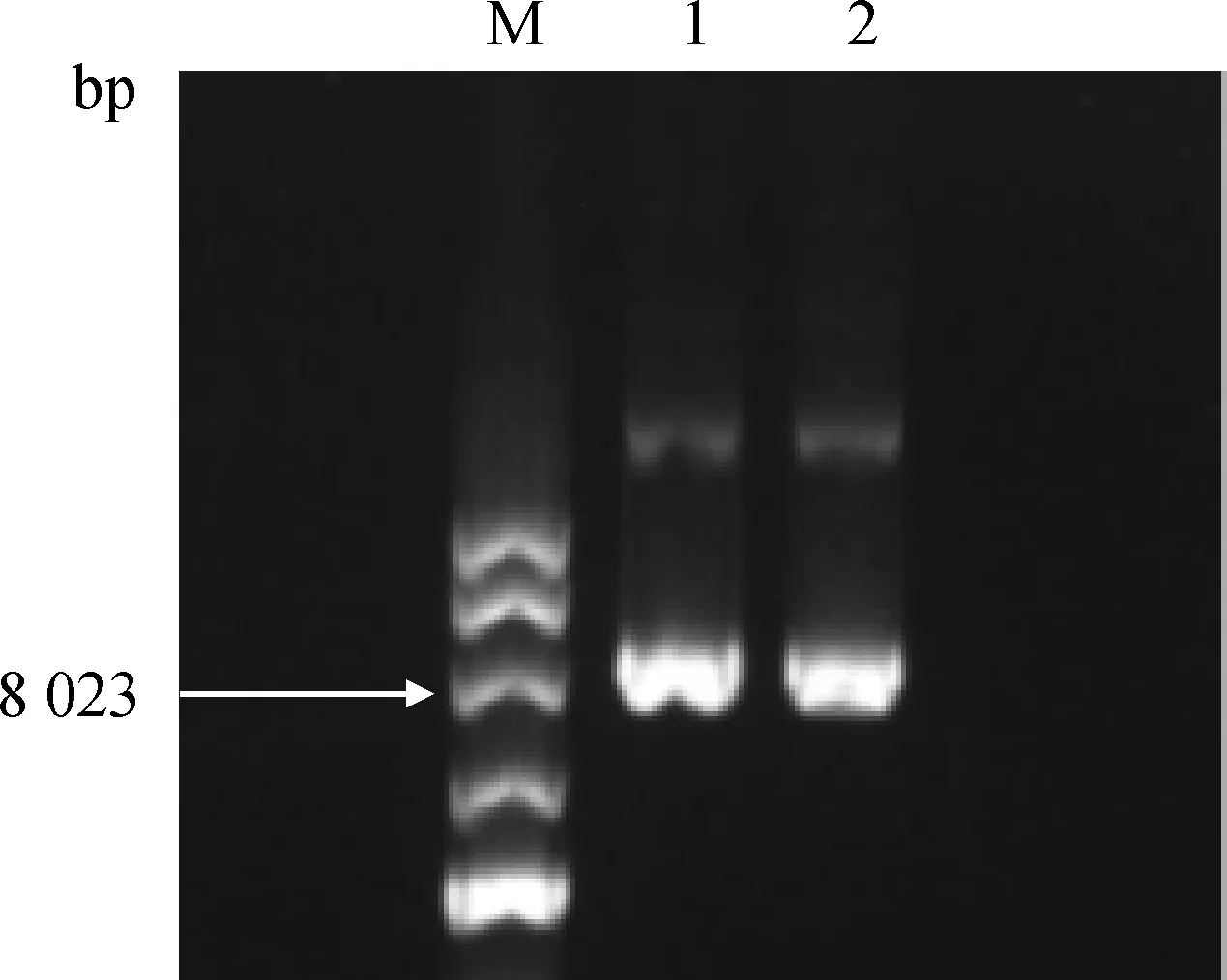
M. DNA相对分子质量标准;1.LpEZX-pre-miR-NC 载体;2. LpEZX-pre-miR-103-1载体M. DNA marker; 1.LpEZX-pre-miR-NC vector; 2. LpEZX-pre-miR-103-1 vector图3 LpEZX-pre-miR-103-1慢病毒质粒构建Fig.3 Construction of lentivirus vector LpEZX-pre-miR-103-1

A1、A2、B1、B2、C1、C2、D1、D2分别为空质粒和pre-miR-103-1侵染293T细胞48 h后的荧光显微镜观察结果;A1、B1、C1、D1为常光下观察结果;A2、B2、C2、D2分别为A1、B1、C1、D1 对应的绿色荧光下观察结果A1,A2,B1,B2 and C1,C2,D1,D2 are the results of observation of 293T cells infected separately by empty plasmid-LpEZX-miR-NC and LpEZX-pre-miR-103-1 after 48 h; A1,B1,C1,D1 are the results of observation in nature light;A2,B2,C2, D2 are the results of observation in green fluorescence corresponding to A1,B1,C1,D1图4 慢病毒质粒侵染293T细胞48 h后观察包装结果Fig.4 Packaged results of 293T cells infected by lentivirus vector after 48 h
2.2.3 慢病毒质粒 bbu-miR-103-1滴度测定结果 在293T 细胞系中感染慢病毒质粒病毒上清液,在随机选取的10个视野里测定病毒的滴度,结果表明,空载滴度达3.42×106PFU·mL-1,bbu-miR-103-1病毒滴度为3.47×106PFU·mL-1(图5)。结果表明,bbu-miR-103-1与对照的滴度相当,可以进行等量病毒感染。
2.3 慢病毒介导miR-103-1中的过表达结果
2.3.1 乳腺上皮细胞的培养 采用组织块法培养水牛乳腺上皮细胞,乳腺上皮细胞12 d左右逐渐生长出来,细胞间排列紧密,呈多角形,单层紧密向外生长,长至15 d左右如鹅卵石铺路(图6),呈典型的动物乳腺上皮细胞特征。

A1、A2、B1、B2和C1、C2、D1、D2分别为随机选取的空质粒和pre-miR-103-1质粒病毒滴度感染293T细胞的测定视野;A1、B1、C1、D1为常光下观察结果;A2、B2、C2、和D2分为A1、B1、C1、D1 对应的绿色荧光下观察结果A1,A2,B1,B2 and C1,C2,D1,D2 are detection fields of view selected randomly of 293T cells infected by empty plasmid-LpEZX-miR-NC and LpEZX-pre-miR-103-1, separately; A1,B1,C1,D1 are the results of observation in nature light;A2,B2,C2,D2 are the results of observation in green fluorescence corresponding to A1,B1,C1,D1图5 病毒上清液滴度测定Fig.5 Titer detection of supernatant of lentivirus

A和B为原代水牛乳腺上皮细胞从组织中生长出来;C和D为水牛乳腺上皮细胞A and B are the primary buffalo mammary epithelial cells from mammary tissue;C and D are buffalo mammary epithelial cells图6 用于感染的水牛乳腺上皮细胞Fig.6 Buffalo mammary gland epithelial cells used for infected
2.3.2 乳腺上皮细胞的感染 用1 mL对照和miR-103-1病毒原液分别感染水牛乳腺上皮细胞,体外培养48 h后,在显微镜下可见绿色荧光(图7)。且绿色荧光发光较亮,表明miR-103-1及空载对照病毒颗粒已经成功地进入了水牛乳腺上皮细胞中,并且质粒代谢产生了过量的空载和miR-103-1,质粒进入了工作状态,这时eGFP在乳腺上皮细胞中发出绿色荧光。
2.4 过表达和抑制表达bbu-miR-103-1对水牛乳脂合成相关基因的影响
2.4.1 过表达和抑制表达bbu-miR-103-1对推测靶基因PANK3的影响 生物信息学预测bbu-miR-103-1的可能靶基因为1 160个,其中包括PANK3,得分146分,根据其他物种miR-103-1对PANK3及乳脂代谢通路影响,选择PANK3及乳脂通路的相关基因进行QRT-PCR检测。利用化学合成的miR-103-1抑制剂转染水牛乳腺上皮细胞实现抑制表达,运用慢病毒过表达载体LpEZX-pre-miR-103-1感染水牛乳腺上皮细胞实现过表达miR-103-1,然后QRT-PCR检测了过表达和抑制表达bbu-miR-103-1对可能预测的靶向基因PANK3的作用。
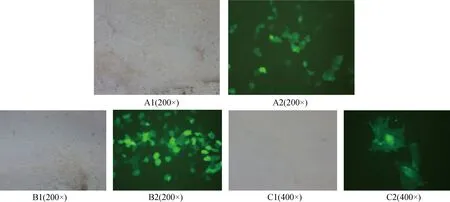
A1、A2和B1、B2、C1、C2分别为空质粒和LpEZX-pre-miR-103-1侵染水牛乳腺上皮细胞48 h后的荧光显微镜观察结果;A1、B1、C1为常光下观察结果;A2、B2、C2为绿色荧光下观察结果A1,A2 and B1,B2,C1,C2 are the results of observation of buffalo mammary gland epithelial cells infected separately by empty plasmid(LpEZX-miR-NC) and LpEZX-pre-miR-103-1 after 48 h; A1,B1,C1 are the results of observation in nature light;A2,B2,C2 are the results of observation in green fluorescence图7 空质粒和LpEZX-pre-miR-103-1过表达慢病毒质粒感染乳腺上皮细胞的结果Fig.7 Observation of buffalo mammary gland epithelial cells infected by empty plasmid (LpEZX-miR-NC) and LpEZX-pre-miR-103-1
QRT-PCR结果表明,过表达miR-103-1能够极显著降低水牛乳腺细胞PANK3的表达(P<0.01),而miR-103-1抑制剂极显著提高水牛乳腺细胞PANK3基因的表达(P<0.01),说明水牛bbu-miR-103-1与PANK3表达量有负向调控规律,根据慢病毒质粒过表达miR-103-1工作原理,结合检测过表达和抑制剂对其他基因没有显著的负向调控规律,预测PANK3为miR-103-1的作用靶基因。
2.4.2 水牛miR-103-1对乳脂合成代谢通路的作用 水牛乳脂合成乳成分中需要多个基因的协调作用来进行有效的转录、翻译和分析,涉及多个生化途径,包括脂肪酸从头合成、甘油三脂合成、乳脂滴合成和分泌、脂肪酸吸收、 脂肪酸激活、脂解及释放、脂肪酸氧化和脂肪酸受体等多个过程,涉及到复杂的基因调控网络。为了探明miR-103-1过表达对水牛乳脂合成代谢通路的级联反应,检测了8个乳脂代谢步骤中22个相关基因表达量的变化。结果表明,过表达miR-103-1对FASN作用不显著(P>0.05);而过表达miR-103-1极显著上调了ACACA的表达(P<0.01),说明miR-103-1主要以促进ACACA开头的脂肪酸合成为主。转录因子固醇调节元件结合蛋白1(SREBP1c)和核受体(LXRa)等是调控乳脂合成相关基因表达的重要因子。过表达miR-103-1能够显著提高SREBP1c的表达(P<0.05),但是对LXRa基因的表达水平作用不显著(P>0.05),表明miR-103-1能够通过影响靶基因PANK3促进SREBP1c信号通路的乳脂合成。过表达miR-103-1主要对脂肪酸从头合成、甘油三脂合成、乳脂滴合成和分泌、脂肪酸吸收和脂肪酸激活等5个乳脂代谢基因起作用,主要对ACACA、GPAM、DGAT1和PDK4产生极显著的上调作用(P<0.01),对SREBP1c、ADFP、CD36、ACSS1等基因产生显著的上调作用(P<0.05)。
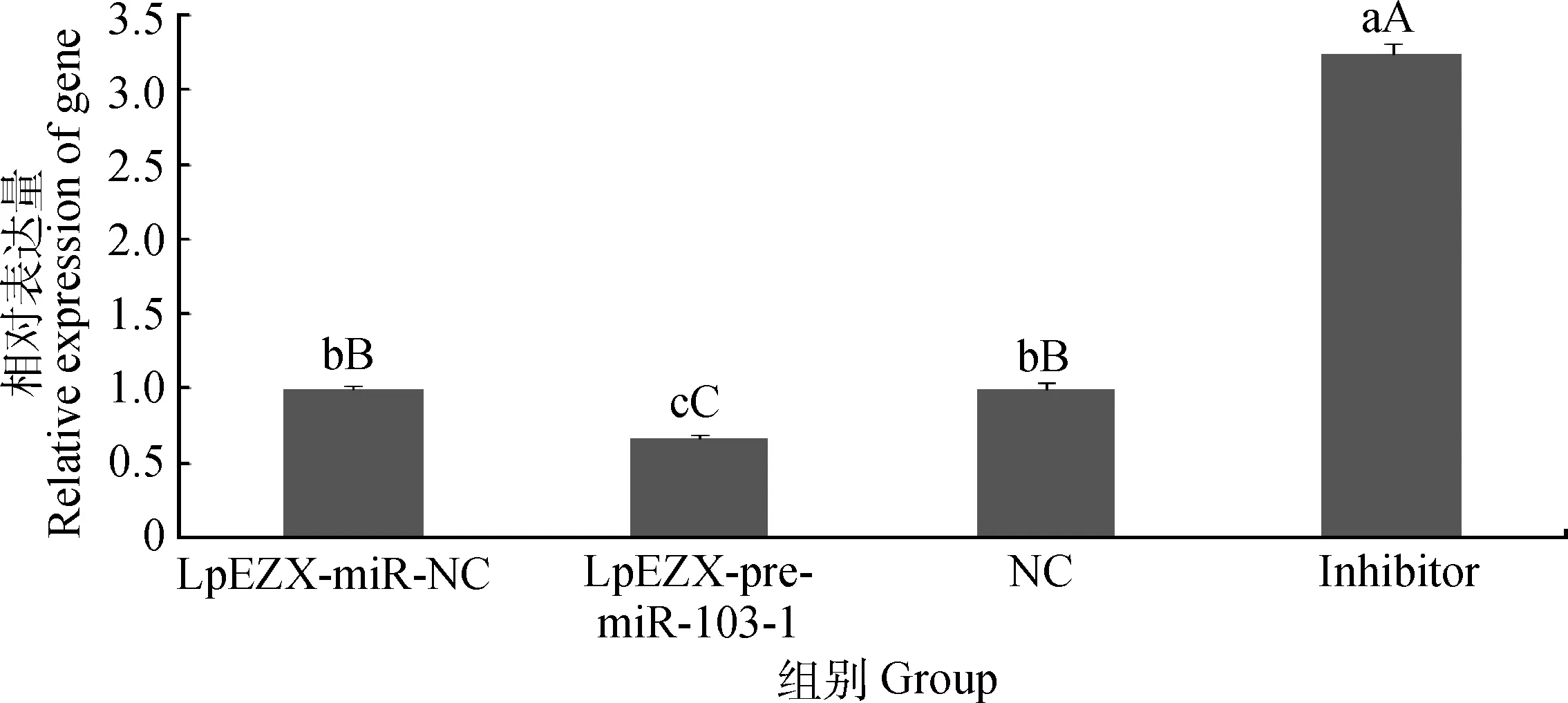
图8 过表达和抑制表达miR-103-1对靶基因PANK3表达的影响Fig.8 Effect of overexpress and suppression of miR-103-1 on the expression of target gene PANK3
表2 过表达miR-103-1对脂肪酸通路其他相关基因表达的影响
Table 2 Effect of overexpress of miR-103-1 on the expression of other related genes in milk fat metabolism
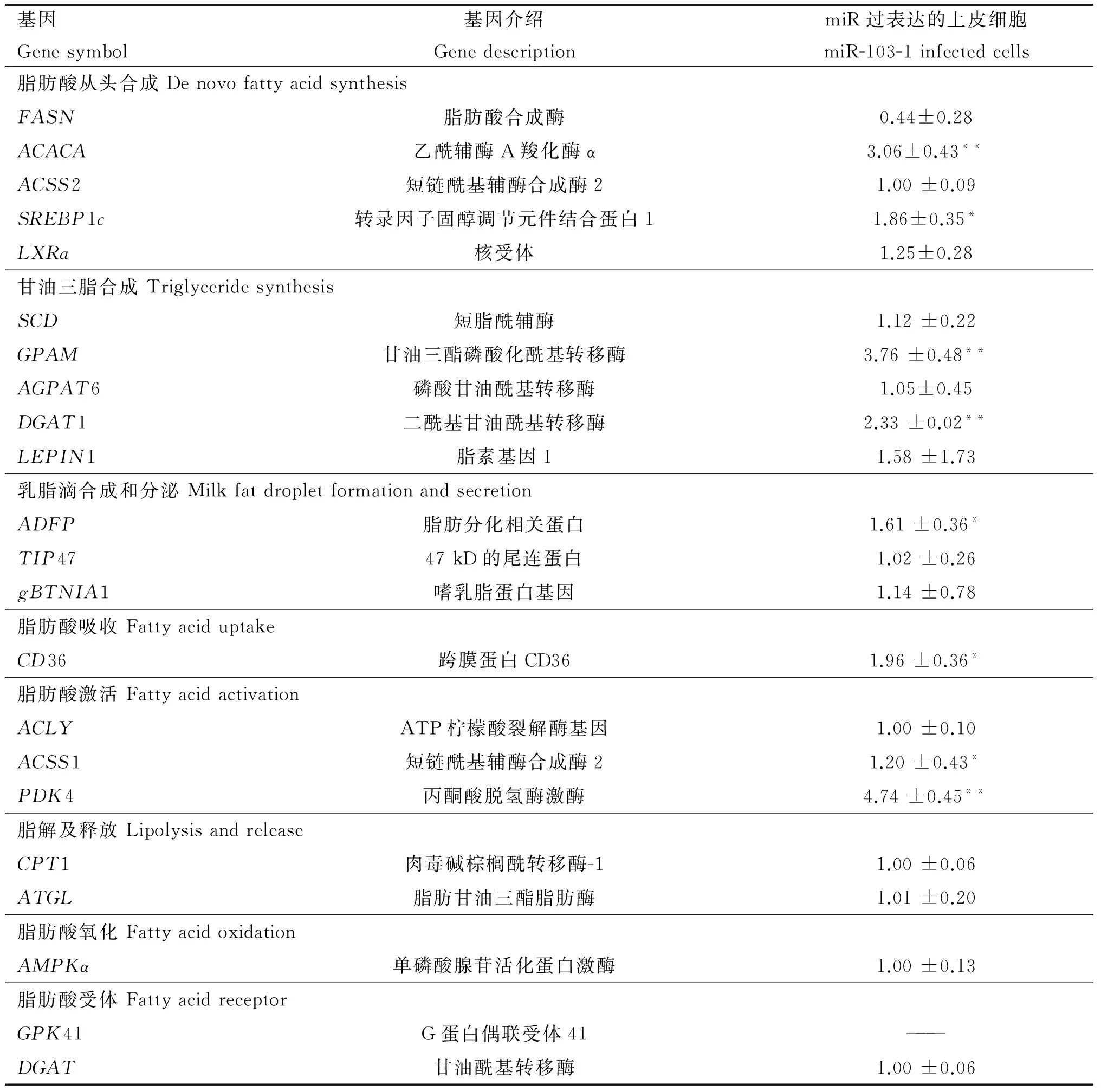
基因Genesymbol基因介绍GenedescriptionmiR过表达的上皮细胞miR-103-1infectedcells脂肪酸从头合成DenovofattyacidsynthesisFASN脂肪酸合成酶0.44±0.28ACACA乙酰辅酶A羧化酶α3.06±0.43**ACSS2短链酰基辅酶合成酶21.00±0.09SREBP1c转录因子固醇调节元件结合蛋白11.86±0.35*LXRa核受体1.25±0.28甘油三脂合成TriglyceridesynthesisSCD短脂酰辅酶1.12±0.22GPAM甘油三酯磷酸化酰基转移酶3.76±0.48**AGPAT6磷酸甘油酰基转移酶1.05±0.45DGAT1二酰基甘油酰基转移酶2.33±0.02**LEPIN1脂素基因11.58±1.73乳脂滴合成和分泌MilkfatdropletformationandsecretionADFP脂肪分化相关蛋白1.61±0.36*TIP4747kD的尾连蛋白1.02±0.26gBTNIA1嗜乳脂蛋白基因1.14±0.78脂肪酸吸收FattyaciduptakeCD36跨膜蛋白CD361.96±0.36*脂肪酸激活FattyacidactivationACLYATP柠檬酸裂解酶基因1.00±0.10ACSS1短链酰基辅酶合成酶21.20±0.43*PDK4丙酮酸脱氢酶激酶4.74±0.45**脂解及释放LipolysisandreleaseCPT1肉毒碱棕榈酰转移酶-11.00±0.06ATGL脂肪甘油三酯脂肪酶1.01±0.20脂肪酸氧化FattyacidoxidationAMPKα单磷酸腺苷活化蛋白激酶1.00±0.13脂肪酸受体FattyacidreceptorGPK41G蛋白偶联受体41———DGAT甘油酰基转移酶1.00±0.06
*.P<0.05;**.P<0.01
3 讨 论
许多miRNA靶向乳腺细胞基因参与调控乳腺的泌乳。比如T.Tanaka等利用芯片、基因敲除和载体构建技术揭示了miR-101a可以调节β酪蛋白表达,miR-101a 和miR-199a通过调节Cox-2参与到乳腺上皮细胞的生长发育中[15];miR-126在乳腺上皮细胞中靶向于孕激素受体[16]; 冯丽等利用生物信息学分析证明let-7g靶向于Tgfbr1来调节鼠乳腺上皮细胞的生长和泌乳[17], miR-139靶向于GHR基因来调节乳腺上皮细胞的泌乳[18]。在脂类代谢过程中,miRNA是一类重要的调控因子,miR-33能够沉默CPT1A(Carnitine palmitoyl transferase1A)基因,降低脂肪酸β氧化, miR-122调节脂类代谢相关基因的表达[19]。已有研究表明,miRNA-103家族的miR-103-1位于PANK3的第5内含子,在泌乳中期高表达,通过靶向调控宿主基因PANK3,从而调控萨能山羊的乳脂代谢,过表达miR-103能够增加乳腺上皮细胞脂滴含量,甘油三酸酯和脂肪酸含量,上调PPARc、DGAT1、ABCA1、LXRa、ABCG1、SREBP1c、FASN和ACACA基因的表达,而FASN和ACACA是SREBP1c的下游靶基因[20]。
本研究在水牛乳腺组织中测序发现了bbu-miR-103-1,并对其靶基因进行了定位等相关生物信息学分析。对miR-103在水牛乳腺上皮细胞中靶基因的研究发现,水牛miR-103-1与PANK3的表达量成反比,说明miR-103-1通过调控靶基因PANK3(Pantothenate kinase 3)来发挥作用。PANK3编码一个属于泛酸激酶家族的蛋白,泛酸激酶是一个在细菌和哺乳动物辅酶A的生物合成中起着关键作用的调控酶,它催化通向普通生物合成辅酶A(CoA)的第一个关键步骤。PANK3作为细胞内CoA的抑制调控剂[21],而乙酰CoA是乙酸在胞质中生成,乙酸是乳腺脂肪酸最开始合成的4碳单位的两个提供者之一(另一个是beta-羟丁酸),即乙酰CoA在脂肪酸合成时为碳链的延长提供碳原子,为合成的原材料。miR-103-1过表达降低了靶基因PANK3的表达,从而解除了PANK3对乙酰CoA的抑制调控作用,促进了乙酰CoA为脂肪酸合成提供更多的原材料,从而促进脂肪酸的从头合成。而从头合成脂肪酸在细胞内有FASN和ACACA酶两条主要途径。SREBP1c和LXRa是调控脂类合成的主要调节元件[22], 他们通过结合下游基因的核酸序列来启动基因的表达,并相互调节平衡以维持细胞状态的平衡[10]。本研究表明,过表达miR-103-1在水牛乳腺细胞中确实促进了ACACA开头的乳脂合成,并且可能是通过显著提高SREBP1c转录因子的mRNA表达水平来实现的,因为其对LXRa没有呈现出类似的显著相关性关系。其中,miR-103-1对PANK3的靶向调控作用,过表达提高SREBP1c和ACACA基因的表达结果与之前研究类似,但是本研究检测对LXRa表达结果与之前研究有所不同[23],这可能因为物种不同导致,具体机理尚需进一步研究。过表达miR-103-1还对GPAM、DGAT1、ADFP、CD36和PDK4等基因产生了显著的上调作用。水牛的乳脂含量约是奶牛的2倍,是否与此直接相关,是否可以应用在提高奶牛的乳脂含量方面,还有待进一步在奶牛活体进行研究。
bbu-miR-103-1的研究也可为其在医学上的应用提供基础资料。miRNAs在医学中有多重作用,自从1965年之后就知道婴儿对乳球蛋白的不容纳性[24]导致一些婴儿对奶的过敏问题[25]。C. Merkl等报道了人工miRNA在猪上具有阻止乳球蛋白表达的作用[26]。A. Jabed等通过表达miRNA-6和miRNA-4成功获得了生产不含乳球蛋白的转基因牛[27]。本研究发现,bbu-miR-103-1在水牛乳脂代谢通路中有作用,在人类和小鼠中miR-103-1中也有类似作用,比如在3T3-L1和脂肪细胞中高富集[28-29]。miR-103-1在肥胖的小鼠中表达上调,miR-103-1是胰岛素受体的关键调控者微囊蛋白Caveolin-1的直接靶基因。miR-103-1失活能够上调脂肪细胞Caveolin-1表达且伴随胰岛素受体的稳定性,促进胰岛素信号通路,降低脂肪细胞大小[30]。本研究结果可为医学上揭示bbu-miR-103作用机理提供科学依据。
4 结 论
水牛bbu-miR-103-1在泌乳期表达量为非泌乳期的5.29倍,差异显著(P<0.05);本研究成功构建、包装和扩繁生产了滴度较高的水牛bbu-miR-103-1的慢病毒质粒LpEZX-pre-miR-103-1的病毒颗粒;过表达和抑制表达bbu-miR-103-1与乳腺细胞靶基因PANK3的表达量呈负相关;过表达bbu-miR-103-1,通过下调PANK3的表达,反馈提高SREBP1c的mRNA水平,促进了SREBP1c信号通路的乳脂合成,最终促进了以ACACA开头的的脂肪酸的从头合成。bbu-miR-103-1对水牛脂肪合成具有十分重要的调控作用。
[1] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J].Cell, 2004, 116(2): 281-297.
[2] 郝俊芳,黄 凯,王月影,等. 炎症相关miRNAs在LPS诱导的小鼠乳腺上皮细胞炎性反应中的表达及miR-223真核表达载体的构建[J].畜牧兽医学报, 2016,47(1): 183-189.
HAO J F, HUANG K, WANG Y Y, et al. Expression of inflammation-related miRNAs in the LPS-induced inflammation in murine mammary epithelial cells and construction of miR-223 eukaryotic expression vector[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(1): 183-189.(in Chinese)
[3] MIAO L, YAO H, LI C, et al. A dual inhibition: microRNA-552 suppresses both transcription and translation of cytochrome P450 2E1[J].BiochimBiophysActa, 2016, 1859(4):650-662.
[4] FRIEDMAN R C, FARH K K, BURGE C B, et al. Most mammalian mRNAs are conserved targets of microRNAs[J].GenomeRes, 2009, 19(1): 92-105.
[5] DORN G W 2nd. MicroRNAs in cardiac disease[J].TranslRes, 2011, 157(4):226-235.
[6] CHEN X, LIANG H, ZHANG J, et al. Secreted microRNAs: a new form of intercellular communication[J].TrendsCellBiol, 2012, 22(3): 125-132.
[7] CHEN X, GAO C, LI H, et al. Identification and characterization of microRNAs in raw milk during different periods of lactation, commercial fluid, and powdered milk products[J].CellRes, 2010, 20(10): 1128-1137.
[8] WANG M, MOISS, KHAN M J, et al. MicroRNA expression patterns in the bovine mammary gland are affected by stage of lactation 1[J].JDairySci, 2012, 95(11):6529-6535.
[9] KOSAKA N, IZUMI H, SEKINE K, et al. microRNA as a new immune-regulatory agent in breast milk[J].Silence, 2010, 1(1): 7.
[10] LI Z, LIU H, JIN X, et al. Expression profiles of microRNAs from lactating and non-lactating bovine mammary glands and identification of miRNA related to lactation[J].BMCGenomics, 2012, 13: 731.
[11] LIN X, LUO J, ZHANG L, et al. MiR-103 controls milk fat accumulation in goat (Caprahircus) mammary gland during lactation[J].PLoSOne, 2013, 8(11): e79258.
[12] 林先滋,罗 军,张犁苹,等. miR-200a对奶山羊乳腺上皮细胞乳脂合成相关基因mRNA表达的影响[J]. 畜牧兽医学报, 2012, 43(7):1028-1036.
LIN X Z , LUO J, ZHANG L P, et al. The effect of miR-200a on gene mRNA expression related to milk fat synthesis in dairy goat mammary gland epithelial cells[J].ActaVeterinariaetZootechnicaSinica, 2012, 43(7):1028-1036. (in Chinese)
[13] 雷小灿, 张海航, 崔奎青,等. 水牛BMP1基因对颗粒细胞增殖与凋亡的功能研究[J]. 畜牧兽医学报,2015,46(10):1766-1774.
LEI X C, ZHANG H H, CUI K Q, et al. Function analysis of buffaloBMP1 gene on proliferation and apoptosis of granulosa cells[J].ActaVeterinariaetZootechnicaSinica, 2015,46(10):1766-1774. (in Chinese)
[14] 李明鸿. 水牛乳腺上皮细胞分离培养和永生化的初步研究[D]. 南宁:广西大学, 2010: 19-21.
LI M H. Primary study on isolation, culture and immortalization of swamp buffalo mammary epithelial cells[D].Nanning: Guangxi University, 2010: 19-21. (in Chinese)
[15] TANAKA T, HANEDA S, IMAKAWA K, et al. A microRNA, miR-101a controls mammary gland development by regulating cyclooxygenase-2 expression[J].Differentiation, 2009, 77(2): 181-187.
[16] 崔 巍, 王春梅, 李庆章,等. miR-126对小鼠乳腺上皮细胞增殖及泌乳功能的影响[J]. 中国乳品工业, 2011, 39(3):17-19,45.
CUI W, WANG C M, LI Q Z, et al. Impact of miR-126 on proliferation and lactation of mouse mammary epithelial cells[J].ChinaDairyIndustry, 2011, 39(3):17-19,45. (in Chinese)
[17] 冯 丽, 李庆章, 崔 巍,等. let-7g对小鼠乳腺发育和泌乳相关功能基因Tgfbr1的作用及其机理[J]. 中国兽医学报, 2012, 32(1):103-107,129.
FENG L, LI Q Z, CUI W, et al. The role and mechanism of let-7g on tgfbrl related to development and lactation of mouse mammary gland[J].ChineseJournalofVeterinaryScience, 2012, 32(1):103-107,129. (in Chinese)
[18] LI Q, WANG C, GAO X. Role of miRNA in mammary gland development and lactation[J].JNortheastAgricUni(Englishedition), 2014, 21(1):70-74.
[19] 张犁苹, 罗 军, 林先滋,等. miR-200家族在西农萨能奶山羊乳腺组织中的表达分析[J]. 畜牧兽医学报, 2013, 44(6):944-951.
ZHANG L P, LUO J ,LIN X Z, et al. Expression profiles of miR-200 family in mammary gland of Xinong Saanen Dairy Goat[J].ActaVeterinariaetZootechnicaSinica, 2013, 44(6):944-951. (in Chinese)
[20] LIN X Z, LUO J, ZHANG L P, et al. MicroRNAs synergistically regulate milk fat synthesis in mammary gland epithelial cells of dairy goats[J].GeneExpr, 2013, 16(1): 1-13.
[21] ROCK C O, CALDER R B, KARIM M A, et al. Pantothenate kinase regulation of the intracellular concentration of coenzyme A[J].JBiolChem, 2000, 275(2): 1377-1383.
[22] 李庆章. 奶牛乳腺发育与泌乳生物学 [M].北京;科学出版社, 2014: 39-40.
LI Q Z. Mammary gland development and lactation biology of dairy cow[M]. Beijing: Science Press, 2014: 39-40. (in Chinese)
[23] 张雅彬, 林雪彦, 闫振贵,等. 真胃灌注葡萄糖对泌乳奶山羊乳脂合成的影响[J]. 畜牧兽医学报, 2014, 45(9):1432-1439.
ZHANG Y B, LIN X Y, YAN Z G, et al. Effects of abomasal glucose infusion on milk fat synthesis in lactaing goats[J].ActaVeterinariaetZootechnicaSinica, 2014, 45(9):1432-1439. (in Chinese)
[24] DAVIDSON M, BURNSTINE R C, KUGLER M M, et al. Malabsorption defect induced by ingestion of beta lactoglobulin[J].JPediatr, 1965, 66: 545-554.
[25] ANDERSON N G, POWERS M T, TOLLAKSEN S L. Proteins of human milk. I. Identification of major components[J].ClinChem, 1982, 28 (4Pt2): 1045-1055.
[26] MERKL C, LEUCHS S, SAALFRANK A, et al. RNA interference in pigs: comparison of RNAi test systems and expression vectors[J].MolBiotechnol, 2011, 48(1): 38-48.
[27] JABED A, WAGNER S, McCRACKEN J, et al. Targeted microRNA expression in dairy cattle directs production of β-lactoglobulin-free, high-casein milk[J].ProcNatlAcadSciUSA, 2012, 109(42): 16811-16816.
[28] XIE H, LIN B. MicroRNAs induced during adipogenesis that accelerate fat cell development are downregulated in obesity[J].Diabetes, 2009, 58(5): 1050-1057.
[29] VATANDOOST N, AMINI M, IRAJ B, et al. Dysregulated miR-103 and miR-143 expression in peripheral blood mononuclear cells from induced prediabetes and type 2 diabetes rats[J].Gene, 2015, 572(1):95-100.
[30] TRAJKOVSKI M, HAUSSER J, SOUTSCHEK J, et al. MicroRNAs 103 and 107 regulate insulin sensitivity[J].Nature, 2011, 474(7353): 649-653.
(编辑 郭云雁)
Expression Pattern and Target Regulation Gene of bbu-miR-103-1 from Lactation and Non-lactation Periods inB.bubalis
CAI Xiao-yan1,2, LI Sheng1,CHEN Qiu-ping1,WANG Ping1, DENG Kai1,LIU Qing-you1*,SHI De-shun1*
(1.StateKeyLaboratoryofTropicalBiologicalResourcesProtectionandUtilization,GuangxiUniversity,Nanning530004,China;2.GuangxiInstituteofAnimalScience,Nanning530001,China)
This study aimed to investigate the expression pattern of bbu-miR-103-1 from lactation and non-lactation periods in buffalo (Bubalusbubalis), and to predict its target gene and function. Expression pattern of bbu-miR-103-1 in lactation and non-lactation periods were detected by qRT-PCR. The precursor expression plasmid of bbu-miR-103-1 was constructed and named LpEZX-pre-miR-103-1 (HIV). It was packaged and propagated to produce high-titer lentivirus in 293T cell lines,which could be used to infect buffalo mammary epithelial cells (BMECs) and over express bbu-miR-103-1. The inhibitor of bbu-miR-103-1 was chemically synthesized and transfected into BMECs to suppress bbu-miR-103-1 at the same time. The relative expression of pantothenate kinase 3(PANK3) and milk fat metabolism related genes were detected by qRT-PCR. The results showed that the relative expression of bbu-miR-103-1 from lactation period was 5.29 times higher than that from non-lactation period in buffalo(P<0.01). The LpEZX-pre-miR-103-1 has been successfully constructed and packaged with the infection titer for 3.47×106PFU·mL-1. Overexpress or suppress of bbu-miR-103-1 extremely significantly down-regulated or up-regulated(P<0.01) the expression level ofPANK3 in BMECs. Over expression of bbu-miR-103-1 extremely significantly enhanced the expression of Acetyl-CoA carboxylase alpha (ACACA), Glycerol-3-phosphate acyltransferase 1 mitochondrial (GPAM), Diacylglycerol O-acyltransferase 1(DGAT1) and Pyruvate dehydrogenase lipoamide kinase isozyme 4(PDK4) (P<0.01),and also siginificantly up-regulated the expression of sterol regulatory element binding protein-1c(SREBP1c), Adipose differentiation-related protein(ADFP), Cluster of differentiation 36(CD36), Acetyl-CoA synthetase short-chain subfamily member 1(ACSS1)(P<0.05). Over expression of bbu-miR-103-1 down-regulated the expression ofPANK3,and improved the mRNA level ofSREBP1cby feedback regulation,finally promoted the de novo synthesis of fatty acid fromACACApathway. bbu-miR-103-1 plays an important role in enhancing milk fatty acid synthesis, which provides a molecular base for revealing the mechanism of high-level milk fat content in buffalo.
buffalo;bbu-miR-103-1;expression pattern;PANK3
10.11843/j.issn.0366-6964.2016.11.006
2016-01-11
国家自然科学基金(31260552);国家高技术研究发展计划(863计划)(2011AA100607);优势生态牧草品种遴选及果草耦合系统碳氮源汇的研究与示范(桂科合14125008-2-13);国审牧草新品种紫色象草的繁育与推广(桂渔牧科201453057)
蔡小艳(1982-),女,山西兴县人,博士生,主要从事动物生殖生理及牧草研发,E-mail: caixiaoyan282@163.com
*通信作者:石德顺,博士,研究员,主要从事动物生殖生理研究,E-mail: ardsshi@gxu.edu.cn;刘庆友,博士,研究员,主要从事动物生殖生理研究,E-mail: qyliu2002@126.com
S823.83;S813.3
A
0366-6964(2016)11-2191-11
