山羊CC类趋化因子受体(CCR2)基因的克隆及组织表达分析
2016-12-13朱江江林亚秋
朱江江,林亚秋,王 永,2,李 倩,2,林 森,2
(1. 青藏高原动物遗传资源保护与利用四川省重点实验室,成都 610041;2. 西南民族大学生命科学与技术学院,成都 610041)
山羊CC类趋化因子受体(CCR2)基因的克隆及组织表达分析
朱江江1,林亚秋2*,王 永1,2,李 倩1,2,林 森1,2
(1. 青藏高原动物遗传资源保护与利用四川省重点实验室,成都 610041;2. 西南民族大学生命科学与技术学院,成都 610041)
本研究旨在克隆山羊CC类趋化因子受体基因(CCR2)的CDS区序列,并检测其在山羊不同组织中mRNA和蛋白表达水平,从而为CCR2基因在山羊脂代谢中的作用研究奠定基础。选取2~3周岁的健康简州大耳羊和藏山羊羯羊各4只,屠宰后分别采集心、肝、脾、肺、肾、肌肉和皮下脂肪组织,分别提取组织总RNA及总蛋白,利用RT-PCR法克隆山羊CCR2基因序列,进行生物信息学分析,并利用实时定量PCR法和Western blot分别检测CCR2基因mRNA和蛋白的表达水平。结果显示,克隆得到CCR2基因cDNA序列1 186 bp,包含CDS全长1 100 bp,5′ UTR 2 bp 和3′ UTR 74 bp,编码370个氨基酸残基。山羊CCR2氨基酸序列与牛、猪、小鼠、人的相似性分别为97.3%、91.9%、77.0%和69.2%。山羊CCR2基因与牛具有最近的亲缘关系,其次为猪、狗和小鼠,而与人的亲缘关系较远。组织表达结果显示,CCR2在两种山羊肾和心中均具有较高的表达水平,而在皮下脂肪和肌肉中的表达水平较低。这些结果表明,CCR2可能在山羊脂质代谢过程中具有重要的调控作用。
山羊;CCR2;克隆;组织表达
随着人们消费水平的提高和对绿色、健康生活饮食的倡导,羊肉因为味美、低胆固醇以及营养丰富而越来越深受人们的喜爱[1-3]。肌内脂肪(IMF)是山羊肉质的重要影响因素,与肉的嫩度、风味以及多汁性等性状紧密相关[4]。因此,深入研究山羊脂质代谢的分子调控机制对于改善山羊肉质有着重要意义。
单核细胞趋化蛋白-1(MCP-1)是趋化细胞因子CC 亚家族中的一员[5]。MCP-1可招引单核细胞迁移至内皮下[6],活化为巨噬细胞,进而吞噬已进入内膜的脂蛋白[7]。在人的脂肪细胞中,MCP-1释放水平与CAAT区增强子结合蛋白D(CEBPD)的表达水平呈正相关,并参与到脂肪细胞的分化过程中[8]。可见MCP-1在脂质代谢过程中具有重要的调控作用。MCP-1主要是通过与CC类趋化因子受体2 (CCR2)相结合来发挥作用[9]。CCR2基因的过表达能够增加机体对MCP-1的敏感性,进而促进单核细胞的迁移,其表达量与血液低密度脂蛋白呈正相关,而与高密度脂蛋白呈负相关[10-11]。MCP-1/CCR2能够引起小鼠脂肪组织巨噬细胞的积累从而介导由肥胖导致的胰岛素抵抗。敲除MCP-1或CCR2能够降低细胞内巨噬细胞的数量[12],促进小鼠的脂质代谢,抑制固醇调节元件结合蛋白1c(SREBP1c)的表达,促进ATP结合盒转运子A1(ABCA1)基因的表达[13],最终降低小鼠脂肪含量。而甘油三酯的积累则能够抑制MCP-1和CCR2基因的表达[14],推测CCR2基因在调控脂质代谢过程中具有重要作用。然而,现在对于山羊CCR2基因的序列及其在不同组织中表达特性方面研究的缺失,严重影响了对于CCR2功能的深入了解。
本研究以简州大耳羊和藏山羊为研究对象,克隆CCR2基因,获得其CDS区序列,利用实时定量PCR(qPCR)技术检测其在山羊不同组织中的表达情况,从而为进一步研究CCR2基因在调控脂质代谢中的功能奠定基础。
1 材料与方法
1.1 材料
QuantiTect Reverse Transcription Kit和QuantiFastTMSYBR®Green PCR Kit、pMD-19T Vector、gDNAse购于大连TaKaRa公司,Trizol购自Invitrogen公司,琼脂糖凝胶DNA回收试剂盒(AxyPrep DNA Gel Extraction Kit)购自Axygen公司,2×Taq PCR Master Mix、质粒小提试剂盒购自天根生化科技有限公司,DH5α感受态细胞为本实验室自制。苯酚、氯仿、异丙醇、酒精等其他试剂均为国产生化试剂。
1.2 样品采集及总RNA提取
于四川省简阳市和四川省若尔盖县选取健康的简州大耳羊和藏山羊羯羊各4只。清晨空腹屠宰后,迅速采集心、肝、脾、肺、肾、背最长肌和皮下脂肪组织样品各2 g,经DEPC水清洗后,迅速装入无RNA酶的冷冻管中并立即置于液氮中保存,用于组织总RNA及蛋白的提取。
利用Trizol法提取组织总RNA,并用1% 的琼脂糖凝胶电泳检测RNA完整性。采用NanoDrop ND-1000 (Agilent) 分光光度计测定RNA样品的浓度以及OD260 nm/OD280 nm值,并控制在1.9~2.1之间。利用gDNAse去除基因组DNA后,利用QuantiTect Reverse Transcription Kit进行cDNA链的合成。用1%的琼脂糖凝胶电泳检测cDNA的质量。
1.3 山羊CCR2基因的克隆
根据GenBank上牛(NM_001194959)、人(NM_001123041)、小鼠(NM_009915)的CCR2基因保守序列,利用Primer premier 5 设计克隆引物,上游引物:5′-AGATGGACGGCAATGATACG-3′,下游引物:5′-AACCCTGGCGGCTTATTATC-3′,预测产物长度1 186 bp。PCR反应体系为cDNA 1 μL,上、下游引物各1 μL, LaTaq 酶0.2 μL, dNTPs 2 μL, 水14.8 μL. PCR反应条件:95 ℃ 4 min;94 ℃ 30 s,58 ℃ 30 s, 72 ℃ 1.5 min,33个循环;72 ℃ 10 min。PCR反应结束后,取5 μL扩增产物用1%琼脂糖凝胶电泳进行检测。将PCR扩增后的产物经1%的琼脂糖凝胶进行电泳,切胶回收DNA片段。连接pMD-19T载体后转化DH5α感受态细胞,提取质粒后送深圳华大基因科技股份有限公司测序。
1.4 序列分析
利用NCBI网站上ORF Finder分析CCR2基因的开放阅读框;利用NCBI在线工具进行外显子分析(http://www.ncbi.nlm.nih.gov/sutils/splign/splign.cgi?textpage=online&level=form);利用在线软件blastn将测序结果进行同源性分析;利用BioXM2.6软件对山羊、牛、人、小鼠、猪的氨基酸序列进行相似性比对,并利用PHYRE2在线工具(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index)和RasWin软件对其三级结构进行预测比对;利用EXpASy在线工具对CCR2蛋白质分子量(MW)和等电点(PI)进行分析(http://www.expasy.org/cgi-bin/protparam);利用ProtScale在线工具对CCR2亲水性结构进行分析(http://us.expasy.org/cgi-bin/protscale.pl);利用TMPRED在线工具进行跨膜结构分析(http://www.ch.embnet.org/software/TMPRED_form.html);利用MEGA5软件进行CCR2基因物种进化树分析。
1.5 实时定量PCR(qPCR)与组织表达检测
采用Primer premier 5.0软件设计目的基因的荧光特异性引物,引物由北京华大基因科技股份有限公司合成,上游引物:5′-TGTGAGGCTCATCTTCGTGATC-3′,下游引物:5′-GGCTGCTGCTCTTACAGGTACT-3′,预测长度122 bp。在进行正式试验之前,所有的引物都经过PCR扩增后进行琼脂糖凝胶电泳检测。利用CFX96 实时定量PCR仪(Bio-Rad)测定脂代谢相关基因的表达水平。qPCR反应体系:上、下游引物各1 μL,cDNA 1 μL,SYBR 10 μL,水7 μL。定量程序:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,39个循环。熔解曲线分析:95 ℃ 10 s,然后以0.5 ℃/5 s 的速度从55 ℃升到95 ℃。每个品种为4个生物学重复,每个待测样本设3个技术重复,并设置3个无cDNA模板的样本为阴性对照,利用GAPDH作为内参[15]。
1.6 Western blot检测
组织总蛋白样品的提取和Western blot由成都丹凤科技有限公司完成。利用RIPA裂解法提取组织总蛋白,利用湿转法进行Western blot操作。Anti-CCR2兔多克隆抗体(ab21667)购自abcam公司,β-actin鼠单克隆抗体及蛋白二抗均购自北京天根生化有限公司。
1.7 数据分析
采用2-△△Ct法对实时定量PCR数据进行均一化处理。利用SPSS19.0进行方差分析,采用Duncan法对各组织间mRNA表达进行多重比较。
2 结 果
2.1 山羊CCR2基因的克隆及序列分析
分别以简州大耳羊和藏山羊组织总RNA为模板,反转录得到cDNA,并以此cDNA为模板利用T-A克隆的方法克隆得到山羊CCR2基因CDS区序列。结果显示,克隆得到山羊序列为1 186 bp,其中包含CDS区1 110 bp,5′ UTR序列2 bp,3′UTR序列74 bp。其终止密码子为TAG,编码370个氨基酸残基。两个品种山羊CDS区相似性为99.7%,仅在第191位氨基酸具有差异,在简州大耳羊中为丝氨酸(S)而在藏山羊中为脯氨酸(P)(图1A)。山羊序列已经登录GenBank并得到登录号为KR013053。山羊CCR2氨基酸序列与牛、猪、鼠、人的相似性分别为97.3%、91.9%、77.0%和69.2%(图1B)。
山羊CCR2蛋白MW值为41 871.3 u,其PI值为8.66。氨基酸组成结果显示,亮氨酸(L)所占的比例最高为12.2%(45个氨基酸),同时包含24个负电荷氨基酸碱基(天冬氨酸D+谷氨酸E),包含30个正电荷氨基酸碱基(精氨酸R+赖氨酸K)。不稳定指数为31.57,属于稳定蛋白,在哺乳动物细胞中的半衰期为30 h。脂溶系数为105.62,总平均亲水性为0.463,蛋白整体表现出较强的疏水性,仅在前50位、第250位和后20位左右具有较强的亲水性,其中250位左右亲水性最强。山羊CCR2蛋白具有7个跨膜结构,分别为61~78、89~111、128~146、167~189、214~233、254~275、299~318。
三级结构分析结果显示,CCR2基因具有GPCR家族的典型特点,具有7个跨膜结构,在山羊、牛、人、小鼠、猪等物种间CCR2蛋白结构具有较高的相似度(图2)。
2.2 山羊CCR2基因系统进化树分析
为了研究山羊CCR2基因的进化过程,本试验对6种哺乳动物进行了生物进化树分析,结果表明山羊CCR2基因与牛具有最近的亲缘关系,其次为猪、狗、小鼠,而与人的亲缘关系最远(图3)。
2.3 CCR2基因组织定量分析
qPCR结果显示,CCR2基因在不同山羊品种间mRNA表达水平具有显著差异。在藏山羊中,肾和心具有最高的表达水平,均显著高于其他各个组织,在各肌肉组织中(背最长肌、臂三头肌和后腿股二头肌)中的表达量最低(图4A)。蛋白结果也显示CCR2在肾和心中的表达量最高,而在肌肉和皮下脂肪中表达量较低(图5)。
而在简州大耳羊中,肺、脾和皮下脂肪的mRNA的含量最高,而在肌肉组织和心中的表达量较低(图4B)。蛋白结果显示CCR2在肾和心的表达量最高,而在肌肉和脂肪中的表达量较低(图5)。
图1 不同品种山羊(A)和物种间(B)CCR2蛋白相似性分析Fig.1 Similarity of CCR2 protein between breeds of goat (A) and various species (B)
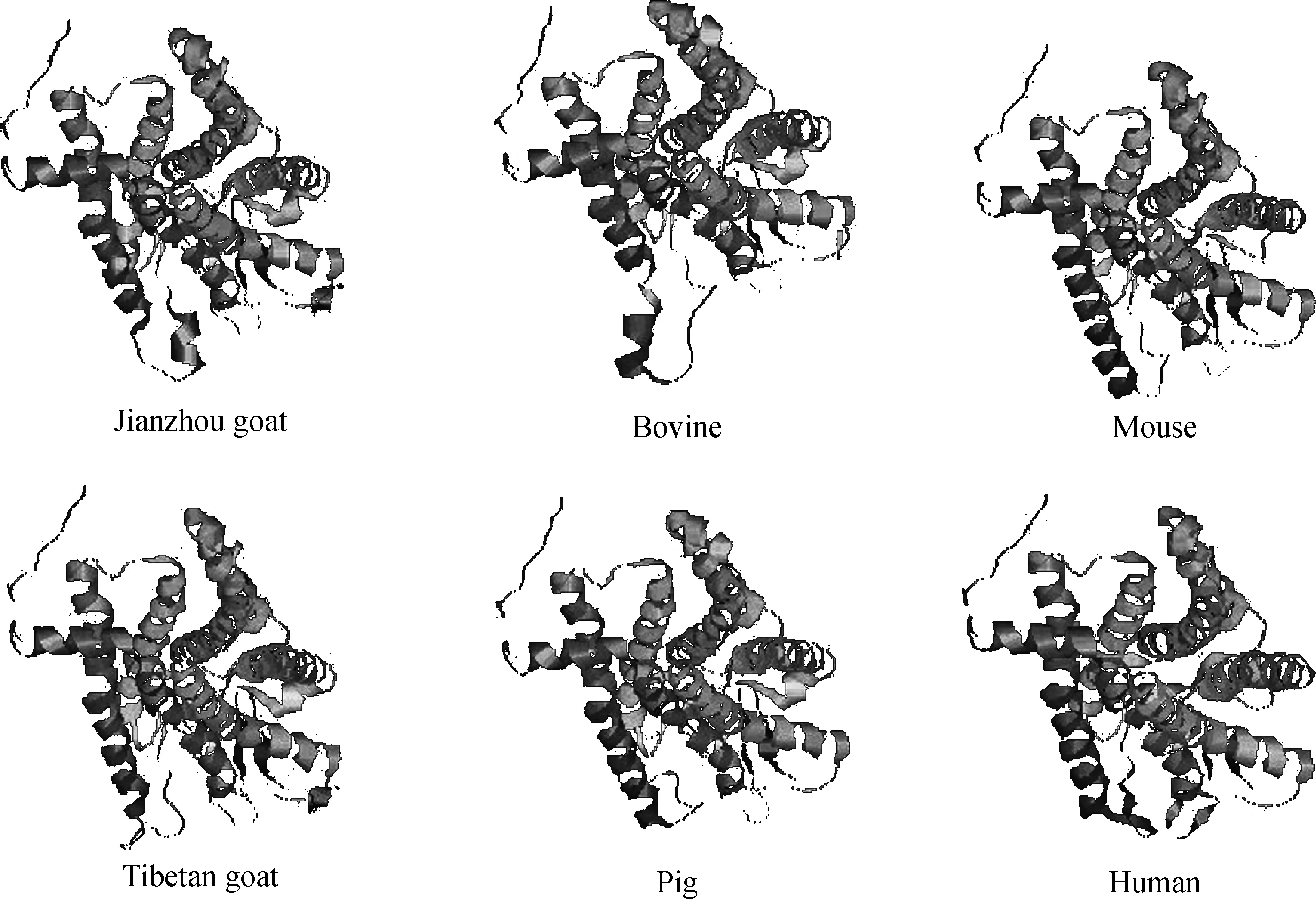
图2 不同物种间CCR2蛋白三级结构对比Fig.2 Structure comparison of CCR2 protein among various species

图3 基于6个代表物种的CCR2基因生物进化树分析Fig.3 Phylogenetic tree based on CCR2 gene sequences of 6 representative species
3 讨 论
IMF是反映山羊肉品质的重要指标,与羊肉嫩度和口感有很大关系,因此研究IMF形成的分子调控机制具有重要的现实意义。现在,虽然已经有很多关于脂代谢基因功能的研究报导[16],然而关注山羊CCR2基因调控IMF沉积的研究并不多见,而基因序列的缺乏和组织表达信息的不完善严重阻碍了对其功能的研究。本研究的创新之处在于以简州大耳羊和藏山羊为研究对象,克隆得到山羊CCR2基因CDS区序列,并通过比较在两种山羊品种不同组织中的表达水平,初步预测其功能。简州大耳羊是四川地区特有的全国肉用山羊新品种,该品种具有生长速度快、产肉性能优良、繁殖性能高、体格大、遗传性能稳定、耐粗饲、适应性好等优点,是四川地区重要的肉用山羊品种。藏山羊是川西北高原地区主要的山羊品种,具有显著的高原动物的特征,在川西北牧区畜牧业中具有重要地位。两种山羊品种生活条件的差异造成了不同的生长性状,简州大耳羊具有显著高于其他山羊品种的肌内脂肪含量,然而现在关于IMF沉积的具体的调控机制尚不清楚。通过分析这两种山羊基因序列和组织表达的特异性,为以后进一步系统的研究CCR2基因在调控脂质代谢中的功能提供了依据,也为促进四川地区山羊产业的长远发展奠定了基础。
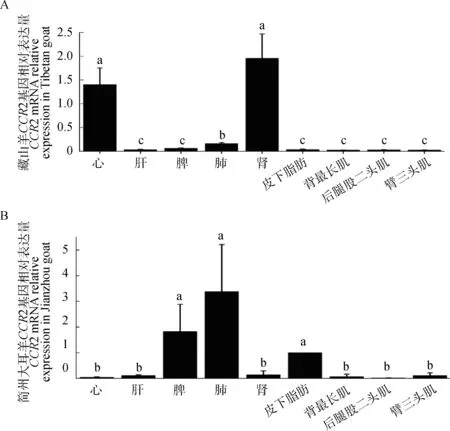
图4 藏山羊(A)和简州大耳羊(B)CCR2基因mRNA的组织表达分析Fig.4 Tissue mRNA expression of CCR2 gene in Tibetan goat (A) and Jianzhou Big-eared goat (B)
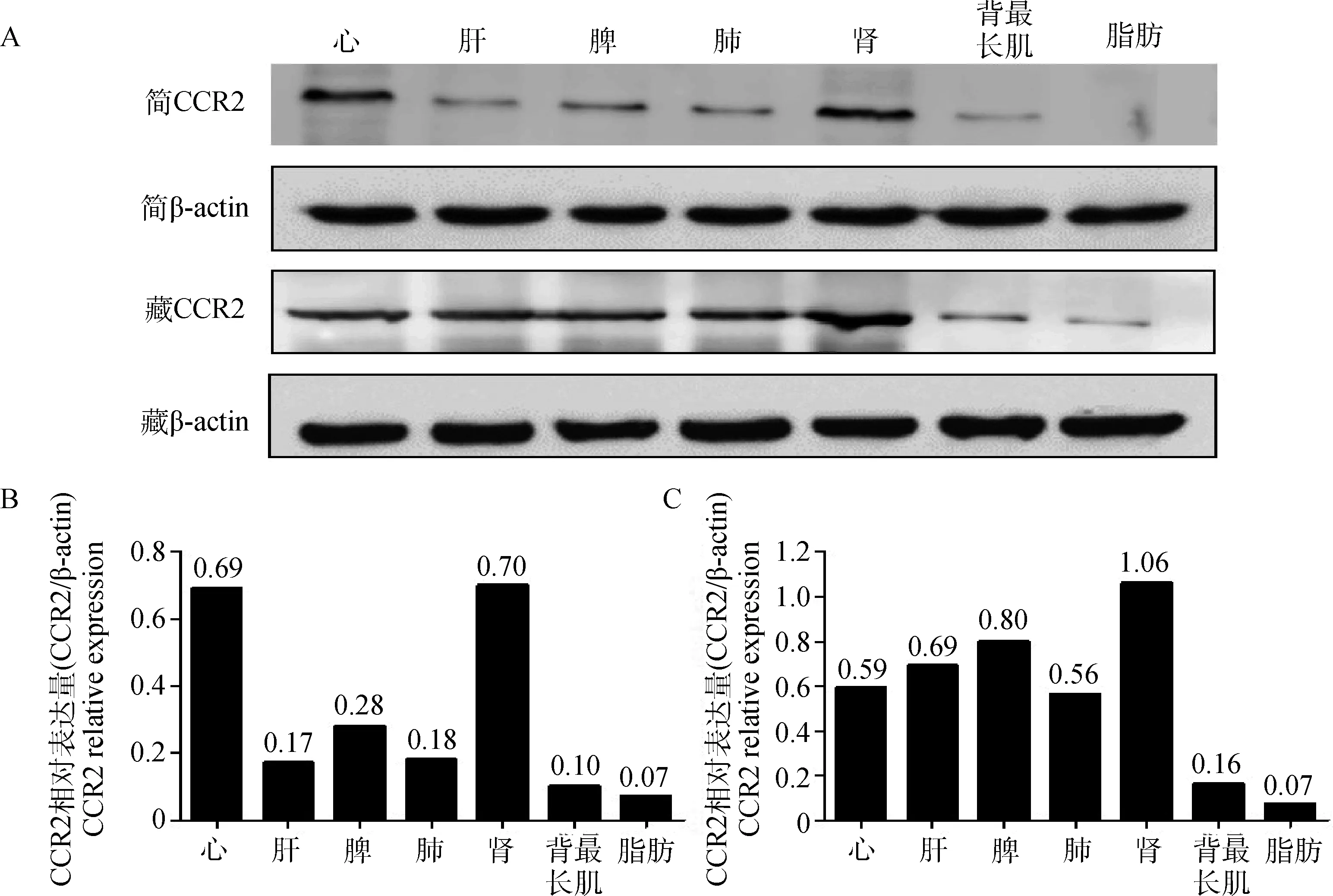
A.CCR2蛋白在简州大耳羊和藏山羊不同组织中表达的Western blot结果;B.CCR2蛋白在简州大耳羊不同组织中的表达分析;C.CCR2蛋白在藏山羊不同组织中的表达分析A. The Western blot result of CCR2 expression in various tissues in Jianzhou Big-eared goat and Tibetan goat; B. The expression analysis of CCR2 in various tissues in Jianzhou Big-eared goat; C. The expression analysis of CCR2 in various tissues in Tibetan goat图5 不同组织CCR2蛋白的Western blot分析Fig.5 Western blot determination of CCR2 protein in various tissues
本研究通过比较简州大耳羊和藏山羊的氨基酸序列发现,两品种山羊在第191位氨基酸具有差异,在简州大耳羊中为丝氨酸(S)而在藏山羊中为脯氨酸(P),而在牛、猪和鼠等低海拔动物中此位点均为丝氨酸(S),推测此位点可能和藏山羊的高原适应性相关。尽管如此,此位点的改变却并没有引起蛋白三维结构的显著变化,不同物种间CCR2均具有明显的7个跨膜结构。然而,在不同的物种/品种间,CCR2的蛋白结构尚不完全一致,推测可能与物种的特异性有关。很显然,这种改变是否会引起蛋白功能的变化还需要在细胞和活体水平上进行进一步的验证,然而其保守的7个跨膜结构则暗示了其作用主要是作为GPCRs蛋白来实现的。
进化树结果显示,山羊CCR2基因与牛有最近的亲缘关系,这与FASN等其他基因的结果一致[15,17]。之前通常利用人和小鼠作为参考来研究山羊基因的功能,然而由于亲缘关系较远,其功能往往具有较大的差异。随着近年来对于猪研究的深入[18],其逐渐成为一种较为成熟的模式动物。本研究中山羊与猪具有最近的亲缘关系(除牛以外),这与之前的研究结果一致[19],表明山羊CCR2基因可能具有与猪相近的功能。这也为利用猪作为模式动物应用于山羊研究中提供了依据。
与藏山羊的情况不同,本研究中简州大耳羊CCR2基因在肾和心中的mRNA表达较低,而在肺和脾中的表达量较高,然而,Western blot的结果发现,简州大耳羊和藏山羊CCR2蛋白在肾和心中均具有较高的表达水平。推测可能有两种原因,虽然简州大耳羊在肺和脾中的mRNA的表达水平较高,但仅有较少的mRNA翻译为蛋白质,转录后水平的调控是造成差异的主要原因,其次,在肺和脾中CCR2具有较高的降解率,从而导致了CCR2蛋白含量的降低。虽然对于造成这种差异的具体调控机制还需要进一步的确认,然而在肾和心中的高表达亦预示着CCR2在这两种组织中发挥着重要作用。
此外,mRNA水平和蛋白水平的结果均显示CCR2基因在肌肉组织中具有较低的表达水平。由于CCR2主要是作为GPCRs家族的一员来发挥作用的,具有级联放大的效应[20]。 孙雨婷研究发现,GPR41在山羊乳腺中具有较低的表达量,然而却能够显著调控脂肪酸代谢相关基因的表达,并影响乳脂的合成和分泌[21],因此并不能排除其对肌内脂肪沉积具有重要调控作用的可能性。C.E. Egan等发现敲除CCR2能够抑制B6小鼠肝脂质的积累[22]。CCR2还可以MCP-1/CCR2轴的形式参与到肥胖的产生和脂质代谢过程中[23]。可见,尽管CCR2在肌肉中的表达水平较低,但在脂质代谢过程中具有重要的调控作用。
本试验中虽然GAPDH也可作为内参基因来使用,然而同时使用3种不同的内参基因对检测结果进行标准化被认为是一种更为可靠的组织定量分析方法[24]。内参基因的选择可直接影响定量分析结果的稳定性,本试验中利用GAPDH作为qPCR的内参基因,这可能是导致mRNA检测结果与蛋白检测结果具有差异的原因。在以后的试验中继续利用3种不同的内参基因检测CCR2基因在不同组织中的表达对我们更好的理解CCR2的功能具有重要作用。
4 结 论
CCR2基因CDS全长1 100 bp,编码370个氨基酸残基。山羊CCR2氨基酸序列与牛、猪、小鼠、人的相似性分别为97.3%、91.9%、77.0%和69.2%,山羊CCR2基因与牛具有最近的亲缘关系,而与人的亲缘关系较远。组织表达结果显示,CCR2在两种山羊肾和心中均具有最高的表达水平,而在皮下脂肪和肌肉中的表达水平较低。推测CCR2在调控肌肉脂质代谢中可能具有重要的作用,本研究结果也为进一步研究CCR2在山羊脂质代谢中的作用奠定了基础。
[1] TALPUR F N, BHANGER M I, SHERAZI S T. Intramuscular fatty acid profile oflongissimusdorsiandsemitendinosusmuscle from Pateri goats fed under traditional feeding system of Sindh, Pakistan[J].MeatSci, 2008, 80(3): 819-822.
[2] WEBB E C, CASEY N H, SIMELA L. Goat meat quality[J].SmallRuminantRes, 2005, 60: 153-166.
[3] CASEY N H. Goat meat in human nutrition[C]. International Conference on Goats, 1992, 2: 582-589.
[4] WOOD J D, ENSER M, FISHER A V, et al. Fat deposition, fatty acid composition and meat quality: A review[J].MeatSci, 2008, 78(4): 343-358.
[5] LEE E Y, CHUNG C H, KHOURY C C, et al. The monocyte chemoattractant protein-1/CCR2 loop, inducible by TGF-beta, increases podocyte motility and albumin permeability[J].AmJPhysiolRenalPhysiol, 2009, 297(1): 85-94.
[6] HAN K H, CHANG M K, BOULLIER A, et al. Oxidized LDL reduces monocyte CCR2 expression through pathways involving peroxisome proliferator-activated receptor gamma[J].JClinInvest, 2000, 106(6): 793-802.
[7] LIBBY P. Inflammation in atherosclerosis[J].Nature, 2002, 420(6917): 868-874.
[8] EHRLUND A, MEJHERT N, LORENTE-CEBRIN S, et al. Characterization of the Wnt inhibitors secreted frizzled-related proteins (SFRPs) in human adipose tissue[J].JClinEndocrinolMetab, 2013, 98(3): E503-E508.
[9] GU L, TSENG S, HORNER R M, et al. Control of TH2 polarization by the chemokine monocyte chemoattractant protein-1[J].Nature, 2000, 404(6776): 407-411.
[10] OLD E A, MALCANGIO M. Chemokine mediated neuron-glia communication and aberrant signalling in neuropathic pain states[J].CurrOpinPharmacol, 2012, 12(1): 67-73.
[11] HAN K H, HAN K O, GREEN S R, et al. Expression of the monocyte chemoattractant protein-1 receptor CCR2 is increased in hypercholesterolemia. Differential effects of plasma lipoproteins on monocyte function[J].JLipidRes, 1999, 40(6): 1053-1063.
[12] KANDA H, TATEYA S, TAMORI Y, et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity[J].JClinInvest, 2006, 116(6): 1494-1505.
[13] KANG Y S, LEE M H, SONG H K, et al. CCR2 antagonism improves insulin resistance, lipid metabolism, and diabetic nephropathy in type 2 diabetic mice[J].KidneyInt, 2010, 78(9): 883-894.
[14] KIM Y S, SUNG H J, SON S J, et al. Triglyceride (TG) down-regulates expression of MCP-1 and CCR2 in PMA-derived THP-1 macrophages[J].Genes&Genomics, 2013, 35(1): 125-130.
[15] ZHU J J, SUN Y T, LUO J, et al. Specificity protein 1 regulates gene expression related to fatty acid metabolism in goat mammary epithelial cells[J].IntJMolSci, 2015, 16(1): 1806-1820.
[16] SHARMA U, BANERJEE P, JOSHI J, et al. Ubiquitous expression of genes in tissues of goat (caprahircus) using RNA-seq[J].IntJAnimVetAdv, 2012, 4(4): 292-302.
[17] ZHU J J, LUO J, WANG W, et al. Inhibition of FASN reduces the synthesis of medium-chain fatty acids in goat mammary gland[J].Animal, 2014, 8(9): 1469-1478.
[18] LI M, TIAN S, JIN L, et al. Genomic analyses identify distinct patterns of selection in domesticated pigs and Tibetan wild boars[J].NatGenet, 2013, 45(12): 1431-1438.
[19] WANG W, LUO J, ZHONG Y, et al. Goat liver X receptor α, molecular cloning, functional characterization and regulating fatty acid synthesis in epithelial cells of goat mammary glands[J].Gene, 2012, 505(1): 114-120.
[20] MATSUMURA S, MIZUSHIGE T, YONEDA T, et al. GPR expression in the rat taste bud relating to fatty acid sensing[J].BiomedRes, 2007, 28(1): 49-55.
[21] 孙雨婷. 短链脂肪酸受体GPR41基因在奶山羊乳腺上皮细胞脂代谢中的作用研究[D]. 杨凌:西北农林科技大学, 2015.
SUN Y T. Effect of short-chain fatty acid receptor GPR41 gene on lipid metabolism in mammary gland epithelial cells of dairy goat[D]. Yangling: Northwest A&F University, 2015.(in Chinese)
[22] EGAN C E, DAUGHERITY E K, ROGERS A B, et al. CCR2 and CD44 promote inflammatory cell recruitment during fatty liver formation in a lithogenic diet fed mouse model[J].PLoSOne, 2013, 8(6): e65247.
[23] RULL A, CAMPS J, ALONSO-VILLAVERDE C, et al. Insulin resistance, inflammation, and obesity: role of monocyte chemoattractant protein-1 (or CCL2) in the regulation of metabolism[J].MediatInflamm, 2010, 326580.
[24] 朱武政,林亚秋,江明锋,等. 肉用山羊脂代谢相关基因与肌内脂肪含量的相关性分析[J]. 畜牧兽医学报,2016,47(7):1333-1341.
ZHU W Z, LIN Y Q, JIANG M F, et al. Association analysis of intramuscular fat content and the expression of genes related to lipid metabolism in meat goat[J].ActaVeterinariaetZootechnicaSinica, 2016,47(7):1333-1341. (in Chinese)
(编辑 郭云雁)
Molecular Cloning and Tissue Expression of Goat Chemokine (CC motif) Receptor 2 (CCR2) Gene
ZHU Jiang-jiang1, LIN Ya-qiu2*, WANG Yong1,2, LI Qian1,2, LIN Sen1,2
(1.KeyLaboratoryofSichuanProvinceforQinghai-TibetanPlateauAnimalGeneticResourceReservationandExploitation,Chengdu610041,China; 2.CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China)
The aim of the study was to clone the CDS ofCCR2 gene, and to determine its expression in various tissues, which might provide basis for its functional research on regulating lipid metabolism. Each of 4 healthy, 2-3 years old castrated Jianzhou Big-eared goats and Tibetan goats were selected. After slaughter, the tissue samples from heart, liver, spleen, lung, kidney,longissimusdorsimuscle,bicepsfemorismuscle,tricepsbrachiimuscle and subcutaneous fat were collected for the total protein and RNA extraction. The sequence ofCCR2 gene was cloned by RT-PCR and analyzed using bioinformatics. The mRNA and protein expression ofCCR2 was determined using real-time fluorescent quantitative (qPCR) and Western blot, respectively. A length of 1 186 bp cDNA ofCCR2 gene was cloned, containing 1 100 bp CDS, 2 bp 5′ UTR and 74 bp 3′ UTR, encoding 370 amino acids. The goat CCR2 protein shared 97.3%, 91.9%, 77.0% and 69.2% similarity with bovine, pig, mouse and human, respectively. The goatCCR2 gene was closest associated with that of bovine, followed by pig, dog and mouse, and distant with human. The tissue expression analysis showed that expression ofCCR2 was higher in kidney and heart, and lowest in subcutaneous fat and muscles in both of the goat breeds. These data indicate thatCCR2 gene may play an important role in regulating lipid metabolism in goat.
goat;CCR2; cloning; tissue expression
10.11843/j.issn.0366-6964.2016.11.007
2016-03-30
中央高校基本科研业务费专项资金项目 (2015NZYQN80);四川省应用基础研究计划(2016JY0147)
朱江江(1986-),男,湖北钟祥人,博士,助理研究员,主要从事动物遗传育种研究,E-mail: zhujiang4656@hotmail.com
*通信作者:林亚秋,博士,研究员,硕士生导师,主要从事动物遗传育种研究,E-mail: linyq1999@163.com
S827;S813.3
A
0366-6964(2016)11-2202-08
