外源褪黑激素促进绒山羊皮肤毛囊相关基因表达差异的研究
2016-12-13阿云嘎乌日格希拉图那顺其木格郝巴雅斯胡良赵存发李玉荣
刘 斌,杨 军,阿云嘎,乌日格希拉图,那顺其木格,郝巴雅斯胡良,赵存发,李玉荣
(1.内蒙古自治区农牧业科学院,呼和浩特010031; 2.中国科学院昆明动物研究所,昆明 650223;3.鄂托克前旗农牧业局,鄂尔多斯 016200; 4.鄂托克前旗兽医局,鄂尔多斯 016200;5.鄂托克前旗北极神绒牧业研究所,鄂尔多斯 016200)
外源褪黑激素促进绒山羊皮肤毛囊相关基因表达差异的研究
刘 斌1,2,杨 军3,阿云嘎4,乌日格希拉图4,那顺其木格4,郝巴雅斯胡良5,赵存发1*,李玉荣1*
(1.内蒙古自治区农牧业科学院,呼和浩特010031; 2.中国科学院昆明动物研究所,昆明 650223;3.鄂托克前旗农牧业局,鄂尔多斯 016200; 4.鄂托克前旗兽医局,鄂尔多斯 016200;5.鄂托克前旗北极神绒牧业研究所,鄂尔多斯 016200)
旨在通过对非长绒期阿尔巴斯型绒山羊进行褪黑激素埋植,研究褪黑激素对羊绒周期性生长的调控,以期借此延长绒山羊毛囊的兴盛期,提高羊绒产量。将试验羊随机分成两组:埋植褪黑激素的试验组(T)和对照组(C),每组3只(试验组(TI、T2和T3)和对照组(C1、C2和C3)),采集绒山羊的皮肤组织进行组织切片,染色观察埋植褪黑激素对毛囊生长诱导作用。分别抽提两组样本总RNA,逆转录合成相应被标记的cDNA探针,采用Agilent绵羊的8×15K规格全基因组表达谱芯片进行杂交,筛选差异表达基因。利用实时荧光定量PCR技术进行验证。结果表明,从组织学分析可观察到埋植褪黑激素对毛囊生长具有明显的促进作用;芯片数据显示,筛选出差异表达的基因95个,其中61个表达上调、34个下调。GO分析基因数量分布情况:参与分子功能的基因占47.78%,参与生物学过程的基因占33.89%,组成细胞成分的基因占18.33%。与对照组的样本相比,埋植褪黑激素后相关基因的差异性表达涉及毛囊生长及周围皮肤附属物形态发生等生物学过程。这些差异性表达的基因为绒山羊毛囊生长及周期性调控的基因功能研究提供极有价值的参考。
绒山羊;褪黑激素;基因芯片;基因差异表达
内蒙古绒山羊是重要的绒用动物,羊绒被用来制造奢侈针织物,拥有很高的经济价值。绒山羊的毛被主要分为有髓的粗毛和无髓的绒毛两种类型,它们分别由初级毛囊和次级毛囊产生,它们在结构和组成上非常相似,而在细度上存在明显的差别,这种差别的产生是由相应毛囊的形态和尺寸决定的。羊绒的产量主要依赖于羊绒纤维生长的面积和长度,而这些是由次级毛囊的数量和生长周期决定的。因此研究外源褪黑激素(Melatonin,MLT)对绒山羊毛囊生长周期的调控,有利于探究光周期引起的神经——激素调节对于羊绒产量的影响,具有重要的理论意义及指导实际生产的价值。羊绒的差异除了受其遗传因素影响外,季节性光周期影响羊绒的生长周期[1]。这种具有季节性的现象依赖于光周期对于体内内分泌的调节,松果体受到光照的刺激而分泌褪黑激素引起多种激素的释放,直接影响羊绒的生长[2-3],因此研究激素对毛囊生长调控至关重要。大多数绒山羊在5~8月份(非长绒期)不长绒,羊绒在8月份开始生长,翌年2月份停止生长,4月底5月初开始脱落[4]。发生这种现象的原因可能是绒山羊神经系统受到短日照的刺激而产生一系列激素,作用于皮肤毛囊而调控羊绒的生长。褪黑激素分泌主要受光照影响,表现出明显的“昼低夜高”节律变化,是调控毛皮动物毛发生长发育的主要因子[5-6]。体外培养下,MLT与催乳素(Prolactin,PRL)均具有促毛囊延伸的作用,外源MLT埋植于动物皮下可促进绒山羊在非产绒季节和产绒季节长绒,从而达到四季长绒,并显著增加产绒量的目的。本研究系利用基因表达谱芯片技术,对埋植MLT绒山羊和正常对照绒山羊皮肤组织的差异表达基因进行筛选,探讨两种皮肤组织表达基因的差异及其可能的分子生物学规律,以期为进一步研究绒山羊绒毛生长机理提供理论基础。
1 材料与方法
1.1 试验动物及组织的处理
本研究在内蒙古鄂尔多斯市鄂托克前旗绒山羊增绒技术示范区进行试验。选择内蒙古白绒山羊(阿尔巴斯型)作为研究对象,在同一资源群体的同一品系群挑选体重差异不大、体况良好、繁殖性能正常的2周岁半同胞母羊3对,共6只。受试羊分为试验组(3只,编号T1、T2、T3)采用埋植褪黑激素的方法进行增绒试验,对照组(3只,编号C1、C2、C3)采用常规放牧饲养管理(每对同父本母羊分别进入试验组和对照组)。参考已有的报道[7]并结合本团队前期的研究结果,5月份按照2 mg·kg-1BW的剂量在耳后皮下埋植褪黑激素。所有羊采用常规放牧饲养管理,自由采食、饮水。6月份采集皮肤样品,在体侧部采取2.0 cm2左右的皮肤样品,液氮中冷冻,-80 ℃冰箱保存备用。皮肤样品除一部分留作基因芯片分析外,剩余皮肤组织制备石蜡切片,组织被二甲苯处理、酒精脱水后以石蜡包埋,于切片机上切成7 μm,进行伊红——苏木素(Sigma)染色,用显微镜观察毛囊组织形态。
1.2 皮肤组织样品RNA的提取、基因芯片杂交与数据分析
Trizol (Invitrogen,Gaithersburg,MD,USA)一步法提取皮肤组织块中的总RNA,过柱纯化,以Total RNA为模板进行反转录,以 Random Primer为引物进行KLENOW酶标记,标记产物用 PCR NucleoSpinExtract II Kit (MN)纯化,纯化后抽干。Cy5标记试验组样本,Cy3标记对照组样本。采用Agilent 公司的G2519F绵羊基因表达谱芯片(芯片杂交试验由北京基因芯片国家工程研究中心暨博奥生物有限公司协助完成),芯片规格8×15K,含有15 208个绵羊基因的表达谱芯片,该芯片无组织特异性,该芯片设计基于绵羊序列信息来自RefSeq、Goldenpa th、Ensembl和Unigene 等不同数据库已知的基因信息,代表基因和转录本信息。芯片用Agilent G2565CA Microarray Scanner进行扫描,得到杂交图片。采用Feature Extraction图像分析软件对芯片图像进行分析,把图像信号转化为数字信号。对原始数据先用Lowess(Locally weighted scatterplot smoothing)等方法对信号值进行归一化处理后,以Fold change>2倍或<0.5倍的标准进行差异基因筛选。若有3个以上生物学重复样本,用SAM(Significance Analysis of Microarrays)软件进行差异基因的分析[8]。
1.3 qRT-PCR验证
利用实时定量PCR技术可以验证埋植褪黑激素的绒山羊和自然条件下绒山羊皮肤组织的基因表达的差异。根据基因芯片分析的结果,从差异显著的基因中挑选出具有代表性的两个基因CSN2和PAX6进行qRT-PCR验证。基因扩增所需引物的设计及制备依照表1列出的相关信息。RNA的提取同1.2。以GAPDH作为内参基因进行Real-time PCR 扩增。采用SYBR Green I荧光染色法测定各基因的相对定量表达。每个样品至少3个重复,结果转化为循环阈值(Ct)的相对扩增倍数。两个样本间的基因表达差异用 2-ΔΔCt的方法计算。
表1 qRT-PCR验证试验涉及基因的引物设计及相关信息
Table 1 Primer design and related information of qRT-PCR
2 结 果
2.1 组织学分析
为了保证组织切片结果与基因芯片分析的一致性,组织切片样本来自用于基因芯片分析的同一块皮肤组织。即埋植MLT以及自然光周期条件下绒山羊体侧皮肤组织,从组织切片的形态上可以明显看出经过埋植MLT后,非长绒期绒山羊皮肤中初级毛囊与次级毛囊数量显著增多,尺寸增大,并向皮下延伸,毛囊增长,毛乳头膨大,显示出明显的兴盛期毛囊的形态特征(图1 A);而自然光周期条件下,绒山羊的皮肤切片中,毛囊在形态上没有生长活动的迹象,毛囊萎缩,一些毛囊中存在角质化毛干及空腔,显示出休止期的形态特征(图1 B)。从组织形态来看,埋植MLT对于毛囊进入兴盛期具有明显的诱导作用。
2.2 分层聚类分析
研究埋植MLT与正常光周期条件下,绒山羊皮肤及毛囊中相似的蛋白质编码基因的表达模式的差异,采用Agilent 公司的G2519F绵羊基因表达谱芯片(8×15K),含有15 208个绵羊基因。通过埋植MLT条件下饲养的阿尔巴斯绒山羊体侧皮肤样本,与正常光周期绒山羊的皮肤样本的芯片数据相比较,对原始数据用Lowess方法进行归一化处理后,运用散点图对数据的变异和误差进行归一化。散点图反映数据归一化以及表达差异分析的变化和误差(图2A~C)。进一步通过分层聚类的方法分析这些基因差异性表达(图2D)。
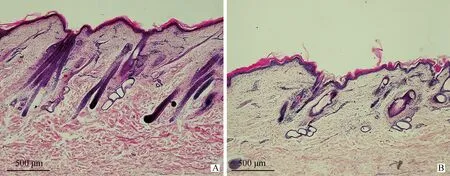
石蜡组织纵切切片苏木素-伊红染色。A.埋植MLT组;B.对照组。比例尺:500 μmLongitudinal section stained by hematoxylin-eosin.A.MLT embedment group;B.Control group.Scale bar:500 μm图1 阿尔巴斯型绒山羊体侧皮肤组织毛囊形态Fig.1 Hair follicle morphogenesis of body side skin tissue in ALPAS Cashmere goat
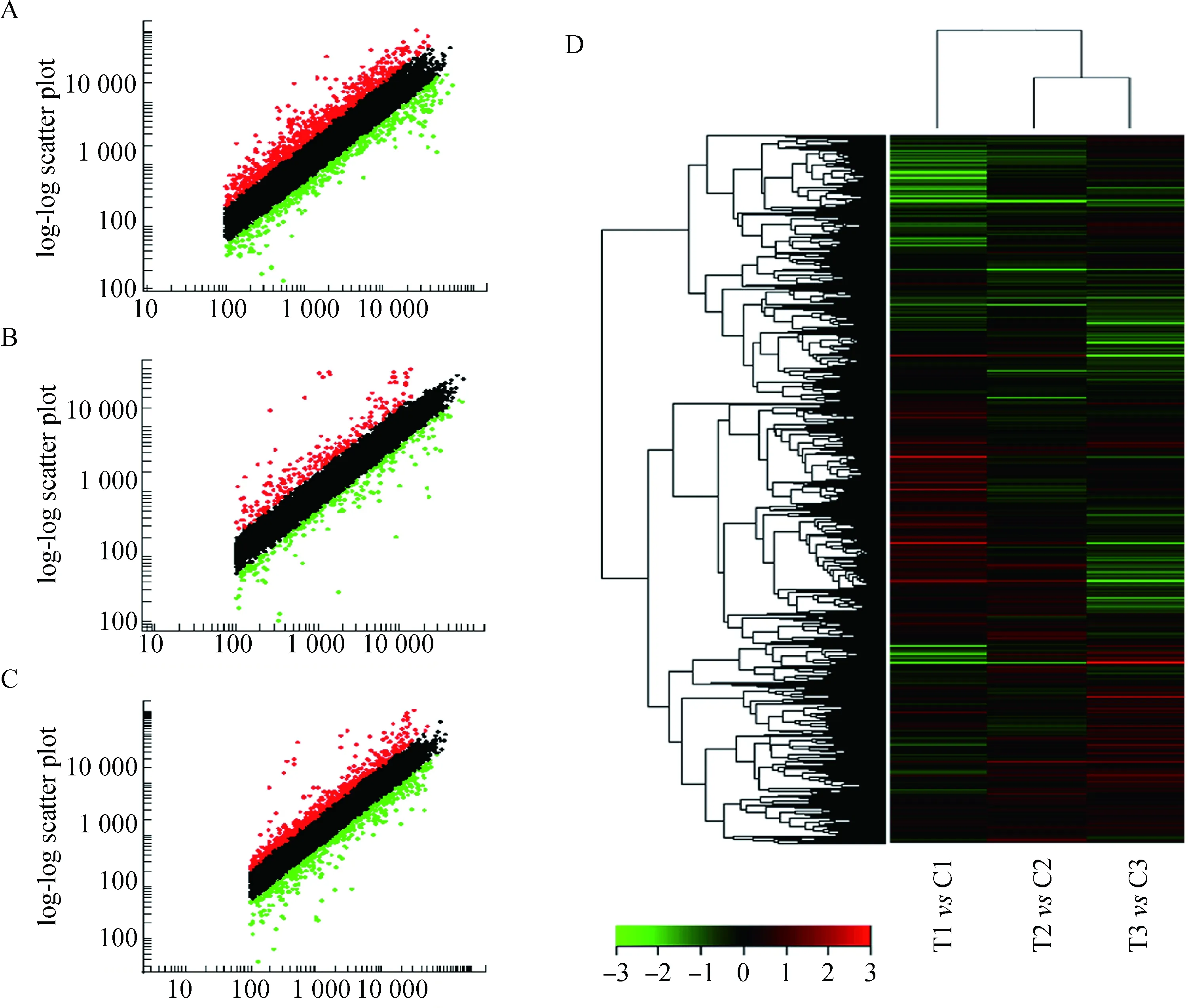
A~C.MLT埋植组与对照组3组样本基因芯片散点图;A. T1 vs C1; B. T2 vs C2; C. T3 vs C3; D.基因差异性表达的聚类图谱,红色表示埋植MLT试验组(T1、T2、T3)相对于对照组(C1、C2、C3)表达上调,绿色表示埋植MLT试验组(T1、T2、T3)相对于对照组(C1、C2、C3)表达下调A-C.Scatter plot;A. T1 vs C1; B. T2 vs C2; C. T3 vs C3; D.Hierarchical clustering analyses:The red color indicated the up-regulation of gene expression in the MLT group (T1,T2,T3) compared to that of the control group (C1,C2,C3).The green color indicates the down-regulation of genes图2 基因芯片散点图及分层聚类分析Fig.2 Visualization of clustered microarray data
2.3 Gene Ontology (GO) 分析
差异表达(Fold change≥2或≤0.5)基因95个,其中表达上调(≥2)基因61个和共同下调(≤0.5)基因34个。基于数据库中基因的注释情况,试图寻找这些差异性表达的基因与山羊毛囊的生长调控相关性。GO分析结果显示,埋植MLT条件下饲养的阿尔巴斯绒山羊相对于正常光周期基因表达的功能聚类。主要分为3大类:分子功能(47.78%)、生物学过程(33.89%)和细胞组成(18.33%)。6月份埋植MLT与正常对照绒山羊皮肤中差异表达基因具体信息见图3。
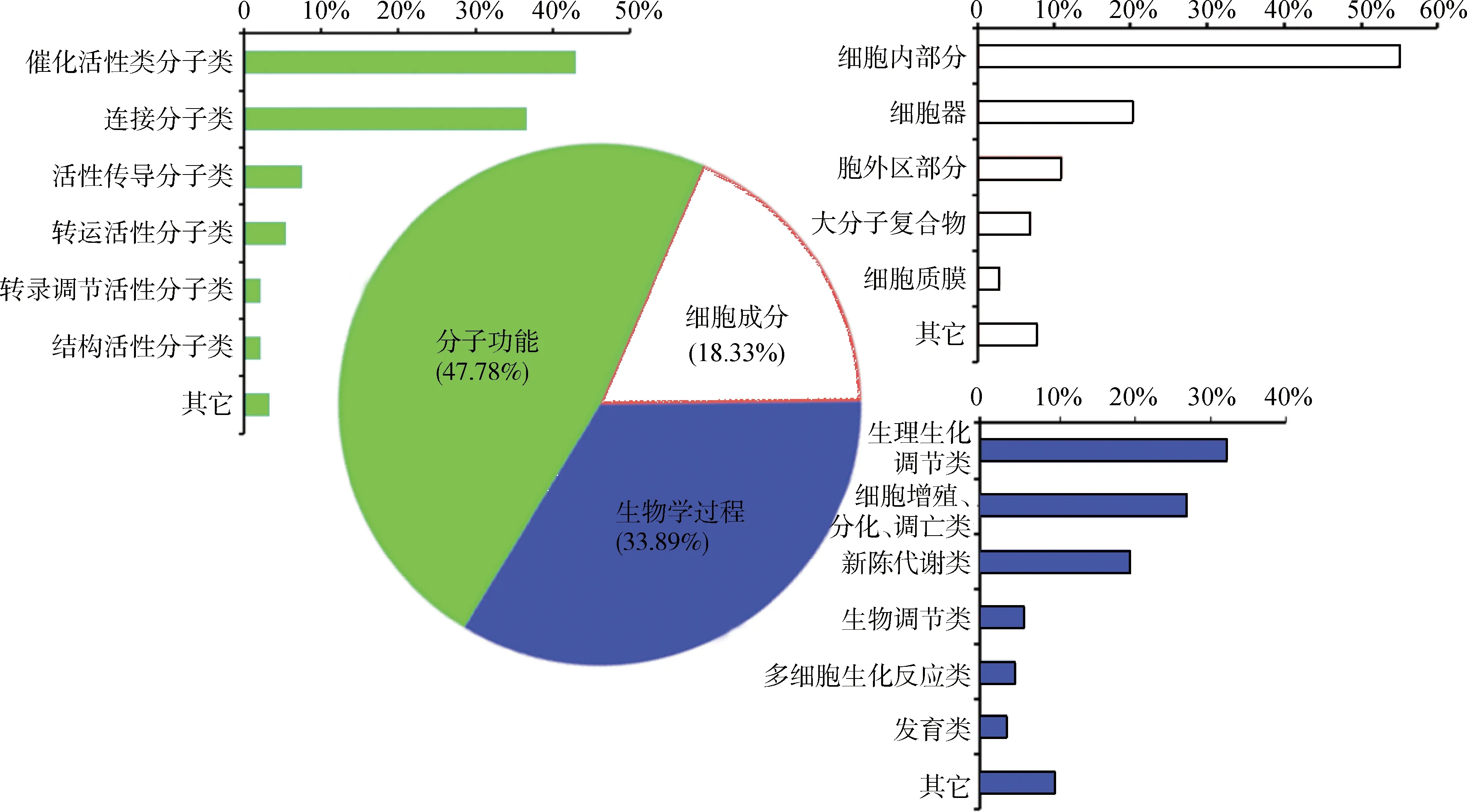
图3 绒山羊差异表达基因的GO分析结果Fig.3 GO analyzing result of differentially expressed genes in Cashmere goat
2.4 差异表达基因分析结果
由于目前大多数基因还未得到详细的注释。根据已有的注释,筛选出19个基因,其中9个上调,10个下调(表2,表3),可能涉及毛囊生长的不同阶段。显示出埋置MLT条件下,诱导绒山羊毛囊基因产生了差异性表达,从而影响毛囊自然的周期性活动,使毛囊提前进入兴盛期,延长了羊绒的生长周期,达到增绒的目的。
2.5 qRT-PCR检测
选取基因芯片数据中表达差异较明显的2个基因PAX6和CSN2进行qRT-PCR检测(图4),对比分析这些基因的表达模式,虽然所选2个基因的mRNA 表达水平的变化与芯片的检测结果显示的表达倍数略有差别,但是二者的变化趋势是一致的,反映基因芯片分析结果的可靠性。
3 讨 论
关于褪黑激素对羊毛生长的影响,已有很多相关报道[9-10],但主要涉及组织学及相关基因分子生物学分析,缺少系统性的大量相关基因的研究。褪黑激素(MLT)是一种神经内分泌激素,在视交叉上核和外围组织的协同下由松果体分泌[11-12]。MLT可以调节细胞内的过程(G蛋白)和第二信使的活动(例如cAMP、IP3、Ca2+)。在神经发育中,褪黑激素作为一个重要的细胞内信号调控基因表达。皮肤及毛囊附属物(毛发、指甲、牙齿等)在胚胎发育过程中起源于外胚层细胞,与神经细胞是同源的,因此MLT对于皮肤及毛囊的调控模式也极有可能与其对神经发育相似。本研究在差异表达的基因中,NPY2R(神经肽Y受体)、ADCYAP1(腺苷酸环化酶活性肽)显著上调,说明这两种基因参与外源MLT引起的信号转导过程,但对于下游基因以及毛囊再生调控的作用还需要进一步研究。
毛囊发育和再生受到各种生长因子、激素和信号分子的严格调控,Wnt信号通路是最重要的途径之一[13-14]。Wnt蛋白信号通路及相关的分子信号转导调控毛囊生长的周期性活动,作为其中关键一环,CTNNB1(β-catenin)是一种多功能的蛋白质,主要为介导细胞间黏附并参与基因的表达,其表达决定毛囊发育及再生的命运[15]。β-catenin是毛发形成中不可缺少的调节因子,并促进毛囊干细胞从休止期进入兴盛期,进而启动毛发周期[16]。在人类及小鼠的研究中已经证实Wnt/β-catenin途径对于毛囊及牙齿的发育至关重要[17]。本研究数据分析显示,相对于对照组羊皮肤组织,埋植MLT试验组绒山羊样本中CTNNB1(β-catenin)基因的表达差异极显著,3组重复均显示较高的表达比率。可以推测,Wnt/β-catenin信号通路响应非长绒期埋植MLT引起的一系列信号转导,从而促进绒山羊绒毛进入兴盛期,这一途径可能是外源MLT引起羊绒生长的关键因素。
表2 绒山羊毛囊生长相关的上调基因
Table 2 The up-regulated genes related to Cashmere goat hair follicle growth
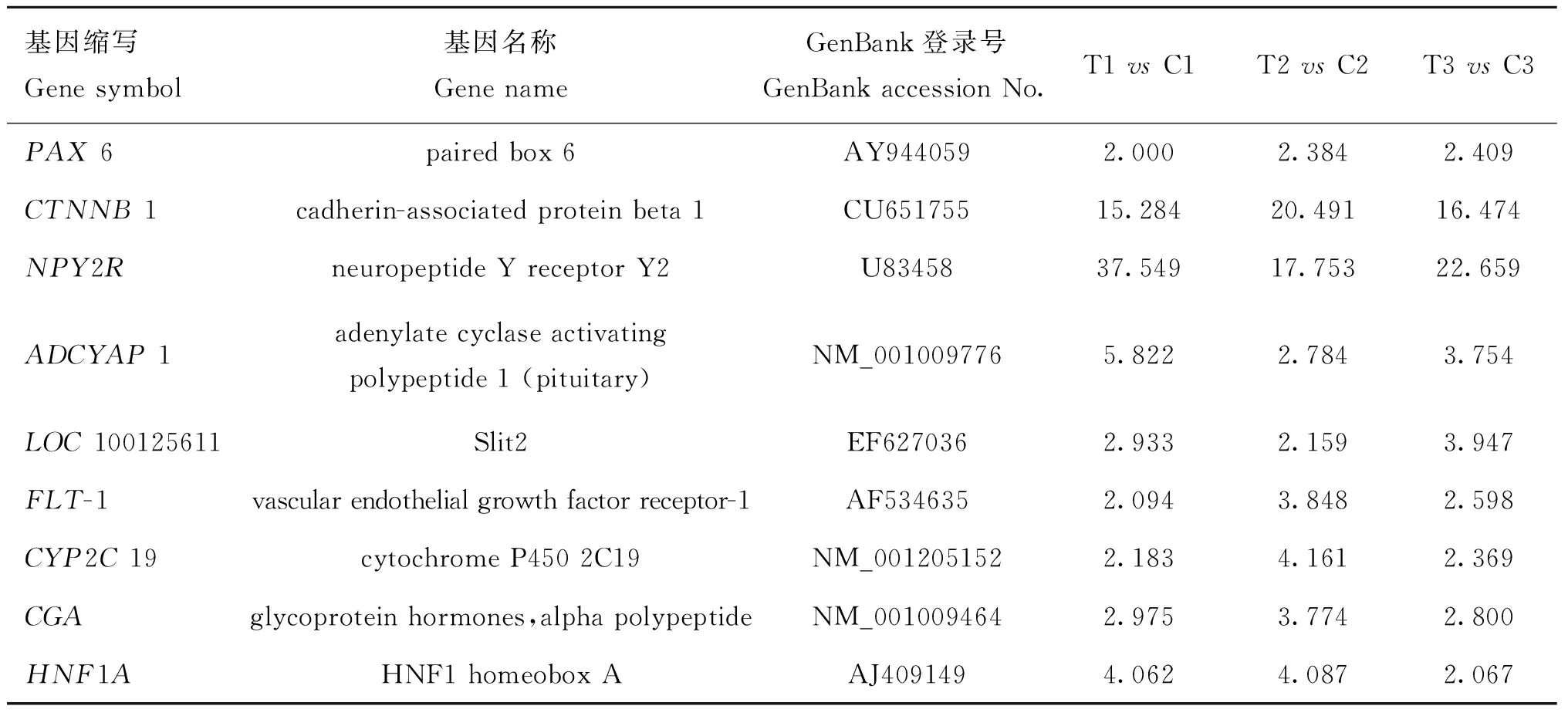
基因缩写Genesymbol基因名称GenenameGenBank登录号GenBankaccessionNo.T1vsC1T2vsC2T3vsC3PAX6pairedbox6AY9440592.0002.3842.409CTNNB1cadherin-associatedproteinbeta1CU65175515.28420.49116.474NPY2RneuropeptideYreceptorY2U8345837.54917.75322.659ADCYAP1adenylatecyclaseactivatingpolypeptide1(pituitary)NM_0010097765.8222.7843.754LOC100125611Slit2EF6270362.9332.1593.947FLT-1vascularendothelialgrowthfactorreceptor-1AF5346352.0943.8482.598CYP2C19cytochromeP4502C19NM_0012051522.1834.1612.369CGAglycoproteinhormones,alphapolypeptideNM_0010094642.9753.7742.800HNF1AHNF1homeoboxAAJ4091494.0624.0872.067
表3 绒山羊毛囊生长相关的下调基因
Table 3 The down-regulated genes related to Cashmere goat hair follicle growth
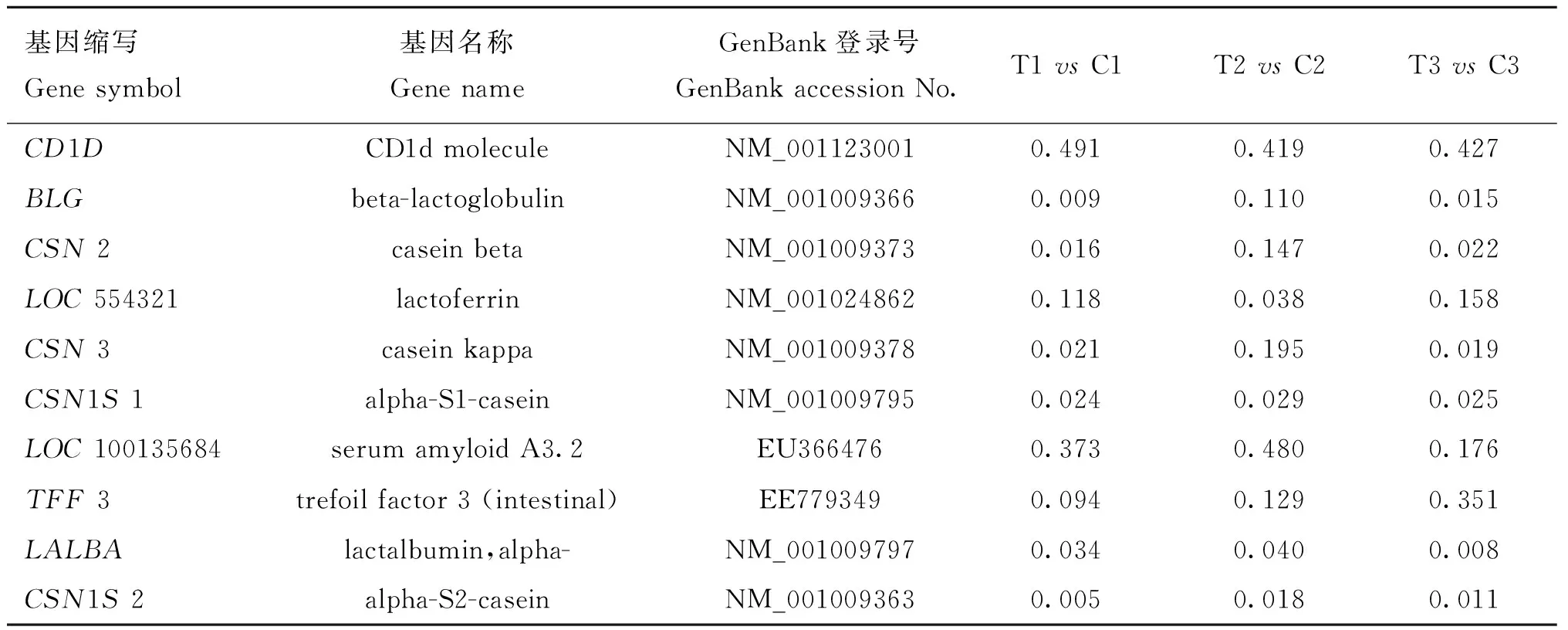
基因缩写Genesymbol基因名称GenenameGenBank登录号GenBankaccessionNo.T1vsC1T2vsC2T3vsC3CD1DCD1dmoleculeNM_0011230010.4910.4190.427BLGbeta-lactoglobulinNM_0010093660.0090.1100.015CSN2caseinbetaNM_0010093730.0160.1470.022LOC554321lactoferrinNM_0010248620.1180.0380.158CSN3caseinkappaNM_0010093780.0210.1950.019CSN1S1alpha-S1-caseinNM_0010097950.0240.0290.025LOC100135684serumamyloidA3.2EU3664760.3730.4800.176TFF3trefoilfactor3(intestinal)EE7793490.0940.1290.351LALBAlactalbumin,alpha-NM_0010097970.0340.0400.008CSN1S2alpha-S2-caseinNM_0010093630.0050.0180.011
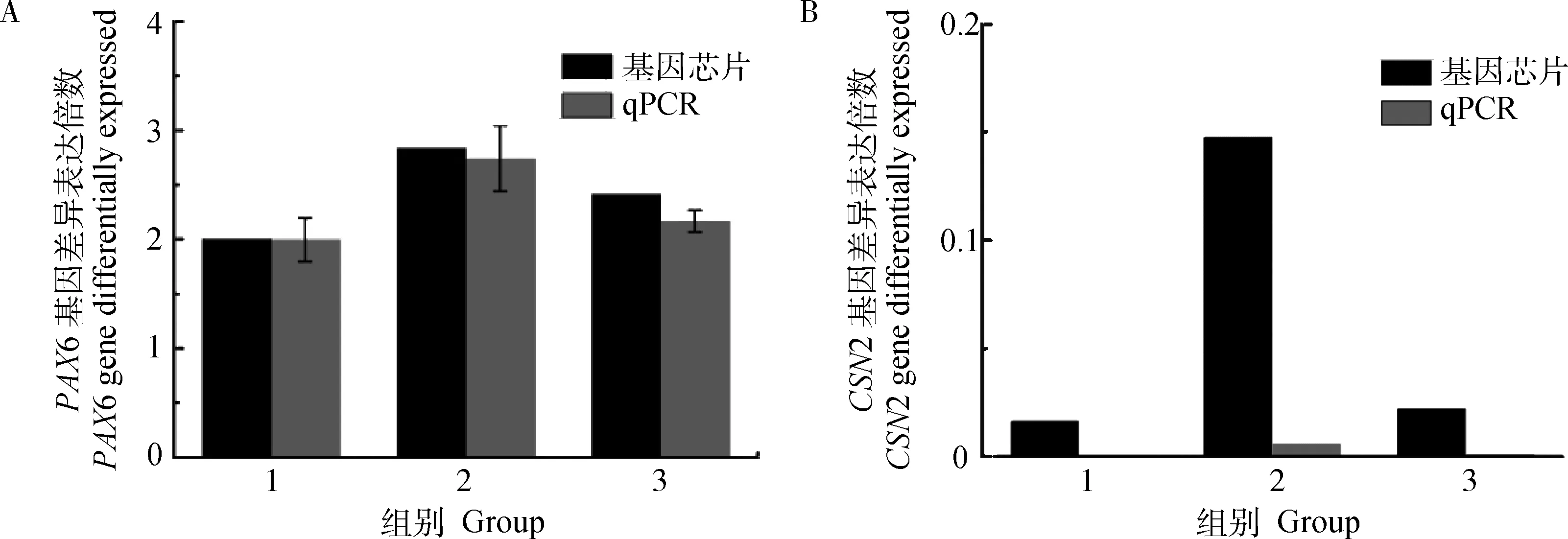
1. T1 vs C1; 2.T2 vs C2; 3. T3 vs C3图4 qRT-PCR检测基因差异表达倍数Fig.4 qRT-PCR verification results
本研究结果分析表明,PAX6具有明显的表达上调。PAX6 是一个功能复杂的蛋白,参与细胞的许多生命活动,PAX6基因编码的转录因子在动物胚胎从区域化到细胞类型分化的不同发育过程中起着重要作用。在细胞强烈增殖时,PAX6表达作为转录因子定位于细胞核内,而PAX6迁移至细胞质,丧失了转录因子的调节作用,表明PAX6可能转录调节下游的因子从而发挥调节细胞增殖的作用。PAX6 在神经系统的发育起重要调节作用[18],而毛囊在发育上起源于外胚层细胞,与神经系统是同源的,因此绒山羊毛囊周期性再生极有可能与PAX6调控神经系统发育有着相似的机制,而这一过程与MLT的分泌存在密切的相关性。CYP1A1(Cytochrome P4501A1)在小鼠皮肤中有少量的表达,相比之下更强的信号被发现于毛囊周围的皮脂腺中[19]。本研究发现埋植MLT的试验组山羊皮肤毛囊样本中CYP2C19显著上调,这可能与毛囊兴盛期中,毛的生长活动以及毛囊附属物相关结构的构建有关,这一现象还需要进行更加深入的研究。在发育过程中,VEGF(Vascular endothelial growth factor)参与调节血管的形成。VEGFR-2(Vascular endothelial growth factor receptor-2)存在于人类毛囊、皮脂腺、汗腺等细胞中,在毛囊的生长中发挥重要作用[20],表达于毛囊隆突部[21]并与K15、K19的阳性信号相关。但是VEGF对于羊毛生长的作用,目前还没有明确的报道。本研究结果显示,MLT埋置组毛囊兴盛期皮肤中FLT1(Vascular endothelial growth factor receptor-1,VEGFR-1)差异性表达,VEGFR-1可能参与绒山羊毛囊的周期性重建,值得进一步深入研究。
4 结 论
本研究结果表明,在埋植MLT条件下参与绒山羊皮肤毛囊生长过程的基因会被调动起来,对比自然条件下的样本发生差异性表达,这些基因中包括许多参与毛囊生长及毛囊周边皮肤附属物构建相关的基因,尤其是CTNNB1的表达,毛囊进入兴盛期的主要原因可能是外源MLT引发一系列分子信号的转导激活WNT/β-catenin途径,决定毛囊进入兴盛期,但其具体的分子机理是仍需进行更加深入的研究。本研究结果为褪黑激素相关信号通路对于毛囊生长的促进作用的分子机制提供证据,并为人工增绒方法在畜牧业生产中的实际应用提供理论依据。
[1] MCGREGOR B A.Nutrition,management and other environmental influences on the quality and production of mohair and cashmere:A review with particular reference to mediterranean and annual temperate climatic zones[J].SmallRuminRes,1998,28(3):199-215.
[2] GEBBIE F,FORSYTH I,ARENDT J.Effects of maintaining solstice light and temperature on reproductive activity,coat growth,plasma prolactin and melatonin in goats[J].JReprodFertil,1999,116(1):25-33.
[3] IBRAHEEM M,GALBRAITH H,SCAIFE J,et al.Growth of secondary hair follicles of the Cashmere goatinvitroand their response to prolactin and melatonin[J].JAnat,1994,185(Pt 1):135-142.
[4] 王 潇,尹 俊.内蒙古白绒山羊毛囊干细胞巢的间接定位[J].农业生物技术学报,2014,22(3):326-332. WANG X, YIN J.Indirect location of hair follicle stem cell niche in Inner Mongolia White Cashmere goat[J].JournalofAgriculturalBiotechnology,2014,22(3):326-332.(in Chinese)
[5] MOELLMANN G,LERNER A B,HENDEE J R.The mechanism of frog skin lightening by acetylcholine[J].GenCompEndocrinol,1974,23(1):45-51.
[6] REPPERT S M,WEAVER D R,RIVKEES S A,et al.Putative melatonin receptors in a human biological clock[J].Science,1988,242(4875):78-81.
[7] CONG Y,DENG H,FENG Y,et al.Melatonin implantation from winter solstice could extend the cashmere growth phase effectively[J].SmallRuminRes,2011,99(1):48-53.
[8] TUSHER V G,TIBSHIRANI R,CHU G.Significance analysis of microarrays applied to the ionizing radiation response[J].ProcNatlAcadSci,2001,98(9):5116-5121.
[9] GHOSH S,SINGH A K,HALDAR C.Seasonal modulation of immunity by melatonin and gonadal steroids in a short day breeder goat capra hircus[J].Theriogenology,2014,82(8):1121-1130.
[10] ZHANG Q,LI J,CHEN Y,et al.Growth and viability of Liaoning Cashmere goat hair follicles during the annual hair follicle cycle[J].GenetMolRes,2014,13(2):4433-4443.
[11] FOULKES N S,ASSONE-CORSI P,BORJIGIN J,et al.Rhythmic transcription:the molecular basis of circadian melatonin synthesis[J].TrendsNeurosci,1997,20(10):487-492.
[12] LANOIX D,BEGHDADI H,LAFOND J,et al.Human placental trophoblasts synthesize melatonin and express its receptors[J].JPinealRes,2008,45(1):50-60.
[13] LI Y H,ZHANG K,YANG K,et al.Adenovirus-mediated Wnt10b overexpression induces hair follicle regeneration[J].JInvestDermatol,2013,133(1):42-48.
[14] MYUNG P S,TAKEO M,ITO M,et al.Epithelial Wnt ligand secretion is required for adult hair follicle growth and regeneration[J].JInvestDermatol,2013,133(1):31-41.
[15] CHEN D,JARRELL A,GUO C,et al.Dermal β-catenin activity in response to epidermal Wnt ligands is required for fibroblast proliferation and hair follicle initiation[J].Development,2012,139(8):1522-1533.
[16] ALONSO L,FUCHS E.Stem cells in the skin:waste not,Wnt not[J].GenesDev,2003,17(10):1189-1200.
[17] WANG B,LI H,LIU Y,et al.Expression patterns of WNT/β-CATENIN signaling molecules during human tooth development[J].JMolHist,2014,45(5):487-496.
[18] MAEKAWA M,TAKASHIMA N,ARAI Y,et al.Pax6 is required for production and maintenance of progenitor cells in postnatal hippocampal neurogenesis[J].GenesCells,2005,10(10):1001-1014.
[19] ROWE J M,WELSH C,PENA R N,et al.Illuminating role of CYP1A1 in skin function[J].JInvestDermatol,2008,128(7):1866-1868.
[20] MAN X Y,YANG X H,CAI S Q,et al.Expression and localization of vascular endothelial growth factor and vascular endothelial growth factor receptor-2 in human epidermal appendages:a comparison study by immunofluorescence[J].ClinExpDermatol,2009,34(3):396-401.
[21] WU X J,ZHU J W,JING J,et al.VEGF 165 modulates proliferation,adhesion,migration and differentiation of cultured human outer root sheath cells from central hair follicle epithelium through VEGFR-2 activationinvitro[J].JDermatolSci,2014,73(2):152-160.
(编辑 程金华)
Exogenous Melatonin Promotes Expression Differences of Skin Hair Follicles Related Genes in Cashmere Goat
LIU Bin1,2,YANG Jun3,A Yun-ga4,WU Ri-gexilatu4,NA Shun-qimuge4,HAO Ba-yasihuliang5,ZHAO Cun-fa1*,LI Yu-rong1*
(1.InnerMongoliaAcademyofAgricultural﹠AnimalHusbandrySciences,Hohhot010031,China;2.KunmingInstituteofAnimalScience,ChineseAcademyofSciences,Kunming650223,China;3.EtuokeqianqiBureauofAgricultureandAnimalHusbandry,Erdos016200,China;4.EtuokeqianqiBureauofVeterinary,Erdos016200,China;5.EtuokeqianqiArcticGodResearchInstituteofCashmereandLivestock,Erdos016200,China)
Effects of embedding melatonin for Arbas Cashmere goats in telogen phase on control of cashmere growth cycle were conducted in order to extend anagen phase and increase the cashmere production. Cashmere goats were selected and randomly divided into 2 groups,each group with 3 goats( the experiment group (T1,T2,T3) and the control group (C1,C2,C3)). Skin tissues of the treatment and control groups were taken and tissue sections were observed for the influence of embedding melatonin on the induction of hair follicle growth. The total RNA was extracted from the 2 groups of samples and synthesized marked cDNA probes by reverse transcription, and had microarray hybridization on 8×15 K(Agilent) sheep genome-wide expression profile to screen differentially expressed genes. The results were verified by real-time fluorescent quantitative PCR technology. Histological analysis showed that embedding melatonin could obviously promote hair follicle growth. Microarray data showed that there were 95 differently expressed genes, including 61 up-regulated and 34 down-regulated. GO analysis indicated that the genes of 47.78% participated in the molecular function, those of 33.89% were involved in biological processes, and those of 18.33% were associated with the composition of cell. Compared with the control groups, differential expression of related genes in treatment groups were involved in the hair follicle morphogenesis and biological processes of surrounding skin appendages. These differently expressed genes provide valuable reference to research Cashmere goat hair follicle growth and the function of the cyclical controlling genes.
Cashmere goat;melatonin;gene microarray;gene differential expression
10.11843/j.issn.0366-6964.2016.11.008
2016-04-01
内蒙古自治区自然科学基金项目(2014BS0333);国家自然科学基金项目(31260545);国家公益性行业(农业)科研专项(201303059);内蒙古农牧业科学院青年创新基金项目(2013QNJJM05)
刘 斌(1979-),男,博士,副研究员,主要从事绒毛用羊分子数量遗传育种研究,E-mail:liubin0613@126.com
*通信作者:赵存发,研究员,主要从事绒毛用羊遗传育种研究,E-mail:zhaocunfa@163.com;李玉荣,研究员,主要从事绒毛用羊遗传育种研究,E-mail:yurong622003@126.com
S827.2
A
0366-6964(2016)11-2210-08
