慢病毒介导稳定表达抑制PRRSV复制的shRNA细胞系的建立
2016-12-13吴锦艳尚佑军王光祥刘湘涛张志东
吴锦艳,田 宏,尚佑军,陈 妍,王光祥,刘湘涛,张志东
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 农业部畜禽病毒学重点开放实验室,兰州 730046)
慢病毒介导稳定表达抑制PRRSV复制的shRNA细胞系的建立
吴锦艳,田 宏,尚佑军,陈 妍,王光祥,刘湘涛*,张志东*
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 农业部畜禽病毒学重点开放实验室,兰州 730046)
利用慢病毒表达技术将稳定持续抑制PRRSV复制的shRNA导入Marc-145细胞,建立稳定表达靶向抑制PRRSV复制的shRNA的Marc-145阳性细胞克隆,并从细胞模型水平阐明抑制PRRSV复制的关键靶基因的干扰效果。采用LR重组技术,将pENTR/U6/Nsp9-4、pENTR/U6/Nsp9-6及pENTR/U6/-CON分别与pDEST载体进行LR重组,获得表达骨架,重组后的表达载体在转染试剂介导下与已经优化的辅助质粒Vira PowerTMPackaging Mix共转染293-FT包装细胞,获得慢病毒样粒子,并用其感染Marc-145细胞,杀稻瘟菌素抗性筛选获得阳性细胞克隆,通过PCR、CPE、TCID50、Real-time PCR和间接免疫荧光试验等方法分别验证上述细胞株的稳定整合以及其表达的shRNA对PRRSV增殖的抑制效果。结果显示:优势干扰序列和无关序列被稳定整合在靶细胞基因组上,无论观察细胞病变效应、免疫荧光产生情况、致细胞半数感染量还是实时定量分析相对表达量,与正常Marc-145和整合有无关序列的两株阴性对照细胞相比,整合有NSP9-4和NSP9-6的两株细胞由于表达了靶向抑制PRRSV复制的shRNA,PRRSV对其易感性降低,而且差别显著,分别将其命名为Marc/pU6/NSP9-4和Marc/pU6/NSP9-6。经验证,本研究成功构建两株稳定表达靶向抑制PRRSV复制的shRNA细胞——Marc/pU6/NSP9-4、Marc/pU6/NSP9-6,同时获得一株表达无意义shRNA的Marc/pU6-CON辅助细胞,该细胞表达的shRNA具有明显抑制PRRSV复制的功能,不仅可以从细胞模型水平阐明抑制PRRSV复制的关键靶基因,也为PRRSV感染引起宿主细胞的变化以及对机体的致病机制等研究提供资料。
PRRSV; shRNA;Marc-145细胞系;慢病毒表达技术
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS),亦称蓝耳病,由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)引起,是一种严重危害养猪业的接触性传染病。RNA干扰(RNA interference, RNAi)是真核生物中的特异核苷酸序列产生的基因沉默现象,被认为有抑制病毒复制的功能,能够简单、高效地阻抑特定基因的表达。所以利用RNAi技术研究siRNA抑制病毒增殖时,选择病毒基因组保守区域是关键,众所周知,选择的干扰靶序列越保守,抑制各血清型基因复制能力会越强。PRRSV基因组含有9个开放阅读框(open reading frame, ORF),分别为ORFla、ORFlb、ORF2a、ORF2b、ORF3、ORF4、ORF5、ORF6和ORF7。ORF1b蛋白比较保守,不编码蛋白水解酶,借助ORF1a编码的蛋白水解酶Nsp4将其切割成4个成熟的非结构蛋白Nsp9~Nsp12,其具备聚合酶、复制酶及其蛋白酶,是病毒复制所必需的[1-2]。Nsp9为依赖于RNA的RNA聚合酶(RNA-dependent RNA polymerase,RdRp),含有正链RNA病毒所特有的4个序列[3],作为催化活性的基元其保守性最高。研究证实nsp9基因的替换会影响病毒在保守细胞上的生长[4]。反向遗传学研究结果显示如果缺失Nsp9,病毒的感染性cDNA无法包装成完整的病毒粒子。作为PRRSV重要的RdRp, Nsp9参与病毒基因组和亚基因组RNA的复制及转录[5-6],而且Nsp9通过与宿主蛋白质相互作用参与病毒复制[7-8]。NSP9 C端的RdRp′结构域与其聚合酶活性及病毒基因组的转录密切相关[9]。最近的研究表明,Nsp9与Nsp10不仅影响我国高致病性PRRSV(HP-PRRSV)在体内外的复制和增殖,而且与病毒的毒力密切相关[5]。也有报道显示,Nsp9与宿主蛋白内annexin A2的相互作用有利于PRRSV在Marc-145中的复制[7]。赵双成[10]采用免疫共沉淀(Co-IP)技术证实Nsp9 C端的RdRp结构域与解旋酶蛋白DDX5N端的DEXDc与HELICc结构域存在相互作用,激光共聚焦分析显示,在Nsp9和DDX5真核表达质粒转染的情况下,两者主要共定位于细胞质及细胞核的周围;而PRRSV感染能诱导DDX5从细胞核转移到细胞质,并与Nsp9共定位。可见,Nsp9是PRRSV编码蛋白质中影响病毒复制和致病性最重要的非结构蛋白之一。由此推断,以PRRSV NSP9作为靶标,应用RNAi技术研究针对NSP9的干扰效果具有现实意义。
近几年应用RNAi技术研究PRRS方面也取得了可喜成绩。曹素芳等针对PRRSV核衣壳蛋白(N基因编码)设计了3对siRNA靶序列,将此克隆到真核表达载体,经过相应鉴定后,筛选到有效的干扰序列,特异性地抑制阻断了PRRSV核衣壳蛋白N基因的表达,为PRRSV新型防治技术研究奠定了基础[11]。贺云霞[12]针对PRRSV较保守的N蛋白选取4个siRNA序列,通过一步PCR法制备shRNA表达盒,转染293T细胞后,发现shRNA179-PCR抑制PRRSV增殖效果明显。宋德武等[13]针对猪繁殖与呼吸综合征病毒GP5基因设计了3个RNAi,构建shRNA表达质粒,瞬时转染Marc-145细胞,攻毒后,经过一系列试验验证,构建的干扰质粒可以高效抑制PRRSV在Marc-145细胞中的复制。可以看出,第一,上述针对的都是结构蛋白,结构蛋白是构成一个形态成熟的病毒颗粒所必需的蛋白质;而非结构蛋白特别是参与病毒复制或基因表达调控的酶,对病毒复制是必需的,只有在这些酶系统的参与下,病毒才具备复制和增殖的功能。第二,都停留在验证干扰效果阶段,仅仅筛选到具有抑制PRRSV复制效果的shRNA,并没有建立真正具有稳定抑制PRRSV复制的细胞系。
经过前期设计、构建、瞬时转染,最终筛选到了2个干扰效果比较理想的靶序列pENTR/U6-shRNA[14-15],作者借助慢病毒表达系统构建shRNA干扰表达载体,经LR重组后,与辅助质粒共转染293-FT细胞,再将其包装成为成熟的缺陷型慢病毒颗粒后感染至Marc-145细胞中,将其整合到Marc-145细胞基因组染色体上,建立靶向抑制PRRSV复制的表达shRNA的阳性细胞株。该细胞株的建立将有助于阐明抑制PRRSV复制的关键靶基因,对病原体感染宿主的功能性进行定位,为动物抗病育种提供新思路。
1 材料与方法
1.1 材料
质粒提取试剂盒购自Omega公司;DMEM-F12、OPTI-MEM购自Sigma公司;胎牛血清购自杭州四季青生物公司;新生牛血清购自PAA;LR Clonase Enzyme Mix、ViraPowerTMPackaging Mix、Blasticidin、感受态细胞One Shot Stbl3、Gateway LR Clonase II Enzyme Mix、pLenti6/BLOCK-iTTM-DEST Gateway Vector Kit均购自Invitrogen公司;MX3005P购自Agilent;T4 DNA Ligase、One Step PrimerScriptTMRT-PCR Kit购自TaKaRa公司;pENTR/U6/Nsp9-4、pENTR/U6/Nsp9-6、pENTR/U6/-CON、293-FT(人胚肾)细胞、Marc-145细胞由中国农业科学院兰州兽医研究所病毒病研究室保存。
1.2 慢病毒介导shRNA表达载体pEX/U6-shRNA的构建及其鉴定
参照Gateway LR Clonase II Enzyme Mix使用说明,分别将pENTR/U6/Nsp9-4、pENTR/U6/Nsp9-6和pENTR/U6/-CON与pLenti6/Dest Gateway Vector载体于25 ℃进行LR重组反应,1.5 h后加1 μL蛋白酶K终止。依据Invitrogen公司One Shot Stbl3 转化步骤,将LR重组后的产物全量转化感受态细胞Stbl3,随机挑取单菌落,质粒提取试剂盒小量提取质粒,首先PCR扩增鉴定,然后将阳性质粒随机送生物公司测序,两种方法均鉴定合适的质粒即为构建的阳性质粒,分别命名为pEX/U6/Nsp9-4、pEX/U6/Nsp9-6和pEX/U6/-CON。
1.3 pEX/U6/Nsp9-4和pEX/U6/Nsp9-6慢病毒的包装
以5×105的浓度将包装细胞293-FT接种于6孔细胞培养板中。待细胞密度达到60%~80%时,利用Lipfection 2000将pEX/U6/Nsp9-4、pEX/U6/Nsp9-6和pEX/U6/-CON分别与已经优化的Vira PowerTMPackaging Mix包装混合物共同转染293-FT细胞,转染后8~10 h吸出培养液,加入3 mL完全培养液,培养48~72 h后,收集包装细胞的培养液,用0.22 μm的醋酸纤维素膜过滤。上清液即为慢病毒样粒子,置超低温冰箱备用。
1.4 Blasticidin对Marc-145细胞致死浓度的检测
将Marc-145细胞按一定比例接种于24孔细胞板,48 h后,将blasticidin杀稻瘟菌素用细胞完全培养基从0.5~10 μg·mL-1依次递增稀释,用稀释后的含杀稻瘟菌素培养基按梯度给24孔细胞培养板换液,置37 ℃CO2培养箱,连续培养2周,期间可以更换抗性溶液,2周后Marc-145细胞全部死亡对应blasticidin的最低浓度为Marc-145致死剂量。
1.5 转基因阳性细胞克隆的筛选
选取生长良好的Marc-145细胞,分别加入收获的pEX/U6/Nsp9-4、pEX/U6/Nsp9-6和pEX/U6/-CON慢病毒上清,置37 ℃,50 mL·L-1CO2温箱孵育,期间每30 min摇1次培养瓶,持续吸附2 h,同时设阴性对照。吸弃感染液,加入上述已确定致死Marc-145细胞死亡最低blasticidin浓度的DMEM完全营养液,期间继续更换抗性营养液,大约2周后,细胞瓶内出现细胞克隆岛,扩大培养后,继续抗性筛选,直至找到干扰效率较高的阳性克隆,然后扩大培养并且传代建立稳定细胞系,将本研究建立的稳定细胞系分别命名为Marc/pU6/Nsp9-4、Marc/pU6/ Nsp9-6及Marc/pU6-CON。
1.6 稳定整合鉴定
为了鉴定shRNA载体是否稳定整合入Marc-145细胞基因组,取抗性筛选后扩大培养的细胞各1瓶(25 m2),弃培养液,1 mL胰酶消化后,弃掉,轻拍细胞瓶,1 mL PBS收集整合后Marc-145,4 000 r·min-1,离心5 min,细胞用400 μL PBS重悬,方法参照试剂盒说明书,用基因组DNA提取试剂盒提取Marc/pU6/Nsp9-4、Marc/pU6/ Nsp9-6及Marc/pU6-CON细胞基因组DNA,分别用上游引物U6启动子、下游引物慢病毒载体V5进行PCR扩增。
1.7 整合基因组Marc-145细胞表达shRNA抑制PRRSV复制的验证
1.7.1 病毒接种转基因阳性细胞检测病毒感染情况 扩大培养Marc/pU6/Nsp9-4、Marc/pU6 /Nsp9-6及Marc/pU6-CON转基因细胞株,至细胞铺满度达到85%以上,一般细胞分种后培养48 h就可达到要求。三种转基因细胞,每种做3个平行组,首先用维持液清洗细胞面两次,一方面可以去除代谢产物,另一方面除去血清影响。然后每个细胞瓶接种2 mL Marc-145细胞适应病毒[16],其毒价为10-4.29TCID50,感作1 h后换用正常维持液。第一组分别在12、24、48及72 h收集病毒,冻融后测定细胞毒价并观察细胞病变效应;第二组待36 h做间接免疫荧光试验;第三组分别于24、48和72 h收病毒,冻融后做Real-time RT-PCR验证。
1.7.2 TCID50测定转基因阳性细胞的抗病毒效果 分别取第一组制备好的病毒材料按照100 μL病毒加900 μL维持液依次倍比稀释,使成10-1~10-10。选择生长良好的Marc-145细胞接种于96孔培养板,48 h后,弃营养液,每孔加入倍比稀释的病毒液100 μL,每个滴度做8个重复。第11和12列每孔加入100 μL维持液,作为阴性对照,然后将96孔培养板置37 ℃含5%的CO2培养箱,每天观察记录病变情况,并用Reed-Muench公式计算TCID50。
1.7.3 间接免疫荧光验证转基因阳性细胞表达shRNA抑制PRRSV复制情况 对第二组转基因阳性Marc-145细胞接毒培养36 h后,弃去培养液,按照常规方法以0.5 mol·L-1,pH7.6的PBS缓冲液洗涤细胞2次,加入预冷的丙酮,置-20 ℃冰箱固定30 min, PBS洗涤细胞4~5次,吸水纸吸干,稀释液稀释PRRSV阳性血清,按照一定浓度加入一抗,置湿盒中,37 ℃作用1 h,吸干,用PBS洗涤单层细胞4~5次,吸水纸吸干,每孔加入已稀释FITC标记抗猪的二抗IgG,再孵育1 h,吸弃液体,PBS洗涤,吸干后滴加50%甘油,观察结果。
1.7.4 Real-time RT-PCR验证整合Marc-145细胞对nsp9基因干扰效果 针对nsp9基因设计并合成探针法检测引物以及探针引物,同时合成β-actin管家基因的引物。分别稀释成10 μmol·L-1,收集第三组已经准备材料的各个时间段细胞,反复冻融后,各取400 μL,Trizol法分别提取其RNA,ND2000测定其浓度,稀释使所有RNA保持在一个浓度下,每个样品3 μL,引物1 μL,按照One Step PrimerScriptTMRT-PCR Kit说明书配比,同步扩增nsp9和β-actin基因,每个样重复3次。然后,用比较阈值法分析不同样品中PRRSV的相对拷贝数。
2 结 果
2.1 慢病毒介导shRNA构建质粒的重组鉴定
pENTR/U6/Nsp9-4、pENTR/U6/Nsp9-6和pENTR/U6/-CON经LR重组、PCR及测序鉴定,证实,构建的入门载体和慢病毒载体pLenti6/Dest已正确重组,初步证明pEX/U6/Nsp9-4、pEX/U6/Nsp9-6和pEX/U6/-CON 重组质粒已经成功构建。
2.2 Marc-145细胞抗性筛选浓度的确定
杀稻瘟菌素按一定比例稀释后,配成含抗性DMEM完全培养基,给24孔正常Marc-145细胞换液,连续观察,孔内Marc-145细胞会逐渐出现死亡现象,2周后发现,最低质量浓度为3.3 μg·mL-1杀稻瘟菌素孔细胞全部死亡,故将其作为转基因Marc-145细胞筛选浓度。
2.3 Marc-145细胞整合基因组阳性细胞的获得
慢病毒上清感染正常Marc-145细胞后,经适合浓度blasticidin筛选,得到了细胞克隆,经过连续传代和筛选,出现了blasticidin抗性的阳性克隆,细胞扩大培养后如图1中C~E所示。与正常Marc-145细胞相比,整合后的细胞其形态眼观上有所改变。
2.4 Marc-145细胞基因组整合鉴定
Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6及Marc/pU6-CON细胞基因组经U6启动子和慢病毒载体V5引物PCR鉴定后,从图2可以看出,本研究构建的慢病毒携带干扰序列已经成功整合在Marc-145细胞基因组上。
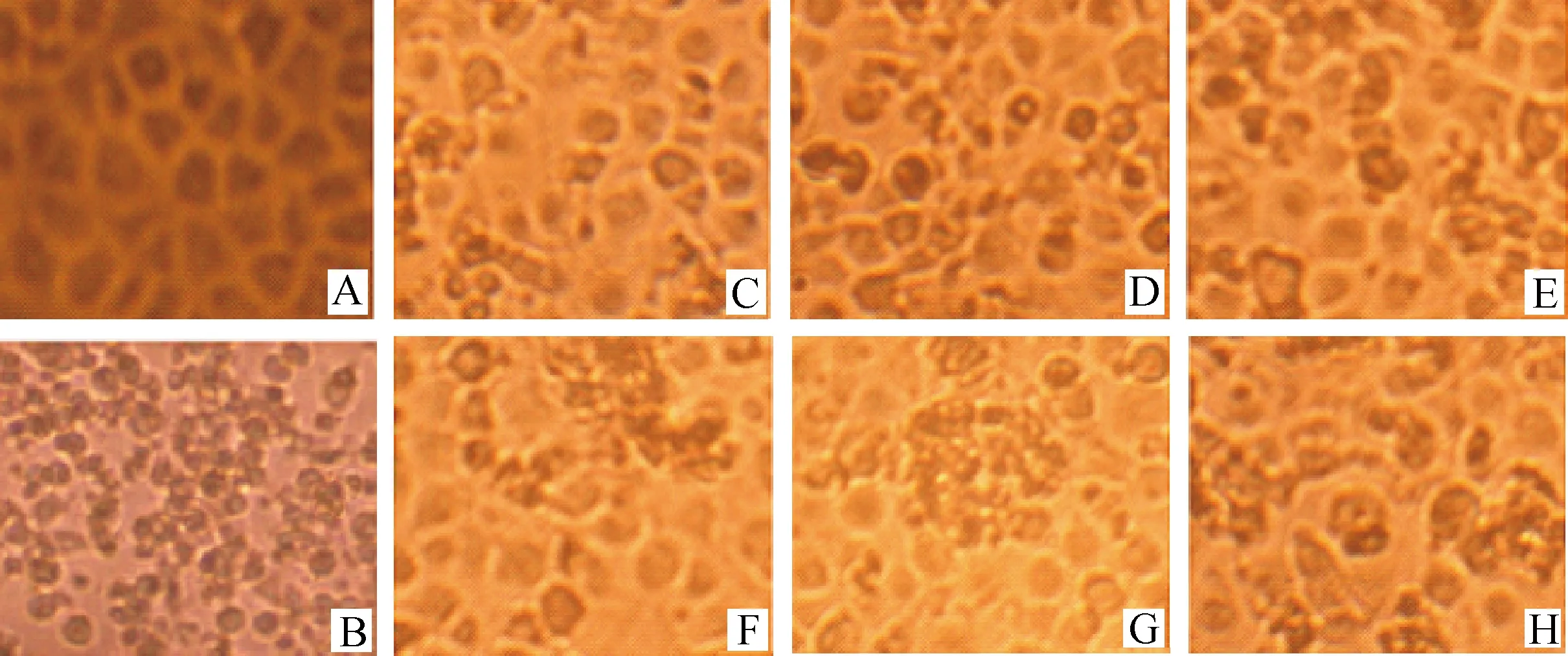
A.正常Marc-145;B.正常Marc-145感染PRRSV;C~E.分别为整合基因组后Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6及Marc/pU6/-CON细胞;F~H.分别为整合基因组后发生CPE的Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6及Marc/pU6-CON细胞A. Normal Marc-145; B. Infected Marc-145 by PRRSV; C. Marc/pU6/Nsp9-4; D. Marc/pU6/Nsp9-6; E. Marc/pU6/-CON; F-H. Infected Marc/pU6/Nsp9-4, Marc/pU6/Nsp9-6 and Marc/pU6-CON by PRRSV, respectively图1 PRRSV感染转基因前、后及发生病变的Marc-145细胞Fig.1 Normal Marc-145, integrated and infected Marc-145 cell by PRRSV

1. Marc/pU6/Nsp9-4;2. Marc/pU6/Nsp9-6;3. Marc/pU6-CON;M. DL2000 DNA相对分子质量标准 ;4.空白对照1. Marc/pU6/Nsp9-4;2. Marc/pU6/Nsp9-6;3. Marc/pU6-CON;M. DL2000 marker;4.Control图2 Marc-145细胞基因组整合后PCR鉴定Fig.2 PCR identification of integrated Marc-145 cellular genome
2.5 转基因阳性细胞接种PRRSV后致细胞病变效应(CPE)
Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6、Marc/pU6-CON及正常Marc-145细胞接毒后第3天,对照Marc/pU6-CON及正常Marc-145部分细胞聚集变圆,Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6也有部分细胞变圆,但变化程度比较轻微。第4天时对照病变明显,转基因细胞病变情况类似对照第3天,第5天时接近对照第4天,可见,转基因细胞表达shRNA且出现明显抑制PRRSV复制现象(见图1中F~H)。
2.6 间接免疫荧光试验验证转基因阳性细胞表达的shRNA对PRRSV复制的抑制
Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6、Marc/pU6-CON及正常Marc-145细胞接种100 TCID50的PRRSV,同时设不接毒的细胞为阴性对照,36 h后,荧光显示如图3,Marc/pU6-CON及正常Marc-145细胞间接免疫后产生荧光比稳定整合的Marc/pU6/Nsp9-4和Marc/pU6/Nsp9-6细胞强,眼观上有明显差异。说明Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6两株细胞表达的shRNA有效抑制了PRRSV的复制和表达。
2.7 转基因阳性细胞抗病毒结果
Marc/pU6/Nsp9-4、Marc/pU6/shRNA/Nsp9-6、Marc/pU6/shRNA-CON及正常Marc-145细胞接毒后,第5天收毒,置-70 ℃反复冻融2次,倍比稀释,测定12、24、48、72 h等不同时间的TCID50。结果,不管哪个时间点,Marc/pU6/NSP9-4和Marc/pU6/NSP9-6 组TCID50值明显低于Marc/pU6-CON及正常Marc-145对照组。说明转基因阳性细胞表达的shRNA具有抑制PRRSV复制的能力,这一结果进一步印证了“2.5和2.6”中直接观察到的细胞病变效应结果(图4)。
2.8 Real-time RT-PCR验证整合Marc-145细胞表达shRNA对nsp9基因干扰效果
Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6、Marc/pU6-CON及正常Marc-145细胞,提取其RNA,ND2000测定质量浓度为200 ng·μL-1,如果模板浓度太高会影响扩增曲线,故每个样品稀释为100 ng·μL-1,在完全一致的PCR条件下,于同一块板上同时扩增nsp9基因和β-actin基因;用比较阈值法分析不同样品中PRRSV的相对拷贝数[17]。从转录水平验证转基因细胞表达的shRNA对nsp9基因干扰效果。由图5可知,与Marc/pU6-CON和正常细胞Marc-145相比,Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6病毒计算拷贝数在0.058以下,对nsp9基因干扰效率达到90.05%以上,说明2个干扰组都表现出很强的抑制病毒感染的效果。
a. 正常Marc-145细胞; b. Marc/pU6/-CON细胞; c. 空白对照; d. Marc/pU6/Nsp9-4细胞; e. Marc/pU6/Nsp9-6细胞a. Infected normal Marc-145; b. Marc/pU6/-CON; c. Control; d. Marc/pU6/Nsp9-4; e. Marc/pU6/Nsp9-6图3 转基因阳性细胞表达的shRNA抑制PRRSV复制的间接免疫荧光验证Fig.3 To verify PRRSV replication inhibition of shRNA expressed by transgenic positive cells through IFA

图4 接毒后转基因阳性Marc-145细胞不同时间TCID50比较Fig.4 Comparison of transgenic Marc-145 cells′ TCID50 post-infection at different time
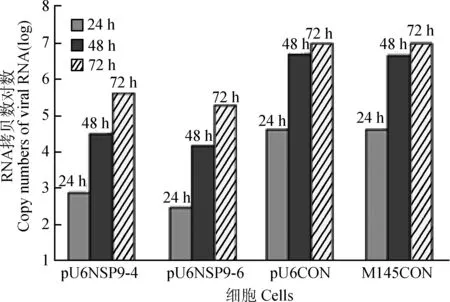
图5 Real-time RT-PCR检测转基因阳性细胞表达的shRNA对PRRSV复制的抑制效果Fig.5 Detection of suppression of PRRSV replication of shRNA expressed by transgenic positive cells through real-time RT-PCR
3 讨 论
本研究通过多种方法及多步骤验证,不仅筛选到具有抑制PRRSV复制能力的两株shRNA,而且成功构建了能够稳定表达shRNA的两株Marc-145细胞系,将其命名为Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6。同时,为便于验证,构建了一株表达随机序列的Marc/pU6/Nsp9-CON细胞系。该细胞系经过PCR、间接免疫荧光、TCID50(组织细胞半数感染量)及Real-time RT-PCR等试验验证后,发现,PRRSV对Marc/pU6/Nsp9-CON和正常Marc-145两者的易感性没有差异;相反,整合在Marc-145细胞上的干扰序列对应两株细胞系由于稳定表达靶向抑制PRRSV复制的shRNA,而具有干扰nsp9基因表达的效果,由此说明整合在细胞上的干扰序列获得表达,从图1~5中也可以看出干扰PRRSV增殖效果显著。
值得注意的是,建立的Marc/pU6/Nsp9-4、Marc/pU6/Nsp9-6细胞系虽然实验室验证能够持续产生干扰效果,但体内抑制病毒的效率还需要大量试验。另外,siRNA研究证实,载体介导shRNA在抑制病毒核酸复制的同时使病毒产生对RNAi的耐受性,一方面源于体内本身就存在siRNA,病毒粒子会对此产生适应性耐受;另一方面由于转染siRNA的压力以及外源的导入使得病毒粒子选择优势得到进化,为了避免病毒对RNA干扰产生免疫耐受,设计时尽可能选择多对针对多个靶点的siRNA,事实上,以前的研究也证实了这点,并且得到了重视,再者,并非所有干扰片段都能对病毒复制产生较好的抑制效果,所以本研究最初设计了6对针对nsp9基因的shRNA,多种方法筛选,验证后,最终才筛选到2对有意义序列。值得关注的最后一点,虽然 siRNA片段比较短,仅仅21~23 bp,但是,研究证实siRNA也许会通过调节干扰素IFN而引起非特异免疫反应[18],因此,如果用此做转基因动物,siRNA引起的副反应、注射靶点以及如何注射等都值得我们深虑。
外源基因进入细胞通常需要“运载工具”,即载体,目前常用的载体有慢病毒载体、逆转录病毒载体、腺病毒载体等,各种病毒载体各具其优缺点。郑海学等利用逆转录病毒载体系统将T7 RNA 聚合酶基因稳定整合在IB-RS-2细胞,建立稳定表达T7 RNA聚合酶IBRS-2细胞系从而体内拯救SVDV[19]。田宏应用逆转录病毒载体系统研制猪水疱病和猪瘟基因工程亚单位疫苗[20],免疫动物后抗体效价达1∶8以上。本研究选用慢病毒载体(lentiviral vector),其属于逆转录病毒科,是一种来源于逆转录病毒的载体。与逆转录病毒载体相比,虽然都是去除基因组中部分基因,并插入所需的目的基因和标记物构建而成,但慢病毒系统转染效率更高,因为慢病毒不但可感染分裂期细胞,而且还可以感染非分裂期细胞,并可容纳较大的基因片段[21]。而其他载体(如非病毒载体、腺病毒载体、腺相关病毒载体)不具备整合到靶细胞染色体的特性,或者只能整合到分裂细胞的染色体。另外,研究证实自身失活慢病毒载体的安全性比逆转录病毒载体更高[22]。目前慢病毒载体系统应用于RNAi研究已有许多成功的例子。有学者应用慢病毒介导RNAi技术,设计合成针对Clusterin基因的siRNA,研究CLU基因对肾癌786-O细胞的作用,发现具有抑制作用,并建立了CLU基因稳定干扰的人肾癌786-O细胞系[23]。研究shRNA沉默HDAC1表达对食管癌细胞EC109细胞的生长特性后证实,慢病毒介导的干扰序列能有效抑制EC109中的HDAC1的表达,不仅如此,还能抑制细胞的增殖分裂[24]。另外,以前关于RNAi的研究大部分建立在瞬时转染基础上,只是对某个靶点的瞬时验证,仍停留在基因水平,没有形成有形的东西。王晓红等研究发现GP5⊿84-119的表达能够抑制PRRSV的复制,建立了稳定表达缺失84-119氨基酸残基(第二个胞外区)的截短型GP5的Marc-145细胞系[25]。受此启发,本研究在前人研究基础上选用慢病毒表达系统及包装细胞系293-FT,将具有干扰效果shRNA整合在Marc-145细胞基因组染色体上,并建立稳定表达shRNA的Marc-145细胞系,为下一步转基因动物的研究提供理论及物质基础。
[1] 吴 娟, 王潇博, 黄志强,等.抗猪呼吸与生殖综合征病毒Nsp9蛋白单克隆抗体的制备及初步鉴定[J].中国生物制品学杂志,2012, 25(9):1180-1184.
WU J,WANG X B,HUANG Z Q, et al. Preparation and preliminary identification of monoclonal antibodies against Nsp9 proteinofporcine reproductive and respiratory syndrome virus[J].ChineseJournalofBiologicals, 2012, 25(9):1180-1184. (in Chinese)
[2] GORBALENYA A E, KOONIN E V, DONCHENKO A P, et al. Coronavirus genome: prediction of putative functional domains in the non-structural polyprotein by comparative amino acid sequence analysis[J].NucleicAcidsRes,1989, 17(12):4847-4861.
[3] ZHAO M, NING Z, WANG H, et al. Sequence analysis of NSP9 gene of 25 PRRSV strains from Guangdong province, subtropical southern China[J].VirusGenes,2013, 46(1):88-96.
[4] KWON B, ANSARI I H, PATTNAIK A K, et al. Identification of virulence determinants of porcine reproductive and respiratory syndrome virus through construction of chimeric clones[J].Virology, 2008, 380(2):371-378.
[5] LI Y, ZHOU L, ZHANG J, et al. Nsp9 and Nsp10 contribute to the fatal virulence of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China[J].PLoSPathog, 2014, 10(7): e1004216.
[6] ZHOU Y, ZHENG H, GAO F, et al. Mutational analysis of the SDD sequence motif of a PRRSV RNA-dependent RNA polymerase[J].SciChinaLifeSci, 2011, 54(9):870-879.
[7] LI J, GUO D, HUANG L, et al. The interaction between host Annexin A2 and viral Nsp9 is beneficial for replication of porcine reproductive and respiratory syndrome virus[J].VirusRes, 2014, 189:106-113.
[8] DONG J, ZHANG N, GE X, et al. The interaction of nonstructural protein 9 with retinoblastoma protein benefits the replication of genotype 2 porcine reproductive and respiratory syndrome virusinvitro[J].Virology, 2014, 464-465: 432-440.
[9] ZHAO M, NING Z,WANG H, et al. Sequence analysis of NSP9 gene of 25 PRRSV strains from Guangdong province, subtropical southern China[J].VirusGenes, 2013, 46 (1): 88-96.
[10] 赵双成.PRRSV Nsp2、Nsp9与宿主细胞蛋白DDX3X、DDX5相互作用的分子机制[D].北京:中国农业大学, 2015.
ZHAO S C. Molecular mechanisms of the interactions of PRRSV Nsp2 with DDX3X and Nsp9 with DDX5.[D].Beijing: China Agricultural University, 2015.(in Chinese)
[11] 曹素芳, 李 明, 王 岩,等.靶向PRRSV 核衣壳蛋白N基因的siRNA 表达载体的构建及鉴定[J].安徽农业科学,2009, 37(28):13490-13491,13518.
CAO S F, LI M, WANG Y, et al. Construction and identification of siRNA expression vector targeting nucleocapsid proteinNgene of PRRSV[J].JournalofAnhuiAgriculturalSciences, 2009,37(28):13490-13491,13518. (in Chinese)
[12] 贺云霞.应用 RNAi 技术抑制猪繁殖与呼吸综合征病毒复制的研究 [D]. 哈尔滨:中国农业科学院哈尔滨兽医研究所, 2006.
HE Y X. Inhibition of porcine reproductive and respiratory syndrome virusreplication by RNA interference technology[D].Harbin:Harbin Veterinary Research Institute, CAAS, 2006. (in Chinese)
[13] 宋德武, 袁 洁, 李 鑫,等.靶向GP5 基因脱氧核酶抑制 PRRSV在MARC-145细胞中的复制[J]. 中国兽医学报,2011, 31(12):1695-1701.
SONG D W, YUAN J, LI X, et al. Inhibition of PRRSV replication by DNAzymes targeted to matrixproteinGP5 gene in MARC-145 cells[J].ChineseJournalofVeterinaryScience, 2011, 31(12):1695-1701. (in Chinese)
[14] 刘湘涛,吴锦艳,田 宏,等.一种用于抑制猪繁殖与呼吸综合征病毒复制的RNAi及其制备方法:中国, ZL201210180401.0[P].2014-07-02.
LIU X T, WU J Y, TIAN H, et al. A kind of RNAi and preparation method to inhibit PRRSV replication: China, ZL201210180401.0[P].2014-07-02. (in Chinese)
[15] 刘湘涛,吴锦艳,田 宏,等.一种用于抑制猪繁殖与呼吸综合征病毒复制的1010shRNA及其制备方法:中国, ZL201310752351.3[P].2015-9-23.
LIU X T, WU J Y, TIAN H, et al. A kind of1010shRNA and preparation method to inhibit PRRSV replication:China, ZL201310752351.3[P].2015-9-23. (in Chinese)
[16] 吴锦艳, 田 宏, 尚佑军,等.猪生殖与呼吸综合征病毒 HN/XT/07 株的分离鉴定及其Nsp2基因的特性分析[J].中国兽医科学,2008, 38(12):1033-1037.
WU J Y, TIAN H,SHANG Y J,et al. Isolation and Nsp2 genetic characterization of one strain HN/XT/07 of porcine reproductive and respiratory syndrome virus[J].ChineseVeterinaryScience, 2008, 38(12):1033-1037.(in Chinese)
[17] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods, 2001, 25(4):402-408.
[18] SLEDZ C A, HOLKO M, DE VEER M J, et al.Activation of the interferon system by short-interfering RNAs[J].NatCellBiol, 2003, 5(9):834-839.
[19] YAN N, CHEN Z J. Intrinsic antiviral immunity[J].NatImmunol, 2012, 13 (3): 214-222.
[20] ALBINA E, PIRIOU L, HUTET E, et al. Immune responses in pigs infected with porcine reproductive and respiratory syndrome virus (PRRSV)[J].VetImmunolImmunopathol, 1998, 61(1): 49-66.
[21] ALBINA E, CARRAT C, CHARLEY B. Interferon-alpha response to swine arterivirus (PoAV), the porcine reproductive and respiratory syndrome virus[J].JInterferonCytokineRes, 1998, 18(7): 485-490.
[22] OVEREND C, MITCHELL R, HE D, et al. Recombinant swine beta interferon protects swine alveolar macrophages and MARC-145 cells from infection with Porcine reproductive and respiratory syndrome virus[J].JGenVirol, 2007, 88 (Pt 3): 925-931.
[23] HUANG C, ZHANG Q, FENG W H. Regulation and evasion of antiviral immune responses by porcine reproductive and respiratory syndrome virus[J].VirusRes, 2015,202:101-111.
[24] LI E, SUN N, ZHAO J X, et al.Invitroevaluation of antiviral activity of tea seed saponins against porcine reproductive and respiratory syndrome virus[J].AntivirTher, 2015, 20(7):743-752.
[25] 王晓红,宋林林,李亮亮,等.GP5Δ84-119稳定表达对猪繁殖与呼吸综合征病毒复制的影响[J].畜牧兽医学报, 2016,47(2):315-324.
WANG X H, SONG L L, LI L L, et al. The effect of GP5Δ84-119stable expression on the replication porcine reproductive and respiratory syndrome virus[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(2):315-324. (in Chinese)
(编辑 白永平)
Establishment of Cell Lines with Stable Expression of shRNA to Inhibit Porcine Reproductive and Respiratory Syndrome Virus Proliferation Using the Lentiviral Expression System
WU Jin-yan, TIAN Hong, SHANG You-jun, CHEN Yan, WANG Guang-xiang,LIU Xiang-tao*, ZHANG Zhi-dong*
(KeyLaboratoryofAnimalVirologyofMinistryofAgriculture,StateKeyLaboratoryofVeterinaryBiology,LanzhouVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Lanzhou730046,China)
In the present study, Marc-145cell lines with stable expression of shRNA were established by lentiviral expression system to inhibit replication of porcine reproductive and respiratory syndrome virus (PRRSV), and its interference suppression effect to PRRSV key target genes was clarified from the level of cell model. LR recombination reaction between pENTR/U6/Nsp9-4 (pENTR/U6/Nsp9-6, or pENTR/U6/-CON, respectively) and pDEST were done by using the LR technology to obtain expression skeleton. Expression vector and auxiliary plasmid Vira PowerTMPackaging Mix were cotransfected into 293-FT cells by Lipofectamine 2000, respectively, to gain Lentiviral supernate and to infect Marc-145 cells. After 48 h, the cells were incubated in standard culture medium including blasticidin (3.3 μg·mL-1), colonies with blasticidin were obtained when cells were cultured in selection medium within 14 d, monoclonal were expanded, passaged, screened to get monoclonal cell lines. The integration of the obtained monoclonal cell lines were identified by PCR, CPE observation and TCID50determination, and the inhibition effect of the cell lines with shRNA to PRRSV proliferation were detected by indirect immunofluorescence test and real-time PCR methods. pENTR/U6/Nsp9-4, pENTR/U6/Nsp9-6 and Marc/pU6-CON had been integrated into the chromosome of Marc-145 cells and expressed stably at high level. Results showed that the shRNA expressed by two cells with pEN/U6/Nsp9-4, pEN/U6/Nsp9-6 specifically suppressed PRRSV proliferation, respectively. The infection rates of PRRSV to the negative control and normal cells were higher than those to the recombinant Marc/pU6/NSP9-4 and Marc/pU6/NSP9-6, and the difference was obvious. These results demonstrate that Marc/pU6/NSP9-4 and Marc/pU6/NSP9-6 cell lines can effectively express shRNA to inhibit the replication and proliferation of PRRSV. It helps to clarify the key target genes that suppress PRRSV replication, and is expected to construct transgenic animals based on the siRNA targeted PRRSV.
PRRSV; shRNA;Marc-145 cells; lentiviral expression system
10.11843/j.issn.0366-6964.2016.11.016
2016-07-14
农业行业标准制定计划项目(2014-308)
吴锦艳(1975-),女,汉,甘肃静宁人,助理研究员,博士,从事分子病毒学与免疫学研究,E-mail:jingningcaixiong@163.com
*通信作者:刘湘涛,E-mail: hnxiangtao@hotmail.com; 张志东, E-mail: zhangzhidong@caas.cn
S852.659.6
A
0366-6964(2016)11-2280-08
