金丝桃苷增强人γδT细胞增殖及杀伤功能研究①
2016-12-13孙蕾清周忠海吕小婷刘军权
李 莹 周 燏 孙蕾清 周忠海 吕小婷 徐 明 李 昳 刘军权
(解放军第九七医院生物治疗中心,徐州221004)
金丝桃苷增强人γδT细胞增殖及杀伤功能研究①
李 莹 周 燏②孙蕾清 周忠海 吕小婷 徐 明③李 昳④刘军权
(解放军第九七医院生物治疗中心,徐州221004)
目的:研究金丝桃苷对人γδT细胞增殖及功能的影响。方法:以异戊烯焦磷酸法体外扩增人外周血γδT细胞。用不同浓度的金丝桃苷处理,CCK-8法检测细胞增殖。LDH法检测金丝桃苷对前列腺癌细胞DU-145的杀伤活性。流式细胞仪检测处理前后γδT 细胞上穿孔素、颗粒酶、CD107a、IFN-γ的表达情况。结果:异戊烯焦磷法能在体外成功培养出高纯度的 γδT细胞。金丝桃苷在μg/ml范围内可显著促进γδT细胞增殖。金丝桃苷作用于γδT 细胞后杀伤DU-145的能力明显增强,且在3.13~12.5μg/ml浓度时 γδT 细胞上颗粒酶、穿孔素、IFN-γ的表达显著升高,与对照组相比有统计学差异。金丝桃苷对γδT细胞上CD107a的表达无明显影响。结论: 金丝桃苷通过增强γδT细胞上颗粒酶、穿孔素、IFN-γ的表达来增强其杀伤DU-145的作用。
金丝桃苷;γδT细胞;DU-145;杀伤功能
金丝桃苷又名槲皮素-3-O-β-D-吡喃半乳糖苷,是一种从天然植物中提取的黄酮醇苷类化合物,广泛存在于各种植物体内,如金丝桃科、蔷薇科、桔梗科等果实与全草中。以往的研究发现金丝桃苷具有多种药理活性,如抗炎[1]、抗肝损伤[2]、抗血栓[3]、体外抗肿瘤[4-6]并增强机体的免疫功能,而且几乎无毒副作用[7]等。γδT主要分布于小肠、皮肤等黏膜组织,是临床常用的重要免疫效应细胞之一。目前关于金丝桃苷对免疫效应细胞的作用鲜有报道,本实验旨在研究金丝桃苷对γδT细胞增殖及杀伤功能的影响,以期为金丝桃苷的临床应用提供实验依据。
1 材料与方法
1.1 实验材料 金丝桃苷(Hyperoside,上海源叶生物科技有限公司,纯度≥98%);FITC标记的anti-TCR-gamma-delta、PE标记的穿孔素(Perforin)和颗粒酶(GranB)、APC标记的CD-107a、Fix&Perm破膜剂、PE-IgG1、APC- IgG1均购自eBioscience公司;APC标记的IFN-γ购自美国BD公司;CCK-8试剂盒购自碧云天生物技术研究所;重组人白细胞介素2(rhIL-2)购自厦门特宝生物工程股份有限公司;异戊烯焦磷酸(Isopentenyl pyrophosphate,IPP),RPMI-1640培养基、小牛血清购自Gibco公司;人AB型血浆购自徐州市血站。人前列腺癌细胞株DU-145购自中国科学院上海细胞研究所。
1.2 γδT细胞培养及鉴定 取健康志愿者外周抗凝血20 ml,常规分离得到单个核细胞(PBMC),将PBMC置于含100 ml/L小牛血清、50 ml/L AB血清、异戊烯焦磷酸(2 μg/L)和rhIL- 2(100 U /ml)的RPMI1640培养液中,于37℃、5%CO2细胞培养箱中培养10 d,用anti-TCR-gamma-delta-FITC标记后用流式细胞仪检测γδT细胞比例。
1.3 CCK-8法检测细胞增殖 取培养10 d的γδT细胞调整细胞浓度至1 × 109L-1,以180 μl接种于96孔板中,并加入金丝桃苷20 μl(终浓度分别为100、50、25、12.5、6.25、3.13、1.6、0.8、0.4、0.2 μg/ml),同时设0.5%DMSO溶媒对照组,每组设3个复孔。培养68 h后每孔加入CCK-8 20 μl,继续培养 4 h后于450nm处测定光密度值(OD )。
1.4 LDH法检测杀伤活性 以乳酸脱氢酶法检测γδT细胞的杀伤活性[8]。将金丝桃苷 50、12.5、3.13、0.8、0.2 μg/ml浓度处理72 h的γδT细胞作为效应细胞。收集对数生长期的DU-145细胞做为靶细胞,按效靶比10∶1的比例将两者混合,同时设单独效应细胞孔、单独靶细胞孔,于37℃、5% CO2培养箱中培养6 h,离心收集上清在全自动生化分析仪340nm处测定吸光值(A),按下式计算杀伤活性。杀伤活性(%)=[(实验孔A值-效应细胞自然释放孔A值)/(靶细胞最大释放孔A值-靶细胞自然释放孔A值)]×100%。
1.5 流式细胞仪检测γδT细胞上颗粒酶、穿孔素、CD107a和IFN-γ的表达 将γδT细胞调整细胞浓度,以每孔1× 106个/3 ml接种至6孔板内,加入金丝桃苷(终浓度为50、12.5、3.13、0.8、0.2 μg/ml),同时设溶媒对照组,每组3个复孔,于37℃、5% CO2培养箱中培养72 h。收集细胞洗涤,检测CD107a和IFN-γ的试管内分别加入FITC-anti-TCR-gamma-delta、APC-CD107a和FITC-anti-TCR-gamma-delta、APC-IFN-γ,避光孵育15 min,PBS洗涤2次,弃上清,0.5 ml PBS重悬细胞,上机检测。测颗粒酶或穿孔素的管内,加入FITC-anti-TCR-gamma-delta避光孵育10 min,再加入固定液孵育15 min,PBS洗涤,弃上清,加入破膜剂、PE-GranB或PE -Perforin,避光孵育15 min,PBS洗涤2次,弃上清,0.5 ml PBS重悬,上机检测。
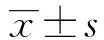
2 结果
2.1 人γδT细胞培养和鉴定 取培养10d的γδT细胞显微镜下观察,可见大的细胞集落,单个细胞呈条梭状。经流式细胞仪检测,γδT细胞的比例可达91.3%,提示γδT细胞培养成功。见图1。
2.2 金丝桃苷对γδT细胞增殖的影响 由图2可看出,金丝桃苷对γδT细胞增殖有一定的影响,在较低浓度(0.2~1.6μg/ml)时,金丝桃苷对细胞增殖影响不明显。在3.13~12.5μg/ml浓度范围内可显著促进细胞增殖,与对照组相比有统计学意义。随着浓度的不断升高,金丝桃苷对细胞增殖出现抑制,在100μg/ml浓度时与对照组相比有显著性差异,因此,在后续实验中,选择了0.2~50μg/ml的浓度范围。

图1 培养前后γδT细胞比例Fig.1 Proportion of γδT cells before and after culture
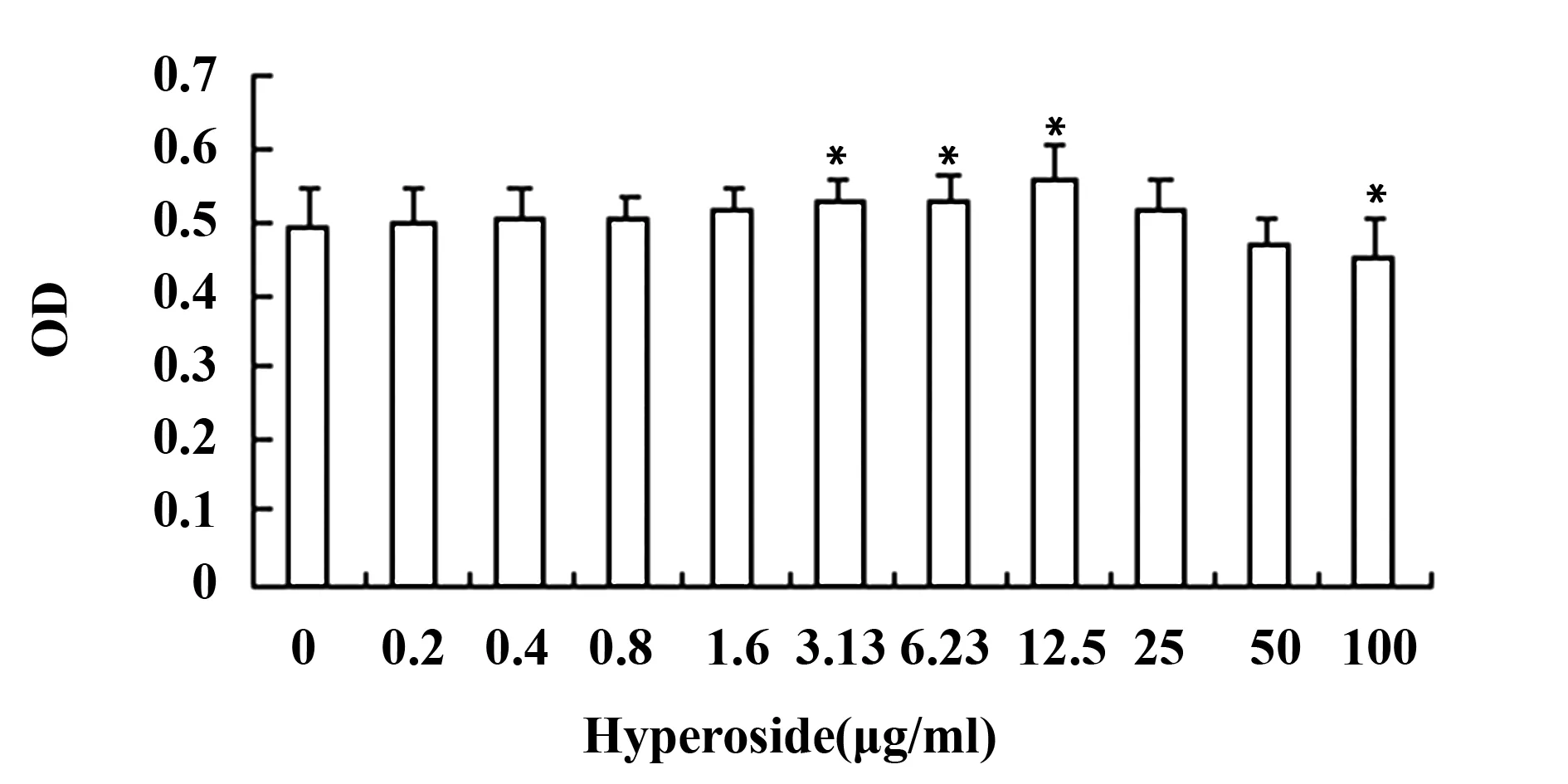
图2 金丝桃苷对γδT细胞增殖影响Fig.2 Effect of Hyperoside on γδT cells proliferationNote: *.P<0.05,VS 0 group.

图3 金丝桃苷对γδT细胞杀伤功能的影响Fig.3 Cytotoxicity of γδT cells treated by Hyperoside Note: *.P<0.05,**.P<0.01 VS 0 group.
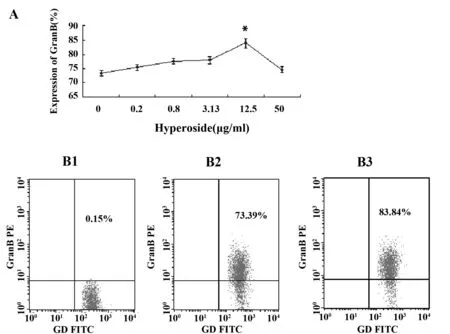
图4 金丝桃苷对γδT细胞上颗粒酶表达的影响Fig.4 Expression of GranB on γδT cells after treated by HyperosideNote: A.The expression of GranB on γδT cells after treated by Hyperoside;B1.Isotype control;B2.0 group;B3.Hyperoside 12.5 μg/ml;*.P<0.05 VS 0 group.
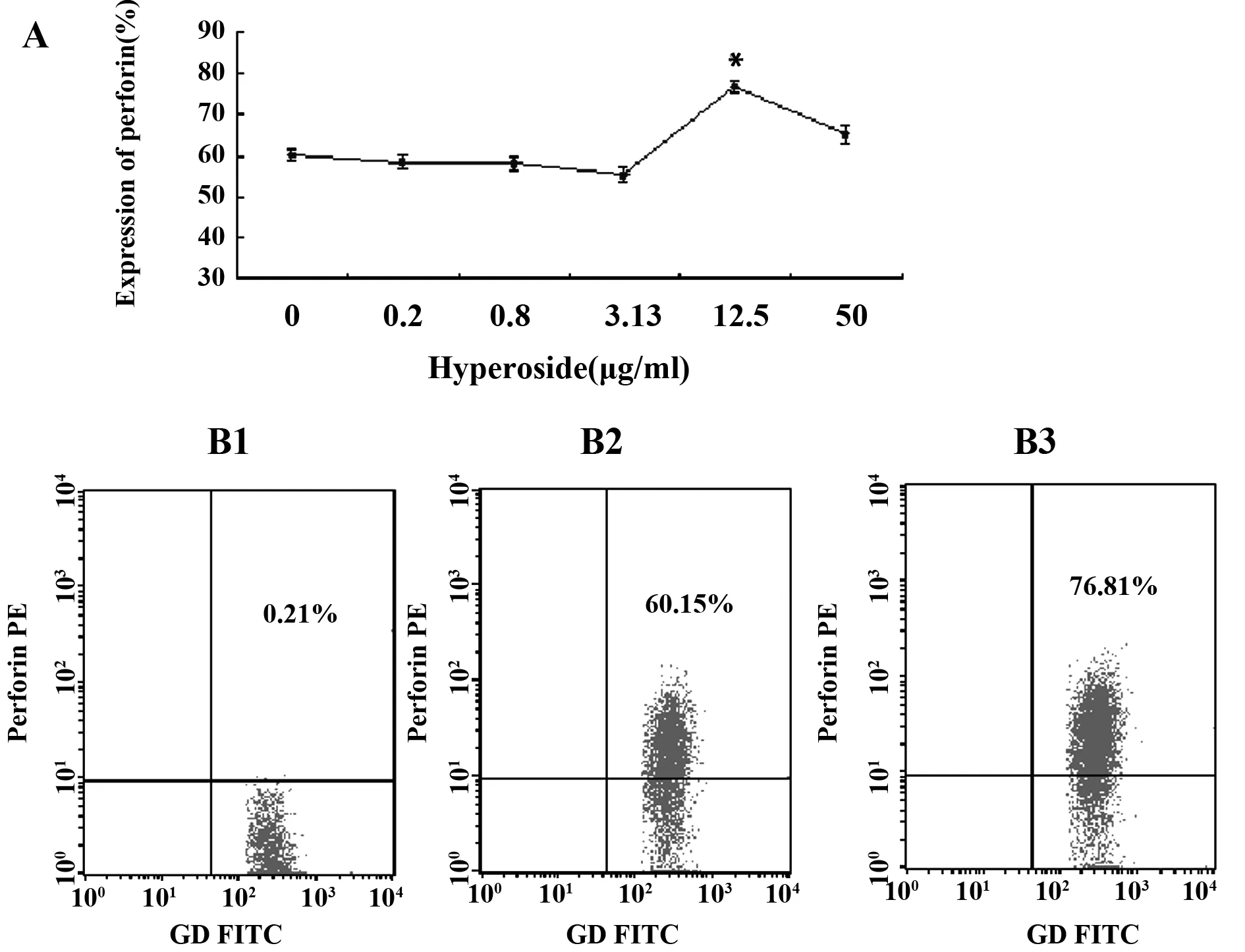
图5 金丝桃苷对γδT细胞上穿孔素表达的影响Fig.5 Expression of Perforin on γδT cells after treated by HyperosideNote: A.The expression of Perforin on γδT cells after treated by Hyperoside;B1.Isotype control;B2.0 group;B3.Hyperoside 12.5 μg/ml;*.P<0.05 VS 0 group.
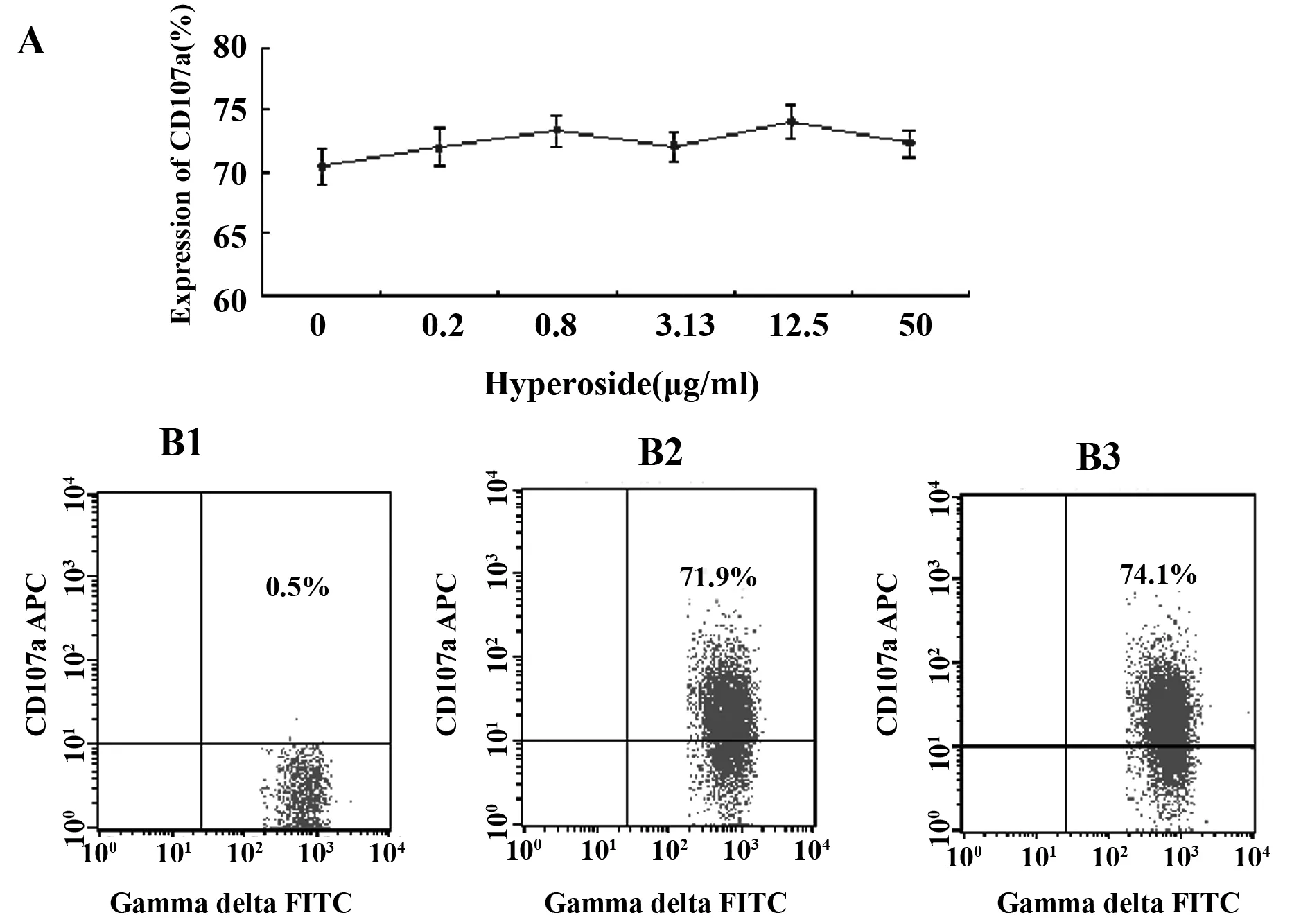
图6 金丝桃苷对γδT细胞上CD107a表达的影响Fig.6 Expression of CD107a on γδT cells after treated by HyperosideNote: A.The expression of CD107a on γδT cells after treated by Hyperoside;B1.Isotype control;B2.0 group;B3.Hyperoside 12.5 μg/ml.
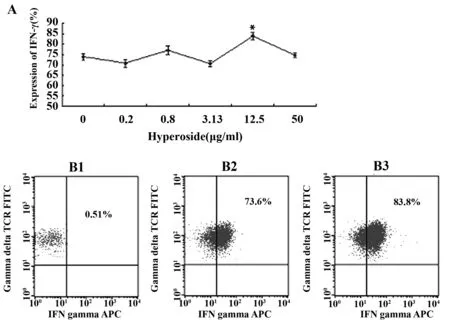
图7 金丝桃苷对γδT细胞上IFN-γ表达的影响Fig.7 Expression of IFN-γ on γδT cells after treated by HyperosideNote: A.The expression of IFN-γ on γδT cells after treated by Hyperoside;B1.Isotype control;B2.0 group;B3.Hyperoside 12.5 μg/ml;*.P<0.05 VS 0 group.
2.3 杀伤活性检测结果 金丝桃苷作用于γδT细胞72h后,对DU-145的杀伤活性有一定程度的提高,在12.5μg/ml浓度时杀伤活性最强,与对照组相比有显著性差异。见图3。
2.4γδT细胞上颗粒酶、穿孔素、CD107a、IFN-γ的表达结果 经金丝桃苷处理72h后,γδT细胞上颗粒酶、穿孔素、IFN-γ的表达都有一定改变,在12.5μg/ml浓度下,三者的表达都显著高于对照组。金丝桃苷对γδT细胞上CD107a的表达影响不明显。见图4~7。
3 讨论
目前有关金丝桃苷的抗肿瘤作用成为研究的热点。金丝桃苷不仅能在体外抑制多种肿瘤细胞株增殖,还能在体内增强机体的免疫功能。黄凯等[9]研究初步发现给予正常小鼠12.5mg/kg金丝桃苷即可增强其非特异性和特异性免疫。王丽敏[10]的研究发现金丝桃苷在小剂量(1.5mg/kg)时就对荷瘤小鼠有抑瘤作用,随着剂量增加抑瘤效果逐渐提高,最高可达约65%。
然而金丝桃苷对免疫效应细胞的作用还少有报道,我们之前报道过金丝桃苷增强共刺激细胞杀伤胃癌的研究[11],本课题主要研究金丝桃苷对γδT细胞增殖及功能的影响。γδT细胞主要分布于皮肤、小肠、食道等黏膜上皮内,在免疫调节、免疫监视中起关键作用,因此也是肿瘤生物治疗中常用的免疫效应细胞。CCK-8实验结果表明在3.13~12.5μg/ml浓度范围内金丝桃苷可显著促进γδT细胞增殖,随着浓度增加则抑制细胞增殖,因此选择0.2~50.0μg/ml浓度范围进行后续实验。在杀伤实验中,我们发现经金丝桃苷预处理过的γδT细胞对前列腺癌DU-145的杀伤能力较未处理组明显增强,在12.5μg/ml时达峰值。
为了进一步验证γδT细胞的杀伤功能的改变,我们用流式细胞仪检测了处理前后γδT细胞上与其特异性杀伤活性密切相关的成分穿孔素、颗粒酶、CD107a及INF-γ的表达情况。穿孔素是存在于CTL、NK和γδT细胞胞质中的细胞毒颗粒。当这些细胞与靶细胞接触后可释放穿孔素, 在靶细胞膜上形成多聚穿孔素管状通道,导致靶细胞溶解[12]。颗粒酶B是CTL和NK细胞颗粒中最重要的丝氨酸蛋白酶,可以进入靶细胞,激活caspase级联反应,从而迅速引起靶细胞DNA的断裂,导致快速的细胞凋亡[13]。抗原特异性T细胞表面的CD107a分子,与抗原特异性细胞活化以后的脱颗粒过程密切相关,可能是CTL脱颗粒以后,细胞溶解性颗粒的胞膜与T细胞膜融合所致[14]。IFN-γ主要由活化的T细胞和NK细胞产生,具有抗炎、抗肿瘤和免疫调节的作用[15]。本研究中我们发现金丝桃苷能明显提高γδT细胞上颗粒酶、穿孔素和IFN-γ表达,分别从73.39%、60.15%、73.6%提高至83.84%、76.81%、83.8%,而对CD107a的表达无明显影响。
综上所述,本课题初步研究了金丝桃苷对γδT细胞的影响,发现金丝桃苷在一定浓度范围内可以促进γδT细胞增殖,并增强其杀伤能力,以期为金丝桃苷的进一步开发应用提供依据。
[1] Ku SK,Zhou W,Lee W,etal.Anti-inflammatory effects of hyperoside in human endothelial cells and in mice[J].Inflammation,2015,38(2):784-799.
[2] Choi JH,Kim DW,Yun N,etal.Protective effects of hyperoside against carbon tetrachloride-induced liver damage in mice[J].J Nat Prod,2011,74(5):1055-1060.
[3] Ku SK,Kim TH,Lee S,etal.Antithrombotic and profibrinolytic activities of isorhamnetin-3-O-galactoside and hyperoside[J].Food Chem Toxicol,2013,53:197-204.
[4] 王丽敏,李 爽,张明远,等.金丝桃苷对人结肠癌HCT8细胞生长周期、细胞凋亡及对Caspase蛋白活性的影响[J].时珍国医国药,2012,23(12),3010-3011.
[5] Li FR,Yu FX,Yao ST,etal.Hyperin extracted from Manchurian rhododendron leaf induces apoptosis in human endometrial cancer cells through a mitochondrial pathway[J].Asian Pac J Cancer Prew,2012,113(8):3653-3656.
[6] 孙时华,姜荣华,祝海燕,等.金丝桃苷体外抗胃癌作用及其机制研究[J].中国临床药理学与治疗学,2014,19(9):979-983.
[7] 艾 国,黄正明,王德文,等.金丝桃苷对Wistar大鼠重复灌胃给药的毒性研究[J].中国新药杂志,2012,21(23):2811-2826.
[8] 刘军权,韩慧敏,陈复兴.用乳酸脱氢酶试剂盒检测LAK细胞活性[J].临床医学检验,1995,13:83.
[9] 黄 凯,杨新波,黄正明,等.金丝桃苷对正常小鼠免疫功能的影响[J].解放军药学学报,2009,25(2):133-135.
[10] 王丽敏,王跃新,朱秋双,等.金丝桃苷对荷瘤小鼠肿瘤抑制作用研究[J].黑龙江医药科学,2010,44(2):62-63.
[11] 代培培,陈剑群,刘军权,等.金丝桃苷增强共刺激细胞杀伤胃癌细胞MKN-45的研究[J].国际免疫学杂志,2014,37(3):242-249.
[12] Urrea Moreno R,Gil J,Rodriguez-Sainz C,etal.Functional assessment of perforin C2 domain mutations illustrates the critical role for calcium-dependent lipid binding in perforin cytotoxic function[J].Blood,2009,113(2):338-346.
[13] Prakash MD,Bird CH,Bird PI.Active and xymogen forms of granzyme B are constitutively released from cytotoxic lymphocytes in the absence of target cell engagement[J].Immunol Cell Biol,2009,87(3):249-254.
[14] Betts MR ,Brenchley JM,Price DA,etal.Sensitive and viable identification of antigen specific CD8+T cells by a flowcytometric assay for degranulation [J].J Immunol Methods,2003,281(1-2):65-78.
[15] Schroder K,Hertzoq PJ,Ravasi T,etal.Interferon-gamma:an overview of signals,mechanisms and functions[J].J Leukoc Biol.2004,75(2):163-189.
[收稿2015-06-25 修回2015-07-29]
(编辑 倪 鹏)
Enhancement of γδT cells proliferation and cytotoxicity by Hyperoside
LI Ying,ZHOU Yu,SUN Lei-Qing,ZHOU Zhong-Hai,LÜ Xiao-Ting,Xu Ming, LI Yi,LIU Jun-Quan.Biological Therapy Center,the 97 Hospital of Chinese PLA,Xuzhou 221004,China
Objective:To investigate the anti-tumor effect of Hyperoside.Methods: Human γδT cells were amplified by isopentenyl pyrophosphate from peripheral blood cells.The proliferation capacity of γδT cells was measured with CCK-8 assay after treated with different concentrations of Hyperoside.Cytotoxicity of γδT cells was detected with LDH assay,and the expression of granzyme,perforin CD107a and IFN-γ on γδT cells were measured by flow cytometry before and after treatment.Results: Hyperoside could significantly stimulate the proliferation of γδT cells at the concentration of 3.13-12.5 μg/ml.Cytotoxicity and expression of granzyme,perforin and IFN-γ of γδT cells were increased after treatment.Conclusion: Hyperoside could enhance cytotoxicity of human γδT cells through up-regulation of granzyme,perforin CD107a and IFN-γ expression.
Hyperoside;γδT cells;DU-145 cell;Cytotoxicity
10.3969/j.issn.1000-484X.2016.04.016
①本文为南京军区医学科技创新课题(11MA040)资助项目。
李 莹(1986年-),女,护师,主要从事护理工作,E-mail:115530179@qq.com。
及指导教师:刘军权(1960年-),男,副主任技师,主要从事肿瘤生物治疗研究,E-mail:595716758@qq.com。
R979.5
A
1000-484X(2016)04-0524-04
②并列第一作者。
③解放军第九七医院干部病房,徐州221004。
④解放军第九七医院检验科,徐州221004。
