正常组与人工模拟寒环境组大鼠肺组织蛋白组学差异分析
2016-12-13刘芳芳李俊莲马彦平张晓薇李艳彦张维骏陶功定
王 平 刘芳芳 李俊莲 马彦平 张晓薇 李艳彦 张维骏 陶功定
(山西中医学院,太原030619)
正常组与人工模拟寒环境组大鼠肺组织蛋白组学差异分析
王 平 刘芳芳 李俊莲 马彦平 张晓薇 李艳彦 张维骏 陶功定
(山西中医学院,太原030619)
目的:探讨正常组与人工模拟寒环境组大鼠肺组织蛋白组学差异表达及质谱分析。方法:选取20只SD大鼠随机分为正常对照组与寒环境组,每组10只。寒环境组模型复制使用人工气候箱:(T)=(6±2)℃,每天刺激4 h(其余时间为正常组温湿度);正常组(T)=(21±2)℃,每天持续24 h。造模7 d后,两组大鼠于麻醉前12 h禁食、禁水,称量体重。麻醉后开胸取出左肺组织10 mg /只,每组取3个样本进行样品蛋白质制备、双向电泳实验、图像分析、质谱检测。结果:对两组差异蛋白图谱进行蛋白质组学分析,鉴定出9个蛋白在两组之间差异表达,寒环境组与正常对照组比较,其中4个表达上调、5个表达下调。结论:通过蛋白质组学分析,鉴定出的蛋白与外寒环境有相关性。
寒环境;肺组织;蛋白组学;差异分析
1 材料与方法
1.1 材料
1.1.1 主要试剂 CHAPS、尿素、丙烯酰胺、三羟甲基氨基甲烷、硝酸银、二硫苏糖醇(DTT)、碘乙酰胺(-20℃保存)、TEMED、痕量溴酚蓝、IPG胶条等。
1.1.2 主要仪器设备 冷冻离心机、固相pH梯度等电聚焦仪、垂直板电泳仪凝胶图像扫描仪、MALDI-TOF-MS(Bruker公司的Auto-Reflex型质谱仪)等。
1.1.3 动物分组与造模 适应性饲养7 d后,将20只SD大鼠随机分为正常对照组与人工模拟寒环境组,每组10只。自由进食饮水。参照文献[1]方法,使用人工气候箱模拟寒环境气候,将大鼠置于环境相应的人工气候箱内,寒环境组:(T)=(6±2)℃,每天刺激4 h(其余时间为正常组温湿度);正常组:(T)=(21±2)℃,每天持续24 h。
1.2 实验方法
1.2.1 试剂配制 组织裂解液、Bradford贮存液、Bradford工作液、Tris-HCl(pH8.8)、13%聚丙烯酰胺凝胶、0.5%琼脂糖封胶液、0.05%考染液(W/V)、考染固定液、考染脱色液、银染液、5%TFA、5×电泳缓冲液(Tris-甘氨酸-SDS)、CCA基质用溶剂、脱盐液、洗脱液、饱和CCA溶液等。
1.2.2 双向电泳蛋白质样品的制备 每组各取3只大鼠肺组织10 mg,液氮研磨至细粉状后称取0.1 mg,加入裂解液950 μl与蛋白酶抑制剂19 μl,超声破碎后加入RNAase与DNAase各10 μl,冰浴、4℃离心各20 min,取上清液,放置冰箱(-80℃)保存。
蛋白质定量:在1.5 ml Eppendorf管内分别加入牛血清白蛋白(BSA,2 mg/ml)1 μl、2 μl、至20 μl,后加双蒸水至100 μl,并设复管。调零后加100 μl双蒸水、1 ml Bradford摇匀。紫外分光光度计595 nm读吸光度值并绘制标准曲线。
1.2.3 双向电泳 第一向固相pH梯度等电聚焦:提取蛋白和重泡涨液(8 mol/L尿素、0.5%IPG缓冲液1.75 μl、2%CHAPS、痕量溴酚蓝、20 mmol/L DTT 7 μl)混合,总体积为350 μl,加入IPG胶槽中,为避免样品溶液中产生气泡,因此使用加样枪时应小心地滴入胶槽中并将IPG干胶的胶面朝下放入胶槽内,盖好胶槽盖之前取1 ml覆盖油覆盖IPG胶条,后将胶槽置于固相pH梯度等电聚焦仪上。20℃设定程序进行重泡涨与等电聚焦,20 h总电压时间积80 000 Vh。
第二向垂直平板电泳:将平衡好的IPG胶条转移至13%的聚丙烯酰胺均胶顶端,为使二者紧密接触,因而尽量排除气泡。蛋白质分子量Marker置于碱性端旁,放置时与胶条平行,同时用0.5%琼脂糖封胶、循环水(18℃)冷却。
1.2.4 银染与考马斯亮蓝染 SDS-PAGE胶依次经过固定30 min、增敏30 min、水洗3×5 min、反应20 min、显影、终止等步骤。银染结束后将凝胶板置于固定液中固定,脱色液中过夜。
1.2.5 采集蛋白图像 设置参数后启动扫描程序,进行扫描灰度尺并矫正亮度、修正图像(角度矫正、噪声过滤等)。最后将图像发送至ImageMaster的软件分析程序,图像分析。
1.2.6 双向凝胶电泳图像分析 检测:确定被检测的点,通过调整改变参数(算子数、灵敏度等)、手工编辑等工作检测出图像中所有的点。
背景扣除:在点密集处设置抽样区域,依次使用计算机完全自动化背景扣除(非点模式)和手工背景扣除。
匹配:为比较不同凝胶中的蛋白表达情况,需要在已经进行完点校正检测的凝胶之间找出代表同一蛋白质的点,然后激活匹配按钮并观察重叠匹配的效果及趋势。
标准化:激活标准化导航、设定参数、查看实验数据,根据各点的检测值进行不同凝胶之间的精确对比。
图像校正:第一、对所有凝胶进行校正光强度校正。第二、单向校正。第三、双向校正。建立凝胶和点的实验数据报告
1.2.7 差异点的标示 将鉴定出来的差异蛋白点标示在相对应的分析胶(银染2-DE图)上,下调用阿拉伯数字表示,上调用阿拉伯数字后加“,”表示以示区别。
1.2.8 肽质量指纹图谱鉴定蛋白质 切胶:使用消毒过的刀片将凝胶切成小胶块(约1~2 mm3)并反复清洗。
脱色与干胶:将小胶块置于100~200 μl的溶液内(50%乙腈、25 mmol/L NH4HCO3)振荡直至胶片中的蓝色完全褪净,后将胶块放置在真空离心干燥机内干燥至体积缩小成近似球状。整个过程约50 min。
酶切与肽段提取:把3~7 μl胰蛋白酶酶液加在干燥好的胶块上,待酶液完全被吸收后加5 μl NH4HCO3溶液保湿,37℃温浴18~20 h。反复收集酶切后的上清并将上清液合并离心干燥。
PMF图像收集及在线检索:所有的PMF质谱图都是使用布鲁克道尔顿公司的Bruker Auto-REFLEX的MALDI-TOF-MS。仪器设置:20 kV,正离子,基质用CCA,内标按照胰蛋白酶自切峰2163.05为校正标准,外标为7种标准肽段的混合物:Angiotesin_Ⅱ_[M+H]+_mono:1046.54;Angiotesin_Ⅰ_[M+H]+_mono:1296.68;Substance_P_[M+H]+_mono:1347.74;Bombesin[M+H]+_mono:1619.82;ACTH_clip(1-17)[M+H]+_mono:2093.09; ACTH_clip(18-39)[M+H]+_mono:2465.20;Somatostatin(28)[M+H]+_mono:3147.47。
最后得到的质谱数据用Mascot(http://www.matrixscience.co.uk)软件在NCBInr数据库内进行检索。检索参数设置为:Database——NCBInr;Taxonomy——Mus Enzyme——Trypsin;Allow up to——1;Variable modifications——Carbamidonethyl(C)和Oxidation(M);Peptide tol.+——0.3.通过PMF鉴定蛋白质可以根据分子量、等电点、肽段匹配数、序列覆盖率以及软件所给分值来最后判断是否是我们所要鉴别的蛋白,如果PMF不能鉴定就进一步采用MS/MS鉴定。
1.3 统计学方法 第一、运用Newman-Keuls方法进行检验不同样本之间的各蛋白点的表达量,并判定是否具有统计学意义。第二、运用Fisher exact的方法来判定相应的差异蛋白点是否可作为标志蛋白,是否具有统计学意义。P<0.05为差异具有统计学意义。
2 结果
2.1 正常组(A组)与寒环境组(E组)蛋白质组差异图像分析 见图1,A组和E组匹配率73.80%。
2.2 正常组与寒环境组比较的差异蛋白质斑点 共计有9个蛋白质斑点在两组之间表达差异,差异点分布在pI3.0~10.0、分子量14.0~97.0 kD之间。见图2。
2.3 正常组与寒环境组差异点小结 与正常对照组相比,寒环境组差异斑点中表达上调的斑点编号是1,5,8,9;表达下调的斑点编号是2,3,4,6,7。见表1。
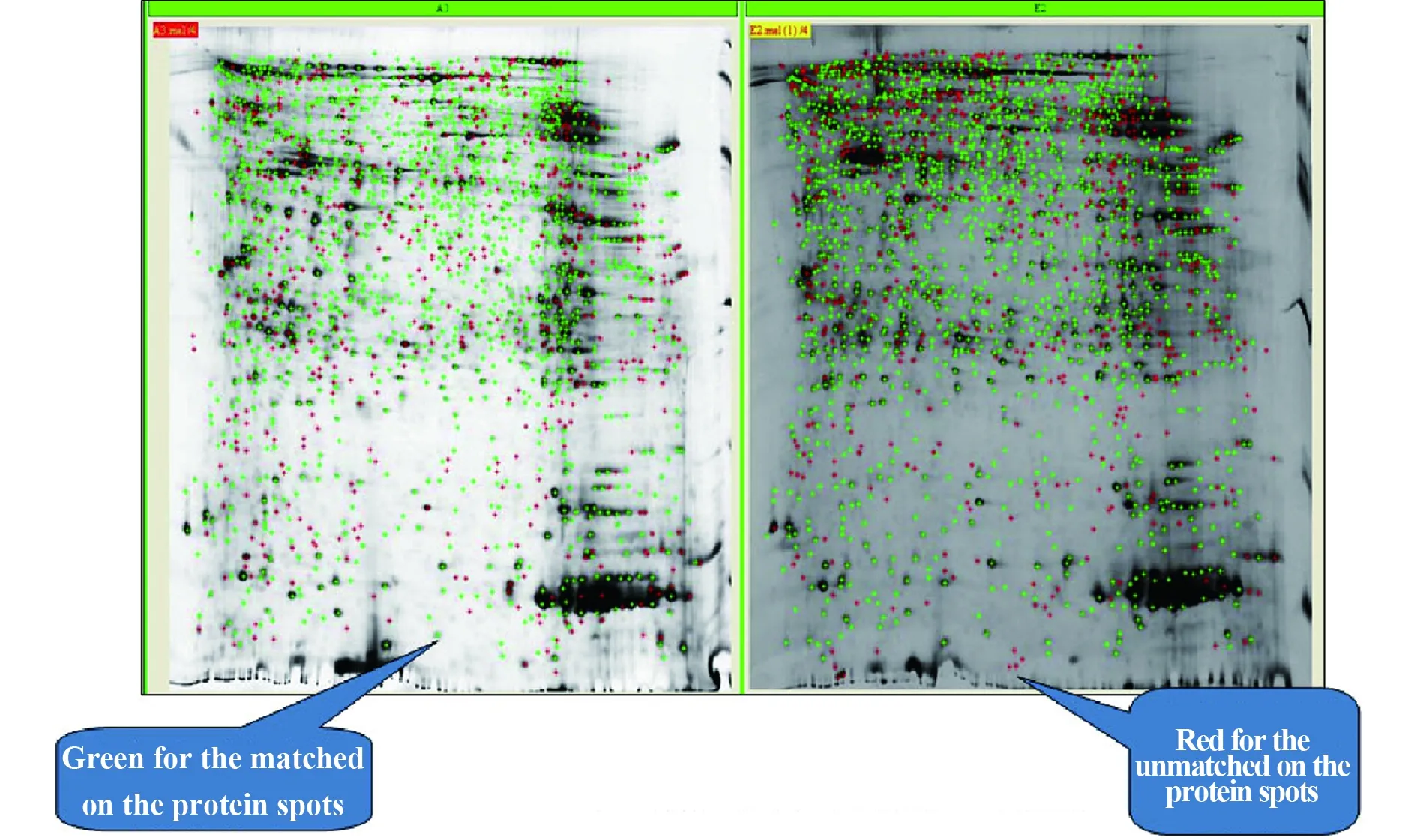
图1 A组与E组蛋白质组差异图像分析(ImageMaster 2D platinum软件)Fig.1 Image analysis of difference between A group and E group
2.4 正常组与寒环境组比较的差异蛋白质功能 热休克蛋白70(Heat shock protein 70,HSP70)是膜结构相关蛋白,主要的生物学作用是因其能结合靶蛋白的疏水片段从而防止肽链的错误盘绕。当细胞受到有害刺激或者环境变化时,细胞的部分结构和功能蛋白就会发生变性[2]。由于HSP70在心脑血管病中对心肌细胞和脑细胞有明显的保护作用[3,4],因而HSP70与临床上多种疾病关系非常密切,例如心脑缺血、癫痫、多发性硬化、感染、肿瘤等。同时它还可以激发抗肿瘤细胞的特异性反应,结合细胞内的全部异常肽库,因而 HSP70-肽疫苗可以是多价的,这不但对于防止免疫逃逸从而增强免疫效果是有利的,同时为肿瘤疫苗开发也提供了新的思路[2]。还有报道指出HSP70有可能是某些致病菌的致病因素[5]。
角蛋白-细胞骨架Ⅰ型10(Keratin,type Ⅰ cytoskeletal 10,CK10)、角蛋白-细胞骨架Ⅱ型1(Keratin,type Ⅱ cytoskeletal 1,CK1),细胞角蛋白在不同表皮及皮肤附属器肿瘤的表达随不同病变和肿瘤而有所变化,但特异性的CK组型仍保持不变[6]。肿瘤的鉴别诊断中常常采用不同细胞角蛋白的联合表达分析。其中最常用、最有价值的一组CK是CK7/CK20[6]。
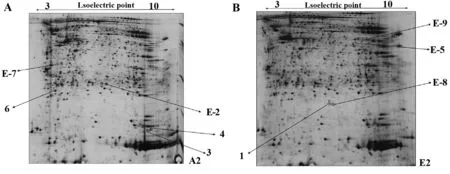
图2 差异蛋白质斑点位置Fig.2 Location of differential protein spotsNote: A.Sample 2 of E group;B.Sample 2 of A group.
表1 正常组与寒环境组比较的差异蛋白质斑点列表
Tab.1 Differential protein spots in normal control group and cold enviroment group

No.ProteinnameAccessionNo.MascotscoreCoveragePIMW1Eukaryotictranslationinitiationfactor5A-1isoformBgi|450354513735%5.08168215Heatshockprotein70cognategi|309319133028%5.37707938Keratin,typeⅠcytoskeletal10gi|35169870830615%4.87537279Argininosuccinatesynthasegi|2545341422417%7.63464672Keratin,typeⅡcytoskeletal1gi|35169507055114%6.39650363Keratin1gi|73312181689%8.16659784ChainE,StructureoftheTypsin-BindingdomainofBowman-Birktypeproteasegi|23033812714%8.69232906Inhibitoranditsinteractiongi|127140111558%4.96212697Withtrypsinmyosinlightchain4Guanicedeaminasegi|991070653126%5.5650984
鸟嘌呤脱氨酶(Guanine deaminase,GD)在嘌呤类分解代谢过程中起着重要的作用,主要是因为它催化鸟嘌呤水解脱氨同时生成黄嘌呤,所以GD是体内十分重要的氨基水解酶。所以在临床上如需判断老年慢性肝病患者肝细胞损坏的情况,可以检测血清中GD的活性变化,它可以作为监测肝细胞损害的敏感指标。
3 讨论
目前,蛋白组学技术在中医基础理论中有关病证、发病研究中的实际应用还未见报道。本实验通过对正常组与寒环境组大鼠的肺组织双向凝胶电泳的差异分析,同时结合软件分析和手工筛选,我们在以上2-DE凝胶上从表达差异蛋白质点中选取点清晰且表达水平改变明显的蛋白质点作为最终质谱鉴定的对象,利用PMF的方法鉴定了3个与寒证可能相关的差异表达的蛋白质。其中在寒环境组大鼠肺组织中高表达的有:热休克蛋白70、角蛋白-I细胞骨架10、鸟嘌呤脱氨酶GD;在正常组高表达的是角蛋白-II型细胞骨架1、角蛋白1、肌球蛋白轻链4。
热休克蛋白是在进化过程中有高度保守性的应激蛋白,对维持机体的自身稳定性起着重要作用。热休克蛋白70在应激状态下可显著升高,在人的单核细胞中诱导前炎症反应[7],且有研究显示某些病原微生物的HSP70具有强抗原性,可以作为疫苗的候选成分[8,9]。HSP70有可能是某些致病菌的致病因素[10],对病原体的攻击产生保护性免疫应答[11]。另有报道指出,细菌感染时,hsp70 是其主要抗原[12],免疫系统对这些高度保守的分子产生免疫应答。本实验研究结果显示,在寒邪组大鼠肺组织中HSP70表达上调,我们推测可能是因为寒邪侵袭机体,引起机体的应激反应,从而出现HSP70的高表达,以提高机体的应激耐受能力。
本实验选取人工模拟寒环境大鼠作为研究对象,选取正常大鼠作为对照,进行大鼠肺组织蛋白质组学的研究,寻找两组大鼠差异蛋白的交集。初步证实了此种差异蛋白质交集的存在,并且此种差异蛋白质的功能主要涉及机体免疫应答,其中热休克蛋白在寒环境组的高表达初步认为可能是寒邪侵袭机体,从而引起机体的应激反应,以提高机体的应激耐受能力。
[1] 章 敏,陈 刚,张六通,等.六淫湿邪动物模型研究[J].湖北中医杂志,2007,29(9):5.
[2] 黄 芸.不同热休克蛋白的比较及其与中医药的关系[J].中华中医药学刊,2010,28(4):718-720.
[3] 陈秀莲,孙 林,于培兰,等.热休克蛋白70与缺血性脑损伤[J].中国临床康复,2006,10(24):137-139.
[4] 许丽丽,石武祥,邬堂春.热休克蛋白 70与心肌炎的关系研究进展[J].现代预防医学,2008,35(3):406-408.
[5] 陈裕充,温 海,李志刚,等.新生隐球菌临床分离株热休克反应的差别及临床意义[J].第二军医大学学报,2002,23(4):433-436.
[6] 孙 莉.细胞角蛋白检测在皮肤上皮性肿瘤诊断中的应用[J].中国麻风皮肤病杂志,2005,21(7):543-545.
[7] Lepore DA,Hurley JV,Stewart AG,etal.Prior heat st-ress improves survival of ischemi creperf used skeletal muscle in vivo [J].Muscle Nerve,2000,23:1847-1855.
[8] Kakey AH,Udono H,Ikuno N,etal.A77-kilo-dalt on prot-ein of Crypt ococcus neoformans,a member of the heats hock protein 70 family,is a major antigen detected in the sera of mice with pulmonary crypt ococcosis[J].Infect Immun,1997, 65(5):1653-1658.
[9] Brunham RC,Peeling R,Maclean I,etal.Postabortal Chlamydiat rachomat is salpingitis:correlating risk with antigen-specif icsero-logical responses and with neutralizat ion[J].J Infect Dis,1987,155(4):749-755.
[10] Bonorino C,Nardin B,Zhang X,etal.Charact eristics of the strong antibody response tomy cobacterial Hsp70:a primary,T cell dependent IgG response with no evidence of natural priming or-gamma delta T cell involvement [J].J Immunol ,1998,161(10):5210-5216.
[11] Bu rleigh BA,Andrews .The mechanism of Tryp anosomacruzi invasion of mammalian cells[J].Annu Rev Microbiol,1995,49:175.
[12] Lisa AE,Elizabeth GI,Ju lie MC,etal.The adjuvant effects of Mycobacterium tuberculosis heat shock protein 70 result form the rapid and prolonged activation of an tigen-specific CD8+T cells in vivo[J].J Immunol,2002,169:5622-5629.
[收稿2015-04-09 修回2015-05-21]
(编辑 张晓舟)
Normal group and artificial simulation of cold environment proteomics of lung tissue of rats variance analysis
WANG Ping,LIU Fang-Fang,LI Jun-Lian,MA Yan-Ping,ZHANG Xiao-Wei,LI Yan-Yan,ZHANG Wei-Jun,TAO Gong-Ding.Shanxi College of Traditional Chinese Medicine University,Taiyuan 030619,China
Objective:To analyse and discuss the variance and mass spectrometry of proteomics of rats' lung tissues between groups of normal and simulated cold environments.Methods: A total of 20 SD rats were randomly divided into two groups of normal and simulated cold environments with 10 rats in each group.The temperature of normal environment group was controlled in 21℃ with a fluctuation of 2℃ lasting 24 h per day.In contrast, the temperature of simulated cold environment group was controlled in 6℃ with a fluctuation of 2℃ lasting 4 h per day while the temperature and humidity for the rest of time were exactly the same as the situation in normal environment group.The preoperative fasting, water-deprivation and weighting were adopted 12 h before anaesthesia to both groups after the continuing 7-day experimentation.Left lung tissues of each rat in both groups were removed by the amount of 10 mg, whereas three random samples from each group were tested by experiments of protein extraction, bidirectional electrophoresis, image analysis and mass spectrometry identification.Results: Given the proteomics analysis of two differential sets, it is indicated that in simulated cold environment group, among nine sorts of protein, four sorts perform rising while five falling compared to that of normal group.Conclusion: There exists a correlation between protein and cold environment based on the results of proteomic analysis.
Cold environment;Lung tissues;Proteomics;Variance analysis
10.3969/j.issn.1000-484X.2016.04.008
王 平(1977年-),女,博士,讲师,主要从事《黄帝内经》生态医学思想研究。
及指导教师:陶功定(1955年-),男,博士,教授,主要从事《黄帝内经》生态医学思想研究,E-mail:taogongding_22@163.com。
R22
A
1000-484X(2016)04-0486-04
