MicroRNA-199a/b-3p抑制三阴乳腺癌细胞增殖机制研究①
2016-12-13王子航王志成张嘉星范运达康劲松米旭光
王子航 王志成 张嘉星 范运达 康劲松 米旭光
(吉林大学临床医学院,长春130021)
MicroRNA-199a/b-3p抑制三阴乳腺癌细胞增殖机制研究①
王子航②王志成 张嘉星 范运达 康劲松③米旭光④
(吉林大学临床医学院,长春130021)
目的:探讨microRNA-199a/b-3p(miR199)抑制三阴乳腺癌细胞增殖存活的作用机制。方法:在三阴乳腺癌细胞BT549、MDA-MB-231转染miR199,荧光定量检测miR199表达量;MTT法检测转染miR199对三阴乳腺癌细胞存活率的影响;细胞周期分析检测,转染miR199对在乳腺癌细胞细胞周期的影响。结果:超表达miR199后,三阴乳腺癌细胞BT549、MDA-MB-231的增殖率分别下降(41.02±2.34)%和(28.42±6.70)%,细胞周期均被阻滞在G1期。结论:miR-199a/b-3p抑制三阴乳腺癌增殖,具有抗三阴乳腺癌增殖药物开发的潜质。
三阴乳腺癌;microRNA-199a/b-3p;增殖
自1991~2010年间,乳腺癌死亡率增长了32.89%,成为死亡率增长最快的癌症,其发病率位居大城市女性肿瘤的第一位[1]。近年来,我国乳腺癌发病率的增长速度已高出原高发国家1~2个百分点,且呈明显的年轻化趋势,每年有16.9万妇女患乳腺癌[2]。根据乳腺癌分子分型,三阴乳腺癌为雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER2)均为阴性表达的乳腺恶性肿瘤,约占所有乳腺癌病理类型的10%~17%[3],相对非三阴乳腺癌,三阴性乳腺癌无分子治疗靶点,内分泌治疗无效;恶性度高,应用化疗药物治疗则敏感率低、副作用大,且预后差,易复发和转移[4]。因此需找新的治疗靶点和手段是三阴乳腺癌研究中的热点,本研究拟通过外源转入microRNA-199a/b-3p对三阴性乳腺癌增殖进行抑制,以达到抗癌的目的。
1 材料与方法
1.1 材料
1.1.1 细胞培养相关材料 三阴乳腺癌BT549、MDA-MB-231细胞,使用含10%胎牛血清(四季青生物公司,中国)的DMEM培养基(Invitrogen,USA),添加含青霉素 100 U/ml,链霉素 100 μg/ml,37℃ 5%CO2条件下培养,细胞生长至对数期时传代。
1.1.2 主要实验试剂耗材 microRNA-199a-3p mimcs(Biomics,中国)、细胞周期与细胞凋亡检测试剂盒(碧云天生物技术研究所,中国)、Lipofecta-mineTM2000(Life Technologies公司,美国)、MTT(Sigma-Aldrich公司,美国)、SYBR GREEN Master mix(Roche,瑞典)、其他常规试剂(北京化工,中国)。
1.2 方法
1.2.1 细胞的转染(脂质体法) 在转染前24 h,1×106/孔在6孔细胞培养板中接种细胞。转染前将细胞培养液换成不含抗生素不含血清的不完全培养液。将待转染miRNA mimics按说明书加入到250 μl双无培养液中,吹打混匀。同时,将5~10 μl脂质体加入到250 μl双无培养液中,吹打混匀。室温静置5 min后,将两者混匀。室温孵育20 min后,将混合液加入到待转孔中并混匀。培养5 h后,将细胞培养液换成完全培养液。
1.2.2 荧光定量分析 以Trizol法提取细胞RNA,逆转录成cDNA,以SYBR荧光染料定量检测miR-199表达量。根据试剂说明书添加各组分后,95℃预变性30 s,然后40循环的扩增反应(95℃ 5 s,60℃ 34 s),同时融解曲线分析。结果以2-△△Ct表示mRNA拷贝数比值。
1.2.3 细胞增殖分析 将处于生长对数期的细胞消化成单细胞悬液,以0.5~1×104个细胞/孔接种于96孔细胞培养板中。过夜培养后,更换新鲜培养基,每孔100 μl。按转染方法向细胞中加入脂质体-待转染物混合物,每组设三个复孔,同时设对照组,5 h后更换培养基。培养48 h后,每孔加入20 μl MTT溶液(MTT浓度为5 μg/ml的PBS溶液),37℃避光培养4 h后,移除培养液,每孔加入100 μl DMSO,水平振荡10 min,放入酶标仪中检测波长570nm处的光吸收值。代入下述公式计算细胞存活率:细胞存活率(%)=(实验组吸光值-空白孔吸光值)/(对照组吸光值-空白孔吸光值)×100%。实验独立重复三次后,将各转染组的细胞存活率导入SPSS软件,计算P值。
1.2.4 细胞周期分析 将PBS清洗过的待测细胞收集到15 ml尖底离心管中,1 000 r/min离心5 min。弃上清液后用70%乙醇重悬细胞,4℃固定24 h。1 000 r/min离心5 min,移除固定液,加入PI染液,重悬细胞。室温避光30 min后用流式细胞仪进行细胞周期分析。
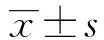
2 结果
2.1 三阴乳腺癌细胞中miR-199a/b-3p表达量分析 在三阴乳腺癌BT549和MDA-MB-231细胞中,miR-199mimcs转染组的miR-199表达量分别是对照组的(22.33±0.86)倍和(24.43±0.91)倍,均显著高于对照组(P<0.01,图1)。
2.2miR-199抑制三阴乳腺癌细胞增殖miR-199mimcs转染24h后,三阴乳腺癌BT549和MDA-MB-231细胞的增殖率分别下降(41.02±2.34)%(图2A)和(28.42±6.70)%(图2B),均显著低于对照组(P<0.01)。
2.3miR-199诱导三阴乳腺癌细胞G1期阻滞 应用流式细胞术细胞周期分析检测miR-199抑制三阴乳腺癌细胞增殖的机制。三阴乳腺癌BT549和MDA-MB-231细胞中miR-199转染组G0/G1期细胞所占比例为(75.10±3.09)%和(68.61±3.07)%,与对照组(50.58±1.15)%和(46.39±2.81)%相比均显著上升(P<0.05)(图3),说明转染miR-199可以将三阴乳腺癌细胞阻滞在G1期。

图1 三阴乳腺癌细胞中miR-199表达量分析Fig.1 Expression of miR-199 in TNBC cellsNote: *.P<0.01.
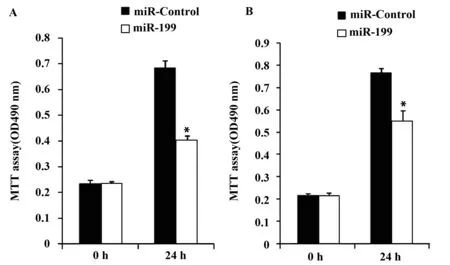
图2 miR-199抑制BT549(A)和MDA-MB-231(B)增殖Fig.2 Proliferation of BT549 and MDA-MB-231 (B) inhibited by miR-199Note: *.P<0.01.

图3 miR-199对BT549(A)和MDA-MB-231(B)细胞周期的影响Fig.3 Cell-cycle(G0/G1,S and G2/M)analysis of BT549 (A)and MDA-MB-231(B) transfected with miR-199Note: *.P<0.05.
3 讨论
我国乳腺癌发病率位居大城市女性肿瘤的第一位,死亡率增长迅速,乳腺癌已成为对妇女健康威胁最大的疾病[5]。现在乳腺癌的治疗药物以蒽环类、紫杉类、诺维本和健择为主导,对于偏晚期乳腺癌新辅助化疗、新辅助内分泌治疗将成为常规治疗方法进入临床[6]。依据乳腺癌基因表达特征,将乳腺癌分为5个亚型:包括导管A型(LuminalA型),导管B型(LuminalB型),HER-2过表达型(HER-2+型),基底细胞样型(Basal-like型)和正常型(Normal-like型)五型[7]。三阴乳腺癌(TNBC)指的是雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER-2)表达均为阴性的乳腺癌,约占全部乳腺癌类型的10%~17%[8]。内分泌治疗及针对HER-2的分子靶向治疗对于三阴乳腺癌无效,目前治疗中的主要手段为化疗,但预后较差[9]。MicroRNA(miRNA)非编码单链的小分子RNA,具有转录后调节功能,其异常表达与多种肿瘤的发生发展密切相关[10]。因此,miRNA在肿瘤诊断、肿瘤分型、预后判断及基因治疗中的作用越来越受到关注。
在多种肿瘤细胞中,MiR-199a/b-3p呈现低表达,恢复miR-199a/b-3p表达可抑制肿瘤细胞的增殖,转移等[11,12]。因此,本研究拟探究miR-199a/b-3p对三阴乳腺癌增殖的影响及相应机制。在三阴乳腺癌BT549和MDA-MB-231细胞中超表达miR-199a/b-3p后,细胞的增殖明显下降,说明miR-199a/b-3p具有抑制三阴乳腺癌细胞增殖的能力,与其在肝癌、骨肉瘤和肾癌细胞中作用相同[11,13]。细胞周期分析发现超表达miR-199a/b-3p后,BT549和MDA-MB-231细胞中G0/G1期细胞所占比例显著增加,说明miR-199a/b-3p将三阴乳腺癌细胞的细胞周期进程阻滞在G0/G1期,这与其在其他类型肿瘤中的机制相同,相关分子机制可能与miR-199a-3p抑制mTOR、BCAR3、cMET或Brm等蛋白表达相关,但不排除还与抑制其他基因相关。进一步研究miR-199a-3p抑制三阴乳腺癌增殖的分子机制,可为三阴乳腺癌治疗新靶点的发现提供较高的理论基础,并具有一定的临床价值。
[1] 石晓君,张晓佳,王富生,等.1990-2010年中国女性乳腺癌的死亡分布特征[J].中华疾病控制杂志,2012,16(9):743-747.
[2] 郑 莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561-569.
[3] 胡 彦.三阴乳腺癌患者预后生存因素临床分析[J].中外医疗,2015,34(10):67-68.
[4] 曹 静,吕志排,雷冬梅,等.乳腺癌的分子分型与临床病理特征及预后的关系[J].诊断学理论与实践,2013,12(4):466-469.
[5] 令狐锐霞,司 文,李 莹,等.3846例乳腺癌流行病学及临床病理学分析[J].解放军医学院学报,2015,36(10):1017-1021.
[6] 钟辉凤,陈晓品.三阴乳腺癌治疗现状[J].现代医药卫生,2015,31(4):488-490.
[7] Lin NU,Vanderplas A,Hughes ME,etal.Clinicopathological features and sites of recurrence according to breast cancer subtype in the National Comprehensive Cancer Network(NCCN)[J].J Clin Oncol,2009,27(15):543-546.
[8] 邱正才.三阴乳腺癌的特征及治疗现状[J].吉林医学,2015,36(13):2766-2767.
[9] 陈玉娟,王晓东,汪 静.三阴乳腺癌的特征及治疗现状[J].中国普外基础与临床杂志,2012,19(9):113-116.
[10] Yates LA,Norbury CJ,Gilbert RJ.The long and short of microRNA[J].Cell,2013,153(3):516-519.
[11] 陶良俊,秦 超,曹 强,等.MicroRNA-199a-3p在肾癌中的表达及作用[J].现代泌尿生殖肿瘤杂志,2012,4(4):229-232.
[12] 王子航,李春实,康劲松,等.microRNA-199a/b-3p对乳腺癌细胞运动能力的影响[J].中国免疫学杂志,2015,31(9):1242-1244.
[13] Hou J,Lin L,Zhou W,etal.Identification of miRNomes in human liver and hepatocellular carcinoma reveals miR-199a/b-3Pas therapeutic target for hepatocellular carcinoma[J].Cancer Cell,2011,19(2):7065-7070.
[收稿2015-11-28 修回2016-01-27]
(编辑 张晓舟)
Effect of miR-199a/b-3p on cell proliferation of TNBC cells
WANG Zi-Hang,WANG Zhi-Cheng,ZHANG Jia-Xing,FAN Yun-Da,KANG Jin-Song,MI Xu-Guang.Clinical Medical College,Jilin University,Changchun 130021,China
Objective:To analyze the inhibiting mechanism of microRNA-199a/b-3p(miR-199)on cell proliferation of triple negative breast cancer(TNBC)cells.Methods: Expression of miR199 in BT549 and MDA-MB-231 cells transfected with miR-199a/b-3p was detected by qRT-PCR.The proliferation of BT549 and MDA-MB-231 cells transfected with miR-199 were analysed by MTT assay.Cell cycle of TNBC cells transfected with miR-199 was detected by Flow Cytometry assay.Results: MiR-199a/b-3p could suppress the proliferation of BT549 and MDA-MB-231 cells.Comparing with normal control,the proliferation rate were up to(41.02±2.34)% and(28.42±6.70)%,and the cell cycle were arrest at G1 phase.Conclusion: MiR-199a/b-3p could suppress the proliferation of TNBC,and may be a promising anti-cancer drug for TNBC.
TNBC;microRNA-199a/b-3p;Proliferation
10.3969/j.issn.1000-484X.2016.04.006
①本文受吉林大学“大学生创新创业训练计划”创新训练国家级培育项目(No. 2015791141)、吉林省科技厅青年基金项目(No.20150520047JH)、吉林省卫生计生科研计划(No.2014Z013)资助。
王子航(1994年-),男,临床医学专业2012级本科,主要从事抗肿瘤机制的研究,E-mail:1456825616@qq.com。
及指导教师:康劲松(1969年-),男,博士,副教授,主要从事肿瘤病理生理的研究,E-mail:kangjs@jlu.edu.cn。 米旭光(1983年-),男,博士,助理研究员,主要从事肿瘤靶向治疗研究,E-mail:mixg699@163.com。
R735.7
A
1000-484X(2016)04-0480-03
②延边大学医学院,延吉 133002。
③吉林大学基础医学院病理生理教研室,长春 130021。
④吉林省人民医院医学诊治实验中心,长春 130021。
