异柠檬酸脱氢酶作为肺癌标志物的临床意义
2016-12-06周喆炎徐开军
孙 涛 周喆炎 边 莉 徐开军 马 荟
(云南省第三人民医院病理科,云南 昆明 650011)
·肿 瘤·
异柠檬酸脱氢酶作为肺癌标志物的临床意义
孙 涛 周喆炎 边 莉1徐开军 马 荟
(云南省第三人民医院病理科,云南 昆明 650011)
目的 探讨异柠檬酸脱氢酶1(IDH1)作为肺癌标志物的临床意义。方法 RT-PCR检测收集的50例肺癌组织和对应的癌旁组织中IDH1、激活蛋白激酶C1受体(RACK1)、过氧化物氧化还原酶2(PRDX2)的表达水平。ELISA检测收集的50例肺癌患者及20例正常人血浆标本中IDH1的表达水平。以肺癌细胞A549为研究对象,转染IDH1 siRNA抑制肺癌细胞中IDH1的表达,MTT检测转染后1、2、3、4、5、6 d的肺癌细胞增殖情况。流式细胞仪检测转染后48 h的细胞凋亡情况。结果 IDH1、RACK1、PRDX2在肺癌组织中均过度表达,IDH1相对于癌旁组织表达量上调最多。20例正常人血浆中IDH1水平中位数为3.48 U/L,50例肺癌患者血浆中IDH1水平中位数为6.55 U/L,组间比较差异显著(P<0.01)。IDH1 siRNA组肺癌细胞A549细胞存活率与siRNA control组相比差异显著(P<0.05,P<0.01)。siRNA control组细胞凋亡率为0.12±0.01,与IDH1 siRNA组(0.41±0.02)比较差异显著(P<0.01)。结论 IDH1在肺癌组织和血浆中高表达。抑制IDH1可以抑制肺癌细胞增殖,促进癌细胞凋亡。IDH1可以作为肺癌标志物用于诊断肺癌。
肺癌;异柠檬酸脱氢酶1
肺癌的发生与吸烟、职业、遗传等多种因素有关。肺癌发病早期症状不明显,确诊时一般为肺癌中晚期,耽误了最佳的治疗时机。小分子标志物诊断癌症是目前研究较多的癌症诊断方法。
异柠檬酸脱氢酶(IDH)广泛存在于真核生物体内,是由IDH基因编码的一种蛋白酶〔1〕。IDH1是IDH的一种亚型,在预防应激、胰岛素分泌、射线抵御等方面具有重要作用。已经有研究表明,肺癌组织和正常的癌旁组织中 IDH1、激活蛋白激酶C1受体(RACK1)、过氧化物氧化还原酶2(PRDX2)为差异表达蛋白,而且参与了肿瘤相关信号通路的传导〔2〕。本研究通过对比肺癌细胞中IDH1、RACK1、PRDX2的表达水平,研究其对肺癌细胞的作用,以期为诊断肺癌提供新思路。
1 材料和方法
1.1 材料
1.1.1 肺癌组织、血浆样本及细胞系 肺癌组织及对应的正常癌旁组织50例,50例肺癌患者及20例正常人血浆标本均来自2011年7月至2016年7月云南省第三人民医院和昆明医科大第一附属医院,患者已签署知情协议书,组织标本和血浆标本性别年龄均无显著差异。肺癌细胞系A549购于中国医学科学院基础医学研究所基础医学细胞中心。
1.1.2 主要仪器及试剂 CO2培养箱,山东博科生物产业有限公司;超净工作台,北京中科院;倒置显微镜,日本尼康;酶标仪,北京柏迈科技有限公司;水浴锅,上海赫田科学仪器有限公司;离心机,湖南恒诺仪器设备有限公司;反转录试剂盒;RT-PCR检测试剂盒,宝生物工程(大连) 有限公司;Matrigel,上海前尘生物科技有限公司;胎牛血清(FBS),杭州四季青有限公司;PBS,碧云天生物技术有限公司;RPMI1640培养基青链霉素胰蛋白酶,上海春晓生物技术有限公司;MTT,上海前尘生物科技有限公司;IDH1酶联免疫检测试剂盒,上海易利生物科技有限公司。
1.2 方法
1.2.1 RT-PCR检测组织样本中IDH1、RACK1、PRDX2水平 收集的50例肺癌组织和对应的正常癌旁组织随机编号为1~50,每一组取0.2 g组织样本放置于组织研磨管中,加入1 ml的磷酸盐缓冲液(PBS),匀浆器研磨后转移到离心管中,3 000 r/min离心5 min后,弃上清液。在组织沉淀中加入TRIzol裂解液,充分混匀后,放置于室温下充分裂解6 min,加入200 μl氯仿,震荡混合后置于室温下静置3 min。12 000 r/min,4℃离心5 min,收集上清液。在上清液中加入600 μl的75%乙醇溶液,混匀后10 000 r/min离心5 min,弃上清液,在室温下干燥10 min,加入适量的焦碳酸二乙酯(DEPC)溶解。提取的RNA经反转录试剂盒说明书反转录合成IDH1、RACK1、PRDX2 mRNA,按照荧光定量PCR试剂盒说明书分析IDH1、RACK1、PRDX2转录水平。
1.2.2 ELISA法检测正常人和肺癌患者血浆中IDH1的表达 收集的50例肺癌患者和20例正常人血浆标本,利用双抗体夹心ELISA检测试剂盒检测血浆标本中的IDH1水平。用酶标仪检测每孔的吸光度,波长为450 nm。
1.2.3 细胞培养 取出保存于液氮罐中的肺癌细胞A549,放置于37℃的水浴锅中孵育5 min,观察冻存管中的液体全部融化后,1 000 r/min离心10 min,弃掉上清液。在细胞沉淀中加入2 ml含10%胎牛血清(FBS)的RPMI1640培养基,充分混匀,接种于6孔细胞培养板中,放置于37℃,5%CO2培养箱中培养。观察细胞融合度为90%时,弃细胞生长液,在细胞中加入PBS洗涤细胞两次,加入0.25%胰蛋白酶,放置于37℃,5%CO2培养箱中消化3 min,观察细胞呈单个存在时,加入细胞培养液,1 000 r/min离心10 min,弃酶消化液,加入PBS洗涤细胞后,加入细胞生长液,接种于细胞培养板中继续培养。
1.2.4 细胞转染 取对数生长期的肺癌细胞A549,加入0.25%胰蛋白酶消化细胞呈单个细胞,加入PBS洗涤细胞两次,放置于37℃,5%CO2培养箱中培养,待细胞融合度达到85%时,将细胞生长液更换为不含胎牛血清的不完全培养液,放置于37℃,5%CO2培养箱中孵育1 h。用不含胎牛血清的不完全培养液分别与IDH1 siRNA和siRNA control混合后,室温下静置5 min,为A液。转染试剂与不完全培养液混合后,在室温下静置20 min,为B液。A液与B液混合后,室温下静置20 min,与细胞混合后,放置于37℃,5%CO2培养箱中培养6 h,更换为含有胎牛血清的完全培养液,继续培养48 h。
1.2.5 MTT检测细胞增殖 转染IDH1 siRNA和siRNA control后的肺癌细胞A549,加入胰蛋白酶消化细胞后,用PBS洗涤细胞,1 000 r/min离心5 min,加入细胞培养液,接种于96孔细胞培养板中,调整每孔中细胞个数为20 000个,放置于37℃,5%CO2培养箱中培养4 h后,待细胞贴壁后,弃细胞生长液,更换新的细胞生长液,培养时间分别为1、2、3、4、5、6 d。加入20 μl的MTT溶液(5 mg/ml),在37℃培养箱中孵育4 h,吸除上清液,加入150 μl的DMSO溶液,避光条件下反应10 min,直至结晶物完全溶解后,酶联免疫检测仪检测各孔的吸光度(OD值),分析细胞增殖情况。
1.2.6 流式细胞仪检测细胞凋亡 转染IDH1 siRNA和siRNA control后的肺癌细胞A549培养48 h后,弃去细胞生长液,在细胞中加入0.25%胰蛋白酶消化细胞后,1 000 r/min离心细胞10 min,在细胞沉淀中加入PBS悬浮细胞后,1 000 r/min离心10 min,加入细胞生长液,使得每毫升细胞悬浮液中含有2×106个细胞。取1 ml的细胞悬浮液,2 000 r/min离心10 min,弃上清液,收集细胞沉淀,加入适量的结合缓冲液后,在细胞中加入5 μl Annexin V和5 μl PI混合,室温下孵育反应10 min后,流式细胞仪检测每组细胞凋亡情况。
1.3 统计学方法 应用SPSS22.0统计学分析软件对数据的组间比较行方差分析。
2 结 果
2.1 RT-PCR检测组织样本中IDH1、RACK1、PRDX2水平 以正常的癌旁组织中IDH1、RACK1、PRDX2水平为参照(设为1),IDH1、RACK1、PRDX2在肺癌组织中均过度表达(分别为3.09±0.15,2.16±0.17,2.20±0.11),IDH1相对于癌旁组织表达量上调最多,故选用IDH1进行后续研究。
2.2 ELISA检测肺癌患者和正常人血浆中IDH1水平 20例正常人血浆中IDH1水平中位数为3.48 U/L,50例肺癌患者血浆中IDH1水平中位数为6.55 U/L,组间比较差异显著(P<0.01)。见图1。
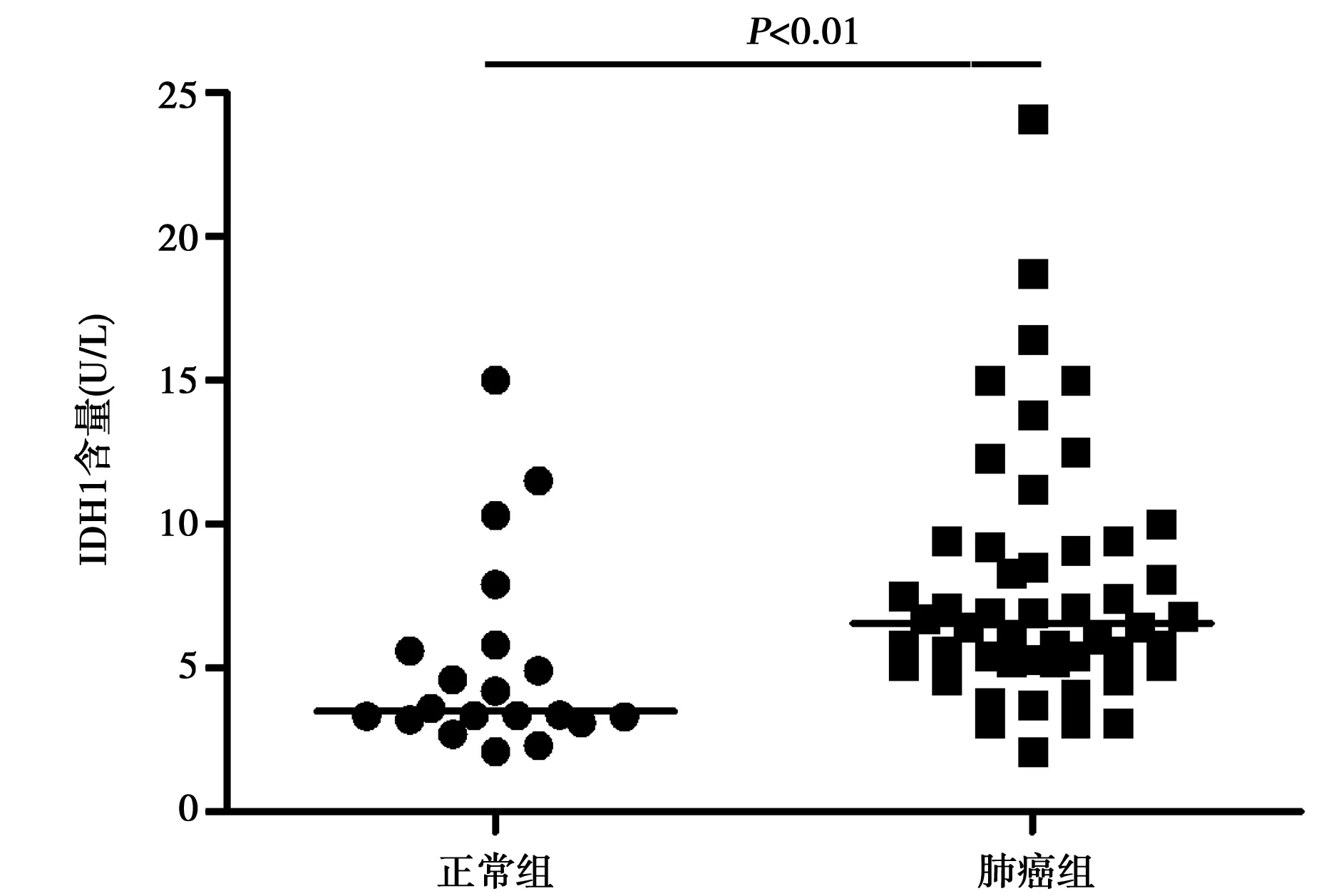
图1 正常人和肺癌患者血清中IDH1含量
2.3 MTT检测细胞增殖结果 IDH1 siRNA组肺癌细胞A549细胞存活率与siRNA control组相比差异显著(P<0.05,P<0.01)。转染IDH1 siRNA可抑制细胞中IDH1的表达,进而有效抑制肺癌细胞的增殖。见表1。
2.4 流式细胞仪检测细胞凋亡 IDH1 siRNA组的肺癌细胞凋亡率为(0.41±0.02),明显多于siRNA control组(0.12±0.01,P<0.05)。可见,抑制IDH1的表达可以有效促进肺癌细胞A549,凋亡。

表1 MTT检测转染后的肺癌细胞A549增殖情况
与siRNA control组比较:1)P<0.05,2)P<0.01
3 讨 论
据世界卫生组织统计,世界范围内每年大约有160万新增肺癌患者,有140万人死于肺癌,肺癌的死亡人数占恶性肿瘤死亡人数的19%。在中国,肺癌的发病率和死亡率均为恶性肿瘤中的第一位,其中城市肺癌的死亡率较农村高,男性的死亡率较女性高。肺癌发病隐匿,约有70%的肺癌患者确诊时已经为肺癌晚期。
分子标记物在多种疾病的诊断中已经得到广泛应用。癌症标志物在正常组织和癌症组织中差异表达,可以是癌基因、抑癌基因或者与癌症相关的基因、抗原〔3~5〕,在肿瘤的诊断中具有监测作用。
IDH1基因在人类染色体2q33上,细胞质内的IDH1可以促进NADPH产生,从而诱导谷胱甘肽的循环再生〔6〕。IDH1参与细胞代谢,在与葡萄糖相关的胰岛素分泌中具有调控作用〔7,8〕。已经有研究表明,IDH1、RACK1、PRDX2在肺癌组织和癌旁组织中差异表达〔9〕。本研究结果显示,IDH1在肺癌组织中表达上调最为明显,并且肺癌患者血浆中IDH1含量明显高于正常人。抑制细胞中IDH1的表达,可以有效抑制肺癌细胞的增殖,并且明显促进肺癌细胞凋亡。
综上所述,IDH1在肺癌组织中过度表达,发挥癌基因的作用。抑制IDH1的表达可以抑制肺癌细胞的增殖,促进肺癌细胞凋亡。这说明IDH1是一种潜在的肺癌标志物,为诊断和治疗肺癌提供了新思路。
1 Chotirat S,Thongnoppakhun W,Wanachiwanawin W,etal.Acquired somatic mutations of isocitrate dehydrogenases 1 and 2(IDH1,and IDH2) in preleukemic disorders〔J〕.Blood Cells Mol Dis,2015;54(3):286-91.
2 Stein EM.IDH2 inhibition in AML:finally progress〔J〕.Best Pract Res Clin Haematol,2015;28(2-3):112-5.
3 田 侠,刘爱军,曹 晨,等.分子标志物在子宫内膜癌中的表达分析〔J〕.现代生物医学进展,2015;15(10):1891-4.
4 Braunschweig T,Chung JY,Choi CH,etal.Assessment of a panel of tumor markers for the differential diagnosis of benign and malignant effusions by well-based reverse phase protein array〔J〕.Diag Pathol,2015;10(1):1-10.
5 Naka T,Hatanaka Y,Marukawa K,etal.Comparative genetic analysis of a rare synchronous collision tumor composed of malignant pleural mesothelioma and primary pulmonary adenocarcinoma〔J〕.Diag Pathol,2016;11(1):38.
6 Reitman ZJ,Sinenko SA,Spana EP,etal.Genetic dissection of leukemia-associated IDH1 and IDH2 mutants and D-2-hydroxyglutarate in Drosophila〔J〕.Blood,2015;125(2):336-45.
7 Stancheva G,Goranova T,Laleva M,etal.IDH1/IDH2 but not TP53 mutations predict prognosis in Bulgarian glioblastoma patients〔J〕.Biomed Res Int,2014;2014(1):251-78.
8 Cimino PJ,Kung Y,Warrick JI,etal.Mutational status of IDH1 in uveal melanoma〔J〕.Exp Mol Pathol,2016;100(3):476-81.
9 孙 楠.异柠檬酸脱氢酶1(IDH1)作为新的非小细胞肺癌标志物的研究〔D〕.北京:北京协和医学院,2014.
〔2015-12-17修回〕
(编辑 袁左鸣)
云南省教育厅科学研究基金项目(2010Y188)
孙 涛(1968-),女,副主任医师,主要从事肺、乳腺肿瘤研究。
R734.2
A
1005-9202(2016)21-5337-03;
10.3969/j.issn.1005-9202.2016.21.056
1 昆明医科大学第一附属医院病理科
