白藜芦醇对同型半胱氨酸损伤的人脐静脉内皮细胞的Akt通路和小窝蛋白的影响
2016-12-06曲红玉李爱歆
张 丽 高 山 曲红玉 李爱歆 郭 丽
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
白藜芦醇对同型半胱氨酸损伤的人脐静脉内皮细胞的Akt通路和小窝蛋白的影响
张 丽 高 山 曲红玉 李爱歆 郭 丽
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
目的 探讨Akt通路和小窝蛋白-1(Cav-1)在白藜芦醇(Res)抗人脐静脉内皮细胞(HUVEC)模型动脉粥样硬化(AS)过程中的作用。方法 利用同型半胱氨酸(Hcy)诱导内皮细胞损伤模型,测定Res对于Akt蛋白表达的影响。通过哌立福新抑制Akt蛋白表达后,观察Res对一氧化氮(NO)系统及Cav-1表达的作用。进一步利用siRNA抑制Cav-1的表达后,进一步研究Res对NO系统的影响。结果 (1)白藜芦醇可抑制Akt蛋白的表达;(2)在抑制Akt蛋白表达后,NO系统表达明显升高,且与Res浓度呈正相关,而Cav-1表达无明显变化,但在加入Res后Cav-1表达明显下降;(3)siRNA沉默Cav-1后,NO系统表达明显升高,且与Res无浓度依赖性。结论 Res通过抑制Cav-1的表达,抑制Akt活性,促进NO系统的作用,改善AS。
白藜芦醇;Akt蛋白;小窝蛋白-1;一氧化氮
氧化应激导致的内皮损伤是动脉粥样硬化(AS)发生发展的始动环节,而平滑肌细胞表达的内皮型一氧化氮合酶(eNOS)及其产生的一氧化氮(NO)可与过氧负离子反应形成过氧化亚硝酸盐,引起组织损伤,促进AS的恶化〔1,2〕。小窝蛋白(Cav)-1作为PI3k/Akt上游的靶点,是研究小窝结构和功能的标志蛋白,Cav-1的表达与AS的发病程度有密切联系〔3〕。白藜芦醇(Res)作为一种活性氧(ROS)清除剂,可有效抑制ROS的产生从而发挥抗炎作用。因此,Res是一种潜在的抗AS的有效成分。本研究拟探讨Res在PI3k/Akt途径中的作用机制。
1 材料与方法
1.1 细胞培养 无菌操作取佳木斯大学附属第一医院健康孕妇新生儿脐带10~15 cm,磷酸盐缓冲液(PBS)浸泡,4℃保存,4 h内使用。采用胰蛋白酶灌注法分离脐静脉内皮细胞(HUVEC),接种至含25%胎牛血清(FBS)的DMEM培养基中,隔日换液除去未贴壁细胞,每3~4 d传代一次,在37℃、5%CO2的培养箱内静置培养。
1.2 模型细胞的制备及处理 将生长状态良好的第2代或第3代细胞用于试验。将HUVEC按2×104个/孔的密度接种于6孔板内,以含10%FBS的DMEM培养液培养,待细胞达到70%~80%的融合度开始试验,试验前采用无血清培养基进行同步化并过夜。培养细胞分为空白对照组(NC组,用PBS处理细胞),同型半胱氨酸(Hcy)内皮细胞损伤组(Hcy组),Cav-1 siRNA的内皮损伤组(Hcy+siRNA组),不同浓度Res的内皮损伤组(Hcy+Res组)以及Cav-1沉默后的不同浓度Res的内皮损伤组(siRNA+Res)。除空白对照组外,其余各组均加入1 mmol/L的Hcy进行内皮损伤模型的构建,细胞培养24 h。
1.3 NO浓度的测定 按照硝酸还原酶试剂盒说明书,测定不同组别的细胞培养液中的NO浓度。
1.4 RT-PCR方法检测eNOS和Cav-1 mRNA的表达 按照RT-PCR试剂盒说明书进行。提取各组细胞中的总RNA并逆转录cDNA。取2 μl cDNA进行PCR,反应体系为25 μl。eNOS上游引物5′-ACCCTAGAATGGAGAGCAT-3′,下游引物5′-GCCTGCACTGTCTGTGCCA-3′,Cav-1上游引物5′-CCTCTACAAGCTCAACAACATG-3′,下游引物5′-CACATCTTCAGAGTCAATCTGG-3′,内参β-actin上游引物5′-AGCGACACAGTGCTGGAC-3′,下游引物5′-ACAAGCAATGATCTTGATGAC-3′ 。
1.5 Western印迹法检测Akt、eNOS和Cav-1蛋白的表达 用10 μmol/L的Akt抑制剂哌立福新处理细胞12 h,测定上清液中的蛋白含量。将30 μg蛋白上样于10%~12% Bis-Tris胶,电泳后转膜。封闭1 h,然后用相应特异性一抗(Akt抗体、p-Akt抗体、eNOS抗体、Cav-1抗体和β-actin 单克隆抗体),分别在室温下处理1 h。最后,用增强的化学发光剂染色、显影。采用Image Lab软件分析蛋白条带。
1.6 统计学方法 应用SPSS19.0软件,计量资料组间比较用单因素方差分析,q检验作两两比较。
2 结 果
2.1 Res对Akt蛋白表达的影响 Hcy组的Akt蛋白表达显著升高。加入Res后,Akt蛋白表达下调。加入不同浓度的Res,各组Akt表达均小于Hcy组(P<0.01)。其中0.1 μmol/L的Res下调作用最明显。随着Res给药浓度的增加,Akt蛋白表达逐渐降低。见图1。
2.2 抑制Akt蛋白表达后Res对NO系统及Cav-1的影响 Hcy组的eNOS表达及NO浓度明显降低,给予Akt抑制剂哌立福新后eNOS表达及NO浓度升高。加入不同浓度Res后,eNOS表达及NO浓度进一步升高。Cav-1表达在给予哌立福新后并无明显变化;给予不同浓度Res后,Cav-1的表达逐渐下调。见图2,表1。

0:NC组;1:Hcy组;2~4:Hcy+Res组(0.1、1、10 μmol/L)图1 Res对Akt蛋白表达的影响

0:NC组;1:Hcy组;2:哌立福新组;3~5:Hcy+Res组(0.1、1、10 μmol/L)图2 抑制Akt蛋白表达后Res对eNOS、Cav-1表达的影响

组别eNOSmRNACav-1mRNANO(μmol/L)NC组1±0.081±0.12126.87±18.76Hcy组0.39±0.131)2.35±0.331)68±14.321)哌立福新组(10μmol/L)0.57±0.111)1.78±0.211)2)88.23±15.321)Hcy+Res(0.1μmol/L)组0.68±0.071)2)1.56±0.331)2)105.56±9.872)Hcy+Res(1μmol/L)组0.75±0.211)2)1.45±0.121)2)113±23.232)Hcy+Res(10μmol/L)组0.87±0.162)1.39±0.152)115±13.682)
与NC组比较:1)P<0.01;与Hcy组比较:2)P<0.01;下表同
2.3 siRNA沉默Cav-1后,各组Cav-1表达的变化 利用siRNA选择性沉默Cav-1后,Cav-1蛋白表达显著降低;Hcy组Cav-1 mRNA表达量0.87±0.16,Hcy+siRNA组为0.14±0.13组间比较差异显著(P<0.01)。提示siRNA成功抑制Cav-1表达。见图3。
2.4 Cav-1沉默后,Res对NO系统表达的影响 Cav-1沉默后,eNOS表达显著上调;给予不同浓度Res后,eNOS的表达未观察到明显变化。见图4,表2。
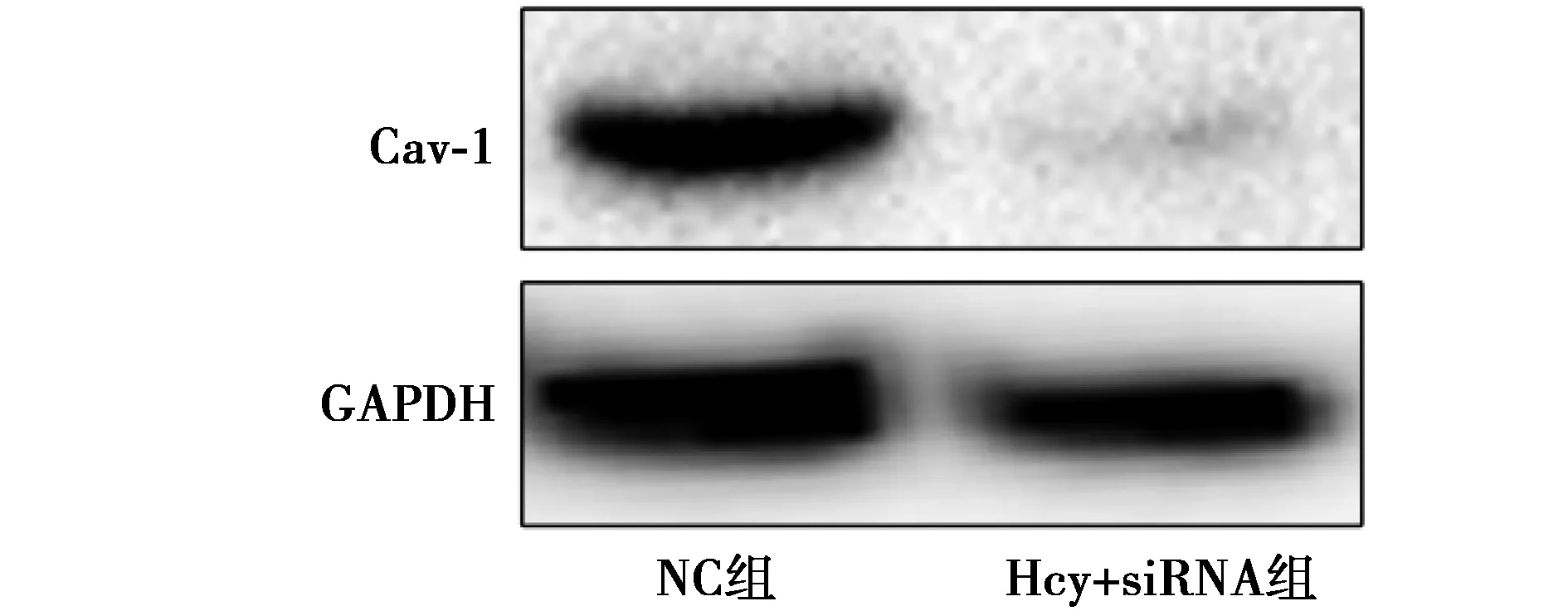
图3 siRNA沉默Cav-1后,各组Cav-1表达变化

0:NC组;1:Hcy组;2:Hcy+siRNA组;3~5:Hcy+Res(0.1、1、10 μmol/L)组图4 Res对NO系统表达的影响

组别eNOS/GAPDH比值NO(μmol/L)NC组0.99±0.14130.68±11.87Hcy组0.32±0.091)68.97±7.031)Hcy+siRNA组0.64±0.131)2)94.26±10.461)2)Hcy+Res(0.1μmol/L)组0.74±0.112)118.37±8.382)Hcy+Res(1μmol/L)组0.80±0.132)120.27±16.872)Hcy+Res(10μmol/L)组0.89±0.212)125.36±12.542)
3 讨 论
高胆固醇血症、高血压、糖尿病和长期抽烟常会导致血管内皮功能异常,并进一步促进AS的发生发展〔4〕。血管内皮细胞产生的NO一方面对于血管内皮的舒张至关重要,另一方面也具有较强的抗炎及抗血栓形成作用,能够有效抑制AS的形成。因此,常作为血管内皮功能的指示分子〔5〕。
在内皮细胞内,有众多因子通过诱导Akt信号通路激活并抑制NO的生成进而导致AS〔6〕。Xiao等〔7〕通过32P同位素标记实验证实,血管内皮细胞生长因子(VEGF)能够通过抑制Akt介导的eNOS在Ser1177位点的磷酸化进而促进内皮细胞中NO的释放。Akt在血管内皮细胞中的过多激活会降低血液流速,缩小血管横截面积,促进AS的发生。在本实验中,给予Hcy构建HUVEC氧化应激损伤模型后Akt表达明显升高,提示Akt表达很可能与血管内皮损伤存在联系。Res能够抑制ROS,减少细胞毒性作用和凋亡作用,保护线粒体膜及血管内皮细胞。Res能够通过抑制PI3K/Akt通路发挥血管保护作用。本研究中发现,Res能够显著下调HUVEC损伤模型中Akt的表达。当给予Akt抑制剂后,Res仍然能够进一步促进eNOS表达,提示在Akt通路上游,Res很可能有其他血管保护靶点。Taylor等〔8〕发现,eNOS能够被细胞质膜囊泡中的Cav-1调节,eNOS在囊泡内主要被Cav-1蛋白抑制。上皮细胞内的Ca2+-钙调蛋白复合物能够阻断Cav-1与eNOS之间的联系并增强eNOS的活性。Cav-1敲除能够极大提升eNOS的表达,Cav-1-/-与ApoE-/-双敲除小鼠相对于ApoE-/-单敲除小鼠,低密度脂蛋白清除效率显著降低,总胆固醇与甘油三酯显著升高而高密度脂蛋白浓度无明显变化〔9〕。本研究中,Cav-1沉默后eNOS表达显著上升,提示Cav-1能够直接调节eNOS的表达强度;而Res的血管保护作用很可能是通过Cav-1进行调节。当Cav-1被敲除后,Res缺乏下游调节因子,不能够进一步调节NO系统。
1 Libby P,Ridker PM,Hansson GK.Progress and challenges in translating the biology of atherosclerosis〔J〕.Nature,2011;473(7347):317-25.
2 Ponnuswamy P,Schröttle A,Ostermeier E,etal.eNOS protects from atherosclerosis despite relevant superoxide production by the enzyme in apoE mice〔J〕.PLoS One,2012;7(1):e30193.
3 Balakumar P,Kathuria S,Taneja G,etal.Is targeting eNOS a key mechanistic insight of cardiovascular defensive potentials of statins〔J〕? J Mol Cell Cardiol,2012;52(1):83-92.
4 Chistiakov DA,Revin VV,Sobenin IA,etal.Vascular endothelium:functioning in norm,changes in atherosclerosis and current dietary approaches to improve endothelial function〔J〕.Mini Rev Med Chem,2015;15(4):338-50.
5 Li H,Horke S,Förstermann U.Vascular oxidative stress,nitric oxide and atherosclerosis〔J〕.Atherosclerosis,2014;237(1):208-19.
6 Gimbrone MA,García-Cardea G.Vascular endothelium,hemodynamics,and the pathobiology of atherosclerosis〔J〕.Cardiovasc Pathol,2013;22(1):9-15.
7 Xiao N,Qi XY,Tang LN,etal.VEGF promotes cardiac stem cells differentiation into vascular endothelial cells via the PI3K/Akt signaling pathway〔J〕.Artif Cells Nanomed Biotechnol,2014;42(6):400-5.
8 Taylor SY,Dixon HM,Yoganayagam S,etal.Folic acid modulates eNOS activity via effects on posttranslational modifications and protein-protein interactions〔J〕.Eur J Pharmacol,2013;714(1):193-201.
9 Li H,Förstermann U.Uncoupling of endothelial NO synthase in atherosclerosis and vascular disease〔J〕.Curr Opin Pharmacol,2013;13(2):161-7.
〔2015-12-17修回〕
(编辑 袁左鸣)
黑龙江省自然科学基金面上项目(No.D201210)
郭 丽(1972-),女,副主任医师,硕士,主要从事循环系统疾病研究。
张 丽(1973-),女,副主任医师,硕士生导师,主要从事循环系统疾病研究。
R541.4
A
1005-9202(2016)21-5238-03;
10.3969/j.issn.1005-9202.2016.21.010
