不同玻璃液冻存卵巢组织移植于鸡胚前后的氧化应激和细胞凋亡研究
2016-12-03曾玉翠陈芸曾荔苹汤惠茹吴瑞芳
曾玉翠,陈芸,曾荔苹,汤惠茹,吴瑞芳,3*
(1.北京大学深圳医院妇产科,2.北京大学深圳医院超声科,3.深圳市妇科肿瘤医学工程技术研究开发中心,深圳 518036)
·实验研究·
不同玻璃液冻存卵巢组织移植于鸡胚前后的氧化应激和细胞凋亡研究
曾玉翠1,陈芸2,曾荔苹1,汤惠茹1,吴瑞芳1,3*
(1.北京大学深圳医院妇产科,2.北京大学深圳医院超声科,3.深圳市妇科肿瘤医学工程技术研究开发中心,深圳 518036)
目的 研究不同玻璃液(VS)保护下冻存的卵巢组织移植于鸡胚前后的氧化应激和细胞凋亡情况,以评估不同玻璃液的冷冻保护效果。 方法 将卵巢组织分割成1~2 mm×1 mm×1 mm的小块分别放入VS1、VS2、VS3、VS4 4种不同的玻璃液中,经过4种玻璃液平衡后冻存并复苏的卵巢组织称为冻存卵巢组织(FOT),分别将经4种玻璃液冻存的FOT移植到胚龄10 d的鸡卵绒毛尿囊膜(CAM)上培养,于鸡卵胚龄16 d取出移植于CAM的卵巢组织(TOT),以未经玻璃液平衡的新鲜卵巢组织为对照(COT),分析4种玻璃液保存的FOT、TOT、COT中线粒体活性、细胞内活性氧自由基(ROS)水平和间质细胞凋亡情况。 结果 线粒体活性:经过VS1、VS3和VS4冻存的FOT和TOT中的线粒体活性低于COT,差异有统计学意义(P<0.05);经VS2冻存的TOT与COT中线粒体活性无显著性差异(P>0.05)。细胞内ROS水平:经过VS1、VS3和VS4冻存的FOT和TOT细胞内ROS水平低于COT,有统计学差异(P<0.05);经VS2冻存的FOT细胞内ROS水平与COT组比较无显著性差异(P>0.05)。间质细胞凋亡情况:经过VS1、VS2、VS3和VS4平衡的FOT间质细胞凋亡率和COT组之间的差异无统计学意义(P>0.05)。 结论 由玻璃液VS2保护冻存卵巢组织的冷冻损伤小、移植后缺血损伤轻,是本研究优化的卵巢冷冻保护玻璃液;玻璃化冷冻对间质细胞损伤小,适于人卵巢组织的冷冻保存。
玻璃液;卵巢组织;氧化应激;凋亡
Methods:Human ovarian tissues were dissected to 1-2 mm×1 mm×1 mm size,and then put into in four kinds of vitrification solutions(VS1,VS2,VS3,VS4)for cryopreservation.Part of the frozen ovarian tissues(FOT)was grafted into CAM.The transplanted ovarian tissues(TOT)were collected 5 days after transplantation.The tissue without treatment was as control ovarian tissue(COT).The mitochondrial activity,reactive oxygen species(ROS)and apoptosis of stromal cells in COT,FOT and TOT after cryopreservation with four different vitrification solutions were evaluated and compared.
Results:Mitochondrial activity of tissue after cryopreservation with VS1,VS3 or VS4 was significantly lower than COT(P<0.05).TOT after cryopreservation with VS2 was not significant different with COT(P>0.05).ROS levels in FOT and TOT after cryopreservation with VS1,VS3 or VS4 were significantly lower than COT(P<0.05).ROS levels in FOT with VS2 were not significantly different with COT(P>0.05).There was no significant difference in apoptosis between FOT and COT among the four VS groups(P>0.05).
Conclusions:VS2 results in a higher level of mitochondrial activity and ROS,therefore,it is an optimal solution.Vitrification cryopreservation shows little damage to stromal cells,which is an alternative way to protect human ovarian tissue.
(JReprodMed2016,25(11):1006-1012)
近年来随着肿瘤诊疗技术的提高,越来越多的年轻肿瘤患者治疗后可长期生存。然而,大剂量的放化疗药物对生殖腺毒性作用,导致患者在肿瘤治疗结束后出现卵巢早衰和不孕。研究证实,在抗肿瘤治疗前冻存患者卵巢组织来保护其生育力是一个行之有效的方法[1]。
玻璃化冷冻因不需要特殊设备、操作简单,被认为是慢速冷冻的替代方案。在卵巢组织玻璃化冷冻过程中,玻璃化冷冻保护液,简称玻璃液(vitrification solution,VS)对组织的渗透毒性和化学毒性可引起细胞膜结构改变,抗冻保护作用降低,发生组织的冷冻损伤。本文通过激光共聚焦扫描显微镜(CLSM)与原位末端标记(TUNEL)法,研究由不同玻璃液冻存的卵巢组织移植于鸡胚前后氧化应激水平及细胞的凋亡,用以评估不同玻璃液的冷冻保护效果。
材料和方法
一、材料
1.人卵巢组织的获取:本研究方案得到北京大学深圳医院伦理委员会批准,卵巢组织来源于1位因子宫内膜癌行双侧卵巢切除术的39岁患者。手术中卵巢组织离体后立即取材,剖开双侧卵巢组织,各切取一半,置于盛有6 ml 经HEPES缓冲的M199培养液(含20%胎牛血清和100 μg/ml青/链霉素)的离心管中,15 min内送至实验室。
2.卵巢组织的处理与分组:将送至实验室的卵巢组织去除血迹和髓质及肉眼可见的卵泡与黄体等周期性结构后,分割成40余个1~2 mm×1 mm×1 mm的小块。将分割的小块卵巢组织每10块为一个实验组,共4组;同时留取4块新鲜卵巢组织作为对照组(COT),其中2块立即用4%多聚甲醛固定,待原位末端标记法(TUNEL)实验检测细胞凋亡,另2块经MitoTracker Orange CMTMRos和2’,7’-二氯荧光素二乙酸酯孵育后(具体步骤见下文)用2%甲醛固定,待测线粒体活性和氧化应激水平。
二、主要试剂及配制
M199(Gibco,美国);胎牛血清(FBS,Gibco,美国);原位细胞凋亡检测试剂盒(武汉博士德);MitoTracker Orange CMTMRos(M7510,LifeTechnologies,美国);2’,7’-二氯荧光素二乙酸酯(DCF)、蔗糖、海藻糖(Sigma,美国)。
4种玻璃液(VS1-VS4)的选择与配制参阅文献如下:
VS1:7.5% 乙二醇(EG)+7.5%二甲亚砜(DMSO)+M199,15% EG+15% DMSO+M199[2];
VS2:7.5% EG+7.5% DMSO+基础液(M199+20% FBS),15% EG+15% DMSO+0.5 mol/L蔗糖+M199+20% FBS[3];
VS3:25%(EG+DMSO)+M199+20% FBS[4];
VS4:10%(EG+DMSO)+0.1 mol/L蔗糖+0.1 mol/L海藻糖+6% FBS+M199,20%(EG+DMSO)+0.3 mol/L蔗糖+0.1 mol/L海藻糖+6% FBS+M199[5]。
以上渗透性冷冻剂均购于Sigma公司。
三、研究方法
1.卵巢组织的冻存:参阅前期研究[6],平衡时间见表1。各实验组卵巢组织块分别经不同玻璃液平衡后置于金属网格载体,以灭菌纱布吸走多余玻璃液,投入装有液氮的泡沫箱中,冷冻后将组织连同载体置于预冷后的1.8 ml冷冻管(Corning)中,投入液氮罐中冷冻保存。

表1 各实验组卵巢组织平衡时间
2.卵巢组织的冻融:卵巢组织冻存2周后,取出金属网格载体,置于空气中30 s,迅速转入37℃水浴,将卵巢组织依次移入蔗糖浓度梯度为1 mol/L、0.5 mol/L、0.25 mol/L、0.125 mol/L的解冻液中各5 min,复融组织块,漂洗卵巢组织3次。4个实验组中每组冻融的10个卵巢组织块中各取出两块以4%多聚甲醛固定,用于细胞凋亡检测;每组取3块组织行线粒体活性和活性氧自由基(ROS)水平检测;剩余的5块组织用于鸡胚移植。
3.冻融卵巢组织块鸡胚移植:鸡胚准备同前期研究[6],将受精鸡卵放入37℃孵箱中孵育至鸡胚胚龄第10 天取出。内径为5 mm的硅胶环置于去除了上细胞层的CAM上,用眼科镊将复融的卵巢组织块置于硅胶环内。如此将4种玻璃液保护下冻融的各5块卵巢组织分别移植到20个鸡胚CAM上,并在鸡卵外壳上标记编号。移植卵巢组织块后鸡胚继续孵育5 d,于鸡胚胚龄第16天取出,将移植的卵巢组织块连同CAM一起取材。将取下的卵巢组织块中的2块以4%多聚甲醛固定,进行细胞凋亡检测,其余3个卵巢组织块行线粒体活性和ROS水平检测。
4.线粒体活性与ROS检测:经上述实验,获得了3类卵巢组织块,即分别经4种玻璃液平衡后冷冻复融的卵巢组织块(FOT);取下移植5 d后的卵巢组织(TOT);新鲜的对照组卵巢组织(COT)。
参照Martino等[7]介绍的方法,取FOT、TOT与 COT置于10% FBS+PBS+280 nmol/L MitoTracker Orange CMTMRos中,在37℃、6% CO2条件下孵育45 min定位和检测线粒体活性;再将卵巢组织置于10% FBS+PBS+10 μmol/L 2’,7’-二氯荧光素二乙酸酯中孵育45 min,检测ROS水平。上述处理后的卵巢组织于2%甲醛固定。组织脱水、包埋,制作30 μm厚切片,每个组织块取两张连续切片。
将制好的玻片置于CLSM(200×)上,M7510激发出桔色荧光代表有活性的线粒体。DCF激发出绿色荧光代表细胞内ROS水平。每张玻片取3个视野(23 000 pixel2)分析荧光强度,涉及荧光强度的所有参数设置恒定。
5.TUNEL法凋亡检测:FOT、TOT与 COT制作5 μm厚切片,具体操作步骤参照试剂盒说明书。由于卵巢组织块小及卵泡数少,本文仅分析卵巢间质细胞的凋亡情况。间质细胞阳性表现为核染成棕黄色,凋亡率=(阳性细胞数/总细胞数)×100%。
四、统计学分析
采用SPSS 19.0软件进行数据分析。计量资料用(均数±标准差)表示,组间比较用单因素方差分析(ANOVA)LSD法分析,P<0.05为差异有统计学意义。
结 果
一、一般情况
4种玻璃液冻存的卵巢组织块经复融后,各取5块分别移植到鸡胚CAM上,移植后继续孵育5 d,移植的卵巢组织上都长了新生血管,质地柔软,判断组织块全部存活。
二、不同玻璃液冻存的卵巢组织中线粒体活性与ROS水平的定性分析比较
将不同玻璃液冻存的冻融卵巢组织块(FOT)、移植后(TOT)与新鲜组织块(COT)进行线粒体活性和ROS水平检测,观察到卵巢组织切片均标记上了M7510激发的桔色荧光和DCF激发的绿色荧光染料,表明荧光染料组织渗透完全。
结果显示,在CLSM下观察卵巢FOT、TOT与COT的M7510和DCF激发荧光强度不一,即4种不同玻璃液冻存的卵巢组织块冷冻损伤程度不同,新鲜对照组与VS2玻璃液保护的FOT及TOT荧光较强,说明其线粒体活性和ROS水平较高(图1A~D);玻璃液VS1、VS3和VS4保存的FOT及TOT荧光较弱,说明其线粒体活性和ROS水平较低(图1E~H)。

M7510荧光强度代表线粒体活性(桔色);DCF荧光强度代表ROS水平(绿色)。A:COT的M7510荧光强度;B:玻璃液VS2保护下FOT的M7510荧光强度;C:COT的DCF荧光强度;D:玻璃液VS2保护下FOT的DCF荧光强度;E:玻璃液VS1保护下FOT的M7510荧光强度;F:玻璃液VS4保护下TOT的M7510荧光强度,可见细胞坏死带(蓝色箭头所指处),G:玻璃液VS1保护下FOT的DCF荧光强度;H:玻璃液VS4保护下TOT的DCF荧光强度,可见细胞坏死带(蓝色箭头所指处)图1 不同玻璃液冻存的卵巢组织复融与CAM移植后的线粒体活性和ROS水平定性分析
三、不同玻璃液冻存的卵巢组织中线粒体活性与ROS水平的定量分析比较
在CLSM下,对反应卵巢组织线粒体活性的M7510和代表氧化应激状态的DCF激发的荧光信号进行定量分析,由不同玻璃液保护下的FOT与TOT的结果如图2所示。
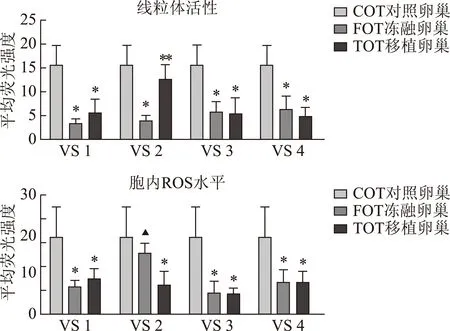
与同组COT比较,*P<0.05;与同组FOT比较,**P<0.05;与同组TOT比较,▲P<0.05图2 不同玻璃液冻存的卵巢组织复融与CAM移植后的线粒体生物能和ROS水平定量分析
线粒体活性:FOT线粒体活性在玻璃液VS1(3.32±1.06)、VS2(3.87±1.24)、VS3(5.75±2.14)和VS4(6.44±2.61)中低于COT(15.66±4.22),差异有统计学意义(P<0.05);TOT线粒体活性在玻璃液VS1(5.44±3.06)、VS3(5.36±3.46)和VS4(4.69±2.09)中与对应的同一种玻璃液的FOT相比,无显著性差异(P>0.05);而VS2的TOT(12.57±3.10)与VS2的FOT相比,线粒体活性显著增强(P<0.01),说明玻璃化冷冻卵巢组织的线粒体产生了一定程度的损伤,VS2玻璃液保护下冷冻的卵巢组织线粒体活性得到了较好的恢复,而其他3种玻璃液保护下冷冻的卵巢组织移植后线粒体活性无改善。
ROS水平:FOT的ROS水平在玻璃液VS1(6.84±1.67)、VS3(5.23±2.98)和VS4(8.06±3.37)中低于COT(19.58±7.69),差异有统计学意义(P<0.05);而VS2保护的FOT的ROS水平(15.18±2.80)与COT比较,无显著性差异(P>0.05);TOT的 ROS水平在VS1(8.85±2.56)、VS3(5.04±1.37)和VS4(7.94±2.63)中与对应的同一种玻璃液FOT相比,无显著性差异(P>0.05),即卵巢组织移植5 d后,ROS水平无改变;而VS2 保护下TOT的ROS水平(7.46±3.34)较移植前(VS2-FOT)为低,差异有统计学意义(P<0.01)。
上述结果提示,玻璃液VS1、VS3和VS4保护的FOT与TOT线粒体活性受到损伤,组织ROS下降;而玻璃液VS2保护下组织线粒体损伤程度较轻,移植后线粒体活性恢复好,并与ROS水平保持动态的平衡。
四、不同玻璃液冻存的卵巢组织块间质细胞凋亡情况比较
卵巢组织复融后,间质细胞形态仍保持正常,少量的间质细胞出现凋亡(图3A红色箭头所指处)。复融的卵巢组织移植5 d后,间质细胞排列稀疏,细胞皱缩,较多间质细胞出现凋亡(图3B蓝色箭头所指处)。
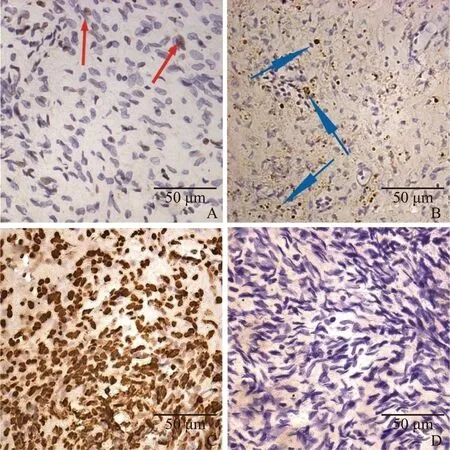
A:FOT凋亡细胞(红色箭头所指处);B:TOT凋亡细胞(蓝色箭头所指处);C:阳性对照;D:阴性对照;图3 卵巢组织冷冻复融和移植后间质细胞凋亡情况
数据显示,FOT的间质细胞凋亡率在VS1(9.67±3.71)、VS2(8.50±3.20)、VS3(6.78±4.03)和VS4(9.36±3.48)中,与COT(7.95±2.89)之间并无显著性差异(P>0.05)。冻融卵巢组织移植后5 d,TOT间质细胞凋亡率在VS1(27.02±2.09)、VS2(13.92±6.27)、VS3(30.18±8.20)和VS4(23.31±11.84)中,显著高于对应的同一种玻璃液的FOT和COT(P<0.05);玻璃液VS2的TOT间质细胞凋亡率低于其他3种玻璃液的TOT凋亡率,差异有统计学意义(P<0.05)(图4)。
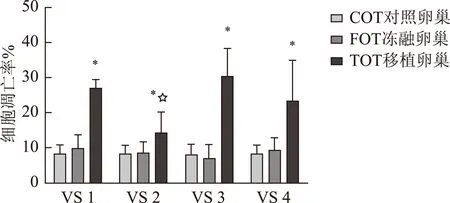
与同种玻璃液的COT和FOT比较,*P<0.05;与不同种玻璃液的TOT比较,☆P<0.05图4 各玻璃液冻存的卵巢组织的凋亡情况
4种玻璃液复融的卵巢组织间质细胞损伤轻微;VS1、VS3和VS4复融卵巢组织移植5 d后,卵巢组织间质细胞凋亡增加,而VS2保护的TOT间质细胞凋亡较少,提示VS2保护的TOT移植物缺血缺氧损伤较轻。
讨 论
在年轻肿瘤患者抗肿瘤治疗前对其卵巢组织玻璃化冻存是保存生殖功能的有效方法。研究卵巢玻璃化冷冻及移植后线粒体功能和或氧化应激反应改变的报道较少[8-9]。本文通过CLSM结合TUNEL方法比较以不同玻璃液保护冻存卵巢组织的生物能、氧化应激状态及其细胞凋亡,并以此优化玻璃液方案。
线粒体作为组织细胞代谢的枢纽,是活性氧自由基(ROS)生成的关键场所。ROS可透过细胞膜改变脂类、蛋白质和核酸等大分子物质的结构和功能,从而导致线粒体的功能减退及能量产生障碍[10]。通常情况下细胞内线粒体内多种抗氧化系统调控线粒体ROS的平衡状态。一旦ROS稳态被破坏,将会启动细胞凋亡程序。
不同个体卵巢组织的线粒体生物能存在较大差异,本研究卵巢组织来源于同一个体,避免了人卵巢组织本身的差异。复苏后,四种玻璃液保护下的卵巢组织生物能均降低,提示卵巢组织线粒体在玻璃化冷冻过程中易受损。VS1、VS3和VS4保护下FOT的ROS水平降低,而VS2 FOT的ROS水平与新鲜对照比较无差异。Rahimi等[10]证实冻融的卵巢组织ROS水平异常升高可导致细胞凋亡。本研究4种玻璃液保护下FOT ROS水平无增高,且间质细胞凋亡率与COT相比亦无增加,提示ROS水平在冷冻复融后卵巢组织的凋亡中起一定作用。
组织移植5 d后,VS1、VS3、VS4的TOT与对应的同一种玻璃液的FOT相比,线粒体的生物能和ROS水平并没有明显的改善,说明该3种玻璃液对卵巢组织线粒体的损伤较为严重,在卵巢组织移植过程中,线粒体活性恢复慢甚至不能恢复。VS2的TOT线粒体生物能相比FOT明显增加,同时ROS水平下降。提示,玻璃液VS2冷冻卵巢组织对线粒体损伤较轻。此时ROS水平下降的可能原因是在移植组织重新建立血供过程中,调控生物氧化功能基因未被破坏,组织在缺血应激下线粒体相关基因被激活,但因氧供不足,组织处于“氧债”阶段,因此产生的ROS反而减少,另外一方面由于线粒体功能恢复,卵巢组织内抗氧化系统或者超氧化物歧化酶激活对自由基清除能力增加。根据Fabbri等[8]研究,卵巢组织冷冻损伤分为三种程度,严重冷冻损伤时,线粒体和ROS水平均明显下降,中轻度损伤导致线粒体生物能升高和/或ROS水平升高或者轻微下降,无损伤时线粒体生物能和ROS水平不改变。本研究提示从卵巢组织生物能/氧化应激水平进行分析得出玻璃液VS2保护组织抗冷冻损伤的作用优于其他3种玻璃液。
卵巢间质细胞不仅可以影响卵泡外膜的形成,而且通过旁分泌因子来影响卵泡的发育和成熟。因此,间质细胞不仅起维持卵巢组织结构作用,还关乎冻存卵巢组织移植后内分泌功能的恢复。本研究中复苏后的卵巢组织间质细胞凋亡率与新鲜的卵巢组织无统计学差异,说明4种玻璃液方案均可以较好地保护卵巢组织间质细胞。许多研究证实玻璃化冷冻后的卵巢组织间质细胞间隙、形态、超微结构与新鲜组织相似[11-12]。但也有研究报道卵巢组织冷冻因低温和高浓度冷冻剂等造成的物理损伤和抗氧化代谢损伤而导致卵巢组织细胞凋亡增加[13]。Mazoochi等[14]报道玻璃化冷冻会引起凋亡相关基因如p53、Bcl-2、Bax、Fas和FasLd等表达改变,导致细胞凋亡。
移植后卵巢组织细胞凋亡与移植组织块血供重建情况直接相关。移植后处于缺血缺氧状态下,卵巢组织的损伤较为严重。Wang等[15]在移植动物模型体内注射VEGF和bFGF来缩短移植组织块缺血缺氧的时间,结果发现移植后细胞凋亡率与新鲜组织无差异,也有研究报道在缺血缺氧应激状态下细胞反而会被激活[16]。本研究卵巢组织移植5 d后,卵巢组织间质细胞的凋亡率与新鲜组织和冷冻复苏后的组织相比明显增加,但VS2移植组织间质细胞凋亡率较VS1、VS3和VS4的TOT为低,从凋亡角度提示VS2对卵巢组织的冻存效果较好。但Amorim等[17]报道移植1周后间质细胞凋亡率与新鲜对照组差异不明显,认为间质细胞凋亡与玻璃液方案并无直接的关系。
总之,玻璃化冷冻对卵巢组织间质细胞损伤小适用于人卵巢组织的冷冻保存。玻璃液VS2对卵巢组织冷冻保存效果较好。本研究鸡胚的移植时间不长,后期将进一步延长移植时间,观察血管完全建立后线粒体功能恢复和细胞凋亡情况,另外需要加大样本量,比较不同病人的卵巢组织线粒体活性/氧化应激水平评估疾病本身的影响及不同玻璃液之间冷冻效果的差异。
[1] Sánchez-Serrano M,Crespo J,Mirabet V,et al. Twins born after transplantation of ovarian cortical tissue and oocyte vitrification[J].Fertil Steril,2010,93:268.e11-e13.
[2] Zhou XH,Wu YJ,Shi J,et al. Cryopreservation of human ovarian tissue:comparison of novel direct cover vitrification and conventional vitrification[J].Cryobiology,2010,60:101-105.
[3] Wang Y,Xiao Z,Li L,et al. Novel needle immersed vitrification:a practical and convenient method with potential advantages in mouse and human ovarian tissue cryopreservation[J].Hum Reprod,2008,23:2256-2265.
[4] Gandolfi F,Paffoni A,Papasso Brambilla E,et al. Efficiency of equilibrium cooling and vitrification procedures for the cryopreservation of ovarian tissue:comparative analysis between human and animal models[J].Fertil Steril,2006,Suppl 1:1150-1156.
[5] Kagawa N,Silber S,Kuwayama M.Successful vitrification of bovine and human ovarian tissue[J].Reprod Biomed Online,2009,18:568-577.
[6] Zeng YC,Tang HR,Zeng LP,et al. Assessment of the effect of different vitrification solutions on human ovarian tissue after short-term xenotransplantation onto the chick embryo chorioallantoic membrane[J].Mol Reprod Dev,2016,83:359-369.
[7] Martino NA,Lacalandra GM,Filioli Uranio M,et al. Oocyte mitochondrial bioenergy potential and oxidative stress:within-/between-subject,in vivo versus in vitro maturation,and age-related variations in a sheep model[J].Fertil Steril,2012,97:720-728.e1.
[8] Fabbri R,Vicenti R,Martino NA,et al. Confocal laser scanning microscopy analysis of bioenergetic potential and oxidative stress in fresh and frozen-thawed human ovarian tissue from oncologic patients[J].Fertil Steril,2014,101:795-804.
[9] Hatami S,Zavareh S,Salehnia M,et al. Comparison of oxidative status of mouse pre-antral follicles derived from vitrified whole ovarian tissue and vitrified pre-antral follicles in the presence of alpha lipoic acid[J].J Obstet Gynaecol Res,2014,40:1680-1688.
[10] Rahimi G,Isachenko E,Sauer H,et al. Effect of different vitrification protocols for human ovarian tissue on reactive oxygen species and apoptosis[J].Reprod Fertil Dev,2003,15:343-349.
[11] Fabbri R,Vicenti R,Macciocca M,et al. Good preservation of stromal cells and no apoptosis in human ovarian tissue after vitrification[J].Biomed Res Int,2014,2014:673537.
[12] Mathias FJ,D’Souza F,Uppangala S,et al. Ovarian tissue vitrification is more efficient than slow freezing in protecting oocyte and granulosa cell DNA integrity[J].Syst Biol Reprod Med,2014,60:317-322.
[13] Rimon E,Cohen T,Dantes A,et al. Apoptosis in cryopreserved human ovarian tissue obtained from cancer patients:a tool for evaluating cryopreservation utility[J].Int J Oncol,2005,27:345-353.
[14] Mazoochi T,Salehnia M,Pourbeiranvand S,et al. Analysis of apoptosis and expression of genes related to apoptosis in cultures of follicles derived from vitrified and non-vitrified ovaries[J].Mol Hum Reprod,2009,15:155-164.
[15] Wang L,Ying YF,Ouyang YL,et al. VEGF and bFGF increase survival of xenografted human ovarian tissue in an experimental rabbit model[J].J Assist Reprod Genet,2013,30:1301-1311.
[16] David A,Van Langendonckt A,Gilliaux S,et al. Effect of cryopreservation and transplantation on the expression of kit ligand and anti-mullerian hormone in human ovarian tissue[J].Hum Reprod,2012,27:1088-1095.
[17] Amorim CA,Dolmans MM,David A,et al. Vitrification and xenografting of human ovarian tissue[J].Fertil Steril,2012,98:1291-1298.
[编辑:侯丽]
Oxidative stress reaction and apoptosis of human ovarian tissue pre/post transplanted into chicken embryos after cryopreservation with different vitrification solutions
ZENG Yu-cui1,CHEN Yun2,ZENG Li-ping1,TANG Hui-ru1,WU Rui-fang1,3*
1.DepartmentofObstetricsandGynecology,BeijingUniversityShenzhenHospital,Shenzhen518036 2.DepartmentofUltrasound,BeijingUniversityShenzhenHospital,Shenzhen518036 3.ShenzhenTechnicalResearchandDevelopmentCenteronGynecologicOncology,Shenzhen518036
Objective:To evaluate the effect of cryopreservation with different vitrification solutions on oxidative stress reaction and apoptosis of human ovarian tissues before and after transplantation into chick embryo chorioallantoic membrane(CAM).
Vitrification solution; Ovarian tissue; Oxidative stress reaction; Apoptosis
10.3969/j.issn.1004-3845.2016.11.011
2016-02-24;
2016-04-04
深圳市科技创新委员会国际合作项目(GJHZ20130417100103783);广东省科技计划项目(社会发展领域科技计划项目)(2013B021800095)
曾玉翠,女,江西上饶人,硕士研究生,生殖内分泌专业.(*
