骆驼凝乳酶的分子结构与制备干酪的研究现状
2016-12-02普燕马晓林张富春李轶杰
普燕,马晓林,张富春,李轶杰
(新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆 乌鲁木齐,830046)
骆驼凝乳酶的分子结构与制备干酪的研究现状
普燕,马晓林,张富春*,李轶杰
(新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆 乌鲁木齐,830046)
骆驼凝乳酶与牛凝乳酶有着相似的一级结构和三级结构,但二者对牛乳的亲和力、催化速率却有着较大的差异,研究其分子水平上的不同,对今后凝乳酶的蛋白质工程改造有着重要意义。同时骆驼凝乳酶制备干酪苦味少,联合骆驼凝乳酶与改良发酵剂制备新型低质、低盐干酪也成为干酪研发的方向之一。该文综述了骆驼凝乳酶的结构、酶学特性、与底物结合的分子研究以及制备干酪等方面的内容。
凝乳酶;骆驼;底物亲和力;晶体结构;干酪
凝乳酶(EC3.4.23.4)是一种酸性蛋白酶[1],广泛存在于新生哺乳动物的胃中。凝乳酶能凝固乳液,延长母乳在新生动物消化道中的存留时间,从而使母乳的营养能充分被小动物吸收[2]。利用凝乳酶凝固乳液这一特性,人们从未断奶小动物(小牛、羔羊等)胃中提取凝乳酶并广泛用于干酪制作。不同动物来源的凝乳酶特性不同,即使干酪制备工艺完全相同,制备的干酪质地与风味也不尽相同。其中小牛凝乳酶凝乳活力高,对乳中κ-酪蛋白水解快速而专一,同时对乳中其它蛋白的水解活性低,即c/p值高,这一特性能使凝乳过程中使更多乳蛋白存留在凝块中,在干酪成熟过程中,其对凝乳中蛋白水解少,从而干酪的出品率高,产生的苦味肽少,口味好,故小牛凝乳酶一直被认为是最佳的制备干酪的凝乳酶。
2006年,KAPPELER等人[3]首次从单峰驼(Camelus dromedarius)体内克隆了凝乳酶基因,在黑曲霉(Aspergillusniger)中成功表达,并检测了其酶学特性。与小牛凝乳酶比较,发现骆驼凝乳酶对牛乳的凝乳活力比小牛凝乳酶高70%,但非特异蛋白水解活力才相当小牛凝乳酶的20%,这使得骆驼凝乳酶的c/p值是小牛凝乳酶的7倍。在理论上,c/p值是评判凝乳酶制备干酪性能优劣的一个重要标志。高c/p凝乳酶制备干酪可能会得到更高的出品率和更好的风味。
2009年,BANSAL等人[4]用骆驼凝乳酶制备cheddar干酪,并以小牛凝乳酶制备的干酪作为对照。2种干酪均在相同的条件下制备,但是由于骆驼凝乳酶的凝乳活力比小牛凝乳酶高,故为保证添加的凝乳酶量使乳液在相同的时间和条件下,达到相同的切割硬度,则骆驼凝乳酶的用量比小牛凝乳酶用量少。制备出的两种干酪在组分和pH没有任何差异;但是初级水解程度(以pH4.6可溶性氮表示),骆驼凝乳酶要比小牛凝乳酶低。SDS-PAGE分析乳蛋白被水解的情况,两种干酪中的β-酪蛋白都被乳液中固有存在的血纤维蛋白溶酶(plasmin)水解成β-CN(f29-209),β-CN(f106-209)和β-CN(f108-209),但小牛凝乳酶在干酪成熟过程中产生了β-CN(f1-189/192)肽,此肽在骆驼凝乳酶制备的干酪中没有检测到,这或许是骆驼凝乳酶的用量少,或许是骆驼凝乳酶的非特异水解活性更低,也或许是二者的综合作用结果。而β酪蛋白水解产生的β-CN(f1-189/192),β-CN(f193-209)和β-CN(f190-209)小肽会造成干酪的苦味。以上结果也暗示骆驼凝乳酶制备的干酪苦味更低。2种酶对αs1-酪蛋白的水解产物基本相同,但骆驼凝乳酶制备的干酪在成熟180 d时对其水解量才相当于牛凝乳酶制备干酪30 d水解量,这与骆驼凝乳酶的用量低和非特异水解活力较低均有关。2种干酪中游离氨基酸的含量没有显著差异,这也许是因为游离氨基酸主要是乳酸菌(发酵剂和非发酵剂)的肽酶产生之故。比较干酪成熟的质地,成熟30 d时2种干酪的硬度和咀嚼性没有显著差别,成熟150 d时骆驼制备干酪硬度和咀嚼性测定值均高于小牛凝乳酶制备干酪,180 d时2种干酪的总体感官相似,但是骆驼凝乳酶制备干酪硫强度、肉汤味和苦味均较低。
骆驼凝乳酶比小牛凝乳酶有更高的c/p以及更优越的制备干酪的性能。丹麦科汉森公司就通过黑曲霉大量发酵骆驼凝乳酶并上市,与此同时,骆驼凝乳酶的基因和蛋白序列[5]、用骆驼凝乳酶制备干酪[6]已被申请国际专利。如今骆驼凝乳酶已经成功地成为了小牛凝乳酶的替代品,人们不但没有因此止步,反而对骆驼凝乳酶的研究变得更为积极和深入,为了更好地了解骆驼凝乳酶对牛乳的高凝乳活力、高催化效率的机制,从酶的晶体结构、酶对牛乳中α-、β-、κ-酪蛋白的水解肽谱、酶与κ-酪蛋白结合的分子水平等方面进行深入研究。由于牛凝乳酶的相关研究非常多,故在研究骆驼凝乳酶的过程中,也总是伴随着与牛凝乳酶研究结果的比较。同时,为了便于描述,我们将骆驼凝乳酶camel chymosin缩写为CC,牛凝乳酶bovine chymosin缩写为BC,酪蛋白casein缩写为CN。

图1 预测骆驼凝乳酶的二级结构Fig.1 The secondary structure prediction of the camel chymosin预测网址(the structure prediction URL)http://linux1.softberry.com/berry.phtml? topic=pps & group=programs & subgroup=propt
1 骆驼凝乳酶的基因与结构
1.1 骆驼凝乳酶的基因
骆驼凝乳酶原前体(pre-prochymosin)基因含有9个外显子[3],开放阅读框含有1146个核苷酸,编码381个AA,N-端前16个AA为信号肽(pre-peptide),中间42个AA为激活片段(activation segment或propeptide),C-端323个AA为成熟凝乳酶(chymosin)。酶信号肽剪切位点、酶原激活位点以及成熟酶的氨基酸数等信息完全与牛凝乳酶相同,同时骆驼凝乳酶氨基酸序列与牛凝乳酶氨基酸序列相似度(sequence identity)和序列相似性(sequence similarity)分别为85%和94%,但48个不同AA散布于整个酶,而不是集中在某个区域[2]。
1.2 骆驼凝乳酶的结构
1.2.1 预测骆驼凝乳酶原的二级结构与三级结构
通过预测网站对CC酶原与BC酶原的二级结构和三级结构进行预测,发现CC与BC在一级结构上的高相似度,使得其也具有相似的二级结构和三级结构(见图1和图2),包括α-螺旋、β-折叠形成的位置、个数等。二级结构预测中,N端都有一个α-螺旋,这是两个酶原前体的信号肽,随后propeptide的N端是β-折叠,后面接着3个α-螺旋,这个预测结构与已经报道的猪胃蛋白酶原和网站预测的骆驼凝乳酶原和牛凝乳酶原的三维结构中propeptide结构吻合。同时在猪胃蛋白酶原中,N端的β-片层位于酶的活性中心,防止底物进入,在pH中性环境中,酶原不具催化活性[7-8],而预测的骆驼和牛凝乳酶原的propeptide结构环绕在凝乳酶2个结构域中间裂隙的周围,2个催化Asp位于裂隙中间,故酶活性中心同样被propeptide结构封闭而不表现出活性。

A猪胃蛋白酶原A晶体结构 [7];B和C分别表示预测的骆驼凝乳酶原和牛凝乳酶原三级结构图2 猪胃蛋白酶原A晶体结构[7]和预测骆驼与牛凝乳酶原三级结构Fig.2 The crystal structure of swine pepsin A and the tertiary structure prediction of the bovine and camel chymosin(预测结构网址:http://zhanglab.ccmb.med.umich.edu/I-TASSER/)
成熟凝乳酶的序列从第59位开始,在预测的二级结构图中,连接propeptide和成熟凝乳酶之间是无规则卷曲,这也方便酶活化时的构象改变。目前认为天冬氨酸蛋白酶原的活化过程为:propeptide与酶的活性位点以静电作用结合,propeptide的存在阻止了底物进入酶活性中心,故酶原在中性环境里不具有催化作用;当pH降低,propeptide与酶活性中心的静电作用被破坏,此时propeptide的构象发生改变,酶原的自剪切位点暴露并与酶活性中心结合,酶对该位点进行切割,propeptide从酶活性中心解离,酶的N端发生构象改变,形成一个反式β折叠位于底物与酶结合的裂隙处[8](见图3箭头所指)。

图3 牛凝乳酶和骆驼凝乳酶的晶体结构[11]Fig.3 The crystal structure of the bovine and camel chymosin [11]
1.2.2 骆驼凝乳酶的晶体结构
牛凝乳酶的晶体结构模型已见多次报道[9-10],但是骆驼凝乳酶的晶体结构直到2013年才由JENSEN等人[11]首次报道(见图3)。为了便于将BC和CC结构进行比较,其也同时获得了BC晶体结构,该结构与以前研究报道的牛凝乳酶晶体结构完全相同。CC与BC晶体结构上最大的不同之处在于其N端,BC晶体显示其N端形成了一个反平行式β-折叠(见图3箭头所指)。而CC的晶体结构其N端少了10个AA。将CC晶体复水溶解,对其进行N-末端分析、质谱分析和检测凝乳活力,发现其活力下降,且其活力与N端缺失了3个AA的凝乳酶变体[11]相似(见表1)。
2 骆驼凝乳酶的理化特性与酶学特性
2.1 骆驼凝乳酶的理化特性
在黑曲霉中表达获得的骆驼凝乳酶分子质量为35.6 k~40.3 kDa(糖基化不同)[3,11];等电点理论值为4.85,但实测值为5.5。
JENSEN等[11]人对黑曲霉表达的骆驼凝乳酶进行层析分离,根据洗脱的先后顺序分离出6个凝乳酶变体(variant),其疏水性和等电点均不同,研究者又通过N-末端分析、质谱和差示扫描量热法对每个凝乳酶变体进行分析,得出表1数据。

表1 黑曲霉表达的重组骆驼凝乳酶分离出的不同变体[11]
黑曲霉中的蛋白,若存在Asn-X-Thr/Ser(X为谷氨酸或脯氨酸)序列时,黑曲霉将会对该序列中Asn的Nδ2原子进行糖基化,骆驼凝乳酶存在2个糖基化位点:Asn100和Asn290,其中Asn100更易被糖基化[11]。由表1看出, 1和2中双位点被双糖基化,3和4是单位点被糖基化,同时其差异性可能是糖基化差异产生的,而5和6没有被糖基化,其差异产生原因还需研究。值得注意的是, N端缺失3个AA的变体1,凝乳活力很低。JENSEN等人[11]选取凝乳酶变体2进行了晶体结构研究(见图3)。
2.2 骆驼凝乳酶的酶学特性
早在1993年,WANGO[12]就用骆驼rennet 和牛rennet对驼乳和牛乳进行凝乳研究,发现牛rennet对驼乳凝固主要是牛胃蛋白酶组分的作用,而牛凝乳酶几乎不凝驼乳。2006年,KAPPELER等也发现重组骆驼凝乳酶不能凝固牛乳[3]。
SALIHA等[13]用来自不同年龄(1、3、9年)的骆驼胃粘膜粗提物GEC1、3、9对驼乳和牛乳进行凝乳实验,同时用商品化的牛rennet(80%凝乳酶、20%胃蛋白酶)和商品化牛胃蛋白酶作对照,结果发现GEC9骆驼胃蛋白酶的粗提物对驼乳和牛乳的凝乳效果最好,GEC9凝乳活力为牛rennet的2倍,但对牛乳的蛋白水解活力才是其58.3%。对重组骆驼凝乳酶的蛋白水解活力检测也证实了其蛋白水解活力低于牛凝乳酶[2,14]。
关于黑曲霉表达的重组骆驼凝乳酶的最适作用温度和pH、热稳定性、pH稳定性、c/p值等情况见表2。
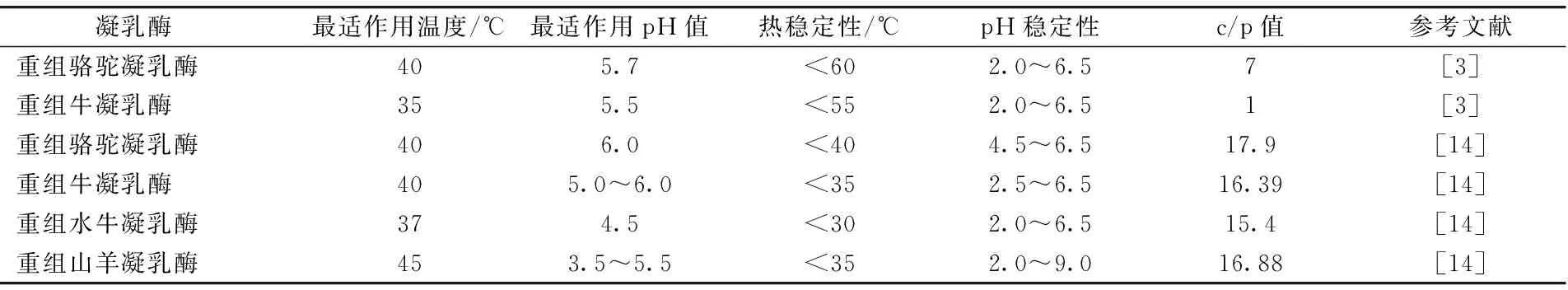
表2 几种重组凝乳酶的酶学特性
注:重组骆驼凝乳酶和牛凝乳酶由黑曲霉表达,重组水牛凝乳酶和山羊凝乳酶由毕赤酵母表达。
从表2看出,骆驼凝乳酶的热稳定性和c/p值高于牛凝乳酶。但关于骆驼凝乳酶的催化效率,有不同的报道。VALLEJO等人[14]比较了4种重组凝乳酶催化效率,底物为牛κ酪蛋白,结果山羊凝乳酶最高,而骆驼凝乳酶最低。KAPPELER等人[3]以合成的牛和骆驼κ酪蛋白P8-P3′的11个氨基酸多肽为底物,检测骆驼凝乳酶和牛凝乳酶的催化效率为152 mM-1s-1和268 mM-1s-1。MØLLER等人[15]以牛κ酪蛋白为底物,通过计算凝乳酶切割牛乳κ-酪蛋白产生的副-κ-酪蛋白和糖巨肽的产生量,得出骆驼凝乳酶催化效率比牛凝乳酶高15%。
3 骆驼凝乳酶对牛乳中主要乳蛋白水解的肽谱分析
3.1 κ-CN水解肽谱
MØLLER等人[15]用毛细管电泳和反相液相色谱-质谱技术分析了CC和BC作用于牛乳κ-CN的最初水解位点(pH6.5,32 ℃)。结果显示2种酶均对κ-CN进行特异性剪切,即切割κ-CN的Phe105-Met106之间的肽键,产生副-κ-CN和糖巨肽。
3.2 αs1-CN水解肽谱
MØLLER等人[16]采用CC和BC水解αs1-CN 24 h(pH6.5,30 ℃),将pH4.6-可溶性氮进行毛细管电泳和反相高效液相色谱分析,结果见表3。

表3 CC和BC水解αs1-CN 24 h的水解肽数[16]
分析水解肽段序列得出,CC和BC都优先水解αs1-CN的Phe23-Phe24肽键,继而水解Leu101-Lys102肽键,产生的f102-199,经BC继续水解最终检测到14条肽,而CC只检测到4条,二者共有肽3条。即 CC和BC对αs1-CN的水解位点开始保持一致,只在水解后期出现各自水解特异性。
3.3β-CN水解肽谱
CC和BC优先水解β-CN中的Leu192-Tyr193,从而导致疏水性f193-209肽的大量积累。BC在水解进行的12 h内即可完全水解β-CN,但CC对该肽的水解速率只有BC的7%。接下来,CC水解的肽键是Leu165-Ser166和Phe190-Leu191,对BC来说,其后续水解的肽键是Leu165-Ser166、Gln167-Ser168和Ala189-Phe190。最后,f1-192会被CC和BC在Ser57-Leu58、Leu163-Ser164和Trp143-Met144处切割,而BC还会在Ser142-Typ143位点切割,得到最终的水解肽谱。
3.4 骆驼凝乳酶制备干酪苦味较低的原因分析
干酪制备时,极少量存留于凝块中的凝乳酶会在干酪成熟过程中水解凝乳里αs1-CN和β-CN。已知这些蛋白水解肽中有些肽会造成干酪的苦味,影响干酪的口感。已报道用CC制备的干酪比BC制备的干酪,苦味少、硬度高,结合上述CC和BC对乳蛋白的水解肽谱分析,解释如下:
(1)在相同的酶浓度下(IMCU),比较CC和BC水解αs1-CN和β-CN最初位点的水解速率,CC水解速率只相当于BC的36%和7%,这样,经历相同的干酪成熟时间,CC可能水解产生的苦味肽数量少;
(2)BC水解β-CN的肽谱中存在f168-189和f190-192,而CC的水解肽谱中没有这两个肽,MØLLER等人认为这2种疏水肽增加了干酪的苦味;
(3)在pH5.2的条件下,BC对β-CN深度广泛水解,切割β-CN中的93-94和127-128之间的肽键,这可能是干酪苦味增加的重要因素,若使用CC则可能不会切割这2个位点[16]。
4 骆驼凝乳酶与κ-CN底物特异结合的分子研究
4.1 结合位点的命名
为方便而清楚描述酶的活性位点与κ-CN结合情况,SCHECHTER和BERGER对酶与底物结合的AA进行了命名。从κ-CN剪切位点算起,往κ-CN N-端方向,依次AA命名为P1、P2、P3……Pn,往κ-CN C-端方向,依次AA命名为P1′、P2′、P3′……Pn′。举例:骆驼κ-CN的剪切位点为Phe97-Ile98,那么Ser96、Phe97、Ile98和Ala99 就命名为SerP2、PheP1、IleP1′和Ala P2′。同理与κ-CN P1、P2、P3……Pn相互作用的酶活性裂隙中的亚位点结构(subsite)依次命名为S1、S2、S3……Sn和S1′、S2′、S3′……Sn′。由于酶对底物的特异性结合与酶的亚位点结构有关,故这些亚位点结构又被称为“特异性口袋”(specificity pocket)[2,11]。
4.2 骆驼凝乳酶与κ-CN的亲和力
MØLLER等人[15]根据凝乳酶切割牛乳κ-CN产生的副-κ-CN和糖巨肽的产生量,计算出CC和BC的Km和Kcat。结果显示CC与牛κ-CN结合的亲和力比BC与牛κ-CN结合的亲和力(Km)低约30%,但结合的转换数(Kcat)却高出60%,这样,计算酶的催化效率(Kcat/Km),CC高出约15%。在局部,CC表面负电荷丛(cluster)的电子密度低,可能减弱了与牛κ-酪蛋白C端的His-Pro正电荷丛的静电作用,这样降低了CC对底物的亲和力,加速了酶与底物的解离。
4.3 骆驼凝乳酶的表面静电荷
JENSEN等人[11]在pH6.65(牛乳的生理pH)条件下计算CC和BC的表面静电荷总值和pI值,CC为-9ec和4.8,BC为-15ec和5.4。CC的表面正电荷区域比BC更大,其原因可能是:在凝乳酶的C端,CC的56位为His,而BC是Gln,即此处CC多了1个带正电荷的AA;在凝乳酶的N端,CC的249和251位分别为不带电的Asn和Gly,而BC此处为两个Asp,带负电荷;同时,BC中242、254、278 的这3个位点都不带电荷,而CC中为3个带正电的AA(Arg、Arg和Lys),由此形成了1个新的正电荷区域;在凝乳酶的底部,BC中的150和316位分别是2个不带电荷的AA,而CC为2个Arg,又形成了1个正电荷区域[11]。
凝乳酶在κ-CN的Phe105-Met106位点进行切割,研究显示κ-CN酶切位点附近有几个带正电荷的AA,而pH6.65环境下凝乳酶表面总体静电荷为负,这样有利于二者相互作用。但κ-CN的C端由于存在几个Asp和Glu而表现出带负电荷特性,可能因此会出现与凝乳酶的相互排斥。因CC表面负电荷较少,该排斥会明显小些。然而,从CC和BC表面带正电荷区域来看,正电荷区域可能正好位于底物结合裂隙外部,这也许能帮助酶调整方向使得酶表面的正电荷与κ-CN的C端负电荷作用。一般认为凝乳酶C端区域的负电荷丛与κ-酪蛋白His98-His102正电荷丛之间的静电吸引,对酶与底物的特异结合有重大作用。SAFRO等[17]提出,κ-CN His98-His102正电荷丛接近凝乳酶的Gln240-Cys250,从而定置在酶表面活性位点裂隙的附近,因为Gln240-Cys250酸性残基电子密度的明显改变,造成酶伸展,似乎更适合底物在活性位点靠静电作用定位。JENSEN等人[11]还强调了Glu245、Asp247、Asp249和Asp251对吸引κ-CN His-Pro正电荷丛的作用。综上,κ-CN带负电荷的C端,其既被凝乳酶表面的正电荷吸引,又被负电荷排斥,这样有利于κ-CN结合到酶的活性位点的C端。CC底部的带正电荷区域对吸引κ-CN负电荷的C端可能也很重要。故CC表面存在更多的正电荷区域,这似乎对CC较BC高的凝乳活力做了一些解释[11]。还有,CC表面的负电荷丛比较BC不是很适合与κ-CN His98-His102正电荷丛相互作用,这样可能使酶与底物亲和力(Km)弱,同时可能造成水解完成后酶与底物的更快解离(Kcat),这也给我们改进酶的凝乳活力提供了一条新思路。
BØRSTING等人[18]研究不同乳液pH对存留在凝乳中骆驼凝乳酶酶量影响,以BC为对照。乳液设定不同pH,用相同凝乳酶活力的CC和BC凝乳后离心,检测乳清中的凝乳酶活力(以合成肽Pro-Thr-Glu-Phe-(NO2-Phe)-Arg-Leu为底物,HPLC检测催化产物的量),结果发现乳液pH为6.00~6.65时,CC存留在凝乳中的量非常恒定,约20%,而牛凝乳酶的残留量却几乎呈线性上升,从2%增至21%。作者分析,CC对pH的低依赖性可能是由于CC分子带负电荷的量少于BC之故。
4.4 凝乳酶/κ-CN片段复合物模型
PALMER等人[19]先前建立了牛凝乳酶和牛κ-CN片段复合物的模型,该模型符合已有的牛凝乳酶实验数据。SØRENSEN等[2]人采用同源模型和分子动力模拟技术,对CC、BC分别与牛、骆驼κ-CN片段形成的复合物进行分析。κ-CN片段选取切割位点附近的16AA肽,序列见图4。复合物表示形式为:凝乳酶/κ-CN,则4种复合物分别是BOV/BOV、BOV/CAM、CAM/CAM和CAM/BOV(BOV代表牛凝乳酶和牛酪蛋白片段,CAM代表骆驼凝乳酶和骆驼酪蛋白片段)。建立的同源模型将BOV/BOV当作比对模板。

图4 κ-CN片段的序列Fig.4 The AA sequence of the κ-CN图中箭头处为酶的切割位点
分析复合物中酶的波动性,发现波动大的区域为loop和转角。总体上,酶的动力学非常相似,只有在酶的C端波动存在较明显差异。同时复合物中的P3-P2′残基都很稳定,但结合裂隙靠外部的残基波动大,这也说明底物与酶的结合并不是非常坚固,BOV/CAM和CAM/BOV都是在酶的C端、κ-CN片段N端显现出较大波动。通过模型分析,4种酶与底物复合物结构相似,BOV/BOV、CAM/CAM和CAM/BOV复合物结合稳定,BOV/CAM在结合亚位点比较其它模型较不稳定,原因可能是由于牛凝乳酶221位的Lys残基与骆驼κ-CN P4位上的Arg残基之间存在电荷排斥而导致[2]。
4.5 凝乳酶/κ-CN复合物的结合自由能研究
SØRENSEN等人[20]使用分子力学Poisson-Boltzmann表面积法(molecular mechanics Poisson-Boltzmann surface area ,MM-PBSA)计算BOV/BOV和CAM/BOV复合物中酶与底物结合的自由能(ΔG)。BOV/BOV的ΔG为-42.8 kcal/mol,CAM/BOV的ΔG为-33.4 kcal/mol,表明BOV/BOV结合力更强。其又用丙氨酸扫描计算(alanine scanning calculations)方法来分析BOV/BOV和CAM/BOV复合物中各个残基对结合自由能的贡献。丙氨酸扫描计算结果用ΔΔG表示,描述将复合物中的残基突变为Ala后结合自由能的改变。ΔΔG为负数时,表示突变结果能增强酶与底物的结合,ΔΔG为正数时,表示突变结果减弱酶与底物的结合。复合物中的牛κ-CN片段为97-112肽,序列为R-H-P-H-P-H-L-S-F-M-A-I-P-P-K-K,将其中的7个AA残基突变为Ala来计算自由能的变化(突变残基见图5),这相当于把CC和BC的一级结构的差异通过能量学进行近似的量化。
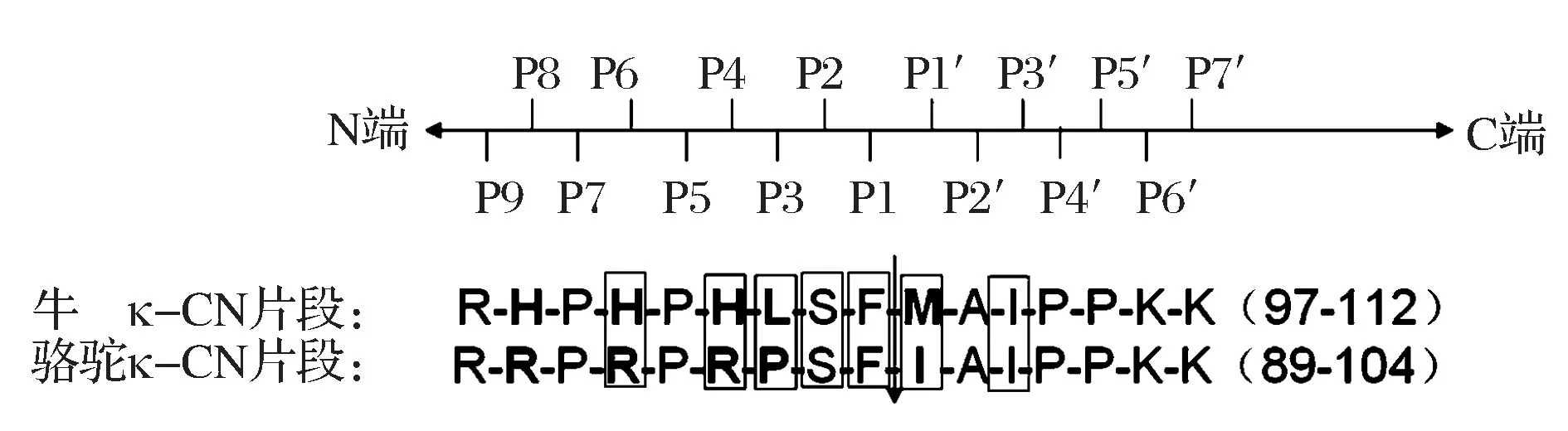
图5 突变κ-CN残基Fig.5 The mutated residues in the κ-CN(框内的残基为突变残基,箭头处表示酶的切割位点)
在所有替换中,只有BOV/BOV中HisP4Ala突变的ΔΔG为负,其它均为正。将极性和非极性能分开比较,单看极性能(ΔEpolar)发现HisP4、LeuP3、PheP1和MetP1′突变为Ala时能量变化对结合有利。这暗示运用突变去除不利的极性作用,而保留非极性作用,将有望提高结合自由能。比如说,将一个极性AA用一个大小相同的非极性AA替换,对凝乳酶分子进行蛋白质改造。
5 骆驼凝乳制备干酪的研究
随着人们对健康和安全要求的提高,CC运用到低脂、低盐干酪制备工艺中,并与改进发酵剂共同促进干酪优良质地与风味的形成。
BØRSTING等[21]用CC加工的低脂切达干酪,蛋白酶解程度较低,苦味少,但断裂应力较高,表现为较硬的干酪质构。然而用BC加工的低脂切达干酪,由凝乳酶催化作用释放的苦味肽β-CN(f193-209),或者由发酵剂蛋白酶产生的αS1-CN (f1-23) 肽含量都较高,干酪的质构较软。
GOVINDASAMY-LUCEY等[22]用CC制备低脂cheddar干酪(牛乳中脂肪含量0.5%,酪蛋白和脂肪比例为5∶1),用BC作为对照,结果显示干酪的成分与pH值二者无差异,质构分析数据显示,两种干酪的硬度和咀嚼性随着干酪成熟不断下降,但CC制备干酪的这两个参数均高于BC制备干酪。感官分析,CC制备干酪苦味少,并且更耐嚼,BC制备干酪质地软些。CC制备干酪中苦味虽然降低了,但没有完全消除。
MOYNIHAN等[23]用CC制作低水分-部分脱脂(LMPS)Mozzarella干酪,成熟期间的总钙和可溶性钙、pH、水分均无差别。成熟84 d,二者的熔化特性相似,制作披萨时,CC制备干酪起泡少,坚固并耐嚼。同时CC制备干酪在焙烤披萨表现出的特性,包括起泡性、干酪丝的厚度、硬度和咀嚼性均可以在更长的成熟期得以维持,故延长了干酪的货架期。
为了抵消低盐(0.85%w/w,正常为1.8%w/w)契达干酪的负面感官,MBØLLER等[24]使用不含谷氨酸盐脱羧酶的发酵剂与骆驼凝乳酶,并联合使用瑞士乳杆菌LactobacillushelveticusCHCC 4481 和戊糖乳杆菌LactobacilluspentosusCHCC 13992制备干酪。结果骆驼凝乳酶能大大降低苦味肽β-CN(f193-209)和αS1-CN(f1-9)的形成,同时瑞士乳杆菌提高了对这些苦味肽的降解,增加了风味氨基酸的释放量,因为使用的发酵剂不含谷氨酸盐脱羧酶,从而积累了更多的游离谷氨酸。戊糖乳杆菌在成熟的150 d内成功地将柠檬酸全部转化为风味增强物质——琥珀酸盐。作者认为运用上述的发酵剂、辅助发酵剂和凝乳酶,其相互补充、联合作用具备改进低盐干酪质地的潜力。
6 展望
重组骆驼凝乳酶的克隆与纯化开辟了凝乳酶研究的新方向,它目前成功地成为了小牛凝乳酶的替代品并已用来工业化制备干酪。对其高凝乳活力和高催化效率的探索可以让人们对现有的凝乳酶进行蛋白质工程改造,创造出具更高凝乳活力、更低非特异蛋白水解活力、加工特性稳定以及能作用不同底物(如驼乳κ-酪蛋白等)的新型酶。
[1] KAGEYAMA T. Pepsinogens, progastricsins, and prochymosins: structure, function, evolution, and development[J]. Cellular and Molecular Life Sciences CMLS, 2002, 59(2): 288-306.
[2] SØRENSEN J, PALMER D S, QVIST K B, et al. Initial stage of cheese production: a molecular modeling study of bovine and camel chymosin complexed with peptides from the chymosin-sensitive region of κ-casein[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5 636-5 647.
[3] KAPPELER S R, van den BRINK H, RAHBEK-NIELSEN H, et al. Characterization of recombinant camel chymosin reveals superior properties for the coagulation of bovine and camel milk[J]. Biochemical and Biophysical Research Communications, 2006, 342(2): 647-654
[4] BANSAL N, KRAKE M A, PIRAINO P, et al. Suitability of recombinant camel (camelus dromedarius) chymosin as a coagulant for cheddar cheese[J]. International Dairy Journal, 2009, 19: 510-517.
[5] KAPPELER S, FARAH Z, van den BRINK J M, et al. Method of producing non-bovine chymosin and use hereof: U.S. Patent 7,270,989[P]. 2007-9-18.
[6] BROE M L, van den BRINK J, HARBOE M K. Coagulation of Milk: United States, US2011/0008492 A1[P].2011-1-13.
[7] HARTSUCK J A, KOELSCH G, REMINGTON S J. The high-resolution crystal structure of porcine pepsinogen[J].Proteins,1992, 13(1):1-25.
[8] RICHTER C, TANAKA T, YADA R Y. Mechanism of activation of the gastric aspartic proteinases: pepsinogen, progastricsin and prochymosin[J]. The Biochemical Journal, 1998, 335: 481-490.
[9] NEWMAN M, SAFRO M, FRAZAO C, et al. X-ray analyses of aspartic proteinases IV: Structure and refinement at 2.2 Åresolution of bovine chymosin[J]. Journal of Molecular Biology, 1991, 221(4): 1 295-1 309.
[10] GILLILAND G L, WINBOME E L, NACHMAN J, et al. The three‐dimensional structure of recombinant bovine chymosin at 2.3 Å resolution[J]. Proteins: Structure, Function, and Bioinformatics, 1990, 8(1): 82-101.
[11] JENSEN J L, MØLGAARD A, POULSEN J N, et al. Camel and bovine chymosin: the relationship between their structures and cheese-making properties[J]. Acta Crystallographica Section D: Biological Crystallography, 2013, 69(5): 901-913.
[12] WANGO J, FARAH Z, PUHAN Z. Extraction of camel rennet and its comparison with calf rennet extract[J]. Milchwissenschaft, 1993 ,48 (6): 322-325.
[13] SALIHA B H, LOUIS L C, FARIDA M M, et al. Comparative study of milk clotting activity of crude gastric enzymes extracted from camels' abomasum at different ages and commercial enzymes (rennet and pepsin) on bovine and camel milk[J]. Emirates Journal of Food & Agriculture (EJFA), 2011, 23(4): 301-310.
[14] VALLEJO J A, AGEITOS J M, POZA M, et al. Short communication: A comparative analysis of recombinant chymosins[J]. Journal of Dairy Science, 2012, 95(2): 609-613.
[15] MØLLER K K, RATTRAY F P, SØRENSEN J C, et al. Comparison of the hydrolysis of bovine K-casein by camel and bovine chymosin: a kinetic and specificity study[J]. Journal of Agricultural and Food Chemistry, 2012, 60(21): 5 454-5 460.
[16] MØLLER K K, RATTRAY F P, ARDÖ Y. Camel and bovine chymosin hydrolysis of bovine a SI-and ß-caseins studied by comparative peptide mapping[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 11 421-11 432.
[17] SAFRO M G, ANDREEVA N S. On the role of peripheral interactions in specificity of chymosin[J]. Biochemistry International,1990, 20(3):555-561.
[18] BØRSTING M W, QVIST K B, ARDÖ Y. Influence of pH on retention of camel chymosin in curd[J]. International Dairy Journal, 2014, 38(2):133-135.
[19] PALMER D S, CHRISTENSEN A U, SØRENSEN J, et al. Bovine chymosin: a computational study of recognition and binding of bovine κ-casein[J]. Biochemistry, 2010, 49(11): 2 563-2 573.
[20] SØRENSEN J, PALMER D S, SCHIØTT B. Hot-spot mapping the interactions between chymosin and bovine kappa-casein[J]. Journal of Agricultural and Food Chemistry, 2013, 61: 7 949-7 959.
[21] BØRSTING M W, QVIST K B, RASMUSSEN M, et al. Impact of selected coagulants and starters on primary proteolysis and amino acid release related to bitterness and structure of reduced-fat Cheddar cheese[J]. Dairy Science & Technology, 2012, 92(5): 593-612.
[22] GOVINDASAMY-LUCEY S, LU Y, JAEGGI J J, et al. Impact of camel chymosin on the texture and sensory properties of low-fat cheddar cheese[J]. Australian Journal of Dairy Technology, 2010, 65(3): 139-142.
[23] MOYNIHAN A C, GOVINDASAMY-LUCEY S, JAEGGI J J, et al. Effect of camel chymosin on the texture, functionality, and sensory properties of low-moisture, part-skim Mozzarella cheese[J]. Journal of Dairy Science, 2014, 97(1): 85-96.
[24] MØLLER K K, RATTRAY F P, ARDÖ Y. Application of selected lactic acid bacteria and coagulant for improving the quality of low-salt Cheddar cheese: Chemical, microbiological and rheological evaluation[J]. International Dairy Journal, 2013, 33(2): 163-174.
Research progress on molecular structure and Cheese-making of the camel chymosin
PU Yan,MA Xiao-lin, ZHANG Fu-chun*,LI Yi-jie
(Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology, Xinjiang University,Urumqi 830046,China)
The preliminary structure and three dimensional structure of camel chymosin are similar to that of bovine chymosin, but their affinity and catalytic rate acting on bovine casein are different significantly. Studying the difference between the both chymosins on molecular level has great significance for chymosin protein engineering in future. The cheese made with camel chymosin has less bitter taste. Now combination of camel chymosin and the improved cheese starter to produce new type of low-fat, low salt cheese will be a new way for development of cheese in future. The progress of the structure and enzymatic properties of camel chymosin, the molecular basis of interaction between the substrates and enzyme,as well as the cheese made with the camel chymosin were reviewed in this paper.
chymosin; camel; affinity; crystal structure; cheese
10.13995/j.cnki.11-1802/ts.201610038
博士,讲师(张富春为通讯作者,E-mail:zfcxju@gmail.com)。
新疆大学博士启动基金(BS150237);国家自然科学基金(31560440)
2016-03-19,改回日期:2016-04-27
