Xp11.2易位/TFE3基因融合相关性肾癌两例报告并文献复习
2016-12-02杨昭伟孔雪魏文焕孙丹殷磊李泽良孔垂泽
杨昭伟 孔雪 魏文焕 孙丹殷磊 李泽良 孔垂泽
1中国医科大学附属第一医院泌尿外科 110001 沈阳
论 著
Xp11.2易位/TFE3基因融合相关性肾癌两例报告并文献复习
杨昭伟1孔雪1魏文焕1孙丹1殷磊1李泽良1孔垂泽1
1中国医科大学附属第一医院泌尿外科 110001 沈阳
目的:探讨肾癌的罕见类型Xp11.2易位/TFE3基因融合相关性肾癌的临床病理特点、治疗及预后。方法:对本院确诊的2例Xp11.2易位/TFE3基因融合相关性肾癌的临床资料进行回顾性分析并对相关文献进行复习。结果:两例均为左侧,例1确诊时已有远处转移,采用左肾姑息性切除术,例2采用根治性左肾切除术,免疫组化染色检查均表达TFE3。例1术后随访11个月,病情进展,骨转移加重;例2术后随访12个月,未见复发及远处转移。结论:Xp11.2易位/TFE3基因融合相关性肾癌是由Xp11.2染色体易位,导致转录因子E3(TFE3)基因与多种不同的基因融合的罕见肾癌,淋巴结转移多见,恶性程度较高,结合组织学特征、免疫组化检测TFE3(+)、荧光原位杂交技术有助于确诊,靶向治疗此类型肾癌可能有一定疗效,外科手术是治疗此类型肾肿瘤的首选和根治性治疗方案。
Xp11.2易位; TFE3基因融合;肾肿瘤;治疗
Xp11.2易位/TFE3基因融合相关性肾癌罕见,其特点是存在Xp11.2染色体易位,导致转录因子E3(TEF3)基因与多种不同的基因融合[1]。首例Xp11.2易位型肾癌由de Jong等[1]于1986年报道。2015年4~7月我们治疗两例Xp11.2易位/TFE3基因融合相关性肾癌,依据肿瘤大小及位置,行左肾肿瘤切除术,现报告如下。
1 资料与方法
1.1 临床资料
例1 女,28岁。左侧腰腹部酸胀痛8个月于2015年5月19日入院,入院查体左腰部巨大肿物,固定不动,彩超及增强CT示左肾弥漫性增大,皮髓质分界不清、增强后明显不均匀强化,腹膜后不规则软组织影,密度与强化方式与左肾实质相近,左肾动静脉受压包绕(图1),5月20日行左肾肿瘤穿刺活检术,活检病理回报为肾细胞癌(倾向TFE3肾癌),应用靶向药物舒尼替尼近2个月,于2015年7月17日再次入院,彩超及增强CT示左肾大小为13.17 cm×6.63 cm×5.91 cm,皮髓质分界不清,增强后不均匀强化,腹膜后不规则软组织影,密度及强化方式与左肾相近,左肾动静脉受压包绕(图2)。PET-CT提示:左肾上极软组织肿块影,密度不均,代谢增高;左肾门水平肿大融合淋巴结影,代谢增高;肾周筋膜增厚,无代谢增高;肝右后叶密度减低影,局部代谢略增高;第11胸椎密度减低影,代谢增高。

左肾巨大混杂密度占位,增强后不均匀强化,左肾动静脉受压包绕。
图1 例1术前近2个月左肾CT影像学资料
例2 男,57岁。全程无痛肉眼血尿10 d于
2015年4月30日入院,彩超示左肾上极7.47 cm×6.18 cm低回声,界限欠清晰,回声不均匀,内见较丰富彩色血流。CT示等密度或低密度病灶,密度不均,边界模糊,最大径7.0 cm×6.8 cm,部分突出于肾轮廓之外,平扫CT值27~35 Hu,增强后不均匀强化,内见丰富强化血管影,CT值74~101 Hu(图3)。
2 结果
手术方式依据肿瘤大小及位置,两例患者影像学提示肿瘤直径>6 cm,采用左肾切除术,首选腹腔镜下手术,例1肿瘤巨大,左肾动静脉受压包绕,与周围组织分界不清,经靶向药物治疗近2个月肿瘤缩小后,于2015年7月22日行经腹左肾姑息性切除术,术后标本见图4,目前随访至11个月,病情进展,全身骨ECT扫描提示,骨转移较前加重,骨痛症状明显;例2肾肿瘤较大,于2015年5月6日行经腰左肾根治性切除术。
术后病理报告均提示Xp11.2易位/TFE3基因融合相关性肾癌,肉眼观:肾组织内见灰黄灰白色肿物弥漫分布,边界较清楚,可见出血、坏死组织;镜下见癌细胞呈腺泡样、乳头状、泡巢状排列,细胞质透亮及嗜酸性,核大深染,核仁明显,例1见核分裂象,左输尿管壁组织周围见癌细胞巢,左肾上腺周围组织内见癌细胞巢(图5)。两例免疫组化染色示:CD10(+)TFE3(+)CD34(血管+)AMACR(P504S)(+),其中例1 Ki-67(3%);例2 Ki-67(约50%)Vimentin(+)CK(PAN)(+)EMA(+)(图6),例2病理诊断为Xp11.2易位/TFE3基因融合相关性肾癌伴透明细胞性肾细胞癌(3级)。例1确诊时已有远处转移,术后继续接受靶向药物治疗及化疗,术后随访11个月,病情进展,骨转移加重,例2术后随访12个月,未见复发及远处转移。
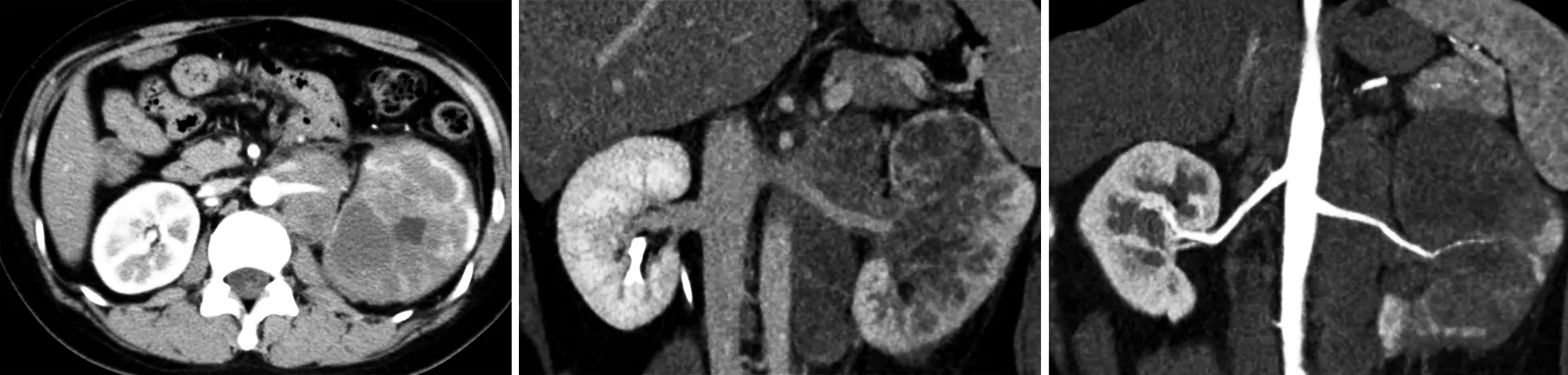
左肾弥漫性增大,增强后不均匀强化,腹膜后不规则软组织影,密度及强化方式与左肾相近,左肾动静脉受压包绕。
图2 应用靶向药物舒尼替尼近2个月后左肾CT影像学资料

图3 增强CT示左肾混杂密度占位,增强后肿物不均匀强化
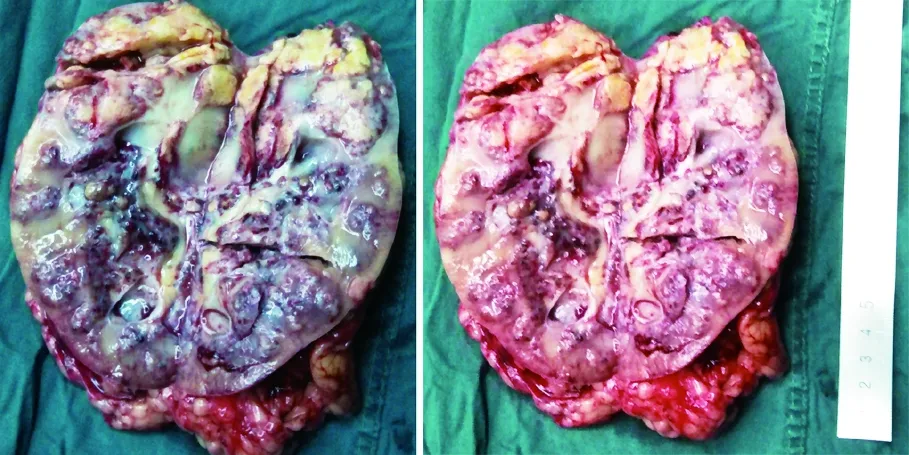
图4 例1术后标本

Xp11.2易位/TFE3基因融合相关性肾癌病理图片 HE×100。
图5 肿瘤细胞呈腺泡样或管状分布,细胞质透亮及细胞质嗜酸性
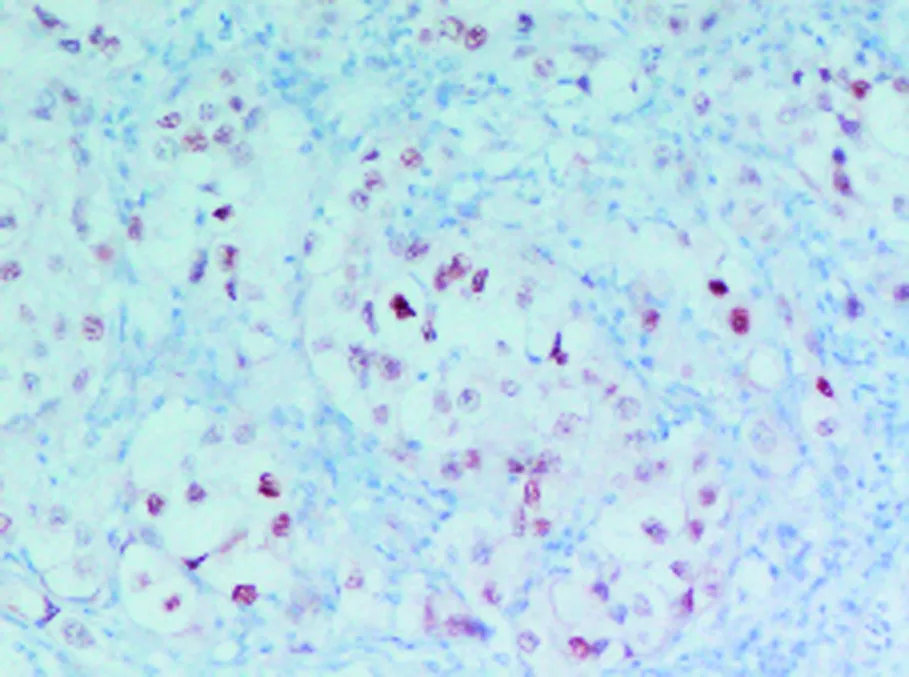
Xp11.2易位/TFE3基因融合相关性肾癌免疫组化染色检查图片,EnVision二步法×400。
图6 肿瘤细胞核TFE3蛋白阳性表达
3 讨论
Xp11.2易位/TFE3基因融合相关性肾癌,是一类罕见的肾细胞癌,其特点是存在Xp11.2染色体易位,导致转录因子E3(TEF3)基因与多种不同的基因融合,1986年由de Jong等首次报道[1],2004年WHO泌尿及男性生殖系统肿瘤分类中将Xp11.2易位/TFE3基因融合相关性肾癌正式列为一个独立的肾癌亚型[2],好发于儿童及青少年[3],约占青少年及儿童肾癌的33.3%[4, 5],占成人肾癌的0.5%~1.5%[6~8 ],女性多于男性,近年来文献报道的发病率有所升高。儿童Xp11.2易位/TFE3基因融合相关性肾癌临床进展较缓慢;成人Xp11.2易位/TFE3基因融合相关性肾癌容易出现淋巴结和远处转移[9],比起其他类型的肾癌,成人中的Xp11.2易位性肾癌恶性较高,预后较差[10]。
Xp11.2易位性肾癌的诊断较为困难,患者可有无痛性肉眼血尿、腰部酸胀痛、绞痛、包块或癌细胞转移性临床症状首发,缺乏特异性的临床表现。这两个病例,例1者病程较久,出现左侧腰腹部酸胀痛,例2出现全程无痛肉眼血尿。影像学检查往往表现为囊实性肿块,中等延长强化,密度不均,部分可见钙化灶。大多数Xp11.2易位性肾癌同时位于肾皮质和髓质,有明确的界限,呈现多样化的包块,包含坏死的成分、囊性、实性的成分和肿瘤内出血,环形钙化在肿瘤内部或肿瘤的周围。超声造影检查显示病灶增强在囊性的部分,这与肾囊肿不同[11];在平扫CT中,肿瘤的密度高于正常的肾皮质或髓质[12]。增强CT中,肿瘤增强低于正常肾皮质在所有增强阶段;高于正常肾髓质在皮质和髓质的期;低于肾皮质或髓质的延迟期[13]。在动态增强CT中,注射造影剂后,Xp11.2易位性肾癌呈现中等延长不均匀强化。在动态增强CT中,乳头状肾细胞癌呈现均匀的少血供包块[14]。徐晓辉等[15]报道增强CT扫描时Xp11.2易位性肾癌强化幅度明显小于肾透明细胞癌,12例 Xp11.2易位性肾癌病例和12例肾透明细胞癌病例的平均CT值增强量分别为(31.75±14.73)Hu和(88.30±31.91)Hu,12例Xp11.2易位性肾癌病例比12例肾透明细胞癌病例的平均CT值增强量小56.55 Hu。本资料两例肿瘤都呈现不均匀强化,造影剂排泄延迟,可见低密度的坏死、囊性成分、肿瘤内出血和强化的实性成分与文献中报道的一致,未见钙化的成分,例1出现淋巴结转移和远处转移,例2的肿瘤CT值增强量47~66 Hu。从影像学上很难区分Xp11.2易位性肾癌和传统型的肾细胞癌,在手术前诊断Xp11.2易位性肾癌具有较大难度[11]。
此类肿瘤均含有Xp11.2染色体易位形成的TFE3融合基因,其中包括t(X;1)(p11.2;q21)可导致PRCC和TFE3基因融合;t(X;17)(p11.2;q25)可导致ASPL与TFE3基因融合;t(X;1)(p11.2;p34)可导致PSF和TFE3基因融合;inv(X)(p11.2;q12)可导致Non O和TFE3基因融合;t(X;17)(p11.2;q23)可导致CLTC和TFE3基因融合,这些融合基因最终表达TFE3融合蛋白[5, 6]。另外一种罕见的易位类型t(X;10) (p11.2;q23)或t(X;3) (p11.2;q23)也有报道,但其融合基因类型未知[16, 17]。在这些融合基因中,ASPL-TFE3[18]和PRCC-TFE3[19]是Xp11.2易位性肾癌最常见的类型。肉眼观肿瘤位于肾皮质或髓质,切面灰黄灰白色,部分组织可见出血、坏死、囊性或钙化。光镜下肿瘤最具特征性组织病理学特征为,ASPL-TFE3 肾癌镜下癌细胞呈乳头状、腺管状和巢状结构排列,嗜酸性细胞质,核仁明显,砂粒体多见。PRCC-TFE3 肾癌镜下癌细胞排列紧凑,核仁不明显,细胞质较少,砂粒体不多。
尽管采用分子生物学方法或染色体分析检测到Xp11.2易位即可以确诊,这种方法费时费力费用高,在临床中难以开展,但肿瘤特征性的高表达TFE3融合蛋白,给我们确诊提供了帮助。Argani等[19, 20]对肾脏肿瘤及肾脏以外的各系统肿瘤研究后发现,其敏感性和特异性分别达到97.5%和99.6%。有学者研究发现,单纯依靠组织学特征和TFE3免疫组化诊断Xp11.2易位性肾癌存在误诊的可能,荧光原位杂交技术可以在基因水平检测出TFE3基因的易位,被认为是诊断Xp11.2易位性肾癌更准确和客观的方法[21~23],因此,免疫组化检测TFE3(+)时,建议进一步做FISH。本研究两例镜下癌细胞呈腺泡样或管状分布,细胞质透亮及细胞质嗜酸性,核大深染,核仁明显,免疫组化TFE3(+),考虑为ASPL-TFE3肾癌,不足之处,未进一步做FISH检测。
Xp11.2易位性肾癌的治疗多采用和传统型的肾细胞癌同样的方式[11]。对于成人转移性Xp11.2易位性肾癌,目前没有一个广泛公认的标准疗法。靶向治疗在Xp11.2易位性肾癌中的应用的报道比较少,处于起步阶段。肾透明细胞癌多见于成人,其特点是VHL抑癌基因的失活,从而导致缺氧反应基因的失调,包括血管内皮生长因子(VEGF)过表达,从而促进肿瘤的生长和进展[24]。靶向血管内皮生长因子(VEGF)抗血管生成药物治疗,对于转移性肾透明细胞癌是药物治疗标准的一线药物;在已经出版的研究中,血管内皮生长因子靶向治疗,对于Xp11.2易位性肾癌,产生多变的疗效[25]。在这两例病例中,对于术前已有远处转移的1例患者给予靶向治疗药物治疗后,部分缓解,瞿元元等[26]报道在3例确诊时已有远处转移的患者术后给予靶向药物治疗后,术后随访1~55个月,中位随访22个月,1例病情稳定,2例部分缓解;有研究显示部分Xp11.2易位/TFE3基因融合相关性肾癌患者在靶向治疗中获益[24]。Tsuda等[27]研究发现ASPL-TFE3,PSF-TFE3和NONO-TFE3融合蛋白结合MET的启动子,上调MET受体酪氨酸激酶的转录表达,促进下游信号蛋白激酶B、3-磷酸酰肌醇激酶以及mTOR代谢途径的活化,进而促进细胞的增殖与分化。MET成为这类型肿瘤的一个潜在的治疗靶点,如:选择性MET酪氨酸激酶抑制剂和RNA干扰介导体外敲除MET。选择性c-MET受体酪氨酸激酶抑制剂tivantinib(ARQ-197)已被证明在I期临床试验的安全性和耐受性好[24]。Bambury等[28]研究发现MET抑制剂tivantinib的2期临床试验,对42例MiT相关性肿瘤患者(包括6例易位肾细胞癌患者)口服MET抑制剂tivantinib,只有1例有部分反应。可能需要我们更进一步研究MET抑制剂对Xp11.2易位性肾癌的作用。外科手术方式的选择依据肿瘤的大小和位置,李世超等[29]对8例Xp11.2易位性肾癌进行回顾性分析,其中3例肿瘤直径大于7 cm,采用根治性肾切除术,1例肿瘤直径约2.5 cm,但位于肾脏中部,也采用根治性肾切除术,4例临床为Ⅰ期,肿瘤直径2~7 cm,采用保留肾单位的肾部分切除术;手术方式首选腹腔镜手术,手术复杂也可选择开放手术,其中6例后腹腔镜手术,其余2例开腹手术,随访6~72个月,无复发、转移。瞿元元等[26]报道37例Xp11.2易位性肾癌,均行手术治疗,其中27例根治性肾切除术,4例保留肾单位的肾部分切除术,3例姑息性肾切除术,2例根治性肾切除术并腹膜后淋巴结清扫术,1例姑息性肾切除术并腹膜后淋巴结清扫术。术后随访1~55个月,中位随访22个月,其中33例存活,4例死亡,死亡患者的比例为10.8%,1例术后15个月死于肾癌复发伴颈部转移,2例分别于术后22、37个月死于肾癌复发伴肺转移,1例术后43个月死于肾癌复发伴肝、肺多部位转移。He等[25]报道22例Xp11.2易位性肾癌,8例开放性根治性肾切除术,10例肿瘤直径腹腔镜根治性肾切除术,4例腹腔镜下保留肾单位的肾部分切除术。15例患者处于临床Ⅰ/Ⅱ期,中位随访34个月(2~85个月),都存活、无复发;7例处于临床Ⅲ/Ⅳ期,其中3例(3/7,42.9%)死于远处转移,中位随访33个月(2~62个月);Xp11.2易位性肾癌患者的总体生存率为86.4%(19/22),中位随访34个月(2~85个月),中位生存时间为84个月,3年和5年的生存率分别为84%和60%。Su等[30]报道8例Xp11.2易位性肾癌,临床Ⅰ/Ⅱ期3例,其中3例诊断时已有淋巴结转移,4例肾根治性切除术,1例保留肾单位手术,3例冷冻消融;1例靶向药物治疗,3例免疫疗法,中位随访29.7个月(11~70个月),无进展生存期(28.4±21.0)个月。Qu等[23]将76例病理可疑Xp11.2易位性肾癌经过免疫组化和FISH检测,确定30例Xp11.2易位性肾癌,23例肾根治性切除术,7例保留肾单位的肾部分切除术;其中18例接受辅助治疗,5例免疫疗法,13例接受靶向药物治疗。另外46例非Xp11.2易位的肾癌组,30例肾根治性切除术,16例保留肾单位的肾部分切除术,其中22例接受辅助治疗,16例免疫疗法,6例接受靶向药物治疗。6例(20%)Xp11.2易位性肾癌确诊时已有远处转移,1例非Xp11.2易位的肾癌确诊时已有远处转移,都接受靶向药物辅助治疗。中位随访26个月(2~85个月),随访期间,30例Xp11.2肾癌病例,8例疾病进展,9例(30%)死于疾病;46例非Xp11.2易位的肾癌,14例疾病进展,2例(4.3%)死于疾病。这30例Xp11.2易位性肾癌组,中位无进展生存期和总生存期,分别为13个月(8.4~17.6个月)和50个月(27.6~72.4个月),未达到非Xp11.2易位的肾癌组。
有研究报道腹腔镜下射频消融辅助肿瘤切除术,对于小的肿瘤(直径<4 cm)和没有远处转移的肿瘤,可能是有效的方法[11]。Xp11.2易位性肿瘤,易发生淋巴结转移和远处转移,恶性程度较高,手术是治疗此类型肾肿瘤的首选治疗方案[31],靶向治疗可能有一定的疗效,应严密长期随访。
[1]de Jong B, Molenaar IM, Leeuw JA, et al. Cytogenetics of a renal adenocarcinoma in a 2-year-old child. Cancer Genet Cytogenet, 1986,21(2):165-169.
[2]Eble JN, Sauter G, Epstein JI, et al. World Health Organization classification of tumors: pathology and genetics of tumors of the urinary system and male genital organs. Lyon: IARC Press, 2004:37-38.
[3]Klaassen Z, Tatem A, Burnette JO, et al. Adult Xp11 translocation associated renal cell carcinoma: time to recognize. Urology, 2012,80(5):965-968.
[4]Klatte T, Streubel B, Wrba F, et al. Renal cell carcinoma associated with transcription factor E3 expression and Xp11.2 translocation: incidence, characteristics, and prognosis. Am J Clin Pathol, 2012,137(5):761-768.
[5]Altinok G, Kattar MM, Mohamed A, et al. Pediatric renal carcinoma associated with Xp11.2 translocations/TFE3 gene fusions and clinicopathologic associations. Pediatr Dev Pathol, 2005,8(2):168-180.
[6]Argani P, Olgac S, Tickoo SK, et al. Xp11 translocation renal cell carcinoma in adults: expanded clinical, pathologic, and genetic spectrum. Am J Surg Pathol, 2007,31(8):1149-1160.
[7]Zou H, Kang X, Pang LJ, et al. Xpl1 translocation renal cell carcinoma in adults: a clinicopathological and comparative genomic hybridization study. Int J Clin Exp Pathol, 2013,7(1):236-245.
[8]Komai Y, Fujiwara M, Fujii Y, et al. Adult Xp11 translocation renal cell carcinoma diagnosed by cytogenetics and immunohistochemistry. Clin Cancer Res, 2009,15(4):1170-1176.
[9]Pwint TP, Macaulay V, Roberts IS, et al. An adult Xp11.2 translocation renal carcinoma showing response to treatment with sunitinib. Urol Oncol, 2011,29(6):821-824.
[10]Qiu Rao, Bing Guan, Zhou XJ, et al. Xp11.2 translocation renal cell carcinomas have a poorer prognosis than non-Xp11.2 translocation carcinomas in children and young adults: a meta-analysis. Int J Surg Pathol, 2010,18(6):458-464.
[11]Xu L, Yang R, Wang W, et al. Laparoscopic radiofrequency ablation-assisted enucleation of Xp11.2 translocation renal cell carcinoma: a case report. Oncol Lett, 2014,8(3):1237-1239.
[12]Zhu QQ, Wang ZQ, Zhu WR, et al. The multislice CT findings of renal carcinoma associated with Xp11.2 translocation/TFE gene fusion and collecting duct carcinoma. Acta Radiol, 2013,54(3):355-362.
[13]Chen X, Zhu Q, Li B, et al. Renal cell carcinoma associated with Xp11.2 translocation/TFEgene fusion: imaging findings in 21 patients. Eur Radiol, 2016,Jun,http://link.springer.com/article/10.1007%2Fs00330-016-4421-4
[14]He J, Zhou K, Zhu B, et al. Dynamic Contrast-Enhanced CT characterization of Xp11.2 translocation/TFE3 gene fusions versus Papillary Renal Cell Carcinomas. Biomed Res Int, 2015,2015:298679.
[15]徐晓晨,甘卫东,李笑弓,等.Xp11.2易位/TFE3基因融合相关性肾癌与肾透明细胞癌的螺旋CT诊断鉴别.现代泌尿外科杂志,2012,17(2):122-124.
[16]Argani P, Ladanyi M. The evolving story of renal translocation carcinomas. Am J Clin Pathol, 2006,126(3):332-334.
[17]Dijkhuizen T, van den Berg E, Wilbrink M, et al. Distinct Xp11.2 breakpoints in two renal cell carcinomas exhibiting X; autosome translocations. Genes Chromosomes Cancer, 1995,14(1):43-50.
[18]Argani P, Antonescu CR, IIIei PB, et al. Primary renal neoplasms with the ASPL-TFE3 gene fusion of alveolar soft part sarcoma: a distinctive tumor entity previously included among renal cell carcinomas of children and adolescents. Am J Pathol, 2001,159(1):179-192.
[19]Argani P, Antonescu CR, Couturier J, et al. PRCC-TFE3 renal carcinomas: morphologic, immunohistochemical, ultrastructural, and molecular analysis of an entity associated with the t(X;1)(p11.2;q21). Am J Surg Pathol, 2002,26(12):1553-1566.
[20]Argani P, Lal P, Hutchinson B, et al. Aberrant nuclear immunoreactivity for TFE3 in neoplasms with TFE3 gene fusions: a sensitive and specific immunohistochemical assay. Am J Surg Pathol, 2003,27(6):750-761.
[21]Green WM, Yonescu R, Morsberger L, et al. Utilization of a TFE3 break-apart FISH assay in a renal tumor consultation service. Am J Surg Pathol, 2013,37(8):1150-1163.
[22]Rao Q, Williamson SR, Zhang S, et al. TFE3 break-apart FISH has a higher sensitivity for Xp11.2 translocation-associated renal cell carcinoma compared with TFE3 or cathepsin K immunohistochemical staining alone: expanding the morphologic spectrum. Am J Surg Pathol, 2013,37(6):804-815.
[23]Qu Y, Gu C, Wang H, et al. Diagnosis of adults Xp11.2 translocation renal cell carcinoma by immunohistochemistry and FISH assays: clinicopathological data from ethnic Chinese population. Sci Rep, 2016,6:21677.
[24]Choueiri TK, Lim ZD, Hirsch MS, et al. Vascular endothelial growth factor-targeted therapy for the treatment of adult metastatic Xpll. 2 translocation renal cell carcinoma. Cancer, 2010,116(22):5219-5225.
[25]He J, Chen X, Gan W, et al. Renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusions: clinical experience and literature review. Future Oncol, 2015,11(24):3243-3252.
[26]瞿元元,张海梁,叶定伟,等.Xp11.2易位/TFE3基因融合相关性肾癌的临床病理特征分析.中华泌尿外科杂志,2014,35(9):641-644.
[27]Tsuda M, Davis IJ, Argani P, et al. TFE3 fusions activate MET signaling by transcriptional up-regulation, defining another class of tumors as candidates for therapeutic MET inhibition. Cancer Res, 2007,67(3):919-929.
[28]Bambury RM, Battley JE, McCarthy A, et al. Translocation renal cell carcinomas: an evolving entity and a member of the microphthalmia transcription factor-associated family of tumors. Clin Genitourin Cancer, 2013,11(3):357-361.
[29]李世超,黄庆波,巩会杰,等. Xp11.2易位/TFE3融合基因相关性肾癌的外科治疗(附8例报告).微创泌尿外科杂志,2015,4(2):114-116.
[30]Su HH, Sung MT, Chiang PH, et al. The preliminary experiences of translocation renal cell carcinoma and literature review. Kaohsiung J Med Sci, 2014,30(8):402-408.
[31]Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update. Eur Urol, 2015,67(5):913-924.
Renal cell carcinoma associated with Xp11.2 translocations/TFE3 gene fusions: a study of 2 cases and review of literature
Yang ZhaoweiKong Xue1Wei Wenhuan1Sun Dan1YinLei1LiZeliang1KongChuize1
(1Department of Urology, the First Affiliated Hospital of China Medical University, Shenyang 110001, China)
Li Zeliang, lzlurology@126.com
Objective: To investigate the clinicopathologic features, treatment and prognosis of renal cell carcinoma associated with Xp11.2 translocations/TFE3 gene fusions. Methods: Two patients with renal cell carcinoma associated with Xp11.2 translocations/TFE3 gene fusions were diagnosed and treated in our institution, and the clinical data were retrospectively analyzed. Results: The renal cell carcinoma of 2 cases reported was located in the left kidney. Case one was diagnosed with distant metastasis and palliative surgery was performed. Case two was given the radical resection of the left kidney. Immunohistochemical examination showed that both patients were positive for TFE3. Two cases were postoperatively followed up for 12 months. The case one had stable clinical condition, and another had no recurrence and distant metastasis. Conclusions: Xp11.2 translocation-associated renal cell carcinoma (Xp11.2 RCC) is characterized by the gene fusions between the transcription factor E3 (TFE3), which is located on the chromosome Xp11.2 and a variety of fusion partners. Xp11.2 RCC is a newly defined rare entity with more lymph node metastasis and higher tumor stage. The diagnosis mainly depends on histopathological characteristics, TFE3-positive immune markers and fluorescenceinsituhybridization technique. Patients with metastatic renal cell carcinoma associated with Xp11.2 translocations/TFE3 gene fusions could benefit from the target therapy. Surgery is the preferred and radical cure for this type of kidney neoplasms.
Xp11.2 translocation; TFE3 gene fusion; kidney neoplasms; treatment
辽宁省科技计划项目(2009225033)
李泽良,lzlurology@126.com
2016-06-30
R737.11
A
2095-5146(2016)05-306-06
