平衡易位携带者61个胚胎植入前遗传学检测周期的结局分析
2023-01-03袁振亚袁牧黄晓洁严为巧宋雪梅
袁振亚 袁牧 黄晓洁 严为巧 宋雪梅
平衡易位是一类常见结构异常染色体疾病,在新生儿中的发生率约为0.2%,在反复妊娠丢失人群中的发生率达到了5%~10%[1-5]。罗氏易位是平衡易位的一种特殊形式。平衡易位携带者产生染色体不平衡配子的概率很高,可能会出现不孕、胚胎停止发育、反复自然流产或出生缺陷,给患者带来痛苦和经济压力[6-7]。胚胎植入前遗传学检测(pre-implantation genetic testing,PGT)技术可在孕前对胚胎进行遗传学检测,筛选整倍体胚胎进行移植,可有效降低易位携带者夫妇的妊娠风险[8]。本研究对50 对平衡易位和罗氏易位携带者的PGT 周期进行研究,深入分析携带者夫妇PGT 周期的临床和实验室数据,探究平衡易位携带者子代胚胎的遗传学特征,为平衡易位携带者的个性化诊疗策略及遗传咨询提供依据。
1 资料与方法
1.1 一般资料
选取2019 年1 月—2021 年12 月在徐州市妇幼保健院生殖医学中心就诊并接受PGT 周期治疗的50 对患者夫妇,每对夫妇其中一方经染色体核型分析确诊为染色体平衡易位或罗氏易位携带者。罗氏易位有17 对夫妇,共完成19 个PGT 周期,纳入罗氏易位组;平衡易位共33 对夫妇,共完成42 个PGT周期,纳入平衡易位组。所有夫妇均签署了相关知情同意书。PGT 及等位基因映射识别胚胎易位状态(mapping allele with resolved carrier state,MaReCs)技术项目的开展通过了徐州市妇幼保健院生殖医学伦理委员会的审查(PGT 批件号:[2018]生殖伦审第(03)号;MaReCs 意见号:XFYJL-2017-02)。
纳入标准:(1)夫妻中有一方明确诊断为染色体平衡易位/ 罗氏易位携带者。(2)患者没有体外受精-胚胎移植的禁忌证。排除标准:(1)复杂易位、夫妻双方同时存在染色体结构异常。(2)具有体外受精-胚胎移植的禁忌证。(3)女方患有影响胚胎着床的相关疾病。(4)其他不适合接受辅助生殖技术的情况。
1.2 方法
使用长方案或拮抗剂方案进行超排卵,采用单精子卵胞浆内显微注射(intra cytoplasmic sperm injection,ICSI)完成受精,使用时差培养系统(Vitrolife,瑞典)进行胚胎培养,参照Gardner 囊胚分级标准[9]进行评分,对评级为4BC 或4CB 及以上的囊胚进行外滋养层细胞活检。使用二代测序平台(Illumina,美国)对活检产物进行PGT 检测,筛选出整倍体胚胎后,结合胚胎动态发育情况和形态学评分综合进行二次筛选,择优进行移植。对要求鉴别易位携带状态胚胎的夫妇,在PGT 检测完成后进行MaReCs,选择正常核型胚胎进行移植。移植后定期进行B 超检查和随访,孕中期进行羊水穿刺术,检测胎儿的染色体核型。
1.3 观察指标
对罗氏易位组与平衡易位组男方年龄、女方年龄、身体质量指数(body mass index,BMI)、基础内分泌水平:卵泡刺激素(follicle-stimulating hormone,FSH)、雌二醇(estradiol,E2)、孕激素(progestin,P)、黄体生成素(luteinizing hormone,LH)、抗苗勒氏管激素(anti-Müllerian hormone,AMH)、窦卵泡数(antral follicle counting,AFC)、D0 获卵总数、MII 数、2PN 数、D3 优胚数、囊胚形成数、活检囊胚数、整倍体率、非整倍体率、易位相关异常胚胎占非整倍体的比率、临床妊娠率、活产率、流产率进行分析。
1.4 统计学方法
使用SPSS 22.0 统计学软件,计量资料男方年龄、女方年龄、BMI、基础内分泌水平(FSH、E2、P、LH、AMH)、AFC、D0获卵总数、MII 数、2PN 数、D3 优胚数、囊胚形成数、活检囊胚数以M(P25,P75)表示,行Kruskal-Wallis 检验,计数资料整倍体率、非整倍体率、易位相关异常胚胎占非整倍体的比率、临床妊娠率、活产率、流产率以n(%)表示,对整倍体率、非整倍体率、易位相关异常胚胎占非整倍体的比率行χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料比较与体外受精结果
罗氏易位和平衡易位组患者女方年龄、男方年龄、BMI、基础内分泌水平(FSH、E2、P、LH、AMH)、AFC 差异均无统计学意义(P>0.05),有可比性,见表1。
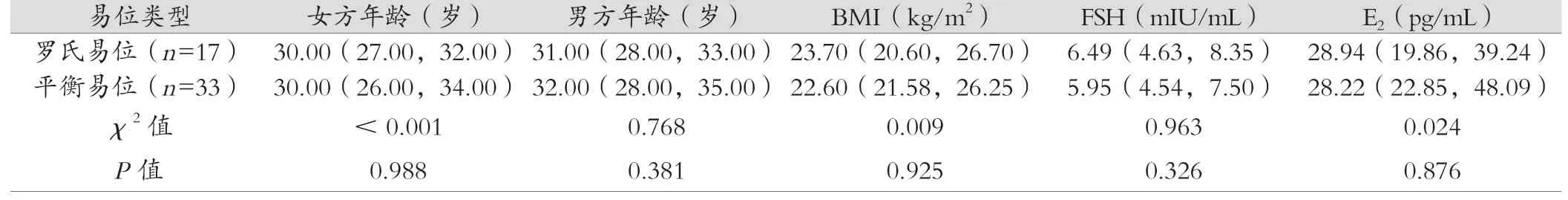
表1 平衡易位/罗氏易位携带者临床信息比较 M(P25,P75)
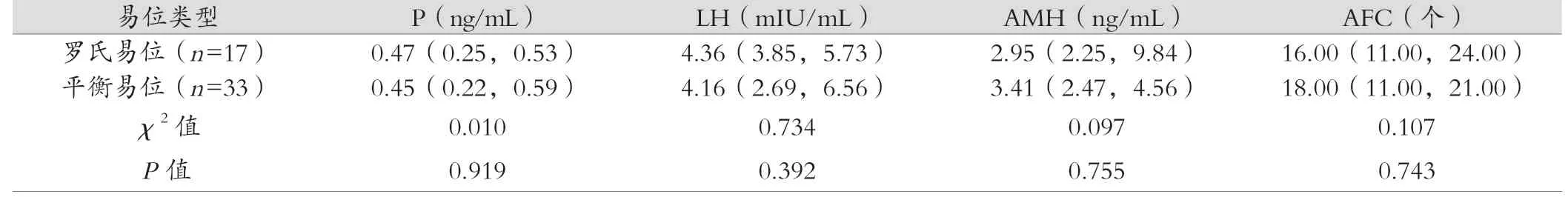
表1 (续)
罗氏易位组和平衡易位组获卵总数、MII 卵数、2PN 数、D3 优质胚胎数、形成囊胚数、活检囊胚数差异均无统计学意义(P>0.05),见表2。
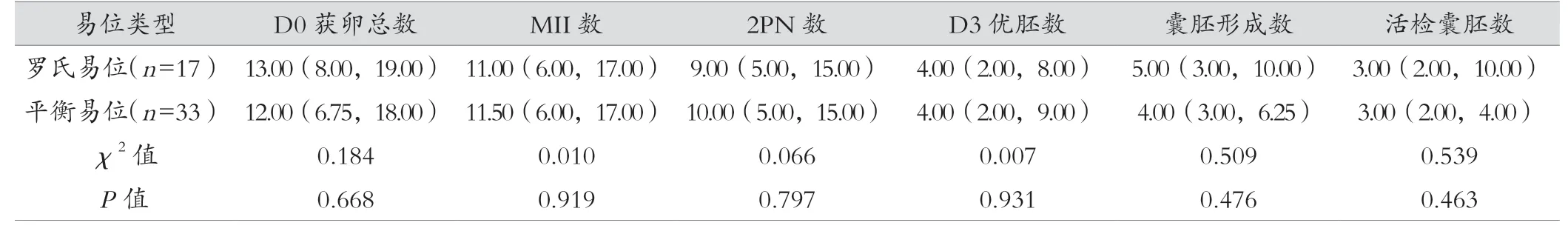
表2 平衡易位/罗氏易位携带者实验室数据 M(P25,P75)
2.2 PGT 与MaReCs 结果
2.2.1 两组整倍体率、非整倍体率及易位相关异常占比情况 罗氏易位组共活检了100 个囊胚,其中整倍体64 个,非整倍体26 个,嵌合体10 个。平衡易位组共活检了159 个囊胚,其中整倍体50 个,非整倍体98 个,嵌合体11 个。PGT 结果显示,罗氏易位组整倍体率显著高于平衡易位组,非整倍体率显著低于平衡易位组,且罗氏易位组非整倍体囊胚中,易位相关异常占比显著低于平衡易位组,差异有统计学意义(P<0.05),见图1。
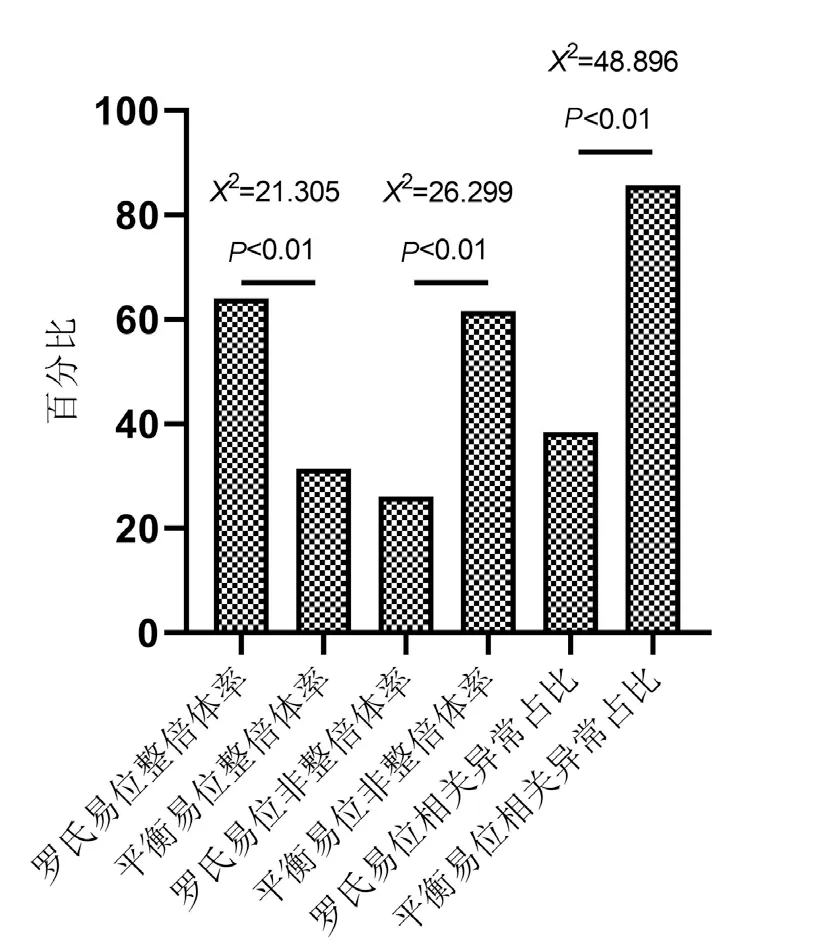
图1 两组整倍体率、非整倍体率及易位相关异常占比情况
2.2.2 平衡易位/罗氏易位携带者核型分析情况 在19 个罗氏易位PGT 周期中,4 周期是女方罗氏易位,15 周期为男方罗氏易位;13 周期要求进行MaReCs,其中5 周期的易位染色体遗传自母亲,3 周期遗传自父亲,5 周期为新发型易位;6周期不要求MaReCs,携带者父母未进行染色体核型分析。在42 个平衡易位PGT 周期中,22 周期是女方平衡易位,20 周期为男方平衡易位;26 周期要求进行MaReCs,其中4 周期的易位染色体遗传自母亲,9 周期遗传自父亲,13 周期为新发型易位;16周期不要求MaReCs,携带者父母未进行染色体核型分析,见表3。

表3 平衡易位/罗氏易位携带者核型分析情况
2.2.3 平衡易位/罗氏易位MaReCs 情况统计 罗氏易位组有12 个周期成功完成MaReCs,包括8 个遗传型和4 个新发型周期。1 个周期识别失败原因为:新发型易位,且当次周期没有足够的易位相关异常胚胎。平衡易位组13 个周期成功完成MaReCs,包括8 个遗传型和5 个新发型周期。有13 个周期识别失败,原因为:其中5 个新发型和5 个遗传型周期已完成易位染色体SNP 单体型构建,但当次周期没有整倍体胚胎,无法区分;2 个新发型周期当次无易位相关异常胚胎,且无整倍体胚胎;1 个新发型周期虽然当次有1 个整倍体胚胎但无易位相关异常胚胎,无法区分,见表4。
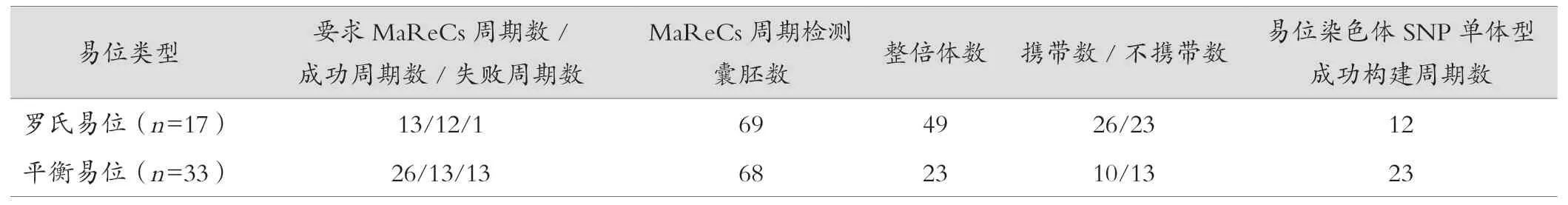
表4 平衡易位/罗氏易位进行MaReCs 情况统计
2.3 移植结局
目前,已有15 对罗氏易位携带者夫妇和18 对平衡易位携带者夫妇获得了单个整倍体囊胚的移植。罗氏易位组中,进行MaReCs 的9 例接受了正常核型囊胚,未进行MaReCs 的6 例接受了整倍体囊胚移植。有13 例获得了宫内妊娠,临床妊娠率达到了86.67%(13/15),11 例顺利分娩,活产率为73.33%(11/15),流产率为15.38%(2/13),产前诊断结果与PGT 结果一致,侵入性产前诊断率达到100%。
平衡易位组中,进行MaReCs 的10 例接受了正常核型囊胚移植,未进行MaReCs 的8 例接受了整倍体囊胚移植。有15 例获得了宫内妊娠,临床妊娠率达到了83.33%(15/18),13 例顺利分娩,活产率为72.22%(13/18),流产率为13.33%(2/15),产前诊断结果与PGT 结果一致,侵入性产前诊断率达到100%。
3 讨论
染色体平衡易位是导致不良妊娠的主要遗传学因素之一[10-11]。因此,虽然罗氏易位和平衡易位夫妇有机会生育正常表型子代,但往往面临着极大的妊娠风险,同时易位染色体有几率向后代遗传,易位携带核型的子代到了育龄期,将面临和亲代同样的生育困扰。
本研究严格遵循了2018 年《胚胎植入前遗传学诊断/筛查技术专家共识》规定的相关临床执行标准[12]。通过对罗氏易位和平衡易位携带者61 个PGT 周期进行了分析,积累了一定的临床经验。多项研究结果显示,罗氏易位和平衡易位通过PGT 周期获得可移植囊胚的概率为20%~60%[5,8,10]。本研究显示罗氏易位和平衡易位携带者分别可获得64.00%和31.45%整倍体率,与其他同类研究结果相近。罗氏易位和平衡易位组移植后的临床妊娠率分别达到了86.67%和83.33%,且产前诊断与PGT 结果均一致,活产率分别达到了73.33%或72.22%,证明PGT 技术可显著提高罗氏易位和平衡易位携带者妊娠率,降低流产率,提高活产率[10,13-14]。
在遗传咨询过程中,有68.42%(13/19)的罗氏易位携带者和61.90%(26/42)的周期患者要求在PGT 后加做MaReCs,以期获得核型正常的胚胎移植,彻底阻断易位染色体在家族中的传递。本研究发现,相比于罗氏易位携带者,平衡易位携带者子代胚胎有较低的整倍体率和较高的非整倍体率,且由易位导致的染色体不平衡胚胎占比较高。通过首次PGT 周期获取的NGS 信息,即可完成92.31% 罗氏易位和88.46%平衡易位染色体SNP 单体型的构建,构建失败的原因均为新发型易位且当前PGT 周期没有易位相关异常胚胎。部分平衡易位携带者PGT 周期面临着可活检胚胎数少、没有可用胚胎、无法进行MaReCs 的处境,多次促排卵可能是解决这一问题的有效方法之一。临床上采取灵活、个性化的策略来保证易位染色体SNP 单体型构建成功率:对于遗传性易位,可使用携带者及其父母外周血NGS 信息构建易位染色体SNP 单体型。对于新发型易位,可采用易位相关异常胚胎辅助完成构建。如果是男性易位携带者,还可以采集精子,寻找易位相关异常的精子辅助完成构建[15]。对于卵巢储备差、经济压力大等无法进行下一PGT 周期的患者,可在充分知情同意后,收集正常受精但未达到活检标准的废弃胚胎进行检测,辅助完成易位染色体SNP单体型的构建。对于女性易位携带者,可以通过极体活检的方法获得相关遗传学信息。但是,由于女性携带者卵子较珍贵,且临床上对第二极体的活检时间难以把握,活检要求高,对于胚胎发育的影响无法预测,因此极体活检并未得到广泛的临床应用。
PGT 技术的出现给平衡易位携带者带来了生育的希望。虽然可为平衡易位的辅助生殖治疗策略提供一定的指导依据,对患者的知情选择具有参考价值,但本研究仍有一定的局限性。染色体平衡易位的发生是一个复杂的过程,患者在各个环节上的个体化的差异加剧了深入探究和分析平衡易位携带者PGT 周期胚胎遗传学特征的难度,仍需多中心参与、更大的样本量进行更细致的研讨,以期获得更多的经验和策略服务于临床诊疗。
