非小细胞肺癌组织中ALK、ROS1、RET融合基因检测方法的比较
2016-12-02郭文靖朱安娜吴英松
郭文靖 朱安娜 吴英松
·综述·
非小细胞肺癌组织中ALK、ROS1、RET融合基因检测方法的比较
郭文靖1朱安娜1吴英松2★
非小细胞肺癌在恶性肿瘤中的发病率和死亡率中高居榜首,是中国首要的一个公共卫生问题。近年出现的分子靶向药能显著改善非小细胞肺癌患者的生存质量,因此对患者突变基因的准确检测显得尤为重要。目前临床上检测非小细胞肺癌患者ALK、ROS1、RET融合基因的主要方法有荧光原位杂交、免疫组织化学、逆转录聚合酶链反应以及新兴起的下一代测序,但这4种方法优缺点各异。本文通过比较这几种常见的检测方法,为融合基因检测方法的选择提供参考。
非小细胞肺癌;ALK/ROS1/RET融合基因;荧光原位杂交;下一代测序
肺癌是当今社会对人群健康和生命威胁最常见的恶性肿瘤之一[1],分别占男女性恶性肿瘤中的第一位和第二位[2]。在中国,肺癌发病率和死亡率远高于西方国家,且处于持续上升状态。统计显示2015年新增肺癌患者达22万,死亡人数高达15万[2]。肺癌根据免疫组化主要分为2大类:非小细胞肺癌(non⁃small cell lung cancer,NSCLC)和小细胞肺癌,其中NSCLC约占85%[3⁃4]。近几年,肺癌患者中除了存在常见的肿瘤驱动突变基因EGFR、KRAS、BRAF外,还检测到存在间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)[5]、c⁃ros原癌基因1酪氨酸激酶(c⁃ros oncogene 1 receptor tyrosine kinase,ROS1)、RET原癌基因(RET proto⁃onco⁃gene,RET)基因融合的情况。
目前,主要的治疗方式为手术、化疗、放疗。但是随着对肿瘤发病机制和分子生物学的不断深入研究,针对常见肺癌融合基因的靶向药以特异性高,不良反应轻而逐渐进入人们视野。存在ALK、ROS1融合基因的肺癌患者在临床中使用克唑替尼(crizotinib)的疗效显著[6⁃8]。此外,以小分子酪氨酸激酶抑制剂为代表的靶向药已逐步应用于临床试验,其中卡博替尼(cabozantinib)治疗存在RET融合阳性的NSCLC的实验(NCT01639508)已经进入临床试验Ⅱ期[9],靶向药的出现推动了NSCLC治疗的发展。因此,对肺癌患者融合基因的检测,提高患者的生存率具有十分重要的意义。目前临床上检测非小细胞肺癌患者ALK、ROS1、RET融合基因的主要方法有荧光原位杂交、免疫组织化学、逆转录聚合酶链反应以及新兴起的下一代测序,但这4种方法优缺点各异。本文通过比较这几种常见的检测方法,为融合基因检测方法的选择提供参考。
1 ALK、ROS1、RET基因融合及临床表现特征
ALK是一种跨膜受体的酪氨酸激酶,属于胰岛素受体家族。ALK主要与棘皮动物微管相关蛋白(echinoderm m icrotubule associated protein⁃like 4,EML4)发生融合,EML4结构中的N末端碱基区与肿瘤的形成有关。EML4⁃ALK融合是因为2号染色体短臂发生倒位,导致EML4的N⁃末端融合到胞内ALK激酶区域[10]。融合后的EML4启动子可以驱动EML4⁃ALK转录活化表达融合蛋白,ALK活化会导致细胞恶性转化。已发现的融合方式有10多种,其中以V1(EML4的13外显子断裂)和V3变体(EML4的6外显子断裂)最常见[11],常见融合类型见表1。ALK阳性NSCLC是肺癌的一个特定分子亚型,常见于腺癌中,约占全部NSCLC的5%[12],多见于年轻、不吸烟或少量吸烟的患者[13]。临床上多用特异性激酶抑制剂治疗EML4⁃ALK融合患者,能显著延长生存期,中国国家食品药品监督管理总局(China Food and Drug Adm inis⁃tration,CFDA)已批准克唑替尼用于治疗ALK融合基因阳性患者。
ROS1是一种原癌基因,位于6号染色体上,属于胰岛素受体家族的一种跨膜酪氨酸激酶,其细胞外区域由6个重复序列组成,与纤维连接蛋白具有高度同源性,而纤维连接蛋白在细胞黏附中伴有重要作用。在NSCLC中ROS1基因与SLC34A2、CD74发生融合占了50%[14],主要是由于6号染色体易位造成的,常见融合见表2。ROS1基因发生重排时丢失细胞外区域,保留跨膜和细胞内酪氨酸激酶区域,主要发生在ROS1基因的32~36外显子。ROS1融合基因在NSCLC中发生率约为1%~2%[15],和ALK相似,常见于年轻、不吸烟或少量吸烟的腺癌患者中[16]。
RET是一种酪氨酸激酶受体,由半胱氨酸组成的细胞外区、跨膜区、催化酪氨酸激酶作用的细胞内区组成,位于10号染色体,DNA全长为60 kb,含有21个外显子,RET参与细胞增殖、神经传导、细胞迁移和细胞分化。由于10号染色体发生臂间倒位[17],导致和KIF5B发生基因融合,常见与RET融合基因见表3。KIF5B⁃RET融合蛋白包含马达结构域和KIF5B的卷曲螺旋结构域,通过卷曲螺旋结构域的二聚化作用,该融合蛋白的RET酪氨酸激酶活性可异常活化,从而促进肺癌的发生。KIF5B⁃RET融合基因在NSCLC中发生率约为1%~2%[17],同样常见于不吸烟的肺腺癌患者中[18]。临床上常用小分子酪氨酸激酶抑制剂进行治疗,有临床报告显示肺癌中携带RET融合的患者使用卡博替尼、vandetanib(凡德他尼)有一定疗效。
2 检测ALK、ROS1、RET基因融合的方法及比较
针对ALK、ROS1、RET基因融合的患者,临床常用的检测方法有荧光原位杂交(fuorescence in situ hybridization,FISH)、免疫组织化学(immuno⁃histochem istry,IHC)、逆转录聚合酶链反应(re⁃verse transcription⁃polymerase chain reaction,RT⁃PCR)以及新兴起的下一代测序(next⁃generation sequencing,NGS)。
2.1 荧光原位杂交(FISH)
FISH的基本原理是将DNA(或RNA)探针用特殊的核苷酸分子标记,然后将探针按照碱基互补原则特异性结合待检测的单链核苷酸,从而使探针杂交到染色体或DNA纤维切片上,再用与荧光素分子偶联的单克隆抗体与探针分子特异性结合来检测DNA序列在染色体或DNA纤维切片上的定性、定位、相对定量分析。针对检测基因是否融合,可以通过在断裂位置两端设置不同颜色的
探针,在发生断裂融合的细胞中,2种颜色的探针相互分离,而在没有发生断裂融合的细胞则表现为2种颜色相互重叠或靠近。
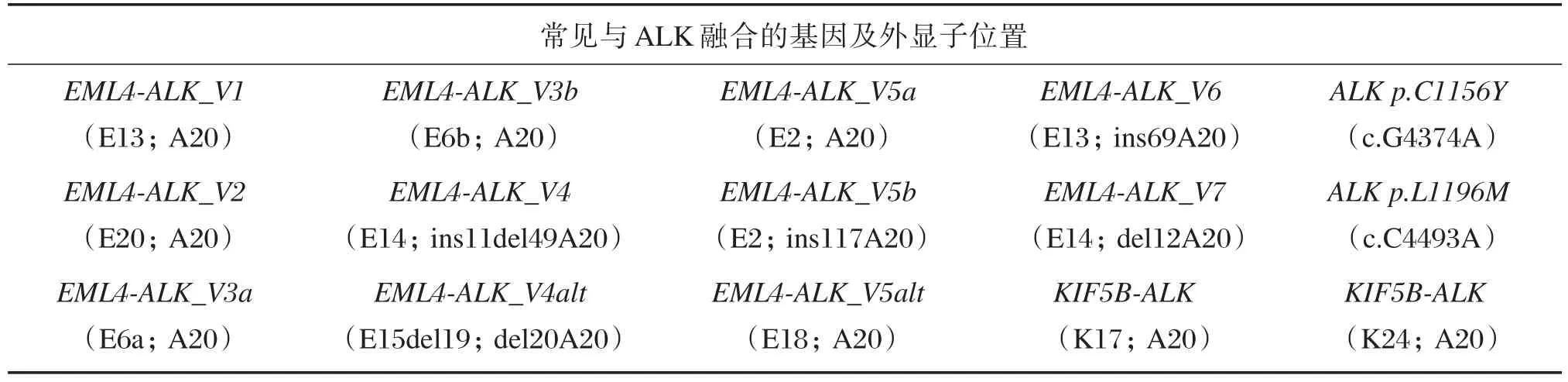
表1 常见与ALK融合的基因及外显子位置Table 1 Common genes fusew ith ALK and the location of the exons
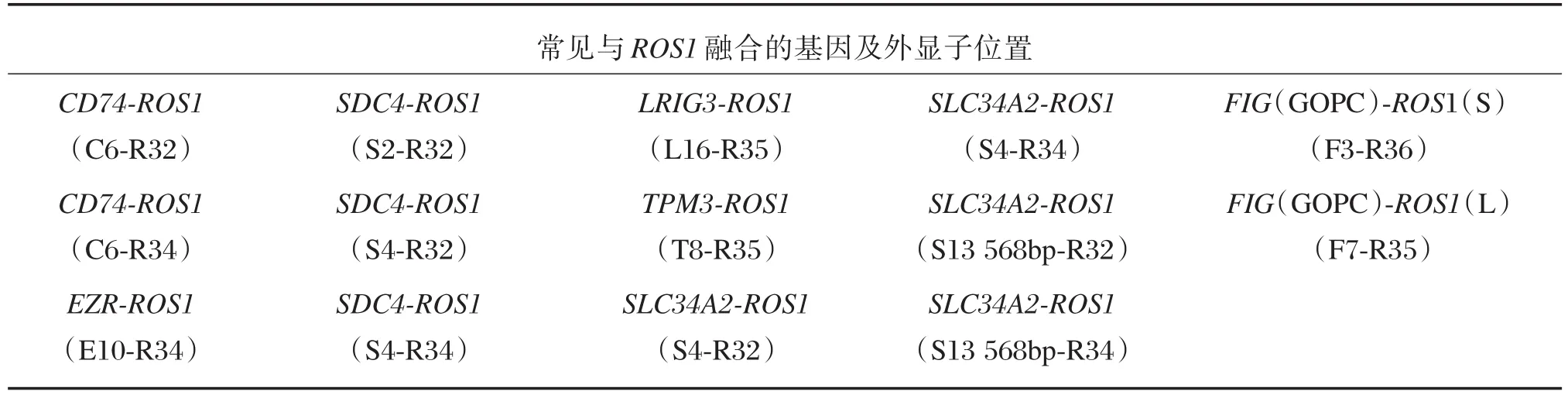
表2 常见与ROS1融合的基因及外显子位置Table 2 Common genes fusew ith ROS1 and the location of the exons

表3 常见与RET融合的基因及外显子位置Table 3 Common genes fusew ith RET and the location of the exons
FISH是目前检测肺癌融合基因的“金标准”,确定适合的抗体快速检测ALK表达蛋白是否发生融合是初步筛查ALK重排的关键[19]。目前常见的商品化试剂盒有Cytocell的ROS1 Dual Color Break Apart Probe,德国ZytoVision的产品Zyto⁃Light®SPEC RET Dual Color Break Apart Probe。经CFDA批准的试剂盒有益善生物技术股份有限公司的ALK基因重排检测试剂盒。虽然FISH专业性强,但在一次实验中不能区分不同类型的融合配体,且无法检测RNA编码和内含子异常的情况。在结果方面需资深人员进行判断,有不少患者用FISH检测结果为阴性,但在药物治疗方面获得良好的疗效[20]。由于FISH是在细胞层面上进行病理学的分析,但晚期NSCLC患者只能提供极小块的活检组织,这导致难以保证有足够细胞进行阳性结果的判读。
2.2 免疫组织化学(IHC)
免疫组织化学根据抗体和抗原之间的结合具有高度的特异性特征,将已知抗体标上荧光素,以此作为探针检查细胞或组织内的相应抗原,在荧光显微镜下观察。当抗原抗体复合物中的荧光素受激发光的照射后会发出一定波长的荧光,从而可以确定组织中的抗原定位或定量。目前商品化的ALK IHC染色的抗体主要有D5F3、5A4[21],常规的判断方法如下:肿瘤细胞无任何染色,阴性;肿瘤细胞呈浅棕色,且没有任何背景染色,弱阳性;肿瘤细胞呈棕色,阳性;肿瘤细胞呈深棕色,强
阳性[22]。经美国食品药品监督管理局(Food and Drug Adm inistration,FDA)批准上市的试剂盒VENTANA ALK(D5F3)CDx Assay采用了兔单克隆抗体检测ALK基因融合。IHC简便易行,价格比FISH便宜,操作方法成熟[23],因而成为临床诊断常用的筛查方法,推荐条件缺乏的实验室可采用此方法进行小样本活检组织的检测,但由于IHC阳性判读标准不统一,不能敏感检测出基因蛋白,此方法的准确性等因素仍在评价中[19],所以对于阳性的样本必须经过FISH、RT⁃PCR或NGS中的至少其中一种方法进行确认。
2.3 逆转录聚合酶链反应(RT⁃PCR)
逆转录聚合酶链反应是先将RNA反转录为cDNA,然后以cDNA为模板扩增合成目的片段,结合荧光标记的方法,在PCR反应体系中加入荧光基团,利用荧光信号累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法,即每循环一次收集一个数据,建立实时扩增曲线,得到Ct值,从而确定起始模板的拷贝数。CFDA已认证厦门艾德生物医药科技有限公司的人类EML4⁃ALK融合基因检测试剂盒,但此试剂盒用荧光PCR法只能检测少数几种已知与ALK融合的基因类型,这严重影响了RT⁃PCR法在临床上检测的应用。RT⁃PCR方法是比FISH、IHC更为敏感的一种检测方法[24],但此方法对组织RNA质量要求高,需要足够大的引物组以涵盖所潜在的所有融合基因,而且可能存在大量潜在的基因亚型无法检测[25]。由于PCR可能导致非特异性扩增造成假阴性的结果,建议阳性样本再通过直接测序法进行验证[26]。
2.4 下一代测序(NGS)
NGS是一种能对几十万到几百万条DNA分子进行大规模平行测序的技术。传统获取生物核苷酸序列的方法主要依靠直接测序法,即Sanger测序法,其利用双脱氧核苷酸末端终止法的原理完成了对人类基因组序列的测定,但Sanger测序法无法检测移位或基因拷贝数变化等基因突变类型,难以完成没有明确致病基因位点及大样本突变位点的筛查,且存在高成本的问题。随着千元测序人类基因组的提出,催生了以高通量、信息量大、灵敏度高、低成本著称的NGS技术[27]。
NGS各大平台在通量、测序长度、覆盖度、运行时间和测序原理上各异。目前有illum ina的So⁃lexa、ABI的Solid和Life Technologies的Ion Tor⁃ rent平台。NGS技术主要用于3大方面:针对疾病的靶向基因测序,全外显子测序和全基因组测序[28]。NGS技术主要流程包括患者样本的采集,DNA/RNA的提取,基于多重PCR方法的文库构建,目的片段的扩增及富集,上机测序及数据分析。当FISH和IHC结果异常时,NGS更被倾向用于进行最终确认[29]。随着认识到血液中存在循环肿瘤DNA(circulating tumor DNA,ctDNA),通过NGS进行液体活检[30],无创筛查成为了热门研究方向,此不仅有利于肿瘤的早期诊断,还可以动态观察肿瘤的发生发展,及时调整治疗方法。目前ThermoFisher的产品oncom ine fusion panel已获得CE⁃IVD认证,同时已商品化的试剂盒有ArcherDx的fusionplexTMALK、RET、ROS1 V2 panel。这2款试剂盒都可同时检测ALK、ROS1、RET 3个融合基因。NGS在检测方面所需RNA量少至10 ng,在一次实验中能靶向获取目的片段进行全部融合基因的分析,且准确度高;在数据分析方面,NGS通量高,信息获取量大,可以明确各融合基因的配体类型[31],分析自动化,并可以通过优化算法[32],减少人为判断错误的情况,但是肿瘤异质性的问题会影响结果的准确性。4种方法相比之下NGS更适合大规模普查NSCLC的融合基因。
3 展望
肺癌的发生发展涉及到基因、环境,是一个极其复杂的过程。所幸目前的小分子酪氨酸激酶抑制剂对有ALK、ROS1、RET融合基因的NSCLC患者存在较好的效果,但是为了更大程度延长患者生存期,分子靶向治疗如何结合手术,化疗,放疗等治疗方法是一个需要临床试验不断验证的过程。在常见驱动突变基因EGFR、KRAS、BRAF等野生型的非小细胞肺癌患者中,寻找一种高敏感、高特异性检测ALK、ROS1、RET融合基因的方法显得十分必要。NGS作为一种新兴起的检测技术,可同时对相应突变区域进行高深度测序,利用生物信息学最终确认融合变异类型并不断发现新的融合分子类型,从而可以用于临床在最佳治疗时期选择相应的分子靶向药物,同时规避容易耐受的药物,但相对传统在原位进行检测的方法,NGS仍需多中心、大规模的临床验证。若研究成果能用于临床检测,这对NSCLC患者的早期诊断、治疗及预后具有极其重要的价值。
[1]Chen W,Zheng R,Zeng H,et al.Epidem iology of lung cancer in China[J].Thoracic Cancer,2015,6(2):209-215.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer JClin,2016,66(2):115-132.
[3]Siegel RL,M iller KD,Jemal A.Cancer statistics,2016[J].CA:A Cancer Journal For Clinicians,2016,66:7-30.
[4]Torre LA,Bray F,Siegel RL,er al.Global cancer sta⁃tistics,2012[J].CA:A Cancer Journal For Clini⁃cians,2015,65:87-108.
[5]Wong DW,Leung EL,So KK,et al.The EML4⁃ALK fusion gene is involved in various histologic types of lung cancers from nonsmokersw ith w ild⁃type EGFR and KRAS[J].Cancer,2009,115(8):1723-1733.
[6]Yoshida T,Oya Y,Tanaka K,etal.Differential crizo⁃tinib response duration among ALK fusion variants in ALK⁃positive non⁃small⁃cell lung cancer[J].JClin Oncol,2016.Epub ahead of print.
[7]Solomon BJ,Cappuzzo F,Felip E,et al.Intracranial efficacy of crizotinib versus chemotherapy in patients w ith advanced ALK⁃positive non⁃small⁃cell lung can⁃cer:results from PROFILE 1014[J].JClin Oncol,2016,34(24):2858-2865.
[8]Ettinger DS,Wood DE,Akerley W,et al.NCCN guidelines insights:non⁃small cell lung cancer,ver⁃sion 4.2016[J].JNatl Compr Canc Netw,2016,14(3):255-264.
[9]程菊,茅矛.肺腺癌的驱动基因突变及相应的靶向治疗[J].中国医药生物技术,2016,11(2):151-158.
[10]徐凌.非小细胞肺癌ALK融合基因研究现况及进展[C].第四届安徽肿瘤内科大会暨第二届苏皖肿瘤内科治疗进展学术会议论文集,2012,261-266.
[11]Sakai K,Okamoto I,Takezawa K,etal.A novelmass spectrometry⁃based assay for diagnosis of EML4⁃ALK⁃positive non⁃small cell lung cancer[J].JThorac On⁃col,2012,7(5):913-918.
[12]Li C,Fang R,Sun Y,et al.Spectrum of oncogenic driver mutations in lung adenocarcinomas from East Asian never smokers[J].Plos One,2011,6(11):e28204.
[13]杨衿记,张绪超,江本元,等.EML4⁃ALK融合基因为靶点的晚期NSCLC个体化治疗研究进展[J].癌症进展,2010,8(6):538-545.
[14]Bubendorf L,Büttner R,A l⁃Dayel F,et al.Testing for ROS1 in non⁃small cell lung cancer:a review w ith recommendations[J].Virchows Arch,2016.Epub ahead of print.
[15]Lira ME,ChoiYL,Lim SM,etal.A single⁃tubemul⁃tiplexed assay for detecting ALK,ROS1,and RET fu⁃sions in lung cancer[J].JMol Diagn,2014,16(2):229-243.
[16]Kim HR,Lim SM,Kim HJ,et al.The frequency and impact of ROS1 rearrangement on clinical outcomes in never smokersw ith lung adenocarcinoma[J].Ann On⁃col,2013,24(9):2364-2370.
[17]方霆.非小细胞肺癌中RET融合基因的研究进展[J].临床与病理杂志,2015,35(2):284-288.
[18]乔洪源,欧阳学农,余宗阳,等.KIF5B-RET融合基因在非小细胞肺癌中的研究进展[J].肿瘤学杂志,2013,19(10):750-753.
[19]National Comprehensive Cancer Network.Non⁃small lung cancer(Version 7.2015)[EB/OL].http://www. nccnchina.org/files/NSCLC_7.2015_active_ 122214_ZH_FULL_V2.pdf,2015⁃02⁃06/2016⁃09⁃20.
[20]Sun JM,Choi YL,Won JK,et al.A dramatic re⁃sponse to crizotinib in a non⁃small⁃cell lung cancer pa⁃tientw ith IHC⁃positive and FISH⁃negative ALK[J].J Thorac Oncol,2012,7(12):e36-38.
[21]Ma H,Yao WX,Huang L,et al.Efficacy of D5F3 IHC for detecting ALK gene rearrangement in NSCLC patients:a systematic review and meta⁃analysis[J]. Oncotarget,2016.Epub ahead of print.
[22]《常规免疫组织化学初筛ALK阳性非小细胞肺癌专家共识》专家组.常规免疫组织化学初筛ALK阳性非小细胞肺癌专家共识[J].中华病理学杂志,2015,4(7):476-479.
[23]M ino⁃Kenudson M,Chirieac LR,Law K,et al.A novel,highly sensitive antibody allows for the routine detection of ALK⁃rearranged lung adenocarcinomas by standard immunohistochemistry[J].Clin Cancer Res,2010,16(5):1561-1571.
[24]Cristina T,NikiK,VicenteP,等.IHC、FISH和RT⁃PCR检测对EML4⁃ALK重排的一致性[J].临床与病理杂志,2015,35(2):189-193.
[25]钟山,张海萍,白冬雨,等.非小细胞肺癌组织中ALK、ROS1和RET融合基因的表达及其临床意义[J].中华病理学杂志,2015,44(9):639-643.
[26]张绪超,陆舜,张力,等.中国间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌诊断专家共识(2013版)
[J].中华病理学杂志,2013,42(6):402-406.
[27]Goodw in S,mcPherson JD,m cCombie WR.Com ing of age:ten years of next⁃generation sequencing tech⁃nologies[J].Nature Reviews Genetics,2016,17(6):333-351.
[28]姜烈君,陆晓旭,黄华艺.下一代测序技术的临床应用规范化问题——参考美国医学遗传学与基因组学会行业标准[J].分子诊断与治疗杂志,2016,8(4):217-221.
[29]Pekar⁃Zlotin M,Hirsch FR,Soussan⁃Gutman L,etal. Fluorescence in situ hybridization,immunohistochem⁃istry,and next⁃generation sequencing for detection of EML4⁃ALK rearrangement in lung cancer[J].Oncolo⁃gist,2015,20(3):316-322.
[30]Thompson JC,Yee SS,Troxel AB,et al.Detection of therapeutically targetable driver and resistancemuta⁃tions in lung cancer patients by next generation se⁃quencing of cell-free circulating tumor DNA[J].Clin Cancer Res,2016.Epub ahead of print.
[31]Marchetti A,Pace MV,di Lorito A,et al.Validation of a new algorithm for a quick and easy RT⁃PCR⁃based ALK test in a large series of lung adenocarcino⁃mas:Comparison w ith FISH,immunohistochemistry and next generation sequencing assays[J].Lung Can⁃cer,2016,99:11-16.
[32]Bianchi V,Ceol A,Ogier AG,et al.Integrated sys⁃tems for NGS datamanagement and analysis:open is⁃sues and available solutions[J].Front Genet,2016,7:75.
Com parison of detection methods of ALK/ROS1/RET fusion gene in non⁃small cell lung cancer tissue
GUOWenjing1,ZHU Anna1,WU Yingsong2★
(1.Guangzhou Darui Biotechnology Co.,Ltd.,Guangzhou,Guangdong,China,510665;2.School of Labratory Medicine and Biotechnology,Southern MedicalUniversity,Guangzhou,Guangdong,China,510515)
Themorbidity andmortality of non⁃small lung cancer is the top rate ofmalignant tumor. And it’s one of the important public health problems in China.In recent years,molecular targeted drugs can significantly improve the quality of life of patientsw ith non⁃small cell lung cancer.Therefore,it’s important to detect mutation accurately.Nowadays there are fluorescence in situ hybridization,immunohistochemistry, reverse transcription⁃polymerase chain reaction aswell as next⁃generation sequencing to detect non⁃small lung cancer.This article compares the commonmethodsused in clinical,in order to provide
for the choice of fusion gene detection.
Non⁃small cell lung cancer;ALK/ROS1/RET fusion gene;Fluorescence in situ hybridization;Nextgeneration sequencing
广东省科技计划项目应用型专项资金(2015B020233009)
1.广州市达瑞生物技术股份有限公司,广东,广州510665 2.南方医科大学检验与生物技术学院,广东,广州510515
★通讯作者:吴英松,E⁃mail:wg@smu.edu.cn
