基于高通量测序技术无创筛查双胎染色体非整倍体及胎儿游离DNA浓度分析
2016-12-02许旭平谢美娟甘海燕梁荣良韩尔康杨学习吴英松
许旭平 谢美娟 甘海燕 梁荣良 韩尔康 杨学习 吴英松★
·论著·
基于高通量测序技术无创筛查双胎染色体非整倍体及胎儿游离DNA浓度分析
许旭平1谢美娟1甘海燕2梁荣良1韩尔康2杨学习1吴英松1★
目的评估无创高通量测序方法筛查双胎染色体非整倍体的可行性,并对胎儿游离DNA浓度进行分析。方法收集双胎妊娠样本120例,包括自然双胎67例,辅助生殖技术植入的双胎47例,双胎消失综合征样本6例,并收集68例单胎样本作为对照,采用无创高通量测序方法进行检测。通过Z值进行阴性和阳性判断,根据Y染色体唯一比对条数进行胎儿游离DNA浓度计算,并对三体阳性样本进行核型分析。结果本次实验筛查出2例双胎染色体三体阳性样本,分别为正常/21三体和13三体/18三体,均与核型结果一致。自然双胎妊娠组胎儿游离DNA浓度明显高于辅助生殖技术植入双胎组、双胎消失综合征组和自然妊娠单胎组,P值均小于0.05。其他3组间胎儿游离DNA浓度无显著性差异。结论采用无创高通量测序方法进行双胎妊娠染色体非整倍体筛查也是可行的,同时结果分析应该考虑胎儿游离DNA浓度的影响。
无创产前筛查;双胎;染色体非整倍体;高通量测序;胎儿游离DNA浓度
胎儿游离DNA的发现[1]为无创产前筛查提供了新思路,并且大量临床研究证实高通量测序技术在无创产前筛查中的可行性及优势[2⁃5]。近2年,随着高通量测序技术的迅猛发展,利用高通量测序技术进行无创产前检测(non⁃invasive prenatal teast⁃ing,NIPT)筛查常见染色体的非整倍体日益受到人们的关注,并以其具有非侵入和准确的特点在各大医院得到了陆续开展。目前国内外学者对无创产前筛查的准确性和可行性评估,主要是针对单胎妊娠孕妇而进行的。虽然Audibert[6]和Huang等[7]分别对加拿大人群和中国人群进行了无创产前筛查21和18三体双胎孕妇适用性研究,但是对双胎妊娠孕妇群体的适用性相关研究和报道仍然比较少。因此本研究利用高通量测序技术对双胎妊娠样本进行无创产前筛查,以评估其筛查双胎染色体非整倍体的可行性,并对双胎样本胎儿游离DNA浓度进行分析来评估它对双胎样本的无创产前筛查的影响。
1 对象与方法
1.1 对象
选择2014年12月至2015年11月于达安健康临检中心(广东省广州市)做无创产前筛查的150例中68例怀有男性胎儿的单胎样本作为对照组,217例双胎妊娠中的120例怀有男性胎儿的孕妇样本实验组进行分析,其中包括自然双胎67例,辅助生殖技术植入的双胎47例,双胎消失综合征样本6例。孕妇在采血前均已签署知情同意书并在申请无创产前筛查前均已进行血清学和超声学的检查,且结果提示为高风险。
1.2 方法
1.2.1 标本采集及血浆分离
用无菌的EDTA抗凝管采集孕妇外周血10 m L。先4 300 rpm低速离心10m in,将上清液转移到无菌的低吸附Eppendorf管内,接着13 600 rpm, 4℃,高速离心10m in[8],吸取上层血浆并分装到新的Eppendorf管内,冻存于-80℃冰箱。
1.2.2 血浆中游离DNA提取
血浆游离DNA采用金麦格血清游离DNA提取试剂盒(磁珠法)(GenMag,北京),按照说明书进行提取。
1.2.3 测序文库构建
文库构建采用Ion Plus Fragment Library KitV3和Ion Plus Fragment Library Adapters Kit(Life,美国),并按照说明书操作。文库构建好后采用Qu⁃bit®2.0和dsDNA HSAssay Kit测定浓度,用安捷伦的2100 bioanalyzer(Agilent,美国)检测DNA片段分布情况。
1.2.4 测序
文库采用Ion OneTouch™2仪器进行模板制备,然后使用Ion OneTouch™ES仪器进行阳性模板富集,接着采用Proton测序仪进行上机测序,试剂采用Ion PI™Sequencing 200 Kit v3,芯片为Ion PI™Chip v2(life,美国),并按照说明书进行操作。
1.2.5 核型分析
测序分析结果为染色体三体阳性的样本,通过告知孕妇三体高风险情况并征求孕妇同意下在医院进行羊水穿刺,并将穿刺物送第三方检测机构进行羊水细胞培养染色体核型分析。
1.2.6 数据分析
测序数据经去低质量、去重复、GC校正等处理后,根据类似文献报道的方法[9]分别计算出13号染色体,18号染色体和21号染色体的Z值,并以Z值>3判断为该染色体三体阳性。根据Y染色体唯一比对条数进行胎儿游离DNA浓度计算[10]。采用SPSS 19.0软件进行结果统计,运用单因素方差分析比较自然妊娠双胎组、辅助生殖技术植入的双胎组、双胎消失综合征组和单胎妊娠组4组间胎儿游离DNA浓度、孕周、孕妇年龄和Z值的差异,P<0.05为差异有统计学意义。
2 结果
2.1 样本基本情况分析
188例样本按妊娠情况分成4组,其中自然妊娠双胎组样本67例,孕妇平均年龄为30.39周岁,平均孕周为17.96周;辅助生殖技术植入双胎组样本47例,孕妇平均年龄为32.30周岁,平均孕周为17.64周;双胎消失综合征组样本6例,孕妇平均年龄为31.83周岁,平均孕周为16.33周;自然妊娠单胎组样本68例,孕妇平均年龄为31.51周岁,平均孕周为17.84周;单因素方差分析结果显示,4组间孕妇年龄间无显著性差异(F=1.124,P=0.341),孕周间也未见显著性差异(F=0.268,P=0.848)。
2.2 双胎妊娠染色体非整倍体检出情况
120例双胎妊娠样本中,一共检出2例染色体三体阳性样本,阳性率约为1.7%,其中一例为自然妊娠,测序结果为21三体阳性;另一例为辅助生殖技术植入的样本,测序结果为13三体和18三体阳性。阳性检出结果与后续的核型分析结果一致,具体情况见表1。另外,病例跟踪结果显示,本次研究所检测的阴性样本中未出现假阴性的案例。
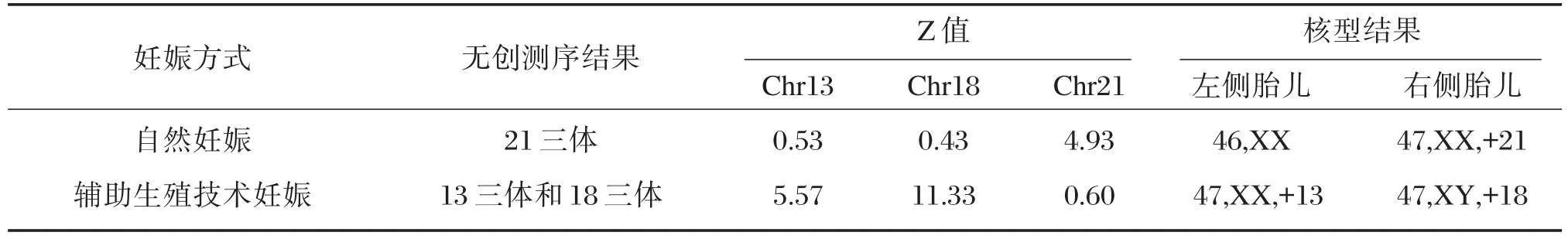
表1 2例染色体三体阳性双胎妊娠样本检测结果Table 1 Resultsof 2 casesof trisomy in tw in pregnancies
2.3 胎儿游离DNA浓度分析
自然妊娠双胎组样本平均的胎儿游离DNA浓度为14.72%;辅助生殖技术植入双胎组样本平均的胎儿游离DNA浓度为11.25%;双胎消失综合征组样本平均的胎儿游离DNA浓度为11.51%;自然妊娠单胎组样本平均的胎儿游离DNA浓度为11.26%,见表2。单因素方差分析结果显示,4组间胎儿游离DNA浓度具有显著差异,F=13.864,P=0.000。组间两两比较分析显示,自然双胎妊娠组胎儿游离DNA浓度明显高于辅助生殖技术植入双胎组、双胎消失综合征组和自然妊娠单胎组,P值均小于0.05。而其他3组间胎儿游离DNA浓度无显著性差异(图1)。

表2 4组间胎儿游离DNA浓度比较Table 2 Fetal DNA fractions of 4 groupsw ith different conceptions
2.4 染色体Z值
单因素方差分析结果显示,自然双胎妊娠组、辅助生殖技术植入双胎组、双胎消失综合征组和自然妊娠单胎组4个组间13号、18号和21号染色体的Z值均无显著性差异(F13=0.268,P13=0.848;F18=0.412,P18=0.744;F21=0.745,P21=0.526)。
3 讨论
自Lo等[1]发现孕妇血浆中存在胎儿游离DNA后,国内外研究人员针对胎儿游离DNA进行了许多理化性质的研究[11⁃13],尤其是在促进无创产前诊断(NIPT)方面取得了突破性的进展[14⁃15]。近
年来随着高通量测序技术的快速发展,测序仪的不断升级换代,以及配套的分析软件和生物信息学的进步,国家政策的支持等,高通量测序筛查常见染色体非整倍体已经初步走进了临床实际运用。高通量测序筛查常见染色体非整倍体具有非侵入性、准确性高,又快速的优点[14,16⁃17],受到了孕妇和医院的青睐,并在我国大型医院陆续得到开展。而国内外学者主要是针对单胎妊娠孕妇进行了无创产前筛查的准确性和可行性评估,而针对双胎妊娠孕妇群体的研究和运用仍然比较少且并未成熟。本研究利用高通量测序技术对双胎妊娠样本进行了无创产前筛查双胎染色体非整倍体,并成功筛查出2例染色体三体阳性样本。同时我们的研究结果也显示自然双胎妊娠组、辅助生殖技术植入双胎组、双胎消失综合征单胎组和自然妊娠单胎组4个组间13号、18号和21号染色体的Z值均无显著性差异,即双胎妊娠时对染色体三体的判断值(Z值)造成影响并不大。这在一定程度上说明高通量测序技术筛查常见染色体非整倍体对双胎妊娠样本同样适用。
自然状态下双胎妊娠的概率约为1/90,由于孕妇年龄的增加,近年来医源性促排卵药物的使用,以及避孕药的使用等使得我国双胎妊娠呈现增高的趋势[18⁃20],平均可达2%。而高龄孕妇怀有染色体非整倍体胎儿的几率高于正常育龄的孕妇。我国全面放开二胎,高龄孕妇可能会进一步增加。另外辅助生殖技术让不孕不育患者看到了希望,为保证存活率一般都植入2个胚胎,这也人为地增加了双胎妊娠的比例。双胎妊娠发生染色体非整倍体的风险也高于单胎妊娠[21]。因此加快促进高通量测序技术筛查双胎染色体非整倍体技术的成熟显得尤为重要。
本次研究筛查出一例一胎为21三体而另一胎为正常胎儿的自然妊娠双胎样本,该病例可能是由于单合子分裂后染色体不分离导致。针对此类情况,孕妇经核型确诊后可以选择实施选择性减胎术而避免三体患儿的出生。本研究还检出1例辅助生殖技术植入双胎染色体三体阳性样本,占总辅助生殖技术植入的双胎样本的2.1%。该样本同时发生了13三体和18三体阳性现象,经核型分析确诊该双胎病例为一胎患有13三体,另一胎患有18三体。该现象提示我们辅助生殖技术植入的双胎患染色体非整倍体的概率可能要高于正常妊娠的孕妇。这可能跟进行辅助生殖技术植入人群的特点有关,但仍然需要更多的研究数据来支持,我们后续将会对该现象做进一步的深入研究。
虽然当我们检测出双胎发生三体阳性时,还未能通过NIPT来判断是其中一个胎儿发生了染色体三体还是2个胎儿都发生了染色体三体,也还未能区分到底是哪一个胎儿发生了三体,但是我们可以减少对阴性样本进行羊水穿刺而给孕妇带来的痛苦和流产风险。
虽然高通量测序技术筛查染色体非整倍体具有很多优点,但也无法回避其受胎儿游离DNA浓度影响这一事实。目前研究发现无创产前筛查的判断值(Z值)受母体血浆中胎儿游离DNA浓度的影响且呈现一定的线性关系[22]。但胎儿游离DNA浓度低于4%时,NIPT的检测结果很容易出现假阴性[23]。本研究发现自然双胎妊娠组胎儿游离DNA浓度要明显高于辅助生殖技术植入双胎组、双胎消失综合征单胎组和自然妊娠单胎组,因此在进NIPT结果分析时,应当考虑胎儿DNA浓度所带来的影响,还应对孕妇的不同妊娠情况加以考虑,并根据不同情况作出相应的分析策略调整和结果校正。自然双胎妊娠组胎儿游离DNA浓度要明显高于辅助生殖技术植入双胎组这个可能是由于两者的孕周计算发生不同或者是辅助生殖技术植入的胚胎在孕妇体内生长发育速度不同于同期大小的自然妊娠的双胎而造成的。其中还观察到双胎消失综合征单胎组和自然妊娠单胎组间胎儿游离DNA浓度不存在显著性的差异,这说明胎儿消失后其游离在母体内的DNA会被迅速清除而不会对继续发育的另一胎儿造成影响,
因此这对该类型的孕妇,仍然可以采取高通量测序方法来筛查染色体非整倍体。
综上所述,采用无创高通量测序方法进行双胎妊娠染色体非整倍体筛查也是可行的,同时在进行结果分析应该考虑胎儿游离DNA浓度的影响。
[1]Lo YM,Corbetta N,Chamberlain PF,et al.Presence of fetal DNA in maternal plasma and serum[J].Lan⁃cet,1997,350(9076):485-487.
[2]Chiu RW,Akolekar R,Zheng YW,et al.Non⁃inva⁃sive prenatal assessment of trisomy 21 by multiplexed maternal plasma DNA sequencing:large scale validity study[J].BMJ,2011,342:c7401.
[3]Bianchi DW,Rava RP,Sehnert AJ.DNA sequencing versus standard prenatal aneuploidy screening[J].N Engl JMed,2014,371(6):578.
[4]Liao C,Zhengfeng X,Zhang K.DNA sequencing ver⁃sus standard prenatal aneuploidy screening[J].N Engl JMed,2014,371(6):577-578.
[5]Jeon YJ,Zhou Y,Li Y,et al.The feasibility study of non-invasive fetal trisomy 18 and 21 detection w ith semiconductor sequencing platform[J].Plos One,2014,9(10):e110240.
[6]Audibert F,Gagnon A.Prenatal screening for and di⁃agnosis of aneuploidy in tw in pregnancies[J].JOb⁃stetGynaecol Can,2011,33(7):754-767.
[7]Huang X,Zheng J,Chen M,etal.Noninvasive prena⁃tal testing of trisom ies 21 and 18 by massively parallel sequencing of maternal plasma DNA in tw in pregnan⁃cies[J].PrenatDiagn,2014,34(4):335-340.
[8]Chiu RW,Poon LL,Lau TK,et al.Effects of blood⁃processing protocols on fetal and total DNA quantifica⁃tion in maternal plasma[J].Clin Chem,2001,47(9):1607-1613.
[9]Chiu RW,Akolekar R,Zheng YW,et al.Non⁃inva⁃sive prenatal assessment of trisomy 21 by multiplexed maternal plasma DNA sequencing:large scale validity study[J].BMJ,2011,342:c7401.
[10]Xu XP,Gan HY,Li FX,et al.A method to quantify cell-free fetal DNA fraction in maternal plasma using nextgeneration sequencing:its application in non⁃inva⁃sive prenatal chromosomal aneuploidy detection[J]. Plos One,2016,11(1):e146997.
[11]Finning K,Martin P,Summers J,etal.Effectof high throughput RHD typing of fetal DNA inmaternal plas⁃ma on use of anti⁃RhD immunoglobulin in RhD nega⁃ tive pregnantwomen:prospective feasibility study[J]. BMJ,2008,336(7648):816-818.
[12]Tsui NB,Kadir RA,Chan KC,et al.Noninvasive prenatal diagnosis of hemophilia by m icrofluidics digi⁃tal PCR analysis ofmaternal plasma DNA[J].Blood,2011,117(13):3684-3691.
[13]Zeybek YG,Gunel T,Benian A,etal.Clinical evalu⁃ations of cell⁃free fetal DNA quantities in pre⁃eclamp⁃tic pregnancies[J].JObstet Gynaecol Res,2013,39(3):632-640.
[14]BianchiDW,Parker RL,Wentworth J,etal.DNA se⁃quencing versus standard prenatal aneuploidy screening[J].N Engl JMed,2014,370(9):799-808.
[15]Shi X,Zhang Z,Cram DS,etal.Feasibility of nonin⁃vasive prenatal testing for common fetal aneuploidies in an early gestational w indow[J].Clin Chim Acta,2015,439:24-28.
[16]Jeon YJ,Zhou Y,Li Y,et al.The feasibility study of non⁃invasive fetal trisomy 18 and 21 detection w ith sem iconductor sequencing platform[J].Plos One,2014,9(10):e110240.
[17]McCullough RM,AlmasriEA,Guan X,etal.Non⁃in⁃vasive prenatal chromosomal aneuploidy testing—clini⁃cal experience:100,000 clinical samples[J].Plos One,2014,9(10):e109173.
[18]李晓洲,史云芳,琚端,等.孕中期羊水染色体检查双胎23对[J].中华医学遗传学杂志,2013,30(6):759-760.
[19]Audibert F,Gagnon A.Prenatal screening for and di⁃agnosis of aneuploidy in tw in pregnancies[J].JOb⁃stetGynaecol Can,2011,33(7):754-767.
[20]A lvarado EA,Pacheco RP,A lderete FG,etal.Selec⁃tive term ination in dichorionic tw ins discordant for con⁃genital defect[J].Eur JObstet Gynecol Reprod Biol,2012,161(1):8-11.
[21]黄轩,罗艳敏,黄林环,等.双绒毛膜双羊膜囊双胎妊娠一胎染色体非整倍体选择性减胎术20例分析[J].中华围产医学杂志,2014,17(11):733-737.
[22]Hudecova I,Sahota D,Heung MM,et al.Maternal plasma fetal DNA fractions in pregnancies w ith low and high risks for fetal chromosomal aneuploidies[J]. PlosOne,2014,9(2):e88484.
[23]Norton ME,Brar H,Weiss J,et al.Non⁃Invasive Chromosomal Evaluation(NICE)Study:results of a multicenter prospective cohort study for detection of fe⁃tal trisomy 21 and trisomy 18[J].Am JObstet Gyne⁃col,2012,207(2):131-137.
Noninvasive prenatal testing for aneup loidy by next generation sequencing of maternal p lasma DNA in tw in pregnancies and its fetal free DNA fraction analysis
XU Xuping1,XIE Meijuan1,GAN Haiyan2,LIANG Rongliang1,HAN Erkang2,YANG Xuexi1,WU Yingsong1★
(1.School of Laboratory Medicine and Biotechnology,Southern Medical University,Guangzhou,Guangdong,China,510515;2.Guangzhou Darui Biotechnology Co.,Ltd.,Guangzhou,Guangdong,China,510665)
Objective To investigate the feasibility of screening aneuploidy by next generation sequencing of maternal plasma DNA in tw in pregnancies and analyzing the fetal free DNA fractions. Methods The data came from 120 casesof tw in pregnancies,including 67 natural tw in pregnancies,and 47 in vitro fertilization(IVF)assisted pregnancies as well as 6 vanishing tw in syndromes.68 cases of singleton pregnancies were also recruited.All cases underwent noninvasive prenatal testing for aneuploidy by next generation sequencing of maternal plasma DNA.The Z score was calculated to determine aneuploidies for chromosomes 21,18 and 13.The fetal free DNA fractionswere determined by calculating the proportion of Y chromosomal unique reads.Results Therewere 1 case of trisomy 21(one normal and the other trisomy 21) and 1 case of both trisomy 13 and trisomy 18(one trisomy 13 and the other trisomy 18)confirmed by karyotyping among tw in pregnancies.The fetal free DNA fractions of natural tw in pregnancies were
Noninvasive prenatal testing;Tw ins;Chromosome aneuploidy;Next generation sequencing;Fetal free DNA fraction
广东省科技计划应用型科技研发专项(2015B020233009);广东省科技计划能力建设项目(2015A030401040)
1.南方医科大学检验与生物技术学院,广东,广州510515 2.广州市达瑞生物技术股份有限公司,广东,广州510665
★通讯作者:吴英松,E⁃mail:wg@smu.edu.cn
significantly higher than IVF assisted pregnancies,vanishing tw in pregnancies and singleton pregnancies(P<0.05).There were no significant differences for fetal free DNA fractions among the latter 3 kinds of pregnancies.Conclusion Itwas feasible to screen chromosome aneuploidy by nextgeneration sequencing of maternal plasma DNA in tw in pregnancies,and itneeds to take fetal free DNA fraction into account during the resultanalysis.
