超声小探头联合刷检现场细胞学对肺周围型病灶的诊断价值
2016-11-29龙发欧振宇黄文婷方菁菁李俊华周爱莲
龙发,欧振宇,黄文婷,方菁菁,李俊华,周爱莲
(1.广东省深圳市光明新区人民医院 呼吸内科,广东 深圳 518106;2.广东省深圳市第五人民医院 呼吸内科,广东 深圳 518001)
超声小探头联合刷检现场细胞学对肺周围型病灶的诊断价值
龙发1,欧振宇2,黄文婷1,方菁菁2,李俊华2,周爱莲2
(1.广东省深圳市光明新区人民医院 呼吸内科,广东 深圳 518106;2.广东省深圳市第五人民医院 呼吸内科,广东 深圳 518001)
目的 探讨超声小探头(EBUS)联合刷检现场细胞学(C-ROSE)对肺周围型病灶的诊断价值。方法 将EBUS送至需探查部位,以获得最佳的超声图像及最佳取材位置,退出超声探头。根据EBUS进入的路径,先行刷检,将刷检所取得的细胞标本分为两份,其中一份行刷检C-ROSE评估,当刷检C-ROSE为恶性时,则停止刷检,如果为无诊断价值时则需在原部位再次刷检或换部位进行刷检或停止刷检进行下一步活检,在每一个部位刷检结束后均行经支气管肺活检。结果 59例患者中,恶性患者43例,肺活检敏感度为55.8%(24/43),刷检细胞学诊断敏感度为81.4%(35/43),两者联合可提高肺癌诊断率,刷检C-ROSE假阳性0.0%,敏感度为74.4%(32/43),刷检C-ROSE结果与刷检细胞学结果一致性极好(Kappa值为0.902,P <0.001)。病灶直径≥3 cm与<3 cm的周围型肺癌刷检及联合活检的诊断率分别为88.9%和92.6%,68.8%和75.0%,差异无统计学意义(P >0.05),各叶之间刷检及联合活检的诊断率差异无统计学意义(P >0.05),当C-ROSE结果为阳性时平均刷检次数为(1.61±0.90),平均操作时间为(20.80±7.93)min;为阴性时平均刷检次数为(2.35±0.69),(26.60±7.22)min,两组间差异有统计学意义(P <0.05),有5.1%(3/59)的肿瘤患者为经刷检C-ROSE提示后更换部位取材发现。结论 EBUS联合刷检C-ROSE在肺周围型病变诊断具有较高的诊断价值,刷检C-ROSE与最终病理结果有很好一致性,当刷检现场细胞为阳性时可减少气管镜操作时间、刷检等及其带来的并发症。
超声小探头;现场细胞学;肺周围型病变;肺癌
周围型肺病灶是指发生于段支气管开口以下的肺部病灶,常通过胸部影像学发现,其性质疾病构成包括恶性和良性疾病,其中肿瘤及肺炎占60.0%以上,其次为结核及其他良性病变,所以对其的诊断非常重要[1]。超声小探头(endobronchial ultrasonography,EBUS)因其有可清晰分辨病灶、安全性高及费用低等特点成为周围型肺疾病重要的检查手段,在上世纪90年代首次有国外学者报道其临床价值[2],但其为非实时引导下取材,对是否取得满意的标本仍难以判断。为解决该问题现场细胞学(rapid on-site evaluation of cytology,C-ROSE)开始应用临床[3]。近年来国内外有多篇研究报道C-ROSE评估在经支气管镜针吸活检术(transbronchial needle aspiration,TBNA)中应用可减少穿刺次数、提高诊断率及减少并发症等,有着较高的临床价值,但有关在肺周围型病变中应用的报道很少[4-7]。本研究对EBUS联合刷检C-ROSE对肺周围型病变进行刷检、活检的可行性、安全性和有效性进行评估,并对病灶直径大小及位置对诊断影响进行分析。
1 资料与方法
1.1一般资料
1.1.1研究对象研究对象为2014年11月-2015年9月在我院呼吸科行支气管镜检查并符合入选标准的59例患者。其中,男31例,女28例,年龄30~87岁,平均(63.54±15.71)岁,病灶大小1.0~6.2 cm。入选标准:①患者为胸部CT发现有肺周围型病灶且不能确诊的患者;②普通电子支气管镜未能发现病灶但超声小探头可发现病灶;③血常规、心电图、出凝血时间及肝肾功能正常;④无全身麻醉禁忌证及支气管镜检查禁忌证;⑤试验对象的选择均取得本人及家属同意,符合医学伦理学要求。剔除标准:①有出血倾向、严重心肺功能不全不能耐受支气管镜检查及不配合操作患者;②EBUS未能发现病灶的患者。
1.1.2主要试剂
迪夫快速染色液,珠海贝索生物有限公司生产。
1.1.3主要实验仪器
EB-530H可弯曲电子支气管镜(外径5.8 mm)、P2615-M微型超声探头(外径2.0 mm)、RS702超声探头驱动器、SP707超声小探头主机(以上设备均为日本富士公司生产)及德国莱卡生物DM500显微镜等。
1.2实验方法
1.2.1EBUS非实时引导下刷检及活检术前行胸部CT,必要时行增强胸部CT,了解病灶大小、位置及明确通向其支气管。术前所有患者给予2%利多卡因10 ml雾化10 min,术中予芬太尼、力月西静脉持续镇静。术中监护患者心律、心率、血氧及血压。予电子支气管镜从患者鼻孔进入支气管内先行常规检查。在完成常规检查后,根据影像学及通向病灶支气管将EBUS送至需探查部位(图1和2),直到术者感觉到有明显阻力时即开始超声扫描,同时缓慢、均匀将探头往外抽出,观察超声图像的变化,出现病灶图像时,调整EUBS增益、对比度、扫描范围(3~6 cm)等参数以获得清晰超声图像来了解病灶大小、病灶与EBUS关系等情况,并在相邻的细支气管重复行上述检查以争取采集到病灶最佳的超声图像及最佳取材位置(图3)。固定气管镜位置,用标记纸在操作通道入口处标记EBUS进入的长度,退出超声探头后,根据标记的EBUS进入的长度,标记好毛刷及活检钳所需进入的长度。沿超声探头插入的路径及插入长度行刷检。毛刷的标本均匀快速涂在3张玻片上,其中一份标本在病理医师在场下行刷检C-ROSE评估,另一份送至广州金域实验中心行细胞学诊断作为刷检细胞学诊断金标准。细胞以迪夫快速染色液按文献[8]所述方法染色,染色后行C-ROSE,当C-ROSE为恶性时(图4),则停止刷检,如果为无诊断价值时则需在原部位再次刷检或换部位进行刷检或进行下一步经支气管肺活检,在每一个部位刷检结束后均行经支气管肺活检。
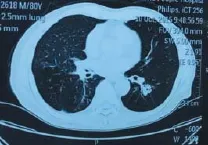
图1 左下肺背段占位CT图
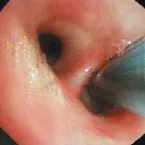
图2 超声对左下肺背段探查图
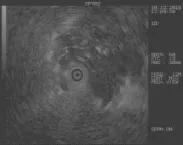
图3 左下肺背段占位超声图
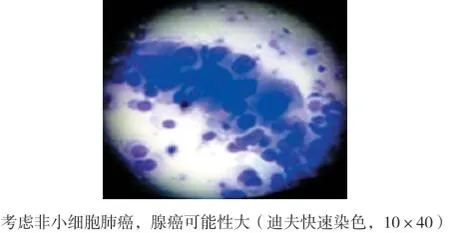
图4 C-ROSE图片
1.2.2刷检C-ROSE评估标准读片根据Guidelines of the Papanicolaou Society of Cytopathology[9]可分为C1~C5五类:C1表示没有诊断性价值的标本或标本不适当,也就是标本正常的支气管黏膜上皮,C2表示良性病变,C3表示标本诊断可疑,可能为良性,C4表示标本诊断可疑,可能为恶性,C5表示为癌性病灶,如果标本分类为C2、C5提示标本取样满意、适当,如分类为C1、C3~C4则提示标本取样不合格,可能需要重新取样。
1.3统计学方法
采用统计软件SPSS 20.0分析数据。计量资料以均数±标准差表示,成组计量资料之间比较用t检验,结果一致性比较用Kappa检验,对两组计数资料进行比较采用χ2检验。所有比较以双侧α=0.05为检验水准,P <0.05为差异具有统计学意义。
2 结果
2.1最终细胞结果与刷检现场细胞结果
刷检细胞学提示肿瘤为35例,大量炎症细胞3例,未发现肿瘤细胞21例,阳性率为59.3%(35/59);C-ROSE发现肿瘤32例,大量炎症细胞3例,未发现肿瘤细胞24例,阳性率为54.2%(32/59);肺活检发现肿瘤24例,结核2例,慢性炎症30例,大量炎症细胞3例,阳性率为40.7%(24/59)。C-ROSE结果与刷检细胞学结果一致性Kappa值为0.902,P <0.001,C-ROSE为阳性的患者中刷检细胞学结果都为阳性,假阳性0.0%。有13例肺活检阴性,刷片为阳性,有2例刷检为阴性肺活检为阳性,肺活检或(和)刷检为阳性有37例,阳性率为62.7%(37/59)。见表1。
2.2EBUS联合C-ROSE下对肺癌的诊断敏感度
本实验22例刷检、活检诊断都为阴性患者中,有12例经手术诊断肺癌4例,肺炎6例,肺脓肿1例,炎性假瘤1例;刷检或(和)活检诊断为结核2例患者及大量炎症细胞3例患者经抗结核或感染治疗后病灶明显缩小,维持原来诊断;有5例患者在观察为期1年观察中有2例患者病灶明显增大并出现肺外病灶,临床诊断为肺癌,3例病灶大小无明显变化,临床诊断为良性病变。本实验中最终诊断为恶性肿瘤患者43例,良性病变16例,其中包括结核患者2例,肺炎10例,炎性假瘤1例,其他良性病变3例。EBUS联合C-ROSE下对肺癌的诊断刷检、肺活检、C-ROSE的敏感度分别为81.4%、55.8%和74.4%,总体对肺癌诊断敏感度为86.0%。见表2。
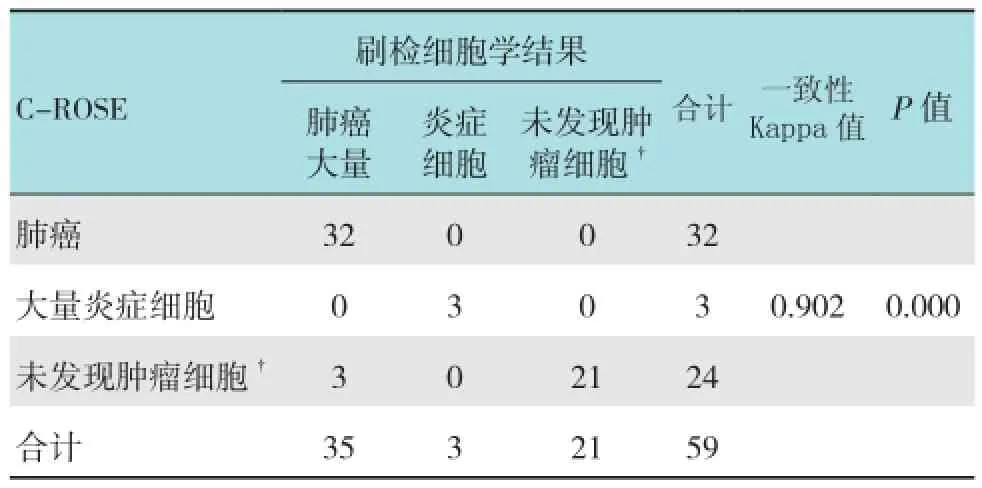
表1 最终细胞结果与刷检现场细胞结果
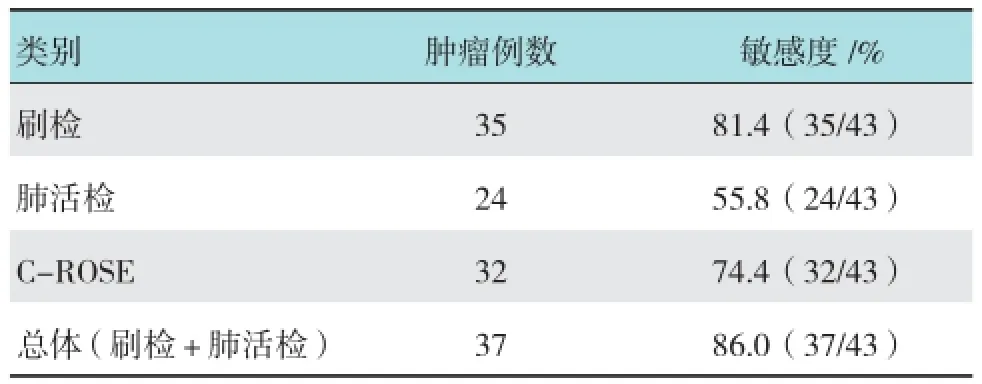
表2 EBUS联合C-ROSE下对肺癌的诊断敏感度
2.3两组间刷检及联合检查对周围型肺癌的诊断比较
病灶直径<3 cm周围型肺癌刷检及联合活检的阳性诊断率分别为68.8%(11/16)和75.0%(12/16),病灶直径≥3cm周围型肺癌刷检及联合活检的阳性诊断率分别为88.9%(24/27)和92.6%(25/27),两组间刷检及联合诊断率差异均无统计学意义(χ2=1.53、1.33,均P >0.05)。见表3。
2.4刷检组各叶之间诊断率的比较和刷检联合活检组各叶之间诊断率的比较
本实验中周围型肺癌位于右上叶有9例(20.9%),右中叶5例(11.6%),右下叶11例(25.6%),左上叶固有支5例(11.6%),左上叶舌支4例(9.3%),左下叶有9处(20.9%),刷检及联合检查对肿瘤诊断分别为:右上叶有8例/9例,右中叶4例/4例,右下叶8例/8例,左上叶固有支3例/4例,左上叶舌支4例/4例,左下叶有8例/8例,在EBUS-C-ROSE指导下刷检组各叶之间诊断率的比较和刷检联合活检组各叶之间诊断率的比较差异均无统计学意义(均P >0.05)。见表4。
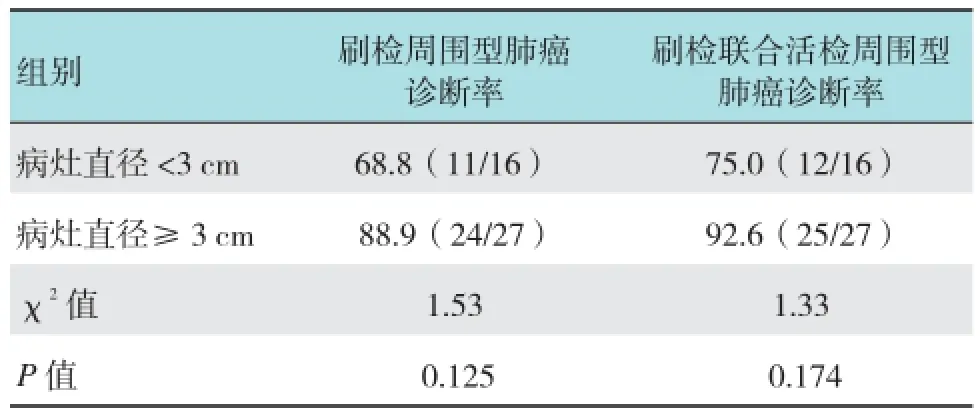
表3 两组间刷检及联合检查对周围型肺癌的诊断比较 %
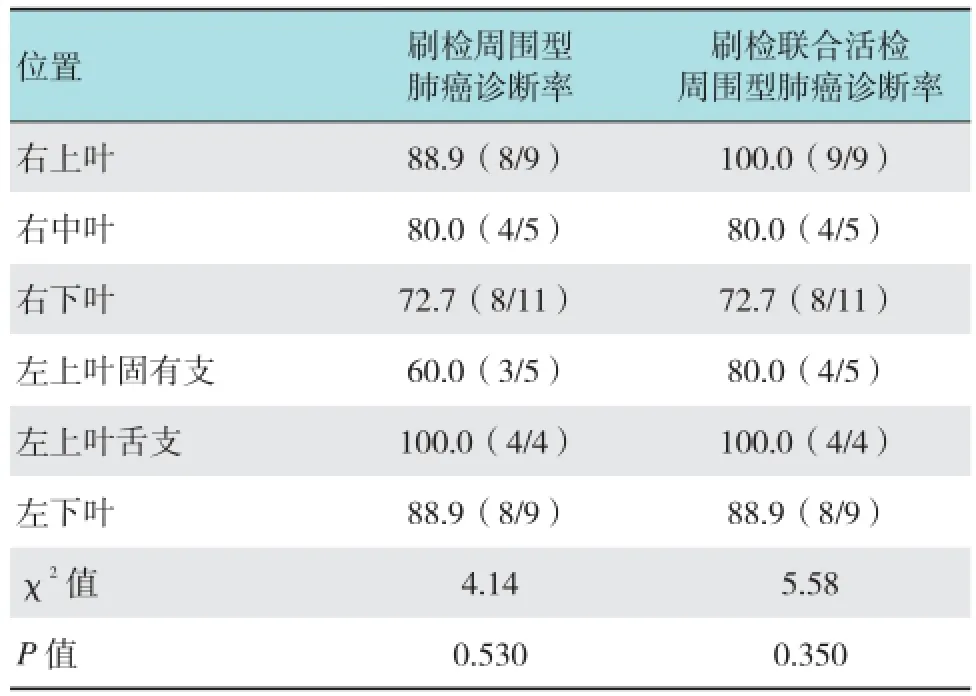
表4 刷检组各叶之间诊断率的比较和刷检联合活检组各叶之间诊断率的比较 %
2.5刷检次数、操作时间与C-ROSE阴阳性结果的关系
在本实验C-ROSE为阳性的32例中,首次C-ROSE为阴性再次刷检后为阳性的患者有13例(40.6%),其中7例为第2次刷检为阳性,5例为第3次刷检为阳性,1例为第4次刷检为阳性。其中有3(5.1%)例为改路径超声探查后刷检获得阳性。当C-ROSE为阳性时平均刷检次数为(1.61±0.90)次,为阴性时平均刷检次数为(2.35±0.69)次,两组刷检次数之间差异有统计学意义(t =-3.58,P =0.001),C-ROSE为阳性时平均操作时间为(20.80±7.93)min,为阴性时平均操作时间为(26.60±7.22)min,两组平均操作时间的差异有统计学意义(t =-2.92,P =0.005)。见表5。
2.6并发症
本实验主要并发症为咯血、胸痛,均未发现气胸、严重低血氧和心律失常等严重并发症。共有31例(31/59,52.5%)出现咯血,但咯血量都较少(<20 ml),在操作过程中经支气管镜活检通道予1∶1 000冰盐水、肾上腺素、凝血酶等处理后出血停止,有11例(11/59,18.6%)出现胸痛,胸痛较轻微,可忍受,未予处理后症状逐渐缓解。
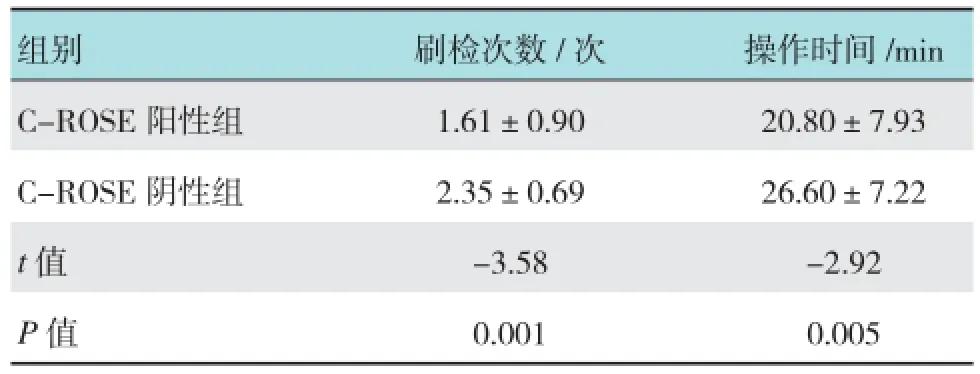
表5 刷检次数、操作时间与C-ROSE阴阳性结果的关系
3 讨论
本实验中EBUS联合C-ROSE对肺周围型病变刷检阳性率和敏感度为59.3%和81.4%,活检阳性率和敏感度为40.7%和55.8%,刷检联合活检阳性率和敏感度为62.7%和86.0%。以上表明在C-ROSE指导下的刷检较活检获得较高的阳性诊断率,其原因首先为活检标本未能在刷检现场细胞下进行判断而造成取材不佳。其次为组织钳所取的标本较小,未能取中肿瘤组织。再次为所取的组织含肿瘤细胞较少,在病理制片、读片时容易漏诊。本实验刷检联合活检中有2例刷检为阴性肺活检为阳性,相对单纯刷检,联合活检提高了3.4%(2/59)的阳性诊断率,与以往研究报道联合性检查可提高检查率观点相一致,但诊断率仅提高3.4%,表明刷检C-ROSE具有重要的指导意义[10-11]。实验中C-ROSE结果与刷检细胞学结果有很好的一致性,并且在本实验中未出现假阳性(Kappa值为0.902,假阳性0.0%)。本研究表明EBUS联合C-ROSE对肺周围型病变进行诊断是一种可行、可靠性高、有效的方法。
病灶自身的特征会对EBUS的诊断造成影响,以往多篇研究报道指出病灶的大小影响EBUS的诊断率,由于技术及气管结构原因取材工具不能接近较小的病灶及病灶较小未累及到更多的细支气管从而影响了诊断率[12-13]。在本实验中直径≥3 cm较直径<3 cm的病灶虽然数值上有更高的诊断率,但差异无统计学意义,提示EBUS联合C-ROSE对提高较小的肺周围型病灶的诊断率有重要的意义。
本实验中各叶的诊断率在统计学上无明显差异,与以往研究报道位置可影响EBUS诊断率及右肺的上叶、左肺上叶固有支诊断率相对较低不一致[12-14]。可能因为在没有刷检C-ROSE的情况下,右肺的上叶及左肺上叶固有支的弯曲角度太大,超声探头难以贴住病灶及取材工具较软,在伸往远处病灶后出现过度弯曲而导致未能完全按探头进入的路径伸往病灶,导致取材不满意,而导致诊断率较低。本实验可在C-ROSE指导重新修正毛刷伸入路径使其能按探头伸进路径到达病灶位置,从而提高诊断率。
本研究中首次C-ROSE为阴性再次刷检后为阳性的患者有13例,其中3例为改路径超声探查后刷检获得阳性,较常规EBUS的单个部位取材提高了5.1%(3/59)的诊断率,与UCHIDA等[15]的观点当C-ROSE为阴性时重新取材可提高诊断率相一致。
本研究中当C-ROSE为阳性时可减少刷检次数及操作时间。减少刷检次数可减少玻片张数,可减少患者病理检查的费用。缩短检查时间可提高气管镜的检查效率,可降低因气管镜检查对患者造成的二氧化碳潴留、血氧、pH降低等不良的生理影响,特别是在减少有严重肺部疾病患者的操作时间中有着重要的意义[16-17]。因C-ROSE与刷检细胞病理结果有极好的一致性,在诊断肿瘤患者时,当C-ROSE为阳性时即可停止后面的活检,这可减少活检带来的出血、气胸和胸痛等并发症,并能更加有效缩短检查时间,增加了气管镜操作的效率及安全性。
综上所述,EBUS联合刷检C-ROSE在肺周围型病变诊断具有较高的诊断价值,当刷检现场细胞为阳性时可减少气管镜操作时间、刷检、活检次数及其所带来的并发症,为肺周围型病变的诊断提供了一种安全、可行的方法。
[1] 张国桢. 实用胸部CT诊断学[M]. 北京: 科学技术文献出版社,1994: 100-102.
[2] HURTER T, HANRATH P. Endobronchial sonography in the diagnosis of pulmonary and mediastinal tumors[J]. Dtsch Med Wochenschr, 1990, 115(50): 1899-1905.
[3] DAVENPORT R D. Rapid on-site evaluation of transbronchial aspirates[J]. Chest, 1990, 98(1): 59-61.
[4] 丁丽红, 万丽, 董磊, 等. 现场细胞学结合免疫组化在小细胞肺癌诊断中的价值[J]. 临床与实验病理学杂志, 2012, 28(9): 1046-1048.
[5] 李凯述, 刘明涛, 姜淑娟, 等. 经支气管镜针吸活检联合现场细胞学对肺癌诊断的临床价值[J]. 中国肺癌杂志, 2014, 17(3): 215-220.
[6] AUSTIN J H, COHEN M B. Value of having a cytopathologist presentduring percutaneous fi ne-needle aspiration biopsy of lung:report of 55 cancer patients and metaanalysis of the literature[J]. AJR Am J Roentgenol, 1993, 160(1): 175-177.
[7] TRISOLINI R, CANCELLIERI A, TINELLI C, et al. Rapid on-site evaluation of transbronchial aspirates in the diagnosis of hilar and mediastinal adenopathy[J]. Chest, 2011, 139(2): 395-401.
[8] SILVERMAN J F, FRABLE W J. The use of the diff-quik stain in the immediate interpretation of fi ne- needle aspiration biopsies[J],Diagn Cytopathol, 1990, 6(5): 366-369.
[9] Papanicolaou Society of Cytopathology Task Force on Stan-dards of Practice. Guidelines of the Papanicolaou Society of Cytopathology for the examination of cytologic specimens obtained from the respiratory tract[J]. Diagn Cytopathol, 1999, 21(1): 61-69.
[10] KUO C H, LIN S M, LEE K Y, et al. Endobronchial ultrasoundguided transbronchial biopsy and brushing: a comparative evaluation for the diagnosis of peripheral pulmonary lesions[J]. Eur J Cardiothorac Surg, 2014, 45(5): 894-898.
[11] GRIFFIN J P, ZAMAN M K, NIELL H B, et al. Diagnosis of lung cancer: a bronchoscopist’s perspective[J]. J Bronchology Interv Pulmonol, 2012, 19(1): 12-18.
[12] YOSHIKAWA M, SUKOH N, YAMAZAKI K, et al. Diagnostic value of endobronchial ultrasono- graphy with a guide sheath for peripheral pulmonary lesions without X-ray fluoroscopy[J]. Chest, 2007, 131(6): 1788-1793.
[13] DOOMS C A, VERBEKEN E K, BECKER H D, et al. Endobronchial ultrasonography in bronchoscopic occult pulmonary lesions[J]. J Thorac Oncol, 2007, 2(2): 121-124.
[14] SHIRAKAWA T, IMAMURA F, HAMAMOTO J, et al. Usefulness of endobronchial ultrasonography for transbronchial lung biopsies of peripheral lung lesions[J]. Respiration, 2004, 71(3): 260-268.
[15] UCHIDA J, IMAMURA F, TAKENAKA A, et al. Improved diagnostic effi cacy by rapid cytology test in fl uoroscopy-guided bronchoscopy[J]. J Thorac Oncol, 2006, 1(4): 314-318.
[16] WALLBRIDGE P D, HANNAN L M, JOOSTEN S A, et al. Clinical utility of sequential venous blood gas measurement in the assessment of ventilatory status during physiological stress[J]. Intern Med J, 2013, 43(10): 1075-1080.
[17] CHHAJED P N, RAJASEKARAN R, KAEGI B, et al. Measurement of combined oximetry and cutane- ous capnography during fl exible bronchoscopy[J]. Eur Respir J, 2006, 28(2): 386-390.
(曾文军 编辑)
Diagnostic value of endobronchial ultrasound combine with rapid on-site evaluation of bronchial brushing for pulmonary peripheral lesions
Fa Long1, Zhen-yu Ou1,Wen-ting Huang1, Jing-jing Fang2, Jun-hua Li2, Ai-lian Zhou2
(1.Department of Respiratory Medicine, Guangming District People’s Hospital, Shenzhen, Guangdong 518106, China; 2.Department of Respiratory Medicine, the Fifth People’s Hospital,Shenzhen, Guangdong 518001, China)
Objective To evaluate the diagnostic value of endobronchial ultrasound combine with rapid on-site evaluation of cytology (C-ROSE) of bronchial brushing (BB) for pulmonary peripheral lesions. Methods Through the ultrasonic probe into the lesion, got the best images of ultrasound images and the best location, then exit the ultrasonic probe. According to the pathways of the ultrasonic probe, bronchial brushing was performed. Bronchial brushing was terminated when diagnostic C-ROSE specimens were characterised as those clearly demonstratingthe typical cytological features of malignancy. Non-diagnostic C-ROSE resulted in further bronchoscopic sampling,including transbronchial lung biopsy and/or sampling from different locations. Blind biopsy was performed with biopsy forceps through pathways of the ultrasonic probe after brushing in every checked part. Results Malignant diagnosis was 43 out of 59 patients, the sensitivity of transbronchial lung biopsy and bronchial brushing were 55.8 % (24/43), and 81.4 % (35/43). The combining bronchial brushing and biopsy improved diagnostic sensitivity. The false-positive the sensitivity of C-ROSE was 0.0 % and 74.4 % (32/43), C-ROSE has good concordance with bronchial brushing cytology in the diagnosis of pulmonary peripheral lesions (Kappa value was 0.902, P <0.001). The diagnostic yields of bronchial brushing and brush combining with biopsy in peripheral lung cancer were 68.8%(11/16) and 75.0 % (12/16) on lesions with <30 mm diameter and were 88.9 % (11/16) and 92.6 % (12/16) on lesions with ≥30 mm diameter, no statistically signifi cant differences were found (P > 0.05). The diagnostic yields between bronchial brushing and bronchial brushing combining with biopsy is also no statistically significant differences in anyone lobes (P >0.05). Procedure times and brushing times were significantly shorter (lesser) for procedures when rapid on-site examinations demonstrated malignancy compared to those where rapid on-site examination was non-diagnostic (20.80 ± 7.93) min versus (26.60 ± 7.22) min, respectively; (P <0.05), (1.61 ± 0.90) times versus(2.35±0.69) times; (P <0.05). 5.1 % (3/59) of the tumor patients were found with redirection of sampling by result of C-ROSE. Conclusion Endobronchial ultrasound combine with rapid on-site evaluation of bronchial brushing is effective for pulmonary peripheral lesions. It can reduce procedure times, brushing times and complications, when rapid on-site examinations demonstrated malignancy.
endobronchial ultrasound; rapid on-site evaluation of cytology; pulmonary peripheral lesions; lung cancer
R734.2
A
10.3969/j.issn.1007-1989.2016.10.013
1007-1989(2016)10-0054-06
2016-03-25
