单孔胸腔镜纵膈淋巴结清扫的应用体会*
2016-11-29柯宏刚肖威章薛群严煜尤庆生陆松华
柯宏刚,肖威章,薛群,严煜,尤庆生,陆松华
(1.南通大学附属医院 胸外科,江苏 南通 226001;2.江苏省海安县人民医院 胸外科,江苏 海安 226600)
单孔胸腔镜纵膈淋巴结清扫的应用体会*
柯宏刚1,肖威章1,薛群1,严煜1,尤庆生1,陆松华2
(1.南通大学附属医院 胸外科,江苏 南通 226001;2.江苏省海安县人民医院 胸外科,江苏 海安 226600)
目的 探讨单孔胸腔镜(SPT)治疗Ⅰ期非小细胞肺癌(NSCLC)时纵膈淋巴结清扫的技术特点。方法 2015年1月-2015年12月,该中心采用SPT治疗63例临床Ⅰ期的NSCLC患者。其中,男35例,女28例,年龄45~79岁,右胸手术37例,左胸手术26例。手术方式为肺叶切除+系统性肺门纵膈淋巴结清扫。纵膈淋巴结的分区以国际肺癌协会(IASLC)为标准,即右胸2-4、7、8和9组,左胸4、5、6、7、8和9组。主要评估指标包括纵膈每组淋巴结清扫的数目和时间,并发症的发生率,胸管引流时间和引流量以及住院时间等。以无疾病生存时间(DFS)为指标随访3~15个月。结果 全部患者均顺利完成SPT手术,无中转开胸或转三孔手术发生,无死亡率发生。纵膈淋巴结清扫的总数目(术中系统性淋巴结清扫后术侧各站淋巴结的总和):右胸(15.3±4.4),左胸(17.7±5.6)。其中,右侧2-4组(6.3±2.1),7组(9.5±4.3),8组(4.5±2.3),9组(2.5±1.7);左侧4组(3.7±1.1),5组(3.7±1.5),6组(4.1±2.0),7组(5.7±3.4),8组(3.6±2.6),9组(2.7±1.3)。纵膈淋巴结清扫的时间:右胸(20.7 ±11.2)min,左胸(45.2±18.5)min,特别是在清扫第4,7组淋巴结时左、右胸比较差异有统计学意义(P <0.05)。术后在并发症的发生率、胸管引流时间、胸管引流总量以及住院时间的比较上,左、右胸手术差异无统计学意义(P >0.05)。术后随访未见肿瘤复发和转移。结论 SPT下行纵膈淋巴结清扫在技术上是安全和有效的,合理的放置镜头和器械,充分的显露和规范的操作流程是手术成功的关键。
电视胸腔镜;肺叶切除;纵膈淋巴结清扫;非小细胞肺癌;单孔法
众所周知,能否彻底清扫纵膈淋巴结是衡量非小细胞肺癌(non small cell lung cancer,NSCLC)手术成功与否的标志之一,在欧洲胸外科医师学会(European Society of Thoracic Surgeons,ESTS)指南[1]中作为核心因素被推荐。单孔胸腔镜(single-port thoracoscopy,SPT)是近年来发展起来的一种以切口小、肋间神经损伤少和疼痛轻等为特点的微创治疗方法[2],在早期NSCLC外科治疗领域最先使用。然而SPT下空间狭小,操作难度大也或多或少阻碍了单孔技术的发展,特别是对于NSCLC手术时能否彻底清扫淋巴结仍缺少循证医学的证据。为了进一步探讨和总结SPT下纵膈淋巴结清扫的手术技巧,本研究回顾性分析了2015年1月-2015年12月我中心采用SPT治疗Ⅰ期NSCLC患者的临床资料。现报道如下:
1 资料和方法
1.1一般资料
2015年1月-2015年12月,我中心对术前诊断为临床Ⅰ期的63例NSCLC [第7版的国际抗癌联盟(Union for International Cancer Control,UICC)TNM分期,cT1-2aN0M0]患者采用SPT进行肺叶切除+肺门纵膈淋巴结清扫术。其中,男35例,女28例,年龄45~79岁,右胸手术37例,左胸手术26例。所有患者的临床数据包括年龄、性别、肿瘤大小、位置、临床分期、病理结果、第一秒用力呼气容积(forced expiratory volume in the first second of expiration,FEV1)、用力肺活量(forced vital capacity,FVC)和一氧化碳弥散量(diffusing capacity of carbon monoxide,DLCO)结果见表1。术前常规行胸部、上腹部增强CT,纤维支气管镜,全身骨扫描和头颅核磁共振检查,排除远处转移,国际肺癌协会(International Association for the Study of Lung Cancer Classification,IASLC)胸部淋巴结标准分区[3]对纵膈淋巴结进行评估。
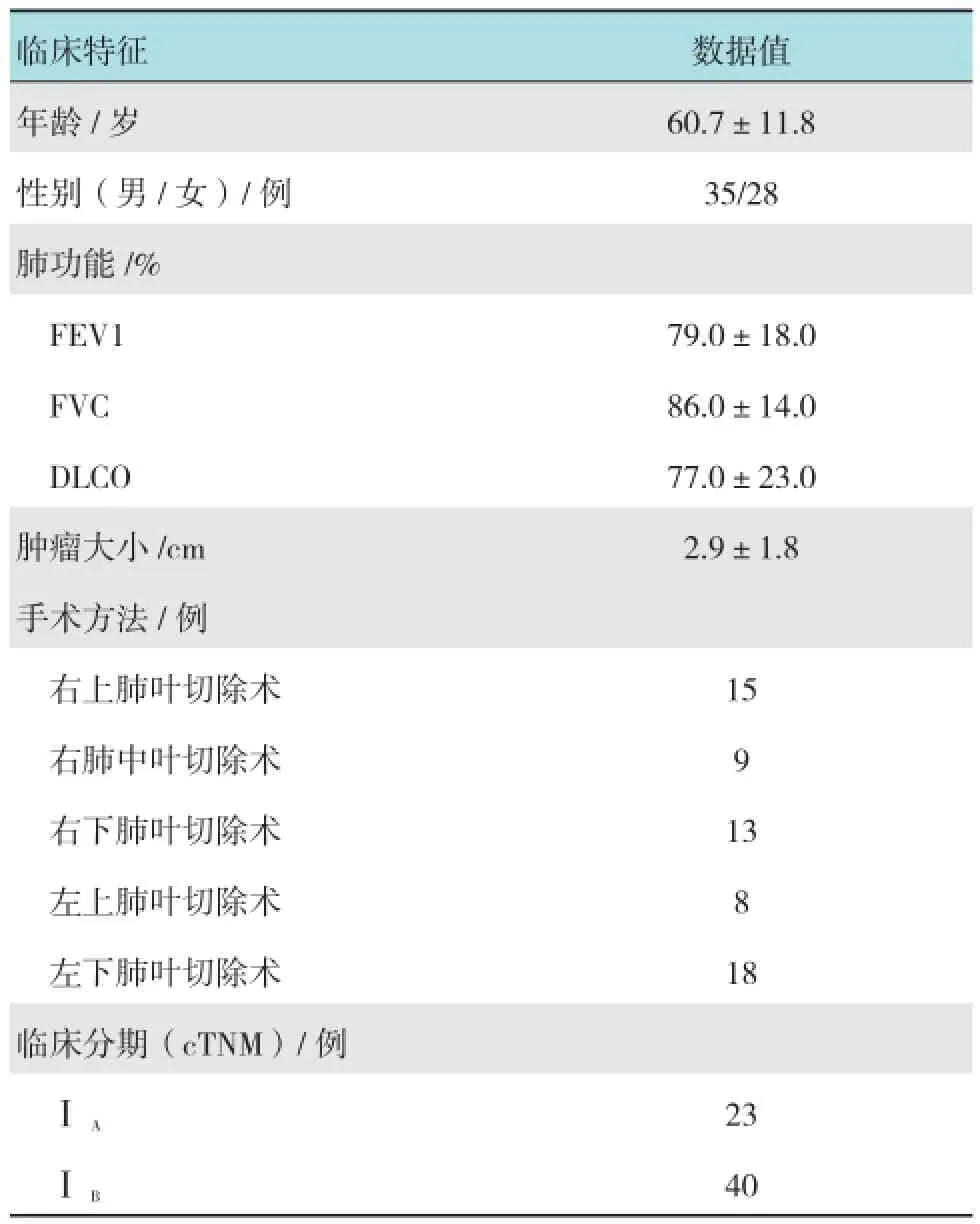
表1 SPT下纵膈淋巴结清扫的患者的临床资料
1.2手术
1.2.1麻醉与切口 所有的患者采用的是静脉复合全身麻醉,双腔气管插管,术中健肺通气。切口位于患侧腋前线与腋中线处的第4或第5肋间,长约4 cm。术中使用切口保护套(60 mm,北京航天卡迪技术开发研究所)。
1.2.2纵膈各站淋巴结清扫 系统性纵膈淋巴结清扫均在肺叶切除后进行。淋巴结清扫中手术操作遵循的原则[4]:尽可能不夹持,最佳保持淋巴结的完整性,同时尽量切除淋巴结及其周围的脂肪组织。使用的能量器械主要为5 mm 超声刀(爱惜康,内镜外科,辛辛那提,美国)。
1.2.3右胸 2R-4R组淋巴结位于上腔静脉后缘,气管前缘,升主动脉和主动脉弓起始,奇静脉弓上缘和右锁骨下动脉下缘所构成的间隙。清扫时从奇静脉弓下缘开始,沿右主支气管和右肺动脉干向上,打开上纵膈胸膜,将奇静脉弓下的脂肪组织向上牵拉,从气管前缘开始逐步向上向前清扫,直至右锁骨下动脉。术中注意保护升主动脉、上腔静脉以及迷走淋巴管。上腔静脉前的淋巴结及部分脂肪组织(3a)以及气管后可以看到的淋巴结(3p)也被清扫。在右胸,隆突下的淋巴结(7)清晰可见,位于双侧气管分叉以下,心包上缘,食管前,下肺静脉的上缘。单孔法胸腔镜下往往从右主支气管后缘开始,逐步向隆突下靠近,最后清扫左主支气管旁的淋巴结。在离断下肺韧带时,可以同时显露和清扫位于下肺静脉下缘区域的淋巴结(8R)以及位于食管旁可见的淋巴结(9R)。见图1。
1.2.4左胸 上纵隔淋巴结应包括位于主动脉弓下缘至左肺动脉前缘的淋巴结(5),主动脉弓的顶部(上缘)至膈神经(后缘)以及心包的上缘的主动脉旁淋巴结(6)以及位于气管左旁区域的所有软组织(4L)。术中尤以4L的手术难度最高。该区域位于主气管的中段,动脉韧带,主动脉弓以及左主支气管之间,空间狭小,暴露困难是手术的难点。当完整切除后,可以充分显露左喉返神经(图2)。由于左胸的解剖特点,经左胸行隆突下淋巴结(7)清扫均较困难。主要问题是术野位置较深,暴露困难,一旦出血将会造成视野不清。SPT下暴露隆突下淋巴结需要一定的技巧。术中注意:①尽量后移手术切口,可定位于腋中线第5肋间,有助于显露第7组淋巴结;②使用超细的手术器械钳夹细沙球,将气管残端向前牵引,增加隆突下手术空间,利于暴露和操作。术中注意保护迷走神经、降主动脉和食管。左胸第8和9组淋巴结的清扫与右胸类似。见图3。

图1 2R-4R淋巴结清扫

图2 经左胸清扫第4组淋巴结需充分显露左喉返神经
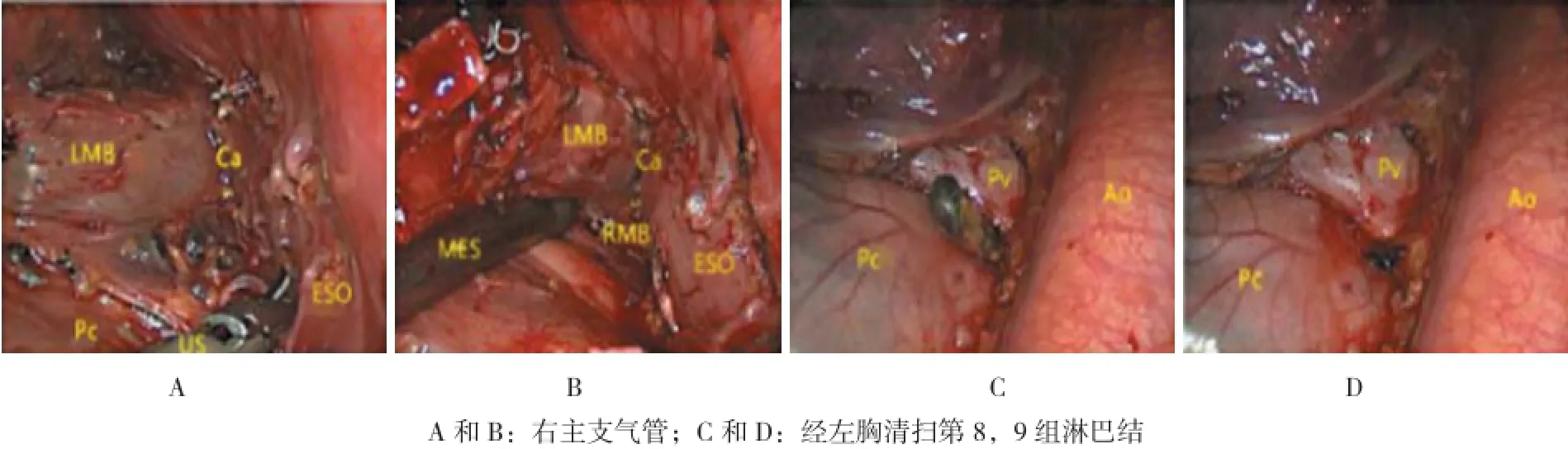
图3 经左胸清扫隆突下淋巴结充分显露出右主支气管
1.3观察与评价指标
包括左右胸纵膈淋巴结清扫的站数,各站纵膈淋巴结清扫的数目和时间,术后并发症的发生率,胸管引流时间和引流量以及住院时间等。术后胸部CT随访3~15个月,按照实体肿瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)评估有无纵膈淋巴结复发。
1.4统计学方法
统计学软件使用的是SPSS 13.0。一般计数可使用EXCEL进行计算,计量资料以均数±标准差(x±s)表示,各组间数据的比较依据资料的性质,采用t检验或方差分析。以P <0.05为差异具有统计学意义。
2 结果
2.1术后病理
所有患者均获得了完整的肺叶切除和肺门纵膈的淋巴结清扫,无中转开胸或改为三孔手术的病例。全组围手术期及术后随访期间死亡率为零。术后病理:腺癌44例(包括黏液性6例,乳头状8例,贴壁性10例,微乳头1例),鳞癌6例。术后病理分期:Ⅰa期23例,Ⅰb期37,Ⅱa期2例,Ⅲa期1例。术后病理分期发生变化的3例(3/63,4.8%)
2.2术中纵膈淋巴结清扫的总数目(个)
左胸(17.7±5.6),右胸(15.3±4.4)。其中,右侧2-4组(6.3±2.1),7组(9.5±4.3),8组(4.5±2.3),9组(2.5±1.7);左侧4组(3.7±1.1),5组(3.7±1.5),6组(4.1±2.0),7组(5.7±3.4),8组(3.6±2.6),9组(2.7±1.3)。见图4。
2.3左、右胸纵膈淋巴结清扫情况比较
在术后胸管引流时间、引流量和住院时间的比较上,左、右胸差异无统计学意义(P >0.05),但在手术时间的比较上,特别是在第4、7组淋巴结清扫的时间上左胸明显长于右胸(P <0.05)。在并发症的比较上,左胸发生1例喉返神经麻痹,术后3个月后逐渐恢复发音;右胸发生1例乳糜胸经保守治疗后好转。术后随访全组患者无肿瘤复发及转移表现。见表2。

图4 SPT胸部各组淋巴结清扫数目分布

表2 SPT下左、右胸纵膈淋巴结清扫围手术期对比 (x±s)
3 讨论
一直以来,对于临床Ⅰ期NSCLC是否需要进行系统性淋巴结清扫始终存在争议。ACOSOG Z0030实验组对1 023例诊断为T1-2N0-1期的NSCLC患者进行随机对照研究[5],结果显示无论是进行系统性清扫还是采样,比较术后中位生存期、5年无疾病生存时间(disease-free survival,DFS)和肿瘤复发等方面差异均无统计学意义。JIANG等[6]也发现,选择性纵膈淋巴结清扫可以明显减少手术创伤,特别是对于年老患者,其远期生存率与系统性纵膈淋巴结清扫相当。然而也有不同意见,REICHERT等[7]对术前PETCT提示纵膈淋巴结阴性的Ⅰ期NSCLC患者实行电视辅助胸腔镜手术(video-assisted thoracic surgery,VATS)下系统性纵膈淋巴结清扫,结果发现有16.9%的患者因肺门或纵膈淋巴结转移出现分期改变,其中9例cN0→pN1(11.7%),4例cN0→ pN2(5.2%),而且术后并发症无明显增加。在本研究中也出现了类似的结果,即3例(3/63,4.8%)临床Ⅰ期的NSCLC患者术前术后N分期发生改变(2例cN0→pN1,1例cN0→pN2),究其原因,笔者认为可能与胸腔镜显露的优势[8]以及胸外科医师越来越娴熟的胸腔镜下淋巴结清扫技术有关,在不增加术后并发症的前提下,系统性淋巴结清扫可以获得准确地病理分期,从而更加精准地指导患者的术后治疗。
SPT是近几年刚刚兴起的一种手术方法,虽然该手术方式具有创伤小,疼痛轻等优势,但操作空间狭小,术中器械易相互干扰也是其未能广泛开展的主要原因。目前关于SPT下纵膈淋巴结清扫的前瞻性临床研究较少,GONZALEZ-RIVAS是最早开展单孔技术的胸外科医生,他认为[9]SPT完全可以安全有效的清扫纵膈淋巴结,在淋巴结清扫的数目上甚至优于两孔或三孔法。HSU等[10]等使用SPT清扫纵膈淋巴结的平均数目为(23.0±12.2),略高于GONZALEZRIVAS等[9]报道的(14.7±6.9),也提示SPT可以获得较满意的纵膈淋巴结清扫。本研究中,左、右胸清扫淋巴结的总数分别为(17.7±5.6)和(15.3±4.4),与上述结果接近。主要体会:对于左侧第5,6组以及双侧第8,9组淋巴结的清扫,在手术操作、暴露等方面,单孔法与两孔或三孔法类似,需要的只是时间和术者的耐心,而真正具有挑战的是对右胸第2、4组、左胸第4、7组淋巴结的清扫。
SPT下显露右胸2、4组淋巴结几乎没有手术盲区,如配合使用关节型的或带有角度的精细器械则操作将更加灵活。在手术流程的设计上,JEON等[11]的经验是从奇静脉弓下缘开始清扫,之后将奇静脉弓上提,并以气管和上腔静脉为界限,彻底清扫该区域的脂肪组织和淋巴结。笔者的经验与上述一致,但需要注意在清扫气管前淋巴结时要仔细辨认较粗大的淋巴管。由于该区域的淋巴管往往与胸导管有交通,损伤后易出现乳糜胸,术中游离时务必要仔细判别,一旦损伤淋巴管,可使用血管夹夹闭。本组早期有1例在术后3天出现乳糜胸,经积极保守治疗后痊愈。对于第2组淋巴结的清扫,笔者的体会是以右锁骨下动脉为界限即可。
左胸第4组淋巴结的清扫是SPT的技术难点。AMER[12]使用三孔胸腔镜对该区域的淋巴结清扫进行了综合分析。他认为手术的重点是区分和保护好左肺动脉干和左侧喉返神经。方法是使用“花生米”沙球下按肺动脉干增加显露空间,同时使用低功率的能量器械进行操作。SPT存在操作空间的缺陷,显露和操作更加困难,笔者对切口内的器械布局进行了规划。首先尽可能将手术切口设置在腋中线,清扫时助手将镜头位于切口最后端,同时在切口最前端使用细沙球轻压左肺动脉干,术者使用超声刀和吸引器在上述两者之间进行操作。术中的流程应首先判定左迷走神经主干及其肺门各分支,在切断左迷走神经上叶分支后,逐步向上游离,优先辨认出左喉返神经,最后沿着主支气管上行清扫左侧第4组淋巴结。清扫时主要以钝性游离为主,如需使用能量器械,应尽量使用低功率超声刀,并将刀头紧靠淋巴结,保护垫片将操作野与重要组织隔开。本研究中发生1例左喉返神经麻痹可能与初期开展时未能充分显示出左喉返神经以及术中能量器械使用不当有关。
隆突下淋巴结的清扫同样也存在暴露的问题。LIU等[13]的经验是将小纱布条放置在下肺静脉的上缘,以保护住左下肺的支气管,同时将肺叶和肺门组织从降主动脉和食管前推向前方,以此来充分暴露隆突,双侧的主支气管,甚至双侧的肺静脉,心包以及食管,双侧的迷走神经以及右侧的肺和胸膜等。GONZALEZ-RIVAS等[14]的经验是推荐使用双关节的器械,同时要充分暴露主支气管、食管和主动脉,另外术中采用头低脚高位,并将手术床向前倾将有助于隆突下淋巴结的切除。笔者在实际操作中结合了上述两位经验的同时,对于隆突位置较深的患者,在切口的最前端置入加长的卵圆钳,展开后可充分显露食管和左主支气管之间的间隙,利于术者操作。对于左肺上叶患者,在切除上叶后充分游离下肺韧带,将有助于将下肺向前牵拉,从而有利于隆突下淋巴结的暴露。
综上所述,SPT下清扫纵膈淋巴结是安全有效的。术中要合理地放置镜头和器械,同时注重对手术靶区的充分暴露,规范的手术流程、良好的操作习惯是手术成功的关键。
[1] LARDINOIS D, DE LEYN P, VAN SCHIL P, et al. ESTS guidelines for intraoperative lymph node staging in non-small cell lung cancer[J]. Eur J Cardiothorac Surg, 2006, 30(5): 787-792.
[2] ROCCO G, MARTUCCI N, LA MANNA C, et al. Ten-year experience on 644 patients undergoing single-port (uniportal)video-assisted thoracoscopic surgery[J]. Ann Thorac Surg, 2013,96(2): 434-438.
[3] GOLDSTRAW P, CROWLEY J J, CHANSKY K, et al. The IASLC Lung Cancer Staging Project: proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM classifi cation of malignant tumors[J]. J Thorac Oncol, 2007,2(8): 706-714.
[4] LIU C, PU Q, GUO C, et al. Non-grasping en bloc mediastinal lymph node dissection for video-assisted thoracoscopic lung cancer surgery[J]. BMC Surgery, 2015, 15: 38.
[5] DARLING G E, ALLEN M S, DECKER P A, et al. Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1 (less than hilar) non-small cell carcinoma: results of the American College of Surgery Oncology Group Z0030 Trial[J]. J Thorac Cardiovasc Surg, 2011, 141(3): 662-670.
[6] JIANG W, CHEN X, XI J, et al. Selective mediastinal lymphadenectomy without intraoperative frozen section examinations for clinical stageⅠnon-small-cell lung cancer: retrospective study of 403 cases[J]. World J Surg, 2013, 37(2): 392-397.
[7] REICHERT M, STEINER D, KERBER S, et al. A standardized technique of systematic mediastinal lymph node dissection by video-assisted thoracoscopic surgery (VATS) leads to a high rate of nodal upstaging in early-stage non-small cell lung cancer[J]. Surg Endosc, 2016, 30(3): 1119-1125.
[8] PALADE E, PASSLICK B, OSEI-AGYEMANG T, et al. Videoassisted vs open mediastinal lymphadenectomy for Stage I nonsmall-cell lung cancer: results of a prospective randomized trial[J]. European Journal of Cardio-Thoracic Surgery, 2013, 44(2): 244-249.
[9] GONZALEZ-RIVAS D, FIEIRA E, DELGADO M, et al. Uniportal video-assisted thoracoscopic lobectomy[J]. J Thorac Dis, 2013,5(Suppl 3): S234-S245.
[10] HSU P K, LIN W C, CHANG Y C, et al. Multiinstitutional analysis of single-port video-assisted thoracoscopic anatomical resection for primary lung cancer[J]. Ann Thorac Surg, 2015,99(5): 1739-1744.
[11] JEON H W, KIM Y D, MOON Y K, et al. Single incision thoracoscopic right upper lobectomy with systematic lymph node dissection[J]. Journal of Cardiothoracic Surgery, 2014, 9: 66.
[12] AMER K. Thoracoscopic mediastinal lymph node dissection for lung cancer[J]. Semin Thorac Cardiovasc Surg, 2012, 24(1): 74-78.
[13] LIU C Y, LIN C S, SHIH C H, et al. Single port video-assisted thoracoscopic surgery for lung cancer[J]. J Thorac Dis, 2014,6(1): 14-21.
[14] GONZALEZ-RIVAS D, PARADELA M, FERNANDEZ R, et al. Uniportal video-assisted thoracoscopic lobectomy: two years of experience[J]. Ann Thorac Surg, 2013, 95(2): 426-432.
(吴静 编辑)
Clinical experience of uniportal video-assisted thoracoscopic mediastinal lymphadenectomy*
Hong-gang Ke1, Wei-zhang Xiao1, Qun Xue1, Yu Yan1, Qing-sheng You1, Song-hua Lu2
(1.Department of Thoracic Surgery, the Affi liated Hospital of Nantong University, Nantong, Jiangsu 226001, China; 2.Department of Thoracic Surgery, the First People’s Hospital, Hai’an,Jiangsu 226600, China)
Objective To investigate the technical characteristics of uniportal video-assisted thoracoscopic mediastinal lymphadenectomy. Methods 63 patients with clinical stageⅠ NSCLC underwent lobectomy and systematic mediastinal lymphadenectomy by uniportal video-assisted thoracoscopic January to December in 2015. The number and resection time of each station of mediastinal lymph nodes were assessed. Mediastinal Lymph nodes were classifi ed according to the International Association for the Study of Lung Cancer classifi cation (IASLC). For right-sided tumors, lymph nodes number 2-4, 7, 8 and 9 were dissected, and for left-sided tumors, lymph nodes number 4, 5, 6, 7, 8, and 9 were dissected. We analyzed the perioperative parameters. Results There was no operative death. All procedures were successful accomplished without conversion to conventional multi-port VATS or open approach. The number of mediastinal lymph nodes removed was as follows: (right side) (15.3 ± 4.4) lymph nodes/patient, (left side) (17.7 ± 5.6) lymph nodes/patient. According the IASLC, we found the following results: 2R-4R(6.3 ± 2.1), 7R (9.5 ± 4.3), 8R (4.5 ± 2.3), 9R (2.5 ± 1.7); 4L (3.7 ± 1.1), 5L (3.7 ± 1.5), 6L (4.1 ± 2.0), 7L (5.7 ± 3.4), 8L (3.6 ± 2.6), 9L (2.7 ± 1.3). Compared with the time of mediastinal lymphadenectomy, there were statistically signifi cant differences between the right and left side, especially in 4L vs 4R and 7L vs 7R. There were no statistically significant differences among the procedures, such as the complication incidence, drainage time and volume,length of hospital stay. No signs of tumor recurrence or metastasis was found in the postoperative follow-up time. Conclusion Uniportal video-assisted thoracoscopic mediastinal lymphadenectomy is feasible safe and effective. Reasonable placement of lens and instruments, adequate exposure and standard procedure may be the key points of the surgery.
video-assisted thoracoscopic; lobectomy; mediastinal lymphadenectomy; non small cell lung cancer; uniportal
R734.2
A
10.3969/j.issn.1007-1989.2016.10.003
1007-1989(2016)10-0010-06
2016-05-12
南通市前沿与关键技术创新-社会民生创新计划-新型临床诊疗技术攻关(No:MS22015123)
陆松华,E-mail:khg1220@163.com
