脐带间充质干细胞对增殖型狼疮性肾炎的临床疗效观察
2016-11-18李俊霞林强陈建谭建明
李俊霞林强陈建谭建明
·论著·
脐带间充质干细胞对增殖型狼疮性肾炎的临床疗效观察
李俊霞1林强1陈建1谭建明2
目的 探讨脐带间充质干细胞(UCMSC)联合糖皮质激素治疗增殖型狼疮性肾炎(LN)的临床疗效与安全性。方法 选取2010年1月至2015年10月在福州总医院肾内科确诊的增殖型LN患者20例,在常规糖皮质激素规律治疗的基础上,自愿接受UCMSC治疗,分析UCMSC治疗LN的疗效、预后及复发情况。统计学分析采用单因素重复测量方差分析和χ2检验的方法。结果 20例患者病理分型分别为:Ⅲ型3例(15﹪)、Ⅳ型12例(60﹪)、Ⅲ+Ⅴ型2例(10﹪),Ⅳ+Ⅴ型3例(15﹪)。(1)狼疮活动指数(SLE-DAI)治疗前0周(15.75±3.97)与治疗后4周(13.85±2.56)、8周(12.05±2.61)、16周(9.40±1.85)、24周(8.80±1.36)之间差异均有统计学意义(P均< 0.05);(2)20例患者完全缓解8例(40﹪),部分缓解7例(35﹪),无效5例(25﹪),总缓解率为75﹪(15/20);(3)完成UCMSC治疗后随访1年,患者无1例死亡,其中1例于治疗后6月、10月发生肺部感染两次,1例于治疗后8月出现带状疱疹病毒感染,对症治疗均痊愈。4例患者治疗前肌酐轻度升高(最高值达167 μmol/L),治疗后肌酐均恢复正常。复发3例,复发率20﹪(1/15);(4)UCMSC治疗过程中最常见的并发症为发热及胃肠道症状,并发症轻,对症处理后均好转。结论 本研究表明UCMSC对改善增殖型LN病情及促进缓解有积极作用,起效较快、并发症较少,其远期疗效仍需进一步观察。
狼疮性肾炎; 脐带间充质干细胞; 临床疗效
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种病因复杂的自身免疫性疾病,我国患病率高,常常累计到肾脏,是引起继发性肾病的常见原因。狼疮性肾炎(lupus nephritis,LN)其临床表现、发病过程、病理、预后呈多样性。LN损害程度常常影响系统性红斑狼疮患者预后,有更高的死亡风险[1]。既往激素联合免疫抑制剂的治疗方法存在副作用大,复发率高的缺点,常常严重影响患者的生活质量。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSC)是一种具有多向分化能力的干细胞,可以调节免疫,并具有并发症少、无明显排斥反应、疗效好、相对费用低等特点。已有研究将UCMSC应用于LN治疗并取得显著的疗效[2-3]。本研究采用UCMSCs联合激素治疗了20例增殖型LN,采用回顾性研究方法,对其疗效进行了观察。
资料与方法
一、研究对象
回顾性分析2010年1月至2015年1月福州总医院肾内科确诊LN的患者,纳入标准:(1)6个月内肾脏病理证实为增殖型LN Ⅲ型、Ⅳ型或伴Ⅴ型;(2)24 h蛋白尿定量≥1 g;(3)年龄18 ~ 65周岁;(4)系统性红斑狼疮疾病活动指数(systemiclupus erythematosus disease activity index,SLE-DAI)评分≥8分。方案呈报伦理通过,入选前签署知情同意书。排除标准:(1)4周内使用过其他免疫抑制剂:CTX、MMF、他克莫司、来氟米特、雷公藤等治疗;(2)血清肌酐(serum creatinine,SCr)大于265.2 μmol/L;(3)新月体肾炎,新月体占肾小球数50﹪以上;(4)肝酶显著异常,超过正常值2倍;(5)其他:伴有严重感染,确诊糖尿病,严重的其他脏器损害等;(6)妊娠。共入组20例患者,病程(10.90±9.36)个月,初诊初治4例,其余为疗效不佳或反复复发的患者。
二、治疗方案
1.激素及其他免疫抑制剂的应用:口服醋酸泼尼松,起始剂量:0.8 ~ 1.0 mg·kg-1·d-1服用8周,逐渐减量,每两周减5 mg,减量至10 mg/d维持。同时所有患者都给予对症支持治疗。病理类型合并Ⅴ型的患者按全球改善肾脏病预后组织(Kidney Disease: Improving Global Outcomes,KDIGO)治疗指南同时给予环磷酰胺CTX小剂量600 mg静脉输注,每个月1次,连续应用6个月。
2. UCMSC治疗:所有患者入组后,在使用起始剂量糖皮质激素的基础上加用UCMSC输注治疗。方法:治疗前半个小时予缓慢静推地塞米松5 mg,肌肉注射异丙嗪25 mg,皮下注射低分子肝素2 500 U,采取外周静脉输注,每隔1周输注1次,输注量一次为(1 ~ 2)×106个/kg,4次为一疗程。同种异体UCMSC来源于本院福建省移植生物重点实验室,抽检各项指标鉴定均合格。
3.观察指标及疗效评价:于治疗前(0周),治疗后第4,8,16,24周几个时间点,测定以下指标,包括:血常规、血生化、24 h尿蛋白定量、尿沉渣、补体C3、C4以及抗核抗体ANA、抗ds-DNA抗体,其中ANA采用间接免疫荧光法测定,抗ds-DNA抗体采用酶联免疫吸附法测定。根据SLE-DAI评分表计算狼疮活动指数评分。患者达到观察终点24周后,继续随访至1年,观察患者是否发生不良事件、复发情况及预后。
疗效评价包括:(1)完全缓解:24 h尿蛋白定量< 0.3 g,血白蛋白≥35 g/L,尿沉渣检测正常(RBC < 5/HP,WBC < 5/HP),SCr稳定(升高不超过15﹪);(2)部分缓解:24 h尿蛋白定量减少≥50﹪且< 3 g,血浆白蛋白≥30 g/L,Scr稳定(升高不超过15﹪);(3)无效:持续24 h尿蛋白定量≥3.0 g;或24 h尿蛋白定量0.3 ~ 3.0 g而且血浆白蛋白<30 g/L;或SCr升高>15﹪。总缓解率为完全缓解和部分缓解之和。
三、统计学分析方法
应用SPSS18.0进行处理,接受UCMSC治疗的患者各项临床指标正态分布通过± s表示,非正态分布通过中位数表示,治疗前后各项指标比较采用单因素重复测量方差分析,UCMSC治疗后患者疗效、复发率和并发症发生率通过百分比(﹪)表示,不同病理类型疗效比较采用χ2检验。以P < 0.05为差异有统计学意义。
结 果
一、研究对象的基线特征
20例患者中男4例,女16例,年龄(33.10± 10.93)岁。治疗前检测相关免疫学指标显示:其中4例患者ANA阴性,1例ds-DNA阴性,ANCA阳性1例。病理类型:Ⅲ型3例、Ⅳ型12例、Ⅲ+Ⅴ型2例、Ⅳ+Ⅴ型3例。患者行UCMSC治疗前的基线特征见表1。
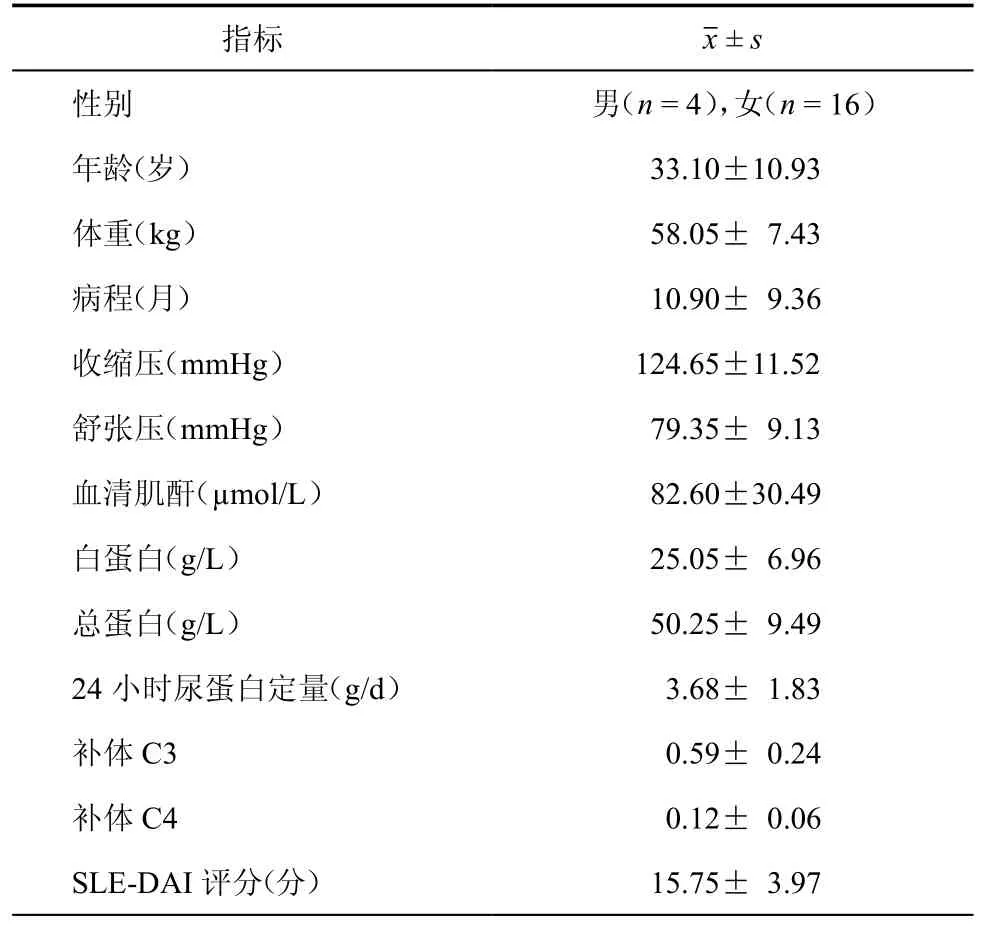
表120 例患者UCMSC治疗前基线特征
二、UCMSC 治疗前后各项临床指标比较(表 2)
治疗前后结果比较显示肌酐差异无统计学意义外,24 h尿蛋白定量UCMSC治疗前(0周)与治疗后4,8,16,24周比较,差异有统计学意义(P < 0.05);4周24 h尿蛋白定量开始减少,24周降低最为明显。白蛋白、总蛋白比较结果显示UCMSC治疗前(0周)与治疗后4、8、16、24周比较差异有统计学意义(P < 0.05);治疗后4周与治疗后8周之间差异无统计学意义(P > 0.05)。
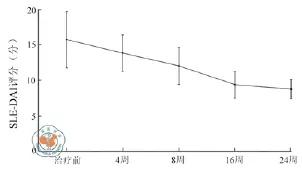
图1 SLE-DAI评分治疗前后变化
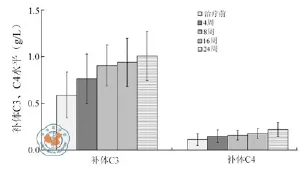
图2 补体C3、补体C4治疗前后变化
表2 UCMSC治疗前后各项生化指标变化(± s)

表2 UCMSC治疗前后各项生化指标变化(± s)
注:a代表与治疗前对比P < 0.05,b代表与治疗后4周对比P < 0.05,c代表与治疗后8周对比P < 0.05,d代表与治疗后16周对比P < 0.05
时间例数24小时尿蛋白定量(g/d)白蛋白(g/L)总蛋白(g/L)肌酐(µmol/L)治疗前203.68±1.8325.05±6.9650.25±9.4982.60±30.49治疗后4周20 2.87±1.74a30.45±7.94a57.00±9.28a78.35±18.99治疗后8周20 2.38±1.53ab31.43±7.09a58.35±7.41a74.45±18.42治疗后16周20 1.64±1.22abc34.50±6.79abc61.60±8.01abc72.35±16.02治疗后24周20 1.28±1.27abcd36.80±7.60abcd65.45±8.20abcd69.20±12.85 F值18.689 39.57229.133 3.135 P值< 0.001< 0.001< 0.0010.068
三、LN活动性分析
LN各项活动性指标治疗前后结果比较显示(图1、2),SLE-DAI评分为治疗前0周(15.75±3.97)与治疗后4周(13.85±2.56)、8周(12.05±2.61)、16周(9.40±1.85)、24 周(8.80±1.36)之间差异均有统计学意义(P < 0.01)。LN给予UCMSC输注治疗后,SLE-DAI评分从4周开始明显下降,16周趋向于稳定;补体C3从4周开始明显升高,8周恢复正常,其后稳定在正常水平。复查血清ANA、抗ds-DNA抗体,至24周观察期结束,患者表现为ANA阴性为4例,抗ds-DNA抗体阴性3例。
四、疗效及预后分析
各时间点LN缓解率详见表3。无效的5例患者中病理类型为:Ⅳ+Ⅴ型2例,IV型3例。至观察终点24周时,不同病理类型之间疗效比较详见表4。20例患者完成一疗程治疗后,继续追踪随访观察1年。在随访过程中,无1例死亡,其中1例患者于治疗后6个月、10个月发生肺部感染两次,给予抗感染治疗后痊愈,这例患者同时有使用CTX治疗。1例患者于治疗后8个月感染带状疱疹病毒,给予抗病毒、神经营养及对症支持治疗后痊愈。4例患者治疗前肌酐轻度升高(最高167 μmol/L),治疗后肌酐均恢复正常。复发3例,复发率20﹪(1/15),其中Ⅳ型1例、Ⅲ+Ⅴ型1例,Ⅳ+Ⅴ型1例;24 h尿蛋白定量增加≥1.0 g。复发后病理改变为Ⅳ型的1例重复静脉输注一疗程UCMSC,其余两例改为糖皮质激素联合他克莫司治疗,均再次缓解。无效的5例患者,改用糖皮质激素联合他克莫司治疗,随访结束时部分缓解2例,其余3例无效。

表3 各时间点疗效分析(例数)

表4 不同病理类型疗效比较(例数)
五、UCMSC治疗相关并发症
治疗过程中相关并发症主要包括发热2例(10﹪)、腹泻2例(10﹪)、呕吐1例(5﹪)、瘙痒1例(5﹪),表现轻,对症处理后即痊愈。整个随访过程中未发现与UCMSC治疗相关的并发症。
讨 论
SLE可以累积多个器官,预后取决于种族、疾病的严重程度和治疗策略。肾脏受累的发生概率高达60﹪,同时是决定SLE预后的一个重要因素,LN的发生率亚洲人明显高于白种人[4]。随着发病机制和治疗方面的研究进展,越来越多的免疫抑制剂如CTX、钙调酶抑制剂、MMF、来氟米特等联合糖皮质激素用于治疗LN,虽然近期预后有所改善,但另一方面增加了严重感染的发生率[5-6]。在近期中国的一项队列研究显示,LN的死亡率为5.3﹪,其中约1/2患者死于感染[7]。由于UCMSC具有多向分化潜能和调节多种活性免疫细胞的作用,如T细胞、B细胞、自然杀伤细胞和树突状细胞[8-9],同时UCMSC采集无痛苦和快速更新的特性,使其在LN治疗上有很好的应用前景,国内外已有相关研究,将其用于治疗LN。
一项关于UCMSC治疗MRL/lpr狼疮鼠的研究结果证实,UCMSC可以改善MRL/lpr狼疮鼠的肾脏病变,同时能够显著降低狼疮活动指标,主要机制可能与降低促炎因子的水平有关[10]。国内的一项关于UCMSC治疗难治性SLE多中心临床研究结果显示:对入组40例患者随访1年,总体生存率为92.5﹪,总缓解率为60﹪,复发率为16.7﹪;患者24 h尿蛋白定量有显著减少,SLE-DAI评分较治疗前也有明显下降。该项研究也指出,为减少复发,六个月后可重复输注UCMSC[11]。
本研究主要针对UCMSC治疗LN的疗效和安全性作一探讨。选取病例为增殖型LN,除了合并Ⅴ型加用环磷酰胺治疗外,其余均单纯给予糖皮质激素联合UCMSC治疗。临床评估指标显示,4周的总缓解率达到20﹪,8周升至60﹪,至观察期24周,患者的总缓解率升至75﹪;说明UCMSC对LN病情的改善有积极的作用,起效快、效果持续久。SLE-DAI评分从4周开始得到明显改善,补体C3恢复较快,在8周左右恢复到正常水平。在1年随访过程中,无1例死亡,未发现严重不良事件,进一步证实UCMSC在治疗LN中的安全性。随访期1年,复发3例,复发率20﹪,复发率低于常规治疗[12],与现有文献报道相符。复发的患者仅1例愿意重新输注UCMSC治疗,治疗后再次缓解。研究过程中发现合并Ⅴ型的LN患者,无效2例,复发2例,疗效不佳,可能与病理类型有关;未合并Ⅴ型的LN患者,单纯给予糖皮质激素联合UCMSC治疗总体疗效较好,为临床治疗LN提供了一个可供选择的新手段,有望减少联用其他免疫抑制剂带来的严重副作用,为存在生育要求的LN患者提供新的治疗方法。因样本量小,对不同病理类型的患者疗效比较差异无统计学意义。
UCMSC治疗LN的可能机制包括:(1)调节Th1/Th2细胞平衡:降低Th 1细胞因子(IFN-γ,IL-2)水平,增加Th2型细胞因子(IL-4、IL-10)表达;(2)降低炎性细胞因子(TNF-α、IL-6、IL-12)水平;(3)通过调节TGF-β和PGE2水平,上调Treg细胞和下调Th17细胞水平;(4)促进CD206表达和巨噬细胞的吞噬活性等。关于UCMSC是否会聚集到肾脏,参与到肾的损伤修复仍存在一定的争议。
本研究关于UCMSC治疗增殖型LN的研究初步证实:UCMSC具有一定疗效,可以促进LN患者临床缓解。相对激素联合免疫抑制剂治疗LN,提高了安全性,降低重症感染的发生概率,为UCMSC治疗LN提供了一定依据。本研究仍存在一定的局限性。首先,因肾脏穿刺活检具有一定创伤性,所有患者均未行重复肾活检,不能提供治疗后的病理资料,因此,无法判断UCMSC对患者肾脏病理的改善作用;其次,这项研究是非随机对照试验,它缺乏接受常规治疗未行UCMSC输注的对照组患者,只能从单中心小样本数据上反映UCMSC治疗LN的疗效和可行性,仍需进一步扩大样本量,增加对照研究,为UCMSC治疗LN提供更多的依据和方法,远期疗效仍待进一步观察。
1 Hanly JG, O'keeffe AG, Su L, et al. The frequency and outcome of lupus nephritis: results from an international inception cohort study[J]. Rheumatology, 2016, 55(2):252-262.
2 朱宁,毛静,张小莲,等.脐带间充质干细胞移植在系统性红斑狼疮患者中的应用研究[J]. 疑难病杂志, 2016, 15(1):44-47.
3 Sun L, Wang D, Liang J, et al. Umbilical cord mesenchymal stem cell transplantation in severe and refractory systemic lupus erythematosus[J]. Arthritis Rheum, 2010, 62(8):2467-2475.
4 Jakes RW, Bae SC, Louthrenoo W, et al. Systematic review of the epidemiology of systemic lupus erythematosus in the Asia Pacific region: prevalence, incidence, clinical features, and mortality[J]. Arthritis Care Res (Hoboken), 2012, 64(2):159-168.
5 Barber CE, Barnabe C. Another consequence of severe lupus: invasive fungal disease[J]. J Rheumatol, 2012, 39(9):1772-1774.
6 Vinicki JP, Catalan Pellet S, Pappalardo C, et al. Invasive fungal infections in Argentine patients with systemic lupus erythematosus[J]. Lupus, 2013, 22(9):892-898.
7 Tang Y, Zhang X, Ji L, et al. Clinicopathological and outcome analysis of adult lupus nephritis patients in China[J]. Int Urol Nephrol, 2015,47(3):513-520.
8 Keating A. Mesenchymal stromal cells:new directions[J]. Cell Stem Cell, 2012, 10(6):709-716.
9 Le Blanc K, Mougiakakos D. Multipotent mesenchymal stromal cells and the innate immune system[J]. Nat Rev Immunol, 2012,12(5):383-396.
10 肖玉翠,王吉波,董静,等.脐带间充质干细胞移植对系统性红斑狼疮免疫系统的影响[J].中国组织工程研究与临床康复, 2011,15(19):3489-3493.
11 Wang D, Li J, Zhang Y, et al. Umbilical cord mesenchymal stem cell transplantation in activeand refractory systemic lupus erythematosus:a multicenter clinical study[J]. Arthritis Res Ther, 2014, 16(2):R79.
12 杨桂鲜,潘丽萍,周巧艳,等.脐带间充质干细胞移植辅助治疗系统性红斑狼疮的疗效观察[J]. 四川大学学报(医学版), 2014,45(2):338-341, 350.
Efficacy and safety of umbilical cord mesenchymal stem cells on proliferative lupus nephritis
Li Junxia1, Lin Qiang1, Chen Jian1, Tan Jianming2.1Nephrology Department, Fuzhou General Hospital of Second Military Medical University, Fuzhou 350025, China;2Urology Department, Fuzhou General Hospital of Nanjing Military Command, Fuzhou 350025, China
Tan Jianming, Email:tanjm156@xmu.edu.cn
Objective To investigate the efficacy and safety of umbilical cord mesenchymal stem cells (UCMSC) combined with glucocorticoids in the treatment of proliferative lupus nephritis(LN). Methods Twenty patients with proliferative LN received UCMSC treatment in addition to the conventional corticosteroid therapy from January 2010 to October 2015, and the efficacy and safety of UCMSC in the treatment of LN were analyzed. One-way repeated-measures ANOVA χ2test was used for statistical analysis. Results Pathologically there were 3 cases of type III (15﹪), 12 of type IV (60﹪), 2 of types III + V (10﹪), and 3 of types IV and V (15﹪). The activity index of lupus nephritis (SLE-DAI) at 4 weeks (13.85 ± 2.56), 8 weeks (12.05 ± 2.61), 16 weeks (9.40 ± 1.85), and 24 weeks (8.80 ± 1.36) post-treatment were all statistically lower than that prior treatment(15.75 ± 3.97) (P < 0.05 for all). Complete remission (40﹪) was observed in 8 patients and partial remission in 7 patients (35﹪), with an overall response rate of 75﹪ (15/20); During 1-year follow-up no death occurred. Pulmonary infections occurred at 6 and 10 months after treatment in 1 patient and herpes zoster virus infection occurred at 8 months in 1 patient. Both patients were cured. The mildly elevatedserum creatinine levels of 4 patients before treatment (the highest value: 167 umol/L) returned to normal range after treatment. Recurrence happened in three cases (20﹪). The most common advert recations were fever and gastrointestinal symptoms, and all were mild and improved after treatment. Conclusion The study demonstrated that UCMSC treatment was effective and safe for proliferative LN. The long-term effect needs to be further observed.
Lupus nephritis; Umbilical cord mesenchymal stem cells; Clinical curative effect
2016-05-06)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2016.03.007
军队重大专项项目(2010gxjs026)
350025 福州,第二军医大学福州总医院临床医学院肾内科1;350025 福州,南京军区福州总医院泌尿外科2
谭建明,Email:tanjm156@xmu.edu.cn
李俊霞,林强,陈建,等. 脐带间充质干细胞对增殖型狼疮性肾炎的临床疗效观察[J/CD].中华细胞与干细胞杂志:电子版,2016, 6(3):174-178.
