诱导人胚胎干细胞分化形成具有三维结构的视网膜样组织的方法研究
2016-11-18宋健李宗义徐国彤金颖
宋健李宗义徐国彤金颖
·论著·
诱导人胚胎干细胞分化形成具有三维结构的视网膜样组织的方法研究
宋健1,3李宗义2徐国彤2金颖1
目的 探讨在成分简单的培养条件下将人胚胎干细胞(hESCs)通过3D培养的方式诱导分化为人神经视网膜各种细胞的方法。方法 将不同系的hESCs用消化酶消化后,以团块形式悬浮培养在含有1﹪ Matrigel的培养液中。对于SHhES8系的hESCs在第1天加入BMP4信号通路抑制剂,然后每2天换液以逐渐降低其浓度。在分化的不同时间,通过检测全能性基因和视网膜标志基因的表达水平以确定hESCs团块的分化状态。对于H9系的hESCs,抑制Wnt信号通路以促进hESCs分化过程中神经视网膜前体细胞重要转录因子CHX10的表达。数据经GraphPad Prism 6.0c student's t-test分析处理。结果 (1)H9系hESC经过15 d的分化,各眼区转录因子的表达水平都有大幅上调(与D0相比,D4时SIX3水平上升到720.1±238.6,P = 0.039;SIX6上升到260.0±132.5,P = 0.122;PAX6上升到2661±1353,P = 0.121;LHX2上升到480.4±27.56,P < 0.000;RAX上升到144.9±35.61,P = 0.016),免疫荧光检测也显示此时分化的细胞已经具备早期视网膜细胞的特征;(2)在H9系hESCs分化第7天添加IWR1e抑制Wnt信号通路,可以有效地提高CHX10的表达,使含CHX10阳性细胞的团块的比例从0﹪上升到86.6﹪(P = 0.000),表明Wnt信号通路在视网膜细胞形成中起重要的调节作用;(3)SHhES8系的hESCs通过悬浮培养,在第24天时可以检测到有CHX10阳性的视泡样结构,继续培养至83 d,可以检测表达不同的神经视网膜细胞标志基因的细胞,包括CRX阳性的感光细胞或前体细胞、AP2α阳性的无长突细胞和ISLET1阳性的神经节细胞。结论 不同系的hESCs对同样的诱导分化显示出不同的反应;抑制Wnt信号通路可以促使CHX10表达,实现早期视网膜细胞的分化成熟;利用无血清悬浮培养的方式,可以使hESCs分化为各种视网膜细胞和具有一定三维结构的视网膜样组织。
人类; 胚胎干细胞; 细胞分化; 视网膜
人胚胎干细胞(human embryonic stem cells,hESCs)是来源于人胚胎囊胚期内细胞团的细胞。在特定培养条件下经过体外分离培养所得到的具有无限自我更新和分化多能性的多能干细胞[1]。通过体外诱导分化,hESCs具有分化为人体所有种类细胞的潜能。随着再生医学的不断进步,人们需要各种不同类型的细胞进行疾病的治疗。诱导hESCs分化为人们所需要的细胞可以为临床疾病治疗提供无限的供体细胞。
视网膜位于眼球的后部,由神经视网膜和视网膜色素上皮层组成,其功能是将光信号转化为神经信号以便大脑产生视觉。它从前脑眼区起源,逐渐发育形成视泡、视杯,进而成为成熟的视网膜。视网膜的细胞构成包括:视杆细胞、视锥细胞、水平细胞、双极细胞、无长突细胞、视神经节细胞、Müller细胞和视网膜色素上皮细胞。前七种细胞构成神经视网膜,后一种细胞形成视网膜色素上皮[2]。
诱导hESCs分化为视网膜细胞的研究处于干细胞分化研究的前沿。最初人们主要进行单层贴壁细胞的诱导分化。随后,人们发现悬浮培养细胞团块也可以诱导hESCs分化为视网膜细胞,而且悬浮培养分化得到的视网膜细胞团块具有一定的视网膜三维结构[3-6]。但是,以往研究建立的诱导分化体系多数添加了动物源的血清。由于血清成分复杂,通过这种方法得到的细胞不利于展开临床研究和应用。因此,有必要建立一种无血清成分的诱导分化体系,使分化得到的细胞可以更为方便地进入临床应用。
材料和方法
一、材料
H9系hESCs和mTeSR购自美国Wicell公司;SHhES8系hESCs为本实验室自建。DMEM/ F12和neurobasal培养液以及N2 supplement、B27 supplement、NEAA、Glutamine均购自美国Gibco公司;Alexa Fluro 488标记的驴抗山羊、山羊抗兔、山羊抗鼠荧光二抗购自美国Proteintech公司。IWR1e购自德国Calbiochem公司,LDN193189购自德国Calbiochem公司,SYBR Green PCR Master Mix购自瑞士Roche公司;磷酸缓冲盐溶液(PBS)购自美国HyClone公司,Matrigel购自美国BD公司,中性蛋白酶(美国Sigma公司),β巯基乙醇和DAKO封片剂购自美国Sigma公司;细胞培养皿用PolyHema(美国Sigma公司)包被;4',6-二脒基-2-苯基吲哚(DAPI)浓度为300 nmol/L,RNA逆转录酶购自天根。
二、方法
1.细胞培养:hESC培养在Matrigel包被的细胞培养皿上,培养液为mTeSR,每4 ~ 5天用中性蛋白酶消化后以团块传代。
2.诱导分化:H9系hESCs用中性蛋白酶消化5 ~ 8 min后,用移液枪吹打下来,沉淀后用含1﹪Matrigel的分化培养液悬浮培养(分化培养液的组成成分为1:1 DMEM/F12和neurobasal,0.5﹪ N2 supplement、1﹪ B27 supplement、1﹪ NEAA、1﹪ L-谷氨酰胺,0.1 mmol/L β巯基乙醇,100 U/ml 青霉素和100 μg/ml链霉素,每2 d换液1次。SHhES8系hESC用中性蛋白酶消化5 ~ 8 min后,用移液枪吹打下来,沉淀后用含1﹪ Matrigel的分化培养液悬浮培养,并在分化第1天向培养液中添加50 nmol/L BMP4抑制剂LDN193189,之后每2 d换液;分化至第48天时,培养液中不再添加Matrigel。
3. RT-qPCR:提取RNA后用反转录盒提供的RNA逆转录酶进行反转录,得到cDNA模板。之后以2 μl模板(1:20稀释)+ 5 μl SYBR Green PCR Master Mix + 3 μl引物的体系在ABI PRISM 7 900实时荧光定量PCR检测仪上进行qPCR反应。将D0时基因在RNA水平的表达量定为1,其他时间点基因在RNA水平的表达量为其与D0时表达量的相对值(表1)。

表1 RT-qPCR引物序列
4.免疫荧光:将10 μm厚的样品切片在室温放置5 min,然后用4﹪多聚甲醛固定15 min。接着用PBS洗3次,每次5 min,然后用透膜封闭液(10﹪山羊血清 + 0.2﹪ Triton溶解在PBS中)封闭30 min。加一抗后置4℃过夜。用PBS洗3次后加荧光二抗,在37℃避光放置1 h,之后用PBS洗1次,5 min,加DAPI反应15 min后,用PBS再洗1次,5 min,最后用DAKO封片剂封片保存(表2)。

表2 免疫荧光一抗的来源及稀释比例
三、统计学分析方法
运用GraphPad Prism 6.0c 统计分析软件对三次独立重复实验进行student's t-test 分析,表示为,以P < 0.05为差异有统计学显著性意义。

图1 H9系hESCs体外视网膜谱系诱导分化时程
结 果
一、H9系hESCs分化为早期视网膜前体细胞
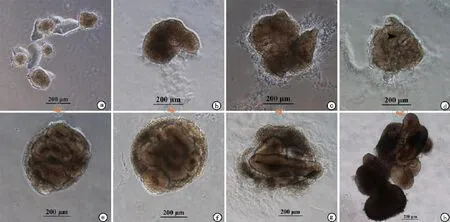
图2 倒置显微镜下观察诱导H9系hESCs向视网膜谱系分化不同时间的形态
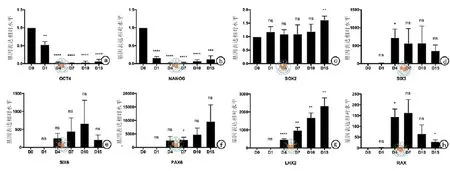
图3 全能性标志基因和视区转录因子表达水平随分化进行而变化
本研究建立了一种无血清的培养方式来诱导hESC向视网膜方向分化。在本实验中,如图1所示,H9系的hESCs先在mTeSR培养液中增殖到一定程度,经中性蛋白酶消化并沉淀后,用含有1﹪Matrigel的分化培养液悬浮培养。随着分化的进行,神经上皮样细胞团块开始出现并逐渐增大(图2)。RT-qPCR检测结果显示,全能性标志基因 NANOG和OCT4的表达水平随着分化的进程逐渐降低,在分化第4天降到很低的水平(与D0相比,D4时NANOG水平下降到0.0245±0.004,P < 0.000; OCT4水平下降到0.0335±0.009,P < 0.000)。与之相反,在分化第4天,眼区转录因子SIX3,LHX2和RAX,表达水平显著升高(与D0相比,D4时SIX3水平上升到720.1±238.6,P = 0.039;LHX2上升到480.4±27.56,P < 0.000;RAX上升到144.9± 35.61,P = 0.016),至少在到分化15 d期间都保持在虽有波动但都在较高水平的趋势。与眼区转录因子不同,转录因子SOX2的表达水平在整个分化过程中没有出现明显的变化(图3)。SOX2的这种表达谱式体现了它既是全能性细胞的标志基因也是神经干(祖)细胞的标志基因。在蛋白水平,免疫荧光检测显示,在分化的第4天只有极少数细胞表达全能性因子OCT4,部分细胞中可以检测到视网膜谱系的标志基因 PAX6和RAX的表达(图4),表明此时细胞团块已经开始眼区的命运决定。在分化的第15天,已检测不到OCT4阳性细胞,而SOX2在大部分细胞中都能被检测到,说明此时大部分细胞都已经向神经谱系分化,同时,在大部分细胞中,视网膜方向的标志基因 PAX6和RAX都能被检测到(图5)。这些结果说明在本实验诱导分化体系中,H9系的hESC被成功地诱导分化为视网膜谱系的细胞。
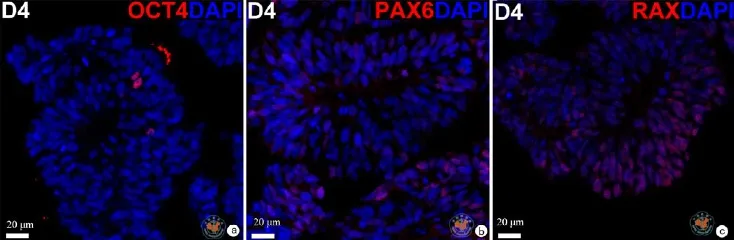
图4 光学显微镜下观察免疫荧光检测H9系hESCs分化至第4天时全能性及早期视网膜标志基因的表达 (免疫荧光染色×20)
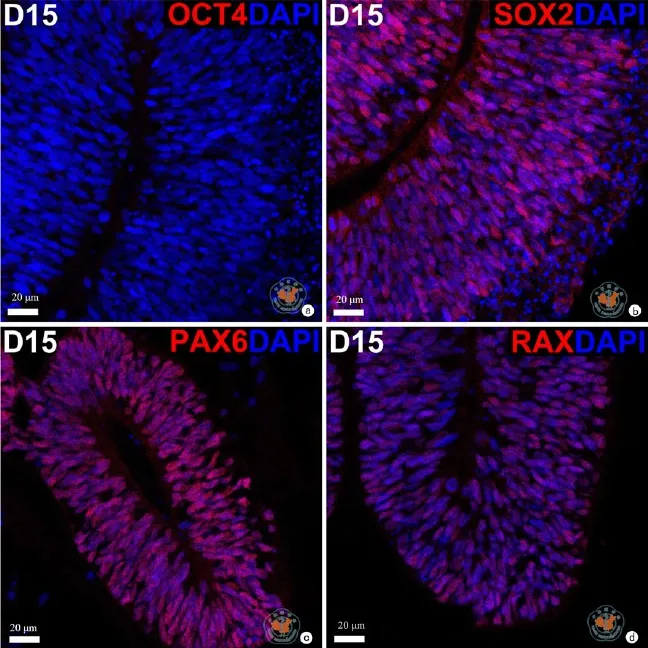
图5 光学显微镜下观察免疫荧光检测H9系hESCs分化至第15天全能性及早期视网膜标志基因的表达 (免疫荧光染色×20)
二、抑制Wnt信号通路可以促进CHX10表达
在H9系hESCs向视网膜谱系的诱导分化过程中,虽然早期视网膜标志基因可以被快速诱导表达,但是在持续的培养过程中,眼区转录因子RAX在RNA水平的表达在第7天之后有一定程度的降低,并且一直检测不到在视网膜发育中起重要作用的转录因子CHX10的表达,造成这种结果的原因可能是H9系hESCs由于其自身的特性,在这种分化条件下并不适宜继续往下分化。本研究尝试在分化体系中引入Wnt信号通路的抑制剂IWR1e以阻断Wnt信号通路(图6),进而促进CHX10的表达。如图7所示,经IWR1e(3 µmol/L)处理8 d后,在部分细胞团块中可检测到CHX10阳性的细胞,含有CHX10阳性细胞团块的比例从未经IWR1e处理组的0﹪上升到处理组的86.6﹪(P = 0.0002)这一结果表明,Wnt信号通路在视网膜谱系分化中起重要的调节作用,抑制Wnt信号通路可以有效地促进CHX10的表达。

图6 抑制Wnt信号通路的H9系hESCs分化时程
三、SHhES8系hESCs分化为具有一定三维结构的视网膜样组织
与H9系hESC的诱导分化不同,SHhES8系hESCs在H9系hESC的诱导分化体系中不能被诱导分化为神经谱系的细胞,必须在其分化早期加入BMP4抑制剂阻断BMP4信号通路,才能实现SHhES8细胞向神经谱系的分化(图8)。通过在第1天加入BMP4抑制剂(LDN193189)的诱导分化,在分化的第13天左右,在细胞团块的周围已经形成神经上皮,并且在大部分细胞中检测到早期视网膜标志基因 RAX的表达,表明此时细胞团块中的大部分细胞已经完成了眼区的命运决定(图9,10)。在分化的第24天左右,已经有视泡样结构出现,在这些视泡样结构中可以检测到CHX10阳性的细胞(图9,10),说明此时已经开始形成早期视网膜。在分化的第40天时,可以检测到含CHX10阳性细胞的团块,但没有检测到CRX阳性的细胞(结果未展示)。在分化到83天时,检测到含有视网膜终末分化标志基因阳性细胞的视网膜样组织。这些细胞包括ISLET1阳性、BRN3阳性的神经节细胞,AP2α阳性的无长突细胞,以及CRX阳性、Recoverin阳性的感光细胞或前体(图11)。同时,这些视网膜样组织中依然存在大量的CHX10阳性细胞(图11),表明成熟的视网膜组织还没有形成。
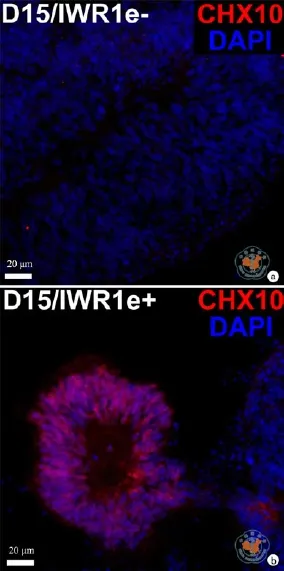
图7 光学显微镜下观察抑制Wnt信号通路促进CHX10的表达 (免疫荧光染色×20)
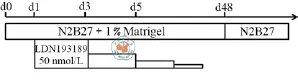
图8 SHhES8系hESC向视网膜谱系分化的时程
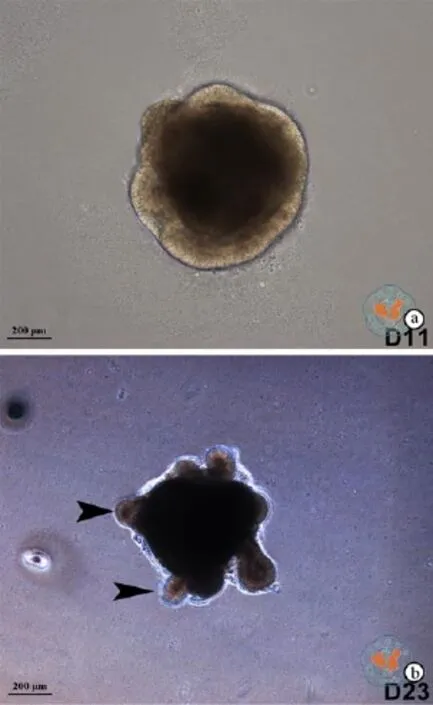
图9 倒置显微镜下观察诱导SHhES8系hESCs向视网膜谱系分化不同时间的形态 (×10)
讨 论
近年来,有关诱导hESC向视网膜方向分化研究的报道不断增多。总体上看,主要的策略是利用一些小分子化合物促使hESCs分化为神经前体细胞,然后利用一些生长因子和血清联合作用,促使神经前体细胞向视网膜谱系分化[4-6]。由于干细胞研究主要是以临床应用为目的,而外源的动物源成分如血清的加入,使分化体系中参入了较多不可控因素。这些不可控因素极大地限制了干细胞在临床上的应用。因此,有必要建立一种无血清的hESCs的诱导分化体系。笔者在前期研究中,分别建立了诱导小鼠和大鼠ESC向视网膜祖细胞分化的体系,并用以完成视网膜祖细胞移植后成瘤机理以及向视网膜神经元或神经胶质细胞分化的调控研究[7-8]。本研究,进一步建立了无血清成分的诱导hESC向神经视网膜细胞的分化体系,不仅丰富了研究体系,更使不可控因素下降了很多,在干细胞临床应用的道路上迈进了一步。
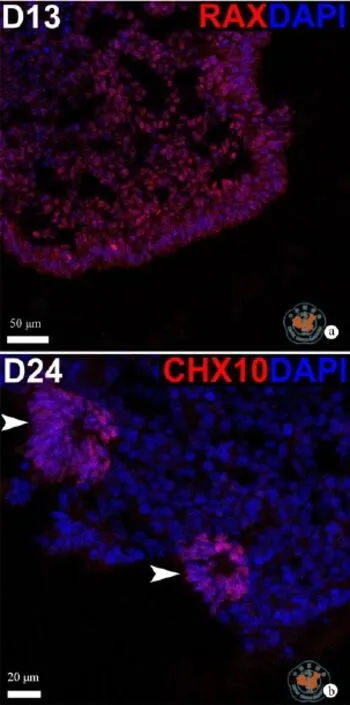
图10 光学显微镜下观察免疫荧光检测SHhES8系hESC分化早期视网膜标志基因的表达 (免疫荧光染色)
由于hESC系建系方式不同、所用囊胚发育阶段不同及建系后培养方式不同等因素,不同的hESC系具有不同特性。这种不同细胞系之间的差异在诱导分化中尤为显著。此项研究证明了这个事实。也有研究指出,不同的体细胞重编程所得到的诱导多能干细胞系之间也存在很大的差异,而这种差异反映到诱导分化中,可能就是同一种分化方法在不同细胞系之间产生不同结果[9]。如何能够使不同细胞系同步为同一种状态,可能是未来多能干细胞研究领域的一项重要课题。最近的原始态(naïve state)hESCs研究[10]表明,常规培养的处于始发态(primed state)hESCs可以回到原始态,也许通过这种方法,可以将不同多能干细胞系进行同步。
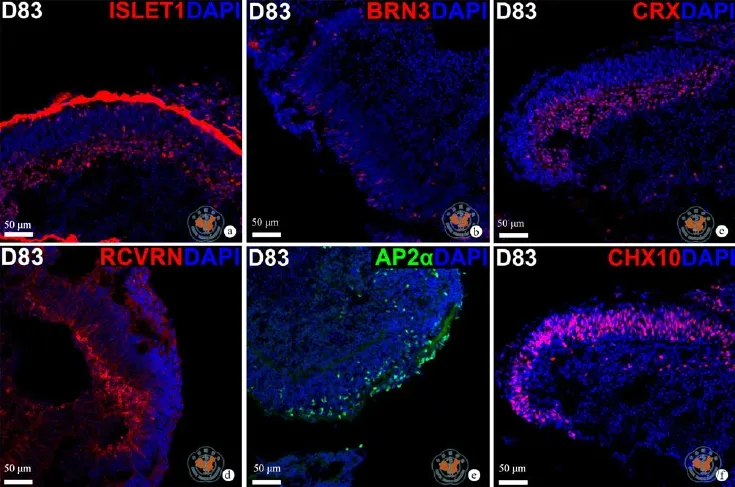
图11 光学显微镜下观察免疫荧光检测SHhES8系hESC分化形成各种视网膜细胞 (免疫荧光染色×10)
在hESCs向视网膜谱系细胞分化过程中,起主要作用的信号通路研究目前还不是很清楚。在实验中,通过抑制Wnt信号通路有效地提高了视网膜发育中关键的转录因子CHX10的表达,从而使H9系向神经视网膜谱系的分化得以进行,虽然抑制Wnt信号通路也可以增加SHhES8系hESCs向视网膜谱系分化过程中CHX10的表达,但是在不添加Wnt信号通路抑制剂的情况下,SHhES8系也可以表现出含有CHX10阳性细胞的视泡样结构(结果未展示),这一发现进一步表明来源于不同hESC系的细胞可以表现出不同的分化特征。值得说明的是,在分化到83 d已检测到含有视网膜终末分化标志基因(ISLET1等)阳性细胞的视网膜样组织中,同时存在大量的CHX10阳性细胞(图12),虽然在成熟视网膜中,CHX10在双极细胞低水平表达,甚至也可能会在Müller细胞有表达,但这两种细胞通常在发育和分化的更晚期才出现。因此,本研究中这个时间点的CHX10阳性细胞应该主要为视网膜祖细胞,这一结果表明,此时视网膜样组织虽有了一定的三维结构,但依然在发育中,成熟的视网膜组织还没有形成。
总而言之,本研究成功地建立了一种简单的、无血清诱导hESC定向分化为视网膜样组织的系统,在研究过程中发现不同hESC系之间呈现不同的分化特性。此外,抑制Wnt信号通路可以有效地促进视泡样结构的形成,尽管目前对Wnt信号通路如何调控视网膜细胞分化尚不清楚,还有待于进一步研究,但本研究为进一步完善hESCs定向分化体系奠定了一定的基础。
1 Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al. Embryonic stem cell lines derived from human blastocysts[J]. Science, 1998,282(5391):1145-1147.
2 Hatakeyama J, Kageyama R. Retinal cell fate determination and bHLH factors[J]. Semin Cell Dev Biol, 2004, 15(1):83-89.
3 Ikeda H, Osakada F, Watanabe K, et al. Generation of Rx(+)/Pax(6+)neural retinal precursors from embryonic stem cells[J]. Proc Natl Acad Sci U S A, 2005, 102(32):11331-11336.
4 Lamba DA, Karl MO, Ware CB, et al. Efficient Generation of retinalprogenitor cells from human embryonic stem cells[J]. Proc Natl Acad Sci U S A, 2006, 103(34):12769-12774.
5 Osakada F, Ikeda H, Mandai M, et al. Toward the Generation of rod and cone photoreceptors from mouse, monkey and human embryonic stem cells[J]. Nat Biotechnol, 2008, 26(2):215-224.
6 Eiraku M, Sasai Y. Self-organizing optic-cup morphogenesis in threedimensional culture[J]. Neurosci Res, 2011, 71(S):E127-E128.
7 Cui L, Guan Y, Qu Z, et al. WNT signaling determines tumorigenicity and function of ESC-derived retinal progenitors[J]. J Clin Invest, 2013,123(4):1647-1661.
8 Qu Z, Guan Y, Cui L, et al. Transplantation of rat embryonic stem cell derived retinal progenitor cells preserves the retinal structure andfunction in rat retinal degeneration[J], Stem Cell Res Ther, 2015,6:219.
9 Zhong X, Gutierrez C, Xue T, et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs[J]. Nat Commun, 2014, 5: 4047.
10 Theunissen TW, Powell BE, Wang H, et al. Systematic identification of culture conditions for induction and maintenance of naive human pluripotency[J]. Cell Stem Cell, 2014, 15(4):471-487.
Induction of 3D retina-like tissues from human embryonic stem cells
Song Jian1,3, Li Zongyi2,Xu Guotong2, Jin Ying1.1Key Laboratory of Stem Cell Biology, Institute of Health Sciences, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences/Shanghai Jiaotong University School of Medicine, Shanghai 200031, China;2Department of Ophthalmology of Shanghai Tenth People' s Hospital, and Lab of Clinical Visual Science of Department of Regenerative Medicine and Tongji Eye Institute, Tongji University School of Medicine, Shanghai 200092, China;3University of Chinese Academy of Sciences, Beijing 100049, China
s: Jin Ying, Email: yjin@sibs.ac.cn; Xu Guotong, Email: gtxu@tongji.edu.cn
Objective To induce human embryonic stem cells(hESCs)to various types of human neural retina cells under a simple culture condition. Methods hESCs from different lines are dissociated into cell clumps and cultured in suspension using the differentiation medium supplemented with 1﹪ Matrigel. In the differentiation of hESCs from SHhES8 line, BMP4 inhibitor will beadded on Day 1 and its concentration will be diluted by medium change.The differentiated cells are identified by the expression of marker genes to determine the differentiation state. To facilitate the expression of the important eye field transcription factor(EFTF)like CHX10 in H9 hESCs during differentiation, the Wnt signaling pathway inhibitor IWR1e is added into the differentiation medium. Results 1. The expression levels of EFTFs were markedly upregulated on D4 and lasted up to D15 of differentiation for hESCs of H9 line(as compared to data of D0, on D4, SIX3 was upregulated to 720.1 ± 238.6, P = 0.039; SIX6 to 260.0 ± 132.5, P = 0.1222; PAX6 to 2661 ± 1353, P = 0.1208;LHX2 to 480.4 ± 27.56, P < 0.0001; and RAX to 144.9 ± 35.61, P=0.0156). Immunofluorescence staining results also show that differentiated cells express marker genes representing the early stage of retina. 2. The addition of Wnt signaling pathway inhibitor IWR1e at Day7 of differentiation in hESCs from H9 line could significantly facilitate the expression of CHX10, the percentage of aggregates with CHX10 positive cells increased to 86.6﹪ from baseline(P = 0.0002). The finding indicates that the Wnt signaling pathway plays an important role in the differentiation of retinal cells. 3. After suspension culture of hESCs from SHhES8 line for 24 days, CHX10 positive optic vesicle-like structures could be observed. At day 83, different types of neural retina cells, include CRX positive photoreceptors or precursors, AP2α positive amacrine cells and ISLET1 positive ganglion cells,could be detected. Conclusion Great differences exist between hESCs from different lines in their response to the same differentiation induction; inhibition of the Wnt signaling pathway could promote CHX10 expression as well as differentiation and maturation of early stage retinal cells; using serum free suspension culture, hESCs could be induced to various types of neural retinal cells and could form neural retina- like tissue with the 3D structure.
Human; Embryonic stem cells; Cell differentiation; Retina
2016-04-05)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2016.03.003
国家自然科学基金(91419309,31171419),重大科学研究计划(2013CB967501)
200031 上海,中国科学院上海生命科学研究院/上海交通大学医学院健康科学研究所 中国科学院干细胞生物学重点实验室1;200092 上海,同济大学附属第十人民医院眼科 同济大学医学院同济眼科研究所和再生医学系临床视觉科学研究实验室2;100049 北京,中国科学院大学3
金颖,Email:yjin@sibs.ac.cn;徐国彤,Email:gtxu@tongji.edu.cn
宋健,李宗义,徐国彤.诱导人胚胎干细胞分化形成具有三维结构的视网膜样组织的方法研究[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(2):146-154.
