差速贴壁法体外分离培养小型猪脂肪间质干细胞的实验研究
2016-11-18焦国华高洪丽吴贽张志光
焦国华高洪丽吴贽张志光
·论著·
差速贴壁法体外分离培养小型猪脂肪间质干细胞的实验研究
焦国华1高洪丽2吴贽1张志光3
目的 探讨差速贴壁法对小型猪脂肪间质干细胞(ADSC)提取和纯化的可行性。方法 从两成软骨10月龄的中国实验用I系小型猪皮下脂肪组织获取ADSC,培养4 ~ 6 h倒置显微镜下观察,见少量细胞贴壁,立刻将含有未贴壁细胞的培养基接种到新培养瓶内继续培养,传统培养法不换培养瓶,以后均每3 d换液1次。完全培养基传至第3代MTT法绘制生长曲线,并测定两种培养法获得的细胞不同代数的贴壁时间;诱导培养基向脂肪细胞、成骨细胞、成软骨细胞诱导并鉴定。贴壁时间、表面抗原阳性率、分化诱导染色阳性率实验数据比较采用单因素方差分析及t检验。结果 采用差速贴壁培养法可分离培养出小型猪ADSC,并可除去部分贴壁的成纤维细胞、上皮细胞和脂滴,传代后培养瓶中脂滴明显减少;差速贴壁培养法获得的ADSC在贴壁时间方面较传统方法获得的ADSC短,前者传代后的贴壁时间(3.5±0.2)h较后者(5.8 ±0.3)h短,差异具有统计学意义(t = 12.55,P = 0.01);两种方法获得的ADSC中CD34阳性率:差速法为(1.17±0.01)﹪,传统法为(0.99±0.03)﹪;CD44阳性率:差速法为(88.90±0.03)﹪,传统法为(89.23±0.10)﹪;CD106阳性率:差速法为(1.18±0.05)﹪,传统法为(1.56±0.06)﹪;差异均统计学意义(t = 0.12,1.23,0.37,P = 0.06,0.07,0.06)。油红O、苏丹黑B、Von kossa、茜素红、阿尔新蓝、II型胶原染色结果表明差速贴壁法获得的ADSC可分化为脂肪细胞、成骨细胞和成软骨细胞,且阳性染色率分别为(78±2)﹪、(82±6)﹪、(85±1)﹪、(83±3)﹪、(76±9)﹪、(74±1)﹪,较传统法的(68±1)﹪、(69±2)﹪、(73±0)﹪、(75±1)﹪、(69±3)﹪、(65±4)﹪高,差异具有统计学意义(t = 5.21,12.56,16.27,10.33,17.01,23.97;P = 0.02,0.03,0.01,0.01,0.00,0.00)。结论 采用差速贴壁培养法可从小型猪皮下脂肪组织可以分离培养出ADSC,从细胞形态学、生物学特性及多向分化能力等方面都较传统法获得的ADSC具有优势。
脂肪细胞; 间质干细胞; 成骨细胞; 软骨细胞; 细胞培养技术
传统观点认为新分离培养的干细胞(48 h之内)在没有贴壁时不能搬动培养瓶,以免影响细胞贴壁及贴壁的稳定性,然而差速贴壁培养法却可应用于表皮干细胞的分选[1-2]。脂肪组织消化后的细胞群中包括多种不同的细胞和杂质,本研究尝试通过差速贴壁培养法可对其进行纯化培养,检测获得的脂肪间质干细胞(adipose-derived mesenchymal stem cell,ADSC)在纯度和生物学特征方面是否优于传统培养法获得的ADSC,为组织工程种子细胞纯化方法的改善奠定基础。
材料与方法
一、主要试剂和材料
试剂:高糖DMEM培养基购自美国Gibco公司;胎牛血清购自美国Hyclone公司;胰蛋白酶、胰岛素、吲哚美辛、IBMX等购自美国Sigma公司。
材料:2 ~ 10月龄中国实验用I系小型猪,体重为5 ~ 15 kg,购自中国农业大学实验用小型猪养殖中心。仪器:Shellab2323-2 CO2培养箱(美国);Axiovert 40倒置显微镜、超净工作台等均为德国生产。
二、方法
1. ADSC的原代培养:2 ~ 10月龄中国实验用I系小型猪颈部或背部切取皮下脂肪组织约10 g,PBS冲洗3 ~ 5遍,去除肉眼可见的血管、血细胞和纤维组织;用眼科剪将脂肪组织剪为约1 mm3方块,PBS悬浮,-300×g速度下离心5 min,去除PBS,0.075﹪ I型胶原酶适量37℃消化45 min,并间断振动,离心后去最上层的脂滴层和上层脂肪层以及中层清亮液体,以除去悬浮的脂肪细胞、组织液和脂滴等,加入PBS冲洗悬置并同前方法离心,重复2次。基础培养基3ml悬置下层细胞血管碎片,接种于24孔板,置于37℃、5﹪CO2、饱和湿度的孵育箱内进行培养。于培养的第2、4、6、8、12、24 h观察,并将未贴壁细胞及培养基一起移入新培养瓶,培养3 d,首次更换培养液以除去未贴壁细胞和残余碎块组织,以后每3 d更换培养液1次,继续培养5 ~ 7 d,细胞汇合之后称为“原代细胞”。其中4、6 h为实验组,其余为对照组,传统培养法组接种后不搬动培养瓶,第72 h更换培养液。
2. ADSC传代后贴壁时间的测定及生长曲线的绘制:两种方法获得的ADSC消化后的每代细胞调整至4.8×103个细胞,接种于48孔培养板内常规培养,每孔约100个。第2、3、4 、5、6、7、8、12 h倒置显微镜下观察,计数4倍物镜下每孔内贴壁细胞数量,每孔重复2次,取平均值,80﹪~ 90﹪细胞贴壁为贴壁时间,以时间h为横坐标,细胞贴壁率为纵坐标作图,同时MTT法绘制细胞生长曲线。细胞贴壁率(﹪)=(细胞贴壁数/接种细胞数)×100﹪。所有实验重复3次。
3.表面抗原的测定:取培养的第3 ~ 5代细胞,弃去培养液,无菌PBS冲洗3遍。加入0.25﹪胰蛋白酶+ 0.02﹪EDTA消化细胞,并用血清终止消化,离心后PBS清洗2次,收集细胞,PBS悬浮,以3× 105的细胞量分别与猪抗猪CD34、CD44、CD106单克隆抗体在室温下反应30 min,并于4℃过夜。PBS洗涤2次,再与鼠抗猪二抗避光反应15 min,流式细胞仪检测分析。所有实验重复3次。
4.多向分化潜能的测定:培养的ADSC消化计数,调整浓度为1×105个细胞/ml,接种到6孔培养板。基础培养基中培养1 d后实验组更换为诱导培养基(向脂肪细胞、成骨细胞和成软骨细胞诱导),对照组仍为基础培养基,培养条件同前,每3 d换液1次。诱导培养的第2、7、14 d,倒置显微镜下观察细胞形态,并于培养的第21 d鉴定诱导情况。所有实验重复3次。
三、统计学分析方法
应用SPSS13.0软件对实验数据进行分析。贴壁时间、表面抗原阳性率、分化诱导染色阳性率实验数据以± s表示,比较采用单因素方差分析及独立t检验。以P<0.05为差异有统计学意义。
结 果
一、原代细胞的形态学观察
两种方法获得的ADSC在形态学和细胞数量方面有细微差别,结果以4 h和6 h换培养瓶组细胞形态较好,细胞刚贴壁时呈圆球形,2 ~ 3d细胞开始生长,形态单一,呈长梭形;8、12和24 h组细胞数量较少,而2 h组和传统培养法细胞数量较多,形态多样化,可见少量多角形细胞,其余差速贴壁法组细胞数量较少,各组细胞均呈成纤维细胞样生长;培养7 ~ 10 d左右可局部生长至80﹪汇合,呈集落样生长,原代传代后为第一代细胞,记为P1,细胞增殖活跃,可见多个核仁,以后每5 ~ 6 d可传代1次,可长期稳定传代(图1)。以下步骤均采用4 h组同传统培养法组相对比。

图1 光学显微镜下观察传统培养法法和差速贴壁离心法获得ADSC形态 (×200)
二、贴壁时间的测定及生长曲线的绘制
差速贴壁培养法获得的ADSC在贴壁时间方面较传统方法获得的ADSC短,前者在传代后(3.5±0.2)h时80﹪ ~ 90﹪的细胞可贴壁,而后者为(5.8±0.3)h,差异具有统计学意义(t = 12.55,P = 0.01,表1)。根据A492的吸光度值及天数(d)进行两组细胞的生长曲线比较(表2)。两组细胞接种后3 ~ 6 h已有70﹪~ 90﹪的细胞贴壁,24 h后开始生长,1 ~ 2 d后增殖速度加快。第3天开始,细胞数量明显增多,5 ~ 6 d左右80﹪~ 90﹪汇合,之后细胞生长速度减慢。细胞生长曲线图表明两种方法获得的ADSC在传代后均经历潜伏期、对数生长期和平台期。
三、表面抗原的测定
流式细胞仪检测结果显示:两种方法获得的ADSC纯度都较高;CD34阳性率:差速法为(1.17±0.01)﹪,传统法为(0.99±0.03)﹪;CD44阳性率:差速法为(88.90±0.03)﹪,传统法为(89.23±0.10)﹪;CD106阳性率:差速法为(1.18±0.05)﹪,传统法为(1.56±0.06)﹪;差异均统计学意义(t = 0.12,1.23,0.37,P = 0.06,0.07,0.06)。(表3,图2)。
表1 差速贴壁法及传统培养法获得的ADSC的贴壁时间的比较(﹪,± s)

表1 差速贴壁法及传统培养法获得的ADSC的贴壁时间的比较(﹪,± s)
2 h3 h4 h5 h6 h7 h8 h12 h传统法2.13±0.3813.86±0.2772.63±0.9283.55±0.4390.10±0.1096.27±0.9297.37±0.0497.15±0.81差速法3.10±0.5021.69±0.2486.52±0.0492.97±0.3195.32±0.5298.31±0.8897.45±0.7697.50±0.15 t 值 11.5210.3817.6815.7313.232.671.891.63 P值 0.01 0.01 0.00 0.01 0.010.090.080.09
表2 差速贴壁法及传统培养法获得的ADSC的A492吸光度值(生长曲线)比较(﹪± s)
表2 差速贴壁法及传统培养法获得的ADSC的A492吸光度值(生长曲线)比较(﹪± s)
1 d2 d3 d5 d7 d9 d11 d13 d传统法9.10±0.278.15±0.8320.07±0.8346.17±0.0963.23±0.8470.17±0.3759.03±0.8758.15±0.23差速法9.12±0.488.07±0.5320.23±0.2246.1±0.0363.13±0.1170.25±0.2259.13±0.3758.2±0.77空白组4.16±0.144.05±0.844.05±0.424.17±0.884.06±0.464.02±0.174.16±0.124.03±0.18 F值11.0317.7219.6020.5025.7827.6129.9028.05 P值 0.01 0.01 0.01 0.00 0.00 0.00 0.00 0.00
表3 细胞表面抗原阳性率的检测结果(﹪± s)

表3 细胞表面抗原阳性率的检测结果(﹪± s)
CD34CD44CD106传统法0.99±0.0389.23±0.101.56±0.06差速法1.17±0.0188.90±0.031.18±0.05 t 值0.121.230.37 P值0.060.070.06
四、分化诱导观察及鉴定
差速贴壁培养法获得的ADSC加入成脂诱导培养基后,细胞的形态于第3 ~ 5 d可发生变化,由长梭形变为多角形甚至圆球形,诱导第7 d倒置显微镜下即可发现胞质内有圆球状半透明的脂滴形成,并随培养时间的延长而增加。成脂诱导培养基培养14 d后,油红O及苏丹黑B染色均呈阳性,脂滴可分布于胞质内,也可分布于胞质外,油红O染色脂滴为红色,苏丹黑B染色为黑色(图3)。加入成骨诱导培养基后,细胞的形态于第3 ~ 5 d由长梭形变为多角形或不规则形,并且有集聚生长的倾向;诱导的第7天倒置显微镜下即可发现细胞聚集形成钙化结节,并随着培养时间的延长而增加;成骨诱导培养14 d后,Von kossa、茜素红染色均呈阳性(图4);ALP活性检测结果表明:诱导后第7天后的ALP较正常对照组有明显的升高,差异具有统计学意义,而且ALP的表达在第10天的时候达到最高水平,随后出现下降趋势(图5),基本同传统培养法。加入成软骨诱导培养基后,细胞的形态于第3 ~ 5天由长梭形变为多角形;成软骨诱导培养14 d后,阿尔新蓝和II型胶原染色均呈阳性,阿尔新蓝染色呈淡蓝色,II型胶原染色呈棕黄色(图6);相关指标检测的阳性率见表4。

图2 流式细胞仪对细胞表面抗原的检测结果
讨 论
大部分文献报道ADSC的分离方法主要为I型胶原酶消化法[3]。值得注意的是,胶原酶消化法离心得到的细胞是一个异质的细胞群。有研究用间接免疫荧光的方法研究了SVF的组成后发现,该细胞群主要是由中胚层起源的间充质细胞、脂肪前体细胞和少量的成纤维细胞、内皮细胞、平滑肌细胞以及微小血管、血细胞等组成,但ADSC占大部分[4-5]。也有研究通过抗VIII因子抗体、抗平滑肌抗体和抗ASO2抗体对从脂肪组织提取的细胞成分进行内皮细胞、平滑肌细胞和基质细胞的鉴定,证明其组成成分主要是基质细胞,含有少量的内皮细胞、平滑肌细胞和前脂肪细胞[6]。研究认为在第1代ADSC中没有发现衰老细胞的存在,前10代内仅有低于5﹪的衰老率,到第15代的时候其衰老率也低于15﹪,证明ADSC在体外具有很强的增殖能力和很低的衰老率。一般经过I型胶原酶消化之后,需采用RBC裂解液KRB(Krebs-Ringer-Bicarboneate)或NH4Cl破坏RBC,然而裂解液不仅能够破坏RBC,同时也会对ADSC造成一定的损伤[7];本实验利用RBC不能贴壁的特性,采用换液的方法去除RBC,获得了较好的效果。经过两次换液以后RBC基本消失,而且没有细胞裂解液对干细胞的损伤,同时获得了较高浓度的ADSC,更有利于干细胞的获取和培养。然而混杂在ADSC中的各种杂质细胞是否有必要完全除尽是一个有待进一步研究的问题。组织工程体外细胞培养的最终目的是将细胞回输到体内充填、形成机体的组织缺损,而机体的任何一个组织或器官都是由多种不同种类的细胞组成的。另外的研究将混杂细胞群接种于培养基培养后其他杂质细胞慢慢变少、消失,2 ~ 3代之后上皮细胞的表面标志就不再表达,ADSC就成为优势细胞[8-9]。迄今为止,所有关于组织工程中ADSC研究的报道,虽然都没有提及ADSC的纯化及植入体内时细胞的纯度问题,但也都取得了较为令人满意的结果[10-12]。普遍认为,关于是否将ADSC纯化之后植入体内是否能够得到更好的实验结果,有待于进一步研究[13-15]。

表4 两种方法获得的ADSC相关检测及比例的比较

图3 差速贴壁法诱导ADSC成脂诱导的观察
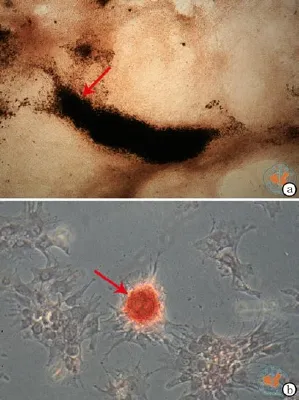
图4 差速贴壁法诱导ADSC成骨诱导的观察
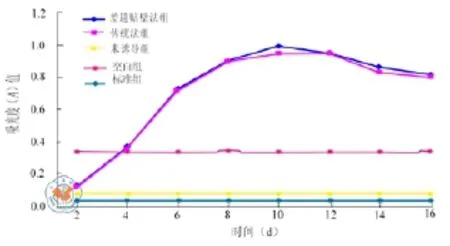
图5 传统培养法法和差速贴壁离心法获得的ADSC成骨诱导中ALP活性检测情况
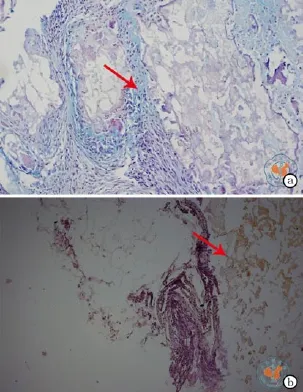
图6 光学显微镜下观察差速贴壁法诱导ADSC成软骨 (× 200)
贴壁生长型细胞的贴壁时间是反映细胞活性的重要指标,细胞贴壁时间延长,贴壁率下降,表明细胞的活性下降。动物皮下脂肪组织中通过I型胶原酶消化法分离获得的细胞群中包含有少量的成纤维细胞和更少量的成熟脂肪细胞,与ADSC相比,成纤维细胞具有很强的贴壁能力,贴壁迅速,在普通玻璃培养瓶中也能很好的贴壁生长,大部分成纤维细胞和脂肪细胞以及脂滴在0.5 ~ 3 h内即可完成贴壁过程[16-19]。利用这一点,本研究采用差速贴壁培养法对小型猪的ADSC进行纯化和培养。本研究结果2 h组和传统培养法组细胞数量较多,考虑原因为2 h时培养瓶中尚没有细胞贴壁,所有细胞全部转移入新的培养瓶,同传统培养法获得的细胞数量基本没有差别;而8 h、12 h和24 h组细胞数量较少,因为换培养瓶时不仅去除了已经贴壁的成纤维细胞,也去除了部分贴壁的ADSC,因此获得的ADSC数量较少。本实验在培养的第4小时将未贴壁细胞转移至新的培养瓶内,除去了已经贴壁的成纤维细胞和部分脂滴,通过贴壁时间测定结果证明小型猪ADSC贴壁时间大约为4 ~ 24 h,此培养法既能提高ADSC的纯度,又可以保证ADSC具有较高传代生长活性的分离时间,为小型猪作为获取ADSC模型及ADSC的纯化方法提供依据。
1 Hoang VT, Buss EC, Wang W, et al. The rarity of ALDH(+) cells is the key to separation of normal versus leukemia stem cells by ALDH activity in AML patients[J]. Int J Cancer, 2015, 137(3):525-536.
2 Ferlin KM, Kaplan DS, Fisher JP. Separation of mesenchymal stem cells through a strategic centrifugation protocol[J]. Tissue Eng Part C Methods, 2016.
3 Ishihara A, Helbig HJ, Sanchez-Hodge RB, et al. Performance of a gravitational marrow separator, multidirectional bone marrow aspiration needle, and repeated bone marrow collections on the production of concentrated bone marrow and separation of mesenchymal stem cells in horses[J]. Am J Vet Res, 2013, 74(6):854-863.
4 Okura H, Saga A, Fumimoto Y, et al. Transplantation of human adipose tissue-derived multilineage progenitor cells reduces serum cholesterol in hyperlipidemic Watanabe rabbits[J]. Tissue Eng Part C Methods,2011, 17(2):145-154.
5 Saga A, Okura H, Soeda M, et al. HMG-CoA reductase inhibitor augments the serum total cholesterol-lowering effect of human adipose tissue-derived multilineage progenitor cells in hyperlipidemic homozygous Watanabe rabbits[J]. Biochem Biophys Res Commun,2011, 412(1):50-54.
6 Casadei A, Epis R, Ferroni L, et al. Adipose tissue regeneration: A state of the art[J]. J Biomed Biotechnol, 2012, 2012:462543.
7 Taha MF, Hedayati V. Isolation, identification and multipotentialdifferentiation of mouse adipose tissue-derived stem cells[J]. Tissue Cell, 2010, 42(4):211-216.
8 Choi HS, Kim WT, Kim H, et al. Identification and characterization of adenovirus early region 1B-associated protein 5 as a surface marker on undifferentiated human embryonic stem cells[J]. Stem Cells Dev, 2011,20(4):609-620.
9 Kim H, Choi HS, Kim CH, et al. Detection and characterization of 2-E2-specific surface protein in human pluripotent stem cells[J]. Hybridoma (Larchmt), 2011, 30(4):401-404.
10 Mineda K, Feng J, Ishimine H, et al. Therapeutic potential of human Adipose-Derived Stem/Stromal cell microspheroids prepared by Three-Dimensional culture in Non-Cross-Linked hyaluronic acid gel[J]. Stem Cells Transl Med, 2015, 4(12):1511-1522.
11 Yang B, Brahmbhatt A, Nieves TE, et al. Tracking and therapeutic value of human adipose tissue-derived mesenchymal stem cell transplantation in reducing venous neointimal hyperplasia associated with arteriovenous fistula[J]. Radiology, 2015:150947.
12 Yuan J, Li W, Huang J, et al. Transplantation of human adipose stem cell-derived hepatocyte-like cells with restricted localization to liver using acellular amniotic membrane[J]. Stem Cell Res Ther, 2015, 6:217. 13 Jeon GS, Im W, Shim YM, et al. Neuroprotective effect of human adipose stem Cell-Derived extract in amyotrophic lateral sclerosis[J]. Neurochem Res, 2015.
14 Park H, Park H, Pak HJ, et al. MiR-34a inhibits differentiation of human adipose tissue-derived stem cells by regulating cell cycle and senescence induction[J]. Differentiation, 2015, 90(4-5):91-100.
15 Veriter S, Andre W, Aouassar N, et al. Human Adipose-Derived mesenchymal stem cells in cell therapy: safety and feasibility in different "hospital exemption" clinical applications[J]. PLoS One,2015, 10(10):e139566.
16 Aykan A, Ozturk S, Sahin I, et al. The effects of hydrogen sulfide on adipocyte viability in human adipocyte and Adipocyte-Derived mesenchymal stem cell cultures under ischemic conditions[J]. Ann Plast Surg, 2015, 75(6):657-665.
17 Chepeleva EV, Pavlova SV, Malakhova AA, et al. Therapy of chronic cardiosclerosis in WAG rats using cultures of cardiovascular cells enriched with cardiac stem cell[J]. Bull Exp Biol Med, 2015,160(1):165-173.
18 Fields MA, Bowrey HE, Gong J, et al. Retinoid processing in induced pluripotent stem Cell-Derived retinal pigment epithelium cultures[J]. Prog Mol Biol Transl Sci, 2015, 134:477-490.
19 周丽娜,崔晓军,苏开鑫,等.成年大鼠骨髓间充质干细胞复合组织工程人工神经修复1cm坐骨神经缺损[J].器官移植, 2015,03:157-161,168.
Cultivation of adipose-derived mesenchymal stem cells by differential adhesion
Jiao Guohua1,Gao Hongli2, Wu Zhi1, Zhang Zhiguang3.1Department of Stomatology, Shenzhen Bao'an District Songgang People's Hospital, Shenzhen 518105, China;2Department of clinical laboratory, Longgang District People's Hospital, Shenzhen 518172, China;3Zhongshan University Guanghua School of Stomatology, Key Laboratory of oral medicine of Guangdong Province, Guangzhou 510055, China
Zhang Zhiguang, Email: drzhangzg@163.com
Objective To investigate the method of purification of adipose-derived stem cell(ADSC)in vitro and to discuss whether the method of differential adhesion have more advantages than the conventional one in harvesting ratio and purification. Methods About 10 g subcutaneous fatty tissue was obtained from the cervical part or back of the type I Chinese experimental minipig, then the substance was cultivated on the underlayer after the step of enzymatic digestion by collagenase type I for 4 hours, change a new culture flask when observed some adherentcells under the inverted microscope. The conventional one does not deal with this step. Change the medium 3 days a time. Change the complete medium with inductive medium(induce into adipocyte and osteoblast)for 2 ~ 4 weeks after the cells passage to 3, then the efficiency of differentiation was assessed. Simultaneously, draw a growth curve by the method of MTT. The experimental data were compared with one factor analysis of variance and t test. Results The ADSC can be obtained successfully from the fatty tissue of minipig by the method of differential adhesion and the observation by microscope and growth curve by MTT indicated that the cell morphology and bionomics of ADSC which were obtained by differential adhesion are superior to those of conventional one. Differential velocity adherent culture method to obtain the ADSC in adherent time aspects compared with the traditional method to obtain the ADSC is shorter, after the former passage affixed to the wall time(3.5± 0.2)h shorter than the latter(5.8 ± 0.3)h, the difference has statistical significance(t =12.55, P = 0.01). Two methods to obtain the ADSC in CD34 positive rate of differential speed method for(1.17 ± 0.01)﹪,the traditional method for(0.99 ± 0.03)﹪; CD44 positive rate of differential speed method for(889 ± 0.03)﹪, the traditional method for(89.23 ± 0.10)﹪; CD106 positive rate of differential speed method for(1.18 ± 0.05)﹪, the traditional method for(1.56 ± 0.06)﹪; there were no significantly differences statistically significance(t = 0.12, 1.23, 0.37, P = 0.06, 0.07, 0.06). Oil red O, Sudan black B, von Kossa, alizarin red, alcian blue and collagen II staining results suggest differential velocity adherent methods ADSC can differentiate into adipocytes, osteoblasts and chondroblasts. Positive staining rate respectively(78 ± 2)﹪,(82 ± 6)﹪,(85 ± 1)﹪,83. 3﹪,76. 9﹪,(74 ± 1)﹪, compared with the traditional method(68 ± 1)﹪,(69 ± 2)﹪,(73 ± 0)﹪,(75 ± 1)﹪,(69 ± 3)﹪,(65 ± 4)﹪ higher, the difference is statistically significant(t = 5.21, 12.56, 16.27, 10.33, 17.01, 23.97; P = 0.02, 0.03, 0.01, 0.01, 0.00, 0.00). Conclusion We can derive ADSC, which still can differentiate into adipocytes, osteoblasts and chondroblasts, from the subcutaneous adipose tissue of the minipig by the method of differential adhesion, and it may be a perfect method to obtain ADSC.
Adipocyte; Mesenchymal stem cells; Osteoblast; Cell culture techniques
2016-03-22)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2016.03.005
国家自然科学基金(81302550);广东省科技计划项目(2014A020212390);广东省自然科学基金(2015A030311039)
518105 深圳市宝安区松岗人民医院口腔科1;518172 深圳市龙岗区人民医院检验科2;510055广州,中山大学光华口腔医学院 广东省口腔医学重点实验室3
张志光,Email:drzhangzg@163.com
焦国华, 高洪丽, 吴贽, 等. 差速贴壁法体外分离培养小型猪脂肪间质干细胞的实验研究[J/CD].中华细胞与干细胞杂志:电子版, 2016, 6(3):160-166.
