高糖对肾小管上皮细胞泛素-核糖体蛋白52与TGF-β/Smad信号通路mRNA表达的影响
2016-11-15任荣,张艳,芝敏,张蕾
任 荣,张 艳,芝 敏,张 蕾
(新疆医科大学第五附属医院肾病科,乌鲁木齐 830011)
高糖对肾小管上皮细胞泛素-核糖体蛋白52与TGF-β/Smad信号通路mRNA表达的影响
任荣,张艳,芝敏,张 蕾
(新疆医科大学第五附属医院肾病科,乌鲁木齐830011)
目的探讨高糖对肾小管上皮细胞泛素-核糖体蛋白(ubiquitin-ribosomal protein 52,UBA52)与TGF-β/Smad信号通路mRNA表达的影响及其UBA52在肾小管上皮细胞转分化中的作用与可能机制。方法根据培养基葡萄糖浓度不同分成葡萄糖低浓度组(5.6 mmol/L葡萄糖)、葡萄糖+甘露醇组(5.6 mmol/L葡萄糖+24.6 mmol/L甘露醇)、葡萄糖中浓度组(20 mmol/L葡萄糖)、葡萄糖高浓度组(30 mmol/L葡萄糖),分别干预48 h。观察不同糖浓度对鼠肾小管上皮细胞(NRK-52E)形态的影响;实时荧光定量PCR检测并比较不同葡萄糖浓度下UBA52、Smad7、转化生长因子β1(TGF-β1)与α-SMA mRNA水平。结果高糖可致NRK-52E向成纤维细胞转分化;葡萄糖低浓度组、葡萄糖+甘露醇组、葡萄糖中浓度组、葡萄糖高浓度组肾小管上皮细胞UBA52 mRNA的表达分别为( 1.002±0.075)、(0.092±0.083)、(1.994±0.146)、(2.160±0.210),差异有统计学意义(P<0.05);TGF-β1的表达分别为(1.003±0.089)、(1.180±0.060)、(1.214±0.169)、(2.158±0.266),差异有统计学意义 (P<0.05);Smad7mRNA表达分别为(1.002±0.078)、(1.106±0.049)、(0.952±0.044)、(0.332±0.110),差异有统计学意义 (P<0.05);α-SMA mRNA表达分别为(1.002±0.007)、(1.046±0.091)、(1.720±0.032)、(2.885±0.254),差异有统计学意义 (P<0.05);伴随着葡萄糖浓度的升高,UBA52、TGF-β1、α-SMA mRNA表达逐渐增加,而Smad7 mRNA的表达逐渐下降。UBA52与TGF-β1 mRNA表达量呈正相关(r=0.58,P<0.05),与 Smad7mRNA表达量呈负相关(r=-0.61,P<0.05)。结论肾小管上皮细胞泛素前体UBA52、TGF-β1、α-SMA mRNA表达呈葡萄糖浓度依赖性增加,而Smad7基因表达呈葡萄糖浓度依赖性下降,UBA52可能参与了高糖环境下肾小管上皮细胞TGF-β/Smad信号通路的调控,实现肾小管上皮细胞转分化。
糖尿病肾病;泛素-核糖体蛋白52(UBA52);Smad7;肾小管上皮细胞转分化
糖尿病肾病中,Smad7通过泛素蛋白酶体途径被泛素化降解,从而使转化生长因子β1(transforming growth factorβ1,TGF-β1)被持续激活是肾小管上皮细胞转分化的原因之一,而泛素蛋白酶体抑制剂MG132可改善高糖环境下的肾小管上皮细胞纤维化[1-2]。研究发现,在糖尿病肾病小鼠及糖尿病肾病患者血液及尿液中泛素的前体泛素-核糖体蛋白52( ubiquitin-ribosomal protein 52,UBA52)大量表达[3],但其是否参与及如何参与糖尿病肾病的发病机制,目前研究较少。本实验拟通过观察不同糖浓度对UBA52及TGFβ1/Smad7mRNA表达的影响,探讨肾小管上皮细胞转分化过程中UBA52与TGFβ1/Smad7的关系。
1 材料与方法
1.1主要试剂与仪器大鼠肾小管上皮细胞NRK52E(中国科学院上海细胞库提供),DMEM低糖培养基(Life technologies公司,美国),胎牛血清(Life technologies公司,美国),青霉素-链霉素双抗(10 000 U)(Hyclone公司,美国),Trizol(美国 MRC),反转录试剂盒,SYBR Select Master Mix(ABI公司,美国)。CO2细胞培养箱(上海力康仪器有限公司 Smart Cell HF-90),荧光倒置显微镜(日本尼康公司 Eclipse TS100-F),PCR 扩增仪(美国Thermo公司),凝胶成像系统(中国上海天能科技有限公司)。
1.2细胞分组及处理用含有10%胎牛血清的DMEM低糖培养基(5.6 mmol/L)培养 NRK52E细胞,接种于25 cm2培养瓶中,置于37℃、5% CO2孵育箱,待细胞生长达到80%时使用无胎牛血清的 DM EM 培养液处理细胞24 h,使细胞生长同步化。24 h后弃去旧培养基,分别加入含不同浓度葡萄糖完全培养基。实验分为4组,分别为葡萄糖低浓度组(5.6 mmol/L葡萄糖)、葡萄糖+甘露醇组(5.6 mmol/L葡萄糖+24.6 mmol/L甘露醇)、葡萄糖中浓度组(20 mmol/L葡萄糖)、葡萄糖高浓度组(30 mmol/L葡萄糖),每组5个重复,置于37℃培养48 h。
1.3RNA抽提及RT-PCR用 Trizol 分别提取各组细胞的总RNA,RNA 样本溶于DEPC水中,测260/280 A比值,计算RNA得率,调整RNA浓度。将提取的总RNA反转录为cDNA,步骤如下:RNA模板2.5 μg,Oligo d T 1 μL,DEPC水补足至11 μL,70℃水浴5 min,立即冰浴,5×buffer 4 μL,RNA酶抑制剂0.5 μL,d NTP 2 μL,DEPC水1.5 μL,37℃水浴5 min,加入反转录酶1 μL,42℃水浴1 h,70℃灭活10 min。
用SYBR Green 染料检测细胞目的基因的表达情况,并将β-actin作为内参照,引物序列见表1。PCR反应体系为:PCR mix 10 μL、primer F 0.4 μL、primer R 0.4 μL、CDNA 1.0 μL、ddH2O 8.2 μL,总反应体积为20 μL。反应条件:50℃ 2 min,95℃ 2 min预变性后,95℃ 15 s,60℃ 60 s 共进行40个循环。采用相对定量公式:2-△△Ct,[△Ct=Ct(目的基因)-Ct(β-actin),△△Ct=△Ct (实验样本)-△Ct (对照样本)],计算细胞目的基因的相对表达量。
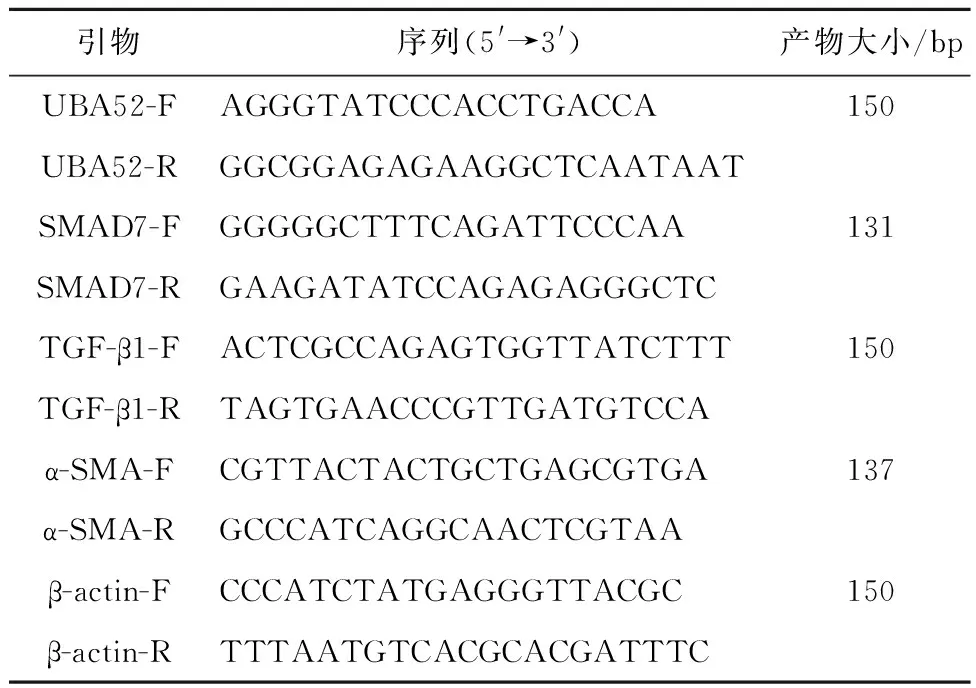
表1 引物序列

2 结果
2.1高糖对NRK52E形态的影响葡萄糖中浓度组及葡萄糖高浓度组部分肾小管上皮细胞呈梭形或星形,并有广泛的伪足形成,呈现出肌成纤维细胞特征(如图1所示)。提示高糖条件下,肾小管上皮细胞向肌成纤维细胞转分化。

图1高糖下肾小管上皮细胞形态学改变(×200)
2.2高糖对NRK52E 中UBA52的表达及TGF/samd信号通路mRNA的影响葡萄糖中浓度组及葡萄糖高浓度组肾小管上皮细胞表达UBA52 mRNA较葡萄糖低浓度组及葡萄糖+甘露醇组明显增多(P<0.05);两两比较的结果:葡萄糖高浓度组比葡萄糖中浓度组肾小管上皮细胞UBA52 mRNA表达增多,差异有统计学意义(P<0.05);葡萄糖低浓度组与葡萄糖+甘露醇组肾小管上皮细胞UBA52 mRNA表达无明显差异(P>0.05),提示UBA52基因表达增加呈葡萄糖浓度依赖性,渗透压增加不影响UBA52基因表达。葡萄糖中浓度组及葡萄糖高浓度组肾小管上皮细胞表达Smad7 mRNA较葡萄糖低浓度组及葡萄糖+甘露醇组明显减少(P<0.05);两两比较的结果显示葡萄糖高浓度从低浓度、中浓度组到高浓度组肾小管上皮细胞Smad7 mRNA表达逐步减少,差异有统计学意义(P<0.05);葡萄糖低浓度组与葡萄糖+甘露醇组肾小管上皮细胞Smad7 mRNA表达无明显差异(P>0.05)。葡萄糖中浓度组及葡萄糖高浓度组肾小管上皮细胞表达TGF-β1及α-SMA mRNA较葡萄糖低浓度组及葡萄糖+甘露醇组明显增加(P<0.05);两两比较的结果显示葡萄糖浓度从低浓度组、中浓度组到高浓度组肾小管上皮细胞TGF-β1及α-SMA mRNA表达逐步增加,差异有统计学意义(P<0.05);葡萄糖低浓度组与葡萄糖+甘露醇组肾小管上皮细胞TGF-β1及α-SMA mRNA表达无明显差异(P>0.05),提示伴随着葡萄糖浓度的增加,UBA52、TGF-β1及α-SMA mRNA表达逐步增多,而Smad7表达逐步减少,差异有统计学意义(P<0.05);但渗透压增加不能改变肾小管上皮细胞对UBA52、Smad7、TGF-β1及α-SMA的基因表达(表2)。

表2 不同葡萄糖浓度对NRK52E转分化相关指标mRNA表达的影响
注:与葡萄糖低浓度组比较,*P<0.05;与葡萄糖+甘露醇组比较,▲P<0.05;与葡萄糖中浓度组比较,▽P<0.05。
2.3UBA52与TGF-β/Smad信号通路的相关性分析对各组NRK52E 细胞中UBA52 mRNA与 TGF-β1 和Smad7 mRNA的表达量进行相关性分析,结果显示,UBA52 mRNA与TGF-β1 表达呈正相关(r=0.58,P<0.05);UBA52与 Smad7表达呈负相关(r=-0.61,P<0.05)。
3 讨论
我国目前糖尿病患病率已达到11.6%,而其中约34.7%的患者并发不同程度的糖尿病肾病(diabetic nephropathy,DN)[4]。糖尿病肾病是终末期肾功能衰竭的主要原因之一[5],其主要的病理改变为肾小球硬化和肾间质纤维化。肾小管上皮细胞转分化为肌成纤维细胞是糖尿病肾病肾间质纤维化发生机制之一,其最主要的组织学特征是肾小管的萎缩和细胞外基质的沉积,转分化的肌成纤维细胞分泌的α-平滑肌肌动蛋白(α-SMA)是细胞外基质的主要组成成分[6]。本实验的结果也证实,葡萄糖中浓度组及高浓度组的肾小管上皮细胞的确在形态学上出现了肌成纤维细胞的特点,且其α-SMA表达明显高于葡萄糖低浓度组,均说明高糖促使肾小管上皮细胞转分化为肌成纤维细胞。
TGF-β/Smad信号通路是肾小管上皮细胞转分化及肾间质纤维化的经典通路。而该信号通路中的信号转导分子Smad7属于负调控因子,可与TGF-β受体识别、牢固结合,介导TGF-β受体泛素化降解,抑制TGF-β1/Smad信号通路活性,其表达的上调,有助于防止肾小管向肌成纤维细胞转分化[7-8]。近年来许多研究证实,高糖可通过调节泛素蛋白酶体途径(Ubiquitin proteasome pathway,UPP)的活性,激活TGF-β/Smad信号通路,并且抑制Smad7的表达,这可能与TGF-β1介导 E3 泛素连接酶 Smad泛素化调节因子2(Smad ubiquitin adjustment factor 2,Smurf2),特异性泛素化降解 Smad7 有关[2]。
UPP途径的活性与泛素池内游离泛素数目有关。UBA52是一种泛素的前体,主要在肾小管上皮细胞表达,由1个泛素及52 个氨基酸残基(核糖体蛋白L40)组成,经过去泛素化酶水解后可释放游离泛素。以往研究表明,糖尿病肾病动物模型及患者血及尿中UBA52表达增加[9-11],可能参与糖尿病肾病形成的机制,但其如何参与了糖尿病肾病的发病机制尚不明确。基因研究发现,其基因上游启动子区域存在E-box序列,高糖可与之结合后,启动UBA52大量表达[11]。本研究的结果表明,中、高葡萄糖浓度组肾小管上皮细胞中UBA52基因的表达较正常葡萄糖浓度组明显增加,且呈葡萄糖浓度依赖性,也支持上述结论。
本实验结果也表明高糖可抑制Smad7基因表达,上调TGF-β1、α-SMA基因表达,而上述基因表达的变化似乎与UBA52的表达呈现一定的相关性。进一步的相关性分析显示UBA52 mRNA表达与Smad7 mRNA表达呈负相关,与TGF-β1mRNA表达呈正相关,提示UBA52可能参与了TGF-β/Smad信号通路的调节,对TGF-β1及Smad7基因表达进行调控,而其发挥作用的机制可能是通过为UPP途径提供泛素,最终导致Smad7被泛素化降解。因此,推测糖尿病肾病情况下,高糖通过刺激肾小管上皮细胞大量表达UBA52,持续活化TGF-β/Smad信号通路,导致肾小管上皮细胞转分化,促进肾小管间质纤维化的发生,参与糖尿病肾病的发生与发展。但这一结论还需通过观察UBA52的沉默或过表达对TGF-β/Smad信号通路的作用进一步证实。
[1]王圆圆,刘丽荣,李 霜,等.蛋白酶体抑制剂MG132减轻糖尿病大鼠肾小管间质纤维化[J].基础医学与临床,2014,34(2):160-167.
[2]Liu FY,Li XZ,Peng YM,et al.Arkadia regulates TGF-beta signaling during renal tubular epithelial to mesenchymal cell transition[J].Kidney Int,2008,73(5):588-594.
[3]Wada J,Sun L,Kanwar YS.Discovery of genes related to diabetic nephropathy in various animal models by current techniques[J].Contrib Nephrol,2011,169:161-174.
[4]中华医学会糖尿病学分会.中国2 型糖尿病及其并发症的流行病学[J].中华糖尿病杂志,2014,6(7):449-498.
[5]Zhang L,Long J,Jiang W,et al.Trends in Chronic Kidney Disease in China[J].N Engl J Med,2016,375(9):905-906.
[6]Forbes MS,Thornhill BA,Galarreta CI,et al.Chronic unilateral ureteral obstruction in the neonatal mouse delays maturation of both kidneys and leads to late formation of atubular glomeruli[J].Am J Physiol Renal Physiol,2013,305(12):F1736-F1746.
[7]Yan X,Liao H,Cheng M,et al.Smad7 protein interacts with receptor-regulated Smads (R-Smads) to inhibit Transforming Growth Factor-β (TGF-β)/Smad signaling [J].J Biol Chem,2016,291(1):382-392.
[8]Yao L,Li L,Li X,et al.The anti-inflammatory and antifibrotic effects of Coreopsis tinctoria Nutt on high-glucose-fat diet and streptozotocin-induced diabetic renal damage in rats[J].BMC Complement Altern Med,2015,15:314-324.
[9]Dihazi H,Müller GA,Lindner S,et al.Characterization of diabetic nephropathy by urinary proteomic analysis:identification of a processed ubiquitin form as a differentially excreted protein in diabetic nephropathy patients[J].Clin Chem,2007,53(9):1636-1645.
[10]Lee JY,Tokumoto M,Fujiwara Y,et al.Involvement of ubiquitin-coding genes in cadmium-induced protein ubiquitination in human proximal tubular cells[J].J Toxicol Sci,2015,40(6):901-908.
[11]Sun L,Pan X,Wada J,et al.Isolation and functional analysis of mouse UbA52 gene and its relevance to diabetic nephropathy[J].J Biol Chem,2002,277(33):29953-29962.
(本文编辑杨晨晨)
Effect of high glucose on expression of UBA52 mRNA and TGF-β/Smad Signaling pathway in Renal Tubular Cell
REN Rong,ZHANG Yan,ZHI Min,ZHANG Lei
(Department of Renal Disease,the Fifth Affiliated Hospital of Xinjiang Medical University,Urumqi 830011,China)
ObjectiveTo explore the effect of high glucose on expression of UBA52 and TGF-β/Smad Signaling pathway in renal tubular cell.MethodsThe rat renal tubular epithelial cells (NRK52E) were cultured in vitro and divided into 4 groups based on its glucose concentration,which were group A (5.6 mmol/L glucose),group B (5.6 mmol/L glucose+24.6 mmol/L mannitol),group C (20.0 mmol/L glucose) and group D (30.0 mmol/L glucose),then cells of each group were cultured in different media for another 48 hours.Cells morphology of each group were observed.Real-time fluorescent quantitative PCR was used to detect UBA52,Smad7,TGF-β1,and α-SMA mRNA expression.ResultsHigh glucose can lead renal tubular epithelial cells to transdifferentiate into fibroblast.the mRNA expression of UBA52,TGF-β1,and α-SMA increased depending on glucose concentration,while the expression of Smad7 mRNA decreased.UBA52 mRNA was positively correlated with TGF-β1 (P<0.05) and negatively with Smad7 expression (P<0.05).ConclusionsUBA52 may be participated into the pathogenesis of diabetic nephropathy by activating on TGF-β/Smad pathway.
Diabetic nephropathy; UBA52; Smad7; Tubular epithelial trans-differentiation
新疆维吾尔自治区自然科学基金(2014211C127)
任荣(1978-),女,硕士,主治医师,研究方向:肾脏病临床与基础。
芝敏,女,主任医师,副教授,硕士生导师,研究方向:肾脏病临床与基础,E-mail:627659081@qq.com。
S941.42+7
A
1009-5551(2016)11-1424-04
10.3969/j.issn.1009-5551.2016.11.019
2016-06-05]
