激活Shh信号通路影响结肠癌细胞上皮间质表型转化的研究
2016-11-15孙亚超王静东孙振强王琦三
孙亚超,王静东,金 博,孙振强,方 法,王琦三
(1新疆医科大学附属肿瘤医院腹外科,乌鲁木齐 830011;2武警新疆总队医院普外科,乌鲁木齐 830096)
激活Shh信号通路影响结肠癌细胞上皮间质表型转化的研究
孙亚超1,王静东2,金博1,孙振强1,方法1,王琦三1
(1新疆医科大学附属肿瘤医院腹外科,乌鲁木齐830011;2武警新疆总队医院普外科,乌鲁木齐830096)
目的阐释激活Shh信号通路对结肠癌上皮间质表型转化(EMT)的影响。 方法常规培养结肠癌细胞株HT-29细胞,设立对照组(培养液中加入PBS)、实验组(即信号通路活化,培养液中加入重组Shh配体);采用Westen-blot检测E-cadherin和Vimentin 蛋白表达水平的变化;RT-PCR检测上皮间质转化标志物E-cadherin和Vimentin 在mRNA水平的变化;行HE染色观察细胞形态变化的改变。结果Westen-blot检测蛋白提示,结肠癌HT-29细胞中,Shh信号通路激活可促进Vimentin蛋白表达(P<0.05),抑制E-cadherin蛋白表达(P<0.05);RT-PCR检测:实验组中E-cadherin和Vimentin的mRNA表达量差异具有统计学意义(P<0.05),与对照组相比较,实验组的Vimentin的mRNA表达量显著升高(P<0.05),E-cadherin的表达量明显降低(P<0.05);HE细胞染色提示对照细胞呈梭形,细胞间更紧密地连接,并与信号通路阻断组细胞无显著差异,而实验组细胞呈椭圆形或圆形,连接疏松,部分细胞呈团簇集群样生长。结论EMT在结肠癌转移过程中起着重要的作用,而Shh信号通路的激活可促进结肠癌细胞EMT的发生、发展。
上皮间质表型转化;Shh信号通路;结肠癌;E-cadherin和Vimentin
上皮-间质表型转化(Epithelial-mesenchymal transition,EMT)是指在某些特殊的病理或者生理条件下,具有极性的上皮细胞失去极性,失去与细胞基底膜的密切联系,进而转化为具有较强活动能力、获取较高的迁移与侵袭力,而且还能够在细胞基质间自由移动的间质表型细胞的复杂过程。近年来的众多研究发现,EMT与肿瘤的侵袭转移有着十分密切的联系,其在结肠癌、胃癌、肝癌、卵巢癌、乳腺癌、肺癌、前列腺癌等多种恶性肿瘤的原位浸润和侵袭转移过程中发挥着重要的作用[1]。越来越多的研究也发现,结肠癌组织及体外培养的结肠癌细胞中也存在着上皮间质表型转化的现象[2-3]。目前鲜见Shh信号通路与结肠癌上皮间充质表型转化关系的研究报道,Shh信号的激活在结肠癌转移过程中是否可以促进结肠癌细胞发生EMT 的过程目前尚不十分清楚。本研究旨在通过对结肠癌细胞株HT-29细胞发生EMT过程中的2个重要标志蛋白分子E-cadherin(钙黏附蛋白-E)和Vimentin(波形蛋白)的表达质量、形态结构改变结果进行分析,进一步探索Shh信号通路调控结肠癌细胞的过程中,上皮间质表型转化的作用及影响。
1 材料与方法
1.1材料与试剂结肠癌细胞株HT-29、PBS溶液、Shh配体、RPMI1640稀释的人工基质Matrigel、HE、RT-PCR试剂盒(FSK.100)TOYOBO公司,Westen-blot试剂盒(北京集思佳扬生物有限公司)。主要仪器:CO2培养箱(美国THERMO ELECTRON公司),超净工作台(青岛海尔公司),显微镜(日本Olympus公司),SpectraMax 190连续波长酶标仪(美国MD公司),流式细胞仪(美国BD公司),超低温冰箱(美国THERMO ELECTRON公司),电热恒温水浴箱(上海跃进医疗器械厂),低温超速离心机和低速离心机(日本Hitachi公司),高压蒸汽灭菌器(上海申安医疗有限公司)
1.2实验方法
1.2.1Westen-blot法检测E-cadherin和Vimentin蛋白表达水平采集细胞,运用蛋白提取液煮沸法提取细胞总蛋白,采用Lowry法测定各样品的浓度,每个样品上样30 μg,SDS-PAGE蛋白电泳将蛋白转移至PVDF膜,依次缓慢加入Shh一抗(鼠单抗)和二抗(羊抗鼠IgG),然后于ECL液温浴,时间为2 min,之后行X线片曝光显影,使用激光光密度图像扫描仪检测各组信号条带的吸光值并记录。
1.2.2RT-PCR法检测E-cadherin和Vimentin 在mRNA水平的变化表达的差异:细胞生长至80%融合时,对照组在培养液中加入PBS,实验组在培养液中加入重组Shh配体,使终浓度为100 nmoL/L,与细胞共同培养48 h。按TRIzol总RNA提取试剂盒(Promega)说明书提取细胞总RNA,参照M-MLV逆转录酶RT-PCR试剂盒(Promega)说明书,分别以E-cadherin、Vimentin和GAPDH引物进行RT-PCR反应。PCR产物经1%琼脂糖凝胶电泳,紫外线凝胶成像分析仪照相,观察E-cadherin、Vimentin和GAPDH产物条带的位置并分析吸光度值。重复实验3次。
1.2.3HE染色观察细胞结构及形态变化制作细胞爬片,用PBS洗涤3 次,95%酒精进行固定,时间为10 min,然后再用PBS洗涤3 次,规范行伊红、苏木素染色,缓慢逐级乙醇脱水,采用二甲苯透明,中性树脂封片,取切片于光镜下观察。
2 结果
2.1Westen-blot法检测蛋白表达实验发现对照组和实验组细胞中E-cadherin和Vimentin蛋白表达变化差异有统计学意义(P<0.05),实验组细胞中的Vimentin表达明显升高,E-cadherin表达降低(图1)。
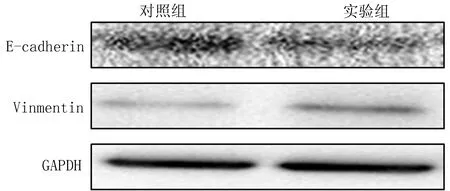
图1 对照组和实验组2种蛋白表达(GAPDH作为内参照)
2.2RT-PCR法检测结果实验组结肠癌细胞Vimentin的mRNA相对表达量显著高于对照组,且两组差异具有统计学意义(P<0.05);实验组E-cadherin的mRNA相对表达量较对照组降低(P<0.05)。同时,激活Shh信号通路后,结肠癌细胞中的E-cadherin和Vimentin的mRNA水平相对表达量之间也有明显差异,即Vimentin 的mRNA表达水平偏高,E-cadherin的mRNA表达水平偏低,见图2。
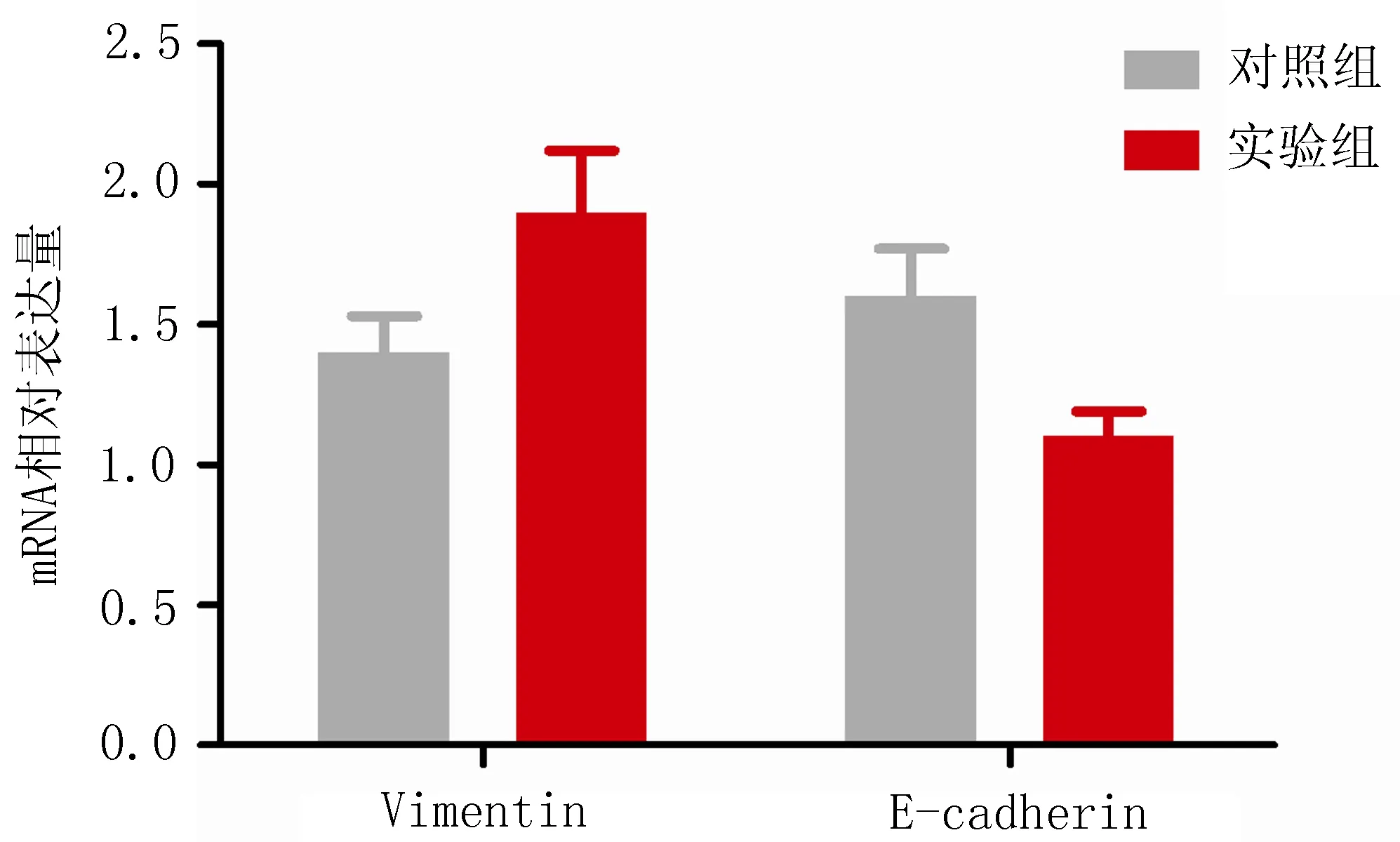
图2 E-cadherin和Vimentin的 mRNA水平的相对表达量
2.3细胞结构及形态变化对照组细胞呈梭形,大小不一,连接紧密;实验组细胞多呈椭圆形或圆形,连接疏松,细胞间接触减小,部分呈团簇集群状生长(图 3)。

图3细胞HE染色(×200)
3 讨论
Jemal等[5]研究发现,转移是肿瘤患者死亡的主要原因,90%确诊实体恶性肿瘤的患者因为肿瘤病灶远处转移侵袭靶组织或器官引起相应组织、器官损害甚至功能衰竭而死亡。在许多恶性肿瘤的发生、发展过程中,Shh信号通路的异常激活扮演着很重要的角色,包括结肠癌在内的多数肿瘤组织中皆能够检测到Shh信号通路的过度激活表达现象[6-7]。Shh 是胚胎发育过程中的重要调节因子,研究发现Hedgehog信号能够通过成纤维细胞生长因子(fibroblastgrowth factor,FGF)、TGF-β、Notch 等一系列细胞信号通路的激活可间接导致EMT 的发生[8-9]。同时,大量的研究也表明上皮间质表型转化在上皮性肿瘤(包括结肠癌)的侵袭与转移过程中发挥着重要的作用[10]。Greenburg等[11]于 1982 年首次提出 EMT 的概念,EMT 最初被认定是胚胎发生的一个特征,与胚胎的组织和器官发育有密切关系,其对原肠胚的形成、心脏瓣膜的形成、神经嵴的形成、肌细胞形成等一系列的组织、器官生长发育过程具有重要的影响[12]。Theiry[1]于2002年研究发现在恶性肿瘤细胞发生转移之前,肿瘤细胞能够通过EMT获得侵袭和转移的能力。此后,肿瘤细胞EMT的发生就成为了肿瘤转移的重要理论解释,慢慢被人们所接受与研究。另外,Kang等[13]研究认为在肿瘤细胞发生EMT的过程中,E-cadherin(钙黏附蛋白-E)被认为是肿瘤细胞的侵袭和转移过程中的主要关键标志分子,并在其中发挥着重大作用。在E-cadherin功能具备的状态下,肿瘤细胞会相互黏附、紧密相贴,当出现E-cadherin表达水平下降的情况时,肿瘤上皮细胞就会发生EMT,使得具备迁移能力和运动活性增强的肿瘤细胞能够向远处迁行移动,最终在靶组织或器官形成新的转移灶。在细胞发生EMT的过程中还有一种关键蛋白即Vimentin(波形蛋白)发生改变,在结肠癌、胃癌、肝癌、肾癌、乳腺癌、胰腺癌、宫颈癌、前列腺癌等许多肿瘤中,这些发生上皮-间质表型转化的肿瘤细胞内,Vimentin的表达量会显著升高,肿瘤细胞的侵袭能力也会随之显著地增强[10-14]。波形蛋白是细胞中间丝的一种重要纤维蛋白,大多数在间叶组织中表达出现,其生物学功能被认为是维持细胞和细胞器的形态,参与、构造细胞骨架与胞膜的形成。当细胞内的波形蛋白表达增强,将会引起细胞骨架重新排列,进而形成细胞-基质黏附,最终能够改变细胞表型和增强细胞迁行运动的能力。本实验研究显示,通过采用重组Shh配体来激活Shh信号通路后,运用Westen-blot方法检测和RT-PCR方法检测结肠癌细胞株HT-29 细胞中E-cadherin和Vimentin2种蛋白表达及其mRNA表达水平的变化发现,信号通路活化组显著表达Vimentin,同时,本实验也发现,激活Shh信号通路后,实验组细胞的E-cadherin分子蛋白表达水平降低,且与对照组比较差异有统计学意义(P<0.05)。由此进一步推测,激活Shh信号通路后,结肠癌细胞发生了上皮间质表型转化。
恶性肿瘤的侵袭与转移是一个多基因、多因素、多步骤的复杂过程,包括肿瘤细胞从肿瘤原发部位脱离,进入周围基质,进而移行进入淋巴系统或循环系统,黏附在淋巴管或血管内皮细胞壁并向脉管外迁行移动,一步一步侵入到转移组织或器官,进行血管的增生,从而在新的部位形成新的肿瘤转移病灶引起相应组织、器官的病变损害。在这个过程中,肿瘤病灶由原发部位游离是肿瘤转移最初始的因素,同时也是肿瘤离开原发部位向远处转移发生、发展形成新的转移灶的重要先决条件[15]。而当上皮细胞发生EMT后,会导致细胞极性丧失、细胞体积伸展变长类似成纤维细胞样,并与周围的细胞和基质接触面积缩小,进而引起细胞间的黏附力和相互作用力减弱,使得细胞相对自由,其迁移和运动的能力得到增强,同时发生细胞生物标记物的改变,即减弱甚至丧失了上皮表型,如E-cadherin;而拥有间质表型,如Vimentin,其中E-cadherin 的表达缺失已被多数学者认为是细胞发生EMT的重要典型标志之一[16]。参考相关文献报道及结合本研究结果,思考Shh信号通路调控结肠癌EMT的发生是否引起结肠癌细胞的远处迁移,通过对两组结肠癌细胞给予不同的处理后,经HE染色镜下观察发现,信号通路活化组细胞形态大部分呈类圆形或圆形、大小不等、细胞间连接较疏松,部分细胞呈团簇集群状生长。另外,结合本实验上述的研究结果即信号活化组细胞中Vimentin的高表达和E-cadherin 的低表达,由此推测出信号活化组细胞经激活Shh信号通路后,细胞发生了上皮间质转化,引起间质表型Vimentin的高表达。同时,细胞骨架是由微管、微丝和中间丝构成,细胞形态与之密切相关,另外细胞骨架还参与了细胞的移行、运动、信息传递、物质转运及细胞分裂、分化及基因表达等多种功能表达的过程。另外,Pawlak等[17]研究阐释,肿瘤细胞内的这种Vimentin高表达会破坏细胞黏着斑,细胞骨架重新排列,从而改变细胞的结构,这种变化会使细胞胞体的刚性降低,增强顺应性,细胞更容易在组织中变形游走,这最终会引导致肿瘤细胞离开原发部位向远处迁行与侵袭的能力得到增强引起肿瘤转移[18]。本研究结果提示,激活Shh信号通路可导致结肠癌HT-29细胞上皮表型发生改变、形态结构发生改变,同时也说明了细胞上皮间质转化后,上皮组织趋向于间质表型发展,其变形能力及顺应性增加,增强了细胞移行运动的能力,为细胞脱离原发部位向远处迁移提供了一定的基础条件。
综上所述,本研究认为激活Shh信号通路能够使结肠癌细胞发生上皮表型向间质表型转化,而这种高表达Vimentin和低表达E-cadherin的细胞状态和结合2种蛋白分子的特性很大程度上能够增强细胞的迁移运动能力。因此推测重组Shh活化配体激活Shh信号通路可以通过诱导结肠癌细胞发生EMT,而细胞发生EMT后,细胞极性丧失,失去与基底膜的联系,细胞体积伸展变长,与周围的细胞及基质接触面缩小,细胞间黏附的能力和相互作用降低,进而引起发生EMT的细胞运动和迁移能力得到显著增强,这一系列的改变很可能为肿瘤细胞脱离原发部位向远处转移、侵入靶组织或器官奠定了基础。至于Shh信号通路的激活对结肠癌EMT的发生之后细胞如何转移、侵袭的具体确切发生、发展机制尚待进一步科学实验研究。
[1]Thiery JP.Epithelial-mesenchymal transitions in tumor progression[J].Nat Rev Cancer,2002,2(6):442-454.
[2]纪志鹏,王琦三,丁印鲁,等.Smo基因在结肠癌组织中的表达及其与术后肝转移的关系[J].中国现代普通外科进展,2012,15(11):20-24.
[3]Ding Yl,Wang QS,Zhao WM,et al.Expression of Smoothened Protein in Colon Cancer and Its Prognostic Value for Postoperative Liver Metastasis[J].Asian Pac J Cancer Prev,2012,13(8):3825-3829.
[4]吴共发,胡洁,王雅娟,等.沉默Tiam1 基因对大肠癌LoVo 细胞上皮-间质转化的影响[J].实用医学杂志,2011 ,27:2321-2324.
[5]Jemal A,Tiwari RC,Murray T,et al.Cancer statistics,2004[J].CA Cancer J Clin,2004,54(1):8 -29.
[6]Ohta M ,Tateishi K,Kanai F,et a1.p53-Independent negative regulation of p21/cyclin dependent kinase-interacting protein 1 by the Sonic edgehog-glioma-associated oncologenepathway in gastric carcinoma cells[J].Cancer Res,2008,65(23):10822-10829.
[7]朱达坚 .Smo蛋白及Glil蛋白在结直肠癌组织中的表达及其意义[J].广东医学,2009,30(50):757-759.
[8]Katoh Y,Katoh M.Hedgehog signalin epithelial-to-mesenchymal transition and miRNA[J].Int J Mol Med,2008,22(3):271-275.
[9]Omenetti A,Porrello A,Jung Y,et al.Hedgehog signaling regulates epithelial-mesenchymal transition during biliary fibrosis in rodents and humans[J].J Clin Invest,2008,118(10):3331-3342.
[10]Iwatsuki M,Mimori K,Yokobori T,et al.Epithelial mesenchymal transition in cancer development and its clinical significance [J].Cancer Sci,2010,101(2):293-299.
[11]Greenburg G,Hay ED.Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J].J Cell Biol,1992,95(1):333-339.
[12]Kong D,Li Y,Wang Z,et al.Cancer stem cells and epithelial-to-mesenchy mal transition(EMT)-phenotypic cells:are they cousins or twins[J].Cancer (Basel),2011,3(1):716-729.
[13]Kang Y,Massague J.Epithelial-mesenchymal transitions:twist in development and metastasis[J].Cell,2009,117:927-939.
[14]Tischler V,Pfeifer M,Hausladen S,et al.L1CAM protein expression is associated with poor prognosis in non-small cell lung cancer[J].Mol Cancer,2011,10(1):127.
[15]Bonnomet A,Syne L,Brysse A,et al.A dynamic in vivo model of epi-thelial-mesenchymal transitions in circulating tumor cells and metasta-ses of breast cancer[J].Oncogene,2012,31(33):3741-3753.
[16]Zeisberg M,Neilson E G.Biomarkers for epithelial mesenchymal transitions[J].J Clin Invest,2009,119(6):1429-1437.
[17]Pawlak G,Helfman DM.Cytoskeletal changes in cell transformation and tumorigenesis [J].Curr Opin Genet Dev,2001,11(1):41-47.
[18]Lenormand G,Fredberg JJ.Deformability,dynamics,and remodeling of cytoskeleton of the adherent living cell [J].Biorheology,2006,43(1):1-30.
(本文编辑张巧莲)
The effect of activating Shh signaling pathway on epithelial-mesenchymal transition of colon cancer cells activating
SUN Yachao1,WANG Jingdong2,JIN Bo1,SUN Zhenqiang1,FANG Fa1,WANG Qisan1
(1Department of Gastrointestinal Surgery,Affiliated Tumor Hospital,Xinjiang Medical University,Urumqi 830011,China;2Department of General Surgery,Xinjiang Uyger Autonomous Region Corps Hospital,Chinese People′s Armed Poloce Force,Urumqi 830096,China)
ObjectiveTo explain effect of Shh signaling pathway on epithelial-mesenchymal transition (EMT)of colon cancer cells.MethodsRoutinely cultured colon cancer HT-29 cells were devided intocontrol group (PBS in broth) and testing group (recombinant shh ligand in PBS);After 24 h of transfection ,cultured cells were harvested to detect the changes of E-cadherin and Vimentin protein by RT-PCR and Western-blot,respectively.The morphological changes of the cells were observed by HE staining.Res-ultsWesten-blot analysis showed that activation of Shh signaling pathway can promote the expression of Vimentin (P<0.05)and inhibit the E-cadherin protein expression (P<0.05) in colon cancer HT-29 cells; Compared with control group,the mRNA expression of Vimentin significantly increased (P<0.05) and the expression of E-cadherin significantly decreased (P<0.05) in the experimental group; HE staining showed that the cell of control group were fusiform ,closely connected,and had no significant difference with the signal path blocking group ,however,the signaling pathway activated cells were round or oval,loose connection,and some were clustered.ConclusionEMT plays an important role in colon cancer metastasis,and activating the Shh signaling pathway can promote the EMT of colon cancer cell.
Epithelial-mesenchymal transition ; Shh signaling pathway; colon cancer; E-cadherin and Vimentin
新疆维吾尔自治区自然科学基金(2013211A066)
孙亚超(1991-),男,在读硕士,研究方向:胃肠肿瘤的基础研究与防治。
王琦三,男,主任医师,副教授,硕士生导师,研究方向:胃肠肿瘤的基础研究与防治,E-mail:370731493@qq.com。
R34
A
1009-5551(2016)11-1428-04
10.3969/j.issn.1009-5551.2016.11.020
2016-03-19]
