烟粉虱溶菌酶基因的鉴定及表达分析
2016-11-14王登杰雷仲仁王海鸿
于 洁,王登杰,雷仲仁,王海鸿
烟粉虱溶菌酶基因的鉴定及表达分析
于 洁1,王登杰2,雷仲仁1,王海鸿1
(1中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;2四川省达州市达川区植保植检站,四川达州 635000)
【目的】鉴定烟粉虱()体内的溶菌酶基因,并对其序列特征、进化关系和表达模式进行分析,探索该基因在烟粉虱应对球孢白僵菌侵染过程中的作用,为进一步解析烟粉虱先天免疫过程提供理论依据。【方法】以第2代高通量测序的结果为依据,比对非冗余核苷酸数据库,筛选E值<10-5的基因为烟粉虱溶菌酶基因(lysozyme gene of,),利用ORF Finder预测的开放阅读框,并得到氨基酸序列;利用Pfam和SMART预测BtLyz的蛋白质结构域;利用SinglP 4.1 Server预测BtLyz序列的信号肽;利用MEGA6.0软件进行BtLyz的氨基酸多序列比对;利用MEGA6.0软件,对BtLyz与其他昆虫的31个同源蛋白序列进行系统进化分析,并利用邻接法构建系统进化树来进一步分析鉴定该基因;采用实时荧光定量PCR(qRT-PCR)分析球孢白僵菌侵染烟粉虱卵、若虫、成虫后,在12、24、36、48、60 h时目标基因的时空表达模式。【结果】鉴定出烟粉虱4个溶菌酶基因,分别命名为、、和,基因序列全长分别为1 819、1 149、829和928 nt,分别编码159、160、148和160个氨基酸,且均含有信号肽。蛋白质结构分析、氨基酸序列比对和系统进化分析发现,BtLyz1和BtLyz4属于i型溶菌酶,BtLyz2和BtLyz3属于c型溶菌酶。BtLyz-1与豌豆长管蚜ApLyz-i1位于同一进化支上,BtLyz4与柑橘木虱DcLyz-i3和豌豆长管蚜ApLyz-i2位于同一进化支上。BtLyz2和BtLyz3与褐飞虱NlLyz-c1和异色瓢虫HaLyz-c3位于同一进化支上。与对照相比,卵期4个溶菌酶基因和若虫期的相对表达量没有显著变化;若虫期的相对表达量先上调再下调,而后又有所上调的波动趋势,24 h时上调表达最明显,为对照组的4.55倍;成虫期和的相对表达量均为先上调再下调,而后又有所上调的波动趋势,60 h时上调表达最明显,为对照组的11.31和4.21倍;若虫期和的相对表达量均为先上调再下调表达,在诱导24 h时上调表达最明显,为对照组的5.09和8.31倍,而后急剧下调,在60 h时下调表达最明显,为对照组的0.19和0.13倍;成虫期和的相对表达量均为先上调再下调的表达趋势,在24 h时上调最明显,为对照组的5.56和8.84倍。【结论】从烟粉虱体内鉴定了4个溶菌酶基因序列,其中2个为c型溶菌酶序列,2个为i型溶菌酶序列;在球孢白僵菌侵染烟粉虱不同虫态、不同时间后,卵期的相对表达量与对照相比没有显著变化;在若虫和成虫期,不同表现出不同的表达趋势。4个可能参与了烟粉虱对真菌侵染的免疫反应,有可能成为烟粉虱生物防治的潜在新靶标。
烟粉虱;溶菌酶;生物信息学分析;实时荧光定量PCR
0 引言
【研究意义】溶菌酶(lysozyme,Lyz)在昆虫先天免疫过程中起到抵抗细菌[1-3]、真菌[1,4-6]和病毒[7]的重要作用,是一种广谱的抗菌效应分子,为昆虫组织中分布最广泛的抗菌蛋白[8]。因此,研究昆虫溶菌酶基因的作用对理解昆虫先天免疫反应具有重要意义。【前人研究进展】溶菌酶又称胞壁质酶或-乙酸胞壁质聚糖水解酶,能够特异水解肽聚糖中-乙酰葡聚胺和-乙酰胞壁酸之间的-1,4-糖苷键,破坏肽聚糖支架,在内部渗透压的作用下致使细胞胀裂开,引起微生物的裂解[1]。在动物中主要有3种不同类型的溶菌酶,即c型溶菌酶(chicken type)、g型溶菌酶(goose type)、i型溶菌酶(invertebrate type)[1,4]。在昆虫体内主要分布为c型和i型溶菌酶:c型溶菌酶有8个半胱氨酸残基(形成分子内二硫键)和2个潜在的催化位点(谷氨酸和天冬氨酸)[9];i型溶菌酶由10或12个半胱氨酸残基形成分子内二硫键[10]。溶菌酶作为首个从昆虫体内纯化的抗菌物质,在多种昆虫中均被发现。大蜡螟()在幼虫到蛹的变态阶段,溶菌酶的活性显著增强[11];棉铃虫()溶菌酶在幼虫期间呈组成型低表达,在蛹期表达量急剧增加,在蛹中期达到峰值,蛹后期和成虫期又下调表达[12];冈比亚按蚊()溶菌酶在不同发育阶段和不同组织中均被发现[13];斜纹夜蛾()溶菌酶在末龄若虫的血淋巴中被分离出来[14];烟粉虱()是蔬菜、花卉和棉花等经济作物上的重要害虫[15],应用球孢白僵菌()防治烟粉虱是一种有效的生物防治手段[16-18]。【本研究切入点】溶菌酶在昆虫先天免疫过程中起着重要作用,目前国内外对昆虫溶菌酶的研究以家蚕()[3,19]、褐飞虱()[20]、沙漠蝗()[21]、冈比亚按蚊[13,22]、斜纹夜蛾[14]等昆虫为主,而针对经济危害性巨大的烟粉虱却没有得到鉴定和相关研究。【拟解决的关键问题】通过对球孢白僵菌侵染烟粉虱的转录组数据分析,鉴定出烟粉虱体内的溶菌酶基因序列,并利用实时荧光定量PCR(qRT-PCR)方法分析烟粉虱不同虫态被球孢白僵菌侵染后的mRNA转录水平变化,以期为深入研究这些基因在烟粉虱先天免疫反应中的作用提供线索。
1 材料与方法
试验于2015年在中国农业科学院植物保护研究所完成。
1.1 BtLyz的蛋白结构检测与系统进化分析
来自于笔者实验室第2代高通量测序结果[17]。将初步筛选得到的基因在NCBI的NR核酸数据库中通过BLASTX算法进行搜索,当E值<10-5时进一步确定为。利用ORF Finder预测的开放阅读框,并得到氨基酸序列;利用Pfam和SMART预测BtLyz的蛋白质结构域;利用SinglP 4.1 Server预测BtLyz序列的信号肽;利用MEGA6.0软件进行BtLyz的氨基酸多序列比对;利用MEGA6.0软件,对BtLyz与其他昆虫的31个同源基因进行系统进化分析,并采用邻接法(neighbor-joining method)构建系统进化树。
1.2 供试真菌
选用球孢白僵菌菌株GZGY-1-3,保藏在中国普通微生物菌种保藏中心(No. 9254),该菌株对烟粉虱具有高致病性[17-18]。参考王登杰等[18]的方法制备培养基:玉米粉2%、麦麸1%、蛋白胨0.5%、KH2PO40.3%、MgSO4·7H2O 0.1%、NH4NO30.1%、琼脂2%、无菌水96%。在温度为25℃、光周期为L﹕D=12 h﹕12 h的条件下将球孢白僵菌分生孢子在培养基上培养14 d,获得分生孢子后,于4℃下冷藏贮存。用无菌的接种环将孢子从培养基上刮下,置于灭菌的0.05%吐温-80溶液中配置成1.0×108个/mL的孢子悬浮液备用。
1.3 供试昆虫
供试烟粉虱采集自河北廊坊中国农业科学院植物保护研究所实验基地番茄()上,根据线粒体DNA上的COⅠ基因序列鉴定其为Q生物型[23],用番茄幼苗饲养于中国农业科学院植物保护研究所蔬菜害虫组养虫室内,饲养条件为温度26℃、光周期L﹕D=12 h﹕12 h、相对湿度60%—80%。
从大量饲养的烟粉虱中收集600对成虫,放入装有6株高25 cm左右的健康番茄苗的养虫笼(35 cm×42 cm×45 cm)内让其产卵,24 h后将植株上的烟粉虱成虫全部移除,保留带有新鲜卵的番茄植株备用。
卵:剪下上述带有新鲜卵的番茄叶片用球孢白僵菌孢子悬浮液浸泡10 s,自然晾干后将叶片放在保湿培养皿中,以未经球孢白僵菌悬浮液处理作对照。于处理12、24、36、48、60 h后分别取样,每次收集300粒卵作为1个样品。取样时用毛细管吸取少量的Trizol试剂,然后在叶片上利用毛细现象吸取叶片上的卵。
若虫:将上述带有新鲜卵的番茄植株放入干净的养虫笼中,15 d后大多数卵已发育为4龄若虫,将带有4龄若虫的叶片剪下,放入球孢白僵菌悬浮液中浸泡10 s,自然晾干后的叶片放在保湿培养皿中,以未经球孢白僵菌悬浮液处理作对照。于处理12、24、36、48、60 h后分别取样,每次收集50只若虫作为1个样品。
成虫:取新鲜干净的番茄幼苗叶片,放入球孢白僵菌悬浮液中浸泡10 s,自然晾干后的叶片放在保湿培养皿中,然后收集当天羽化的烟粉虱成虫若干也放入培养皿中,让其自由接触叶片上的孢子,以未经球孢白僵菌悬浮液处理作对照。于处理12、24、36、48、60 h后分别取样,每次收集50只成虫作为1个样品。
每次收集的样品立即放入液氮中冻存用于qRT-PCR检测。分别收集3次样品作为3次重复。
1.4 总RNA的提取、cDNA第一链的合成及qRT-PCR检测
用1 mL Trizol重悬上述3个虫态不同时间点的烟粉虱样品,按Trizol Reagent说明书提取总RNA,RNA纯度及定量则采用紫外分光光度法进行测定,取OD260/280处于1.9—2.1及OD260/230处于1.8—2.1的RNA备用。依据Reverse Transcription System以2 μg·μL-1总RNA为模板制备cDNA第一链,加入总RNA 1.0 μL、Oligo (dT)15Primer 1.0 μL、Nuclease-Free Water 8.0 μL,混匀后70℃变性5 min,完成后置于冰上,继续在样品管中加入RT-Mix 10 μL(Nuclease-Free Water 1.6 μL、Goscript 5×Reaction Buffer 4.0 μL、25 mmol·L-1MgCl22.0 μL、PCR Nucleotide Mix 1.0 μL、Recombinant RNasin® Ribonuclease Inhibitor 0.4 μL、Reverse Transcriptase 1.0 μL)。反转录程序为:25℃退火5 min,42℃延伸60 min,70℃逆转录酶失活15 min,4℃终止反应。将cDNA稀释10倍后用于qRT-PCR反应。
以烟粉虱第2代高通量测序的结果为依据[17],利用Primer Premier 5.0软件设计引物用于的荧光检测,内参基因采用(表1)。采用GoTaq® qPCR Master Mix试剂盒,设置20 μL反应体系:无核酸酶水7 μL、GoTaq® qPCR Master Mix 10 μL、10 μmol·L-1上下游引物各0.5 μL、cDNA 2 μL。反应程序为:95℃预变性2 min,95℃变性15 s,60℃退火和延伸共1 min,进行40个循环;最后以0.01℃·s-1的速度从65—95℃记录熔解曲线。荧光检测均设置3次技术重复和3次生物学重复用于数据分析。依据各样品和其相对应的的Ct值,参照2-ΔΔCt方法对qRT- PCR结果进行分析[24]。不同样本之间的差异采用SAS 9.2软件进行统计分析,以 Duncan氏新复极差方法进行差异显著性检验。
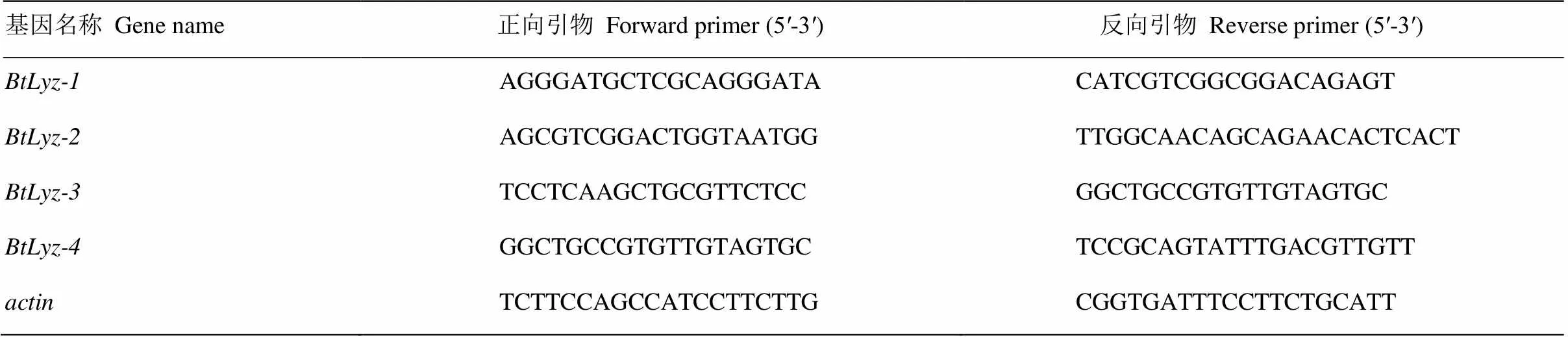
表1 烟粉虱溶菌酶基因的qRT-PCR引物
2 结果
2.1 BtLyz蛋白结构与系统进化分析
通过BLASTX比对发现,有4个基因序列为序列,分别命名为、和,其核酸长度分别为1 819、1 149、829和928 nt,通过ORF Finder预测可能均为全长序列,分别编码159、160、148和160个氨基酸。通过SignalP 4.1 Server 软件分析发现,4个BtLyz均有信号肽,分别由22、21、22和21个氨基酸组成。通过Pfam在线分析发现,4个BtLyz均具有Lyz家族特有的保守性结构域(图1),其中BtLyz1和BtLyz4为i型溶菌酶,BtLyz2和BtLyz3为c型溶菌酶。在i型溶菌酶中,有12个保守的半胱氨酸残基位点(图2);在c型溶菌酶中,有8个半胱氨酸残基和2个潜在的催化位点(即谷氨酸和天冬氨酸)(图3)。对这4个BtLyz和其他昆虫的31个Lyz的遗传进化分析,i型和c型溶菌酶被分成了两个独立的群体:BtLyz1和BtLyz4聚在i型溶菌酶一支上,BtLyz-1与豌豆长管蚜ApLyz-i1位于同一进化支上,BtLyz4与柑桔木虱DcLyz-i3和豌豆长管蚜ApLyz-i2位于同一进化支上;BtLyz2和BtLyz3聚在c型溶菌酶一支上,与褐飞虱NlLyz-c1和异色瓢虫HaLyz-c3位于同一进化支上(图4)。

Destabilase:i型溶菌酶的失稳酶家族保守结构域Destabilase superfamily of i-type lysozyme;LYZ1:c型溶菌酶c-type lysozyme;紫红色表示低复杂度的区域Fuchsia indicated low complexity area

Bt:烟粉虱Bombyx mori;Ag:冈比亚按蚊Anopheles gambiae;Am:意蜂Apis mellifera;Bm:家蚕Bombyx mori;Dm:黑腹果蝇Drosophila melanogaster;Ea:安德爱胜蚓Eisenia andrei;Pa: 美洲大蠊Periplaneta americana。下同The same as below。下划线表示预测的信号肽The predicted secretion signal peptide was underlined;红色字体表示保守的半胱氨酸red letters indicated conserved cysteine;蓝色字体表示保守的组氨酸blue letters indicated conserved histidine;“·”代表序列比对的空位“·” indicated sequence alignment vacancies
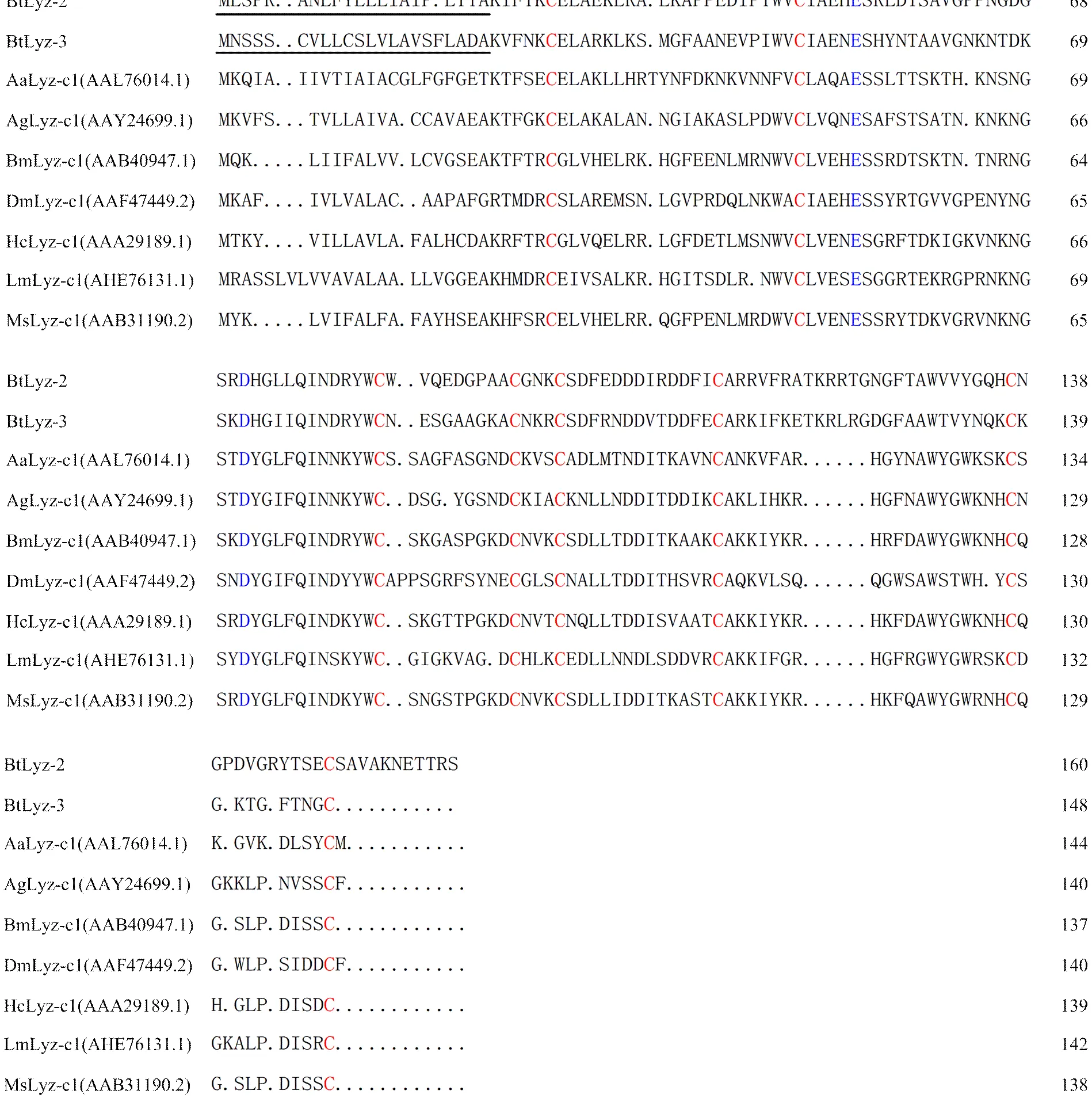
Aa:埃及伊蚊Aedes aegypti;Hc:刻克罗普斯蚕蛾Hyalophora cecropia;Lm:东亚飞蝗Locusta migratoria;Ms:烟草天蛾Manduca sexta。下同The same as below。下划线表示预测的信号肽The predicted secretion signal peptide was underlined;红色字体表示保守的半胱氨酸Red letters indicated conserved cysteine;蓝色字体表示保守的谷氨酸和天冬氨酸Blue letters indicated conserved glutamate and aspartate;“·”代表序列比对的空位“·” indicated sequence alignment vacancies

Ad:达氏按蚊Anopheles darlingi;Ap:豌豆长管蚜Acyrthosiphon pisum;Dc:柑橘木虱Diaphorina citri;Gm:大蜡螟Galleria mellonella;Ha:异色瓢虫Harmonia axyridis;Mr:苜蓿切叶蜂Megachile rotundata;Nl:褐飞虱Nilaparvata lugens:Px:柑橘凤蝶Papilio xuthus;Tb:巴西锥蝽Triatoma brasiliensis;第1支Clade 1:c型溶菌酶c-type lysozymes;第2支Clade 2:i型溶菌酶i-type lysozymes
2.2 球孢白僵菌侵染烟粉虱后的表达分析
烟粉虱受球孢白僵菌侵染后,4个的相对变化量均有变化。卵期在不同时间点的相对表达量较稳定,且均与对照水平相当。在若虫期处于先上调再下调,而后又有所上调的波动趋势,24 h时上调表达最明显,为对照组的4.55倍;和在若虫期均为先上调表达再下调表达,在24 h时上调最明显,为对照组的5.09和8.31倍,而后急剧下调,在60 h时下调表达最明显,为对照组的0.19和0.13倍;在若虫期的相对表达量较稳定,与对照水平相当。和在成虫期均为先上调再下调,而后又有所上调的波动趋势,60 h时上调表达最明显,为对照组的11.31和4.21倍;和在成虫期均为先上调再下调的表达趋势,在24 h时上调最明显,为对照组的5.56和8.84倍(图5)。

图中数据为平均数±标准误。不同小写字母表示经Duncan新复极差方法检验在P<0.05水平差异显著
3 讨论
通过蛋白质结构分析和氨基酸序列比对发现,本试验鉴定的4个BtLyz均具有Lyz的典型特征,此结果与已知昆虫的Lyz蛋白质特征相一致[2,21-22]。本文中笔者发现Q型烟粉虱中的2个基因编码c型溶菌酶,2个基因编码i型溶菌酶。在其他昆虫中,报道了更多的溶菌酶基因,如异色瓢虫中有4个基因编码c型溶菌酶,6个基因编码i型溶菌酶[25];油菜露尾甲()中有6个基因编码c型溶菌酶,5个基因编码i型溶菌酶[26];冈比亚按蚊中有8个基因编码c型溶菌酶,2个基因编码i型溶菌酶[13];褐飞虱中有1个基因编码c型溶菌酶,7个基因编码i型溶菌酶[20]。Q型烟粉虱中是否还存在更多的其他、B型生物型烟粉虱中溶菌酶的存在情况等均需要进一步探究。
烟粉虱4个溶菌酶均含有信号肽,这种结构也在异色瓢虫[25]、冈比亚按蚊[13,22]、褐飞虱[20]等昆虫中发现,Irwin等[27]认为,溶菌酶若具有信号肽,则属于分泌型蛋白,且分子内二硫键使分子呈紧密椭球形有助于溶菌酶分泌到胞外。烟粉虱溶菌酶均具有信号肽和多个保守的半胱氨酸残基,由此推测为分泌型表达蛋白。
鉴定的4个BtLyzs与不同昆虫的Lyz在进化关系上相近。其中,BtLyz2和BtLyz3聚在c型溶菌酶一支上,与褐飞虱NlLyz-c1和异色瓢虫HaLyz-c3位于同一进化支上,说明可能来源于共同的祖先,且在先天免疫反应中执行类似的功能。NlLyz-c1和HaLyz-c3在中性介质中均携带负电荷,属于酸性酶类(pI分别为6.64和5.46),这可能使其在带负电的微生物表面便于扩散[20,25],BtLyz2和BtLyz3在中性介质中可能也携带负电荷。HaLyz-c3是异色瓢虫体内主要的溶菌酶,呈组成型表达,外源微生物对该基因的表达并没有产生明显的影响[25];NlLyz-c1在褐飞虱的5龄若虫阶段显著高水平表达,且在唾液腺中特异性表达[20]。烟粉虱和褐飞虱同属于半翅目,在功能上可能更相似,其中NlLyz-c1呈诱导型表达模式[20],这与烟粉虱被球孢白僵菌侵染时类似。BtLyz1和BtLyz4聚在i型溶菌酶一支上,BtLyz-1与豌豆长管蚜ApLyz-i1位于同一进化支上,BtLyz4与柑橘木虱DcLyz-i3和豌豆长管蚜ApLyz-i2位于同一进化支上,其中,烟粉虱、柑橘木虱和豌豆长管蚜均属于广义的半翅目害虫,说明可能来源于共同的祖先,且在先天免疫反应中执行类似的功能。
通过qRT-PCR检测发现,被球孢白僵菌侵染的烟粉虱体内,4个在不同虫态不同时间点表达量均发生变化,进一步证明了上述4个均与免疫有关的推测。不同的诱导倍数不同,表明烟粉虱的免疫应答方式不同。在褐飞虱的卵期一直处于低表达水平[20],这与烟粉虱卵期和若虫期在不同时间点的相对表达量较稳定的现象类似,推测溶菌酶在烟粉虱卵期和若虫期不发挥免疫功能。棉铃虫幼虫受球孢白僵菌感染不同时间,溶菌酶基因先上调再下调表达,在24 h时达到最高[12],这与和在若虫和成虫期的表达模式类似。受绿僵菌变种(var.)感染的沙漠蝗体内溶菌酶活性显著降低[6],甜菜夜蛾()幼虫在受真菌感染后,溶菌酶基因的表达量先下调再上调,在即将死亡时表达量达到最高[5],这与烟粉虱溶菌酶的表达方式均不同。另外,若虫期和成虫期与成虫期的相对表达量均处于先上调再下调,而后又有所上调的波动趋势,这与其他昆虫溶菌酶的表达模式不同。除和在若虫期的相对表达量变化趋势不同外,其他c型溶菌酶和i型溶菌酶的相对表达量变化趋势一致,推测c型和i型溶菌酶可能在不同的免疫通路中发挥作用。
4 结论
从烟粉虱转录组数据中鉴定了4个溶菌酶基因序列,其中2个为c型溶菌酶序列,2个为i型溶菌酶序列;与对照相比,烟粉虱被球孢白僵菌处理不同时间后,卵期的相对表达量较稳定;在若虫和成虫期,不同表现出不同的表达趋势。4个可能参与了烟粉虱对真菌侵染的免疫反应中,有可能成为烟粉虱生物防治的新靶标。
References:
[1] Fiołka M J, Ptaszyńska A A, Czarniawski W. Antibacterial and antifungal lysozyme-type activity inpupae., 2005, 90(1): 1-9.
[2] Hultmark D, Striner H, Rasmuson T, Boman H G. Insect immunity. Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of., 1980, 106(1): 7-16.
[3] Abraham E G, Nagaraju J, Salunke D M, Gupta H M, Dutta R K. Purification and partial characterization of an induced antibacterial protein in the silkworm,, 1995, 65(1): 17-24.
[4] Javar S, Mohamed R, Sajap A S, Lau W H. Expression profiles of lysozyme-and prophenoloxidase-encoding genes ina species challenged with entomopathogenic fungus,(Metchnikoff) Sorokin using qRT-PCR., 2015, 59(4): 230-236.
[5] Boucias D G, Hung S Y, Mazet I, Azbell J. Effect of the fungal pathogen,, on the lysozyme activity inlarvae., 1994, 40(5): 385-391.
[6] Gillespie J P, Burnett C, Charnley A K. The immune response of the desert locustduring mycosis of the entomopathogenic fungus,var., 2000, 46(4): 429-437.
[7] Lee-Huang S, Huang P L, Sun Y, Huang P L, Kung H F, Blithe D L, Chen H C. Lysozyme and RNases as anti-HIV components in-core preparations of human chorionic gonadotropin., 1999, 96(6): 2678-2681.
[8] Beck G, Habicht G S. Immunity and the invertebrates., 1996, 275(5): 60-66.
[9] Jollès J, Schoentgen F, Croizier G, Croizier L, Jollès P. Insect lysozymes from three species of Lepidoptera: their structural relatedness to the C (chicken) type lysozyme., 1979, 14(4): 267-271.
[10] Vogel H, Altincicek B, Glöckner G, Vilcinskas A. A comprehensive transcriptome and immune-gene repertoire of the lepidopteran model host., 2011, 12: 308.
[11] Altincicek B, Vilcinskas A. Metamorphosis and collagen- IV-fragments stimulate innate immune response in the greater wax moth,., 2006, 30(12): 1108-1118.
[12] Zhang Y, Huang J, Zhou B, Zhang C L, Liu W B, Miao X X, Huang Y P. Up-regulation of lysozyme gene expression during metamorphosis and immune challenge of the cotton bollworm,., 2009, 70(1): 18-29.
[13] Li B, Calvo E, Marinotti O, James A A, Paskewitz S M. Characterization of the c-type lysozyme gene family in., 2005, 360(2): 131-139.
[14] Tateishi K, Kasahara Y, Watanabe K, Hosokawa N, Doi H, Nakajima K, Adachi H, Nomoto A. A new cell line from the fat body of(Lepidoptera, Noctuidae) and detection of lysozyme activity release upon immune stimulation., 2015, 51(1): 15-18.
[15] Brown J K, Frohlich D R, Rosell R C. The sweetpotato or silverleaf whiteflies: biotypes ofor a species complex?, 1995, 40(1): 511-534.
[16] Faria M, Wraight S P. Biological control ofwith fungi., 2001, 20(9): 767-778.
[17] 王登杰, 吴圣勇, 雷仲仁, 王海鸿. 感染球孢白僵菌的烟粉虱若虫免疫应答转录组分析. 应用昆虫学报, 2015, 52(1): 47-55.
Wang D J, Wu S Y, Lei Z R, Wang H H. Transcriptome analysis ofnymphs infected with., 2015, 52(1): 47-55. (in Chinese)
[18] 王登杰, 臧连生, 张烨, 王海鸿, 雷仲仁. 球孢白僵菌对烟粉虱后代生命表参数的亚致死影响. 中国农业科学, 2014, 47(18): 3588-3595.
Wang D J, Zang L S, Zhang Y, Wang H H, Lei Z R. Sublethal effects ofBalsamo on life table parameters of subsequent generations ofGennadius., 2014, 47(18): 3588-3595. (in Chinese)
[19] Iketani M, Morishima I. Induction of antibacterial protein synthesis by soluble peptidoglycan in isolated fat body from larvae of the silkworm,., 1993, 23(8): 913-917.
[20] Bao Y Y, Qu L Y, Zhao D, Chen L B, Jin H Y, Xu L M, Cheng J A, Zhang C X. The genome-and transcriptome-wide analysis of innate immunity in the brown planthopper,., 2013, 14: 160.
[21] Elmogy M, Bassal T T M, Yousef H A, Dorrah M A, Mohamed A A, Duvic B. Isolation, characterization, kinetics, and enzymatic and nonenzymatic microbicidal activities of a novel c-type lysozyme from plasma of(Orthoptera: Acrididae)., 2015, 15(1): 57.
[22] Paskewitz S M, Li B, Kajla M K. Cloning and molecular characterization of two invertebrate-type lysozymes from., 2008, 17(3): 217-225.
[23] 罗晨, 姚远, 王戎疆, 阎凤鸣, 胡敦孝, 张芝利. 利用mtDNA COⅠ基因序列鉴定我国烟粉虱的生物型. 昆虫学报, 2002, 45(6): 759-763.
Luo C, Yao Y, Wang R J, Yan F M, Hu D X, Zhang Z L. The use of mitochondrial cytochrome oxidase Ⅰ (mt COⅠ) gene sequences for the identification of biotypes of(Gennadius) in China., 2002, 45(6): 759-763. (in Chinese)
[24] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod., 2001, 25: 402-408
[25] Vilcinskas A, Mukherjee K, Vogel H. Expansion of the antimicrobial peptide repertoire in the invasive ladybird.:, 2013, 280(1750): 20122113.
[26] Vogel H, Badapanda C, Knorr E, Vilcinskas A. RNA-sequencing analysis reveals abundant developmental stage-specific and immunity-related genes in the pollen beetle., 2014, 23(1): 98-112.
[27] Irwin D M, Gong Z M. Molecular evolution of vertebrate goose-type lysozyme genes., 2003, 56(2): 234-242.
(责任编辑 岳梅)
Identification and Expression Analysis on Lysozyme Gene of
YU Jie1, WANG Deng-jie2, LEI Zhong-ren1, WANG Hai-hong1
(1State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193;2Dachuan Plant Protection and Quarantine Station in Dazhou City of Sichuan Province, Dazhou 635000, Sichuan)
【Objective】The objective of this study is to provide a basis for understanding the important role of lysozyme genes ininfected by the fungus, identify lysozyme genes and analyze their sequence features, evolutionary relationships and expression pattern, and to provide a theoretical foundation for charifying innate immunity in【Method】Target genes were screened from the results of the second-generation high-throughput sequencing against the redundancy nucleotide databases when the E value <10-5. The open reading frame and amino acid sequence ofwere found using the ORF Finder software; the protein domains of BtLyzs were predicted using Pfam and SMART software; the signal peptide sequence of BtLyzs was predicted using SignalP 4.1 Server; the amino acid sequence alignment of BtLyzs was performed using the MEGA6.0 software; BtLyzs were characterized by using phylogenetic analysis with homologous genes of 31 other insects, a neighbor-joining of phylogenetic tree was constructed using the MEGA 6.0 software for further analysis and identification of the genes. The expression pattern of screened genes were determined at egg, nymph and adult stages ofwhich were infected by the fungusafter 12, 24, 36, 48, 60 h using the quantitative real-time PCR (qRT-PCR). 【Result】 Four lysozyme genes were identified and designated as,,and, which were 1 819, 1 149, 829, 928 nt, respectively. They were predicted to encode proteins of 159, 160, 148, 160 amino acids, respectively. Amino acid sequence alignment, phylogenetic analysis and protein tertiary structure prediction showed that BtLyz1 and BtLyz4 belong to i-type lysozymes, BtLyz2 and BtLyz3 belong to c-type lysozymes. BtLyz-1 formed a clade specific withof ApLyz-i1, BtLyz4 formed a clade specific withof DcLyz-i3 andof ApLyz-i2; BtLyz2 and BtLyz3 formed a clade specific withof NlLyz-c1 andofHaLyz-c3. Compared to the control, the relative expression of all four genes in egg andnymph stage underwent the fluctuation of up-regulation, down-regulation, and second up-regulation and peaked at 24 h, it was increased 4.55 folds compared to the control; the transcription ofandadult stage underwent the fluctuation of up-regulation, down-regulation, and second up-regulation and peaked at 60 h, they were increased 11.31 and 4.21 folds compared to the control. the transcription ofnymph stage underwent the fluctuation of up-regulation and down-regulation and peaked at 24 h, they were increased 5.09 and 8.31 folds compared to the control, then down-regulated obviously at 60 h, they were reduced 0.19 and 0.13 folds compared to the control. the transcription ofadult stage underwent the fluctuation of up-regulation and down-regulation and peaked at 24 h, they were increased 5.56 and 8.84 folds compared to the control. 【Conclusion】 Fourgenes were identified in. Among them, two are c-type and two are i-type lysozymes. Transcriptional levels of four BtLyzs genes inwere induced through different developmental stages and different time points in fungi-treated individuals compared to the control, they were not induced significantly in eggs, and showed different expression trends in nymphs and adults. The fourgenes probably might participated in the innate immune responses to fungus infection, and could be a new potential target for biocontrol of.
; lysozymes; bioinformatic analyses; quantitative real-time PCR
2016-02-04;接受日期:2016-04-17
国家科技支撑计划(2012BAD19B06)、国家公益性行业(农业)科研专项(201303019-02)
于洁,Tel:010-62815930;E-mail:candyyudi@163.com。王登杰,E-mail:wdj198974@163.com。于洁和王登杰为同等贡献作者。通信作者王海鸿,E-mail:wanghaihong2020@sina.com
