施氮量对不同肥力土壤氮素转化及其利用率的影响
2016-11-14杨馨逸刘小虎韩晓日
杨馨逸,刘小虎,韩晓日
施氮量对不同肥力土壤氮素转化及其利用率的影响
杨馨逸,刘小虎,韩晓日
(沈阳农业大学土地与环境学院,沈阳 110866)
【目的】评价不同施氮量下不同肥力土壤在小麦孕穗期的土壤活性氮组分(土壤矿质氮、可溶性有机氮和微生物量氮)的转化与氮肥利用率的变化。【方法】以长期(37年)定位试验下不同施肥处理土壤(贫瘠土壤-NF:长期不施肥;低肥力土壤-LF:长期施用化肥;中肥力土壤-MF:长期施用低量有机肥配施无机肥;高肥力土壤-HF:长期施用高量有机肥配施无机肥)为研究对象,通过盆栽试验,利用15N示踪法,研究添加外源硫酸铵氮肥(N0:0 kg·hm-2、N1:135 kg·hm-2、N2:180 kg·hm-2)之后,小麦生长旺盛时期(孕穗期)土壤活性氮组分在不同肥力土壤中的变化以及与土壤供氮效应之间的联系。【结果】随施氮量增加,不同肥力土壤的可溶性氮均呈先增加后降低的趋势,在N1处理最高,而各处理的土壤微生物量氮在N2达到最大,N1最低;不同肥力土壤可溶性氮变化均为高肥力土壤>中肥力土壤>低肥力土壤>贫瘠土壤,而微生物量氮变化均为高肥力土壤>中肥力土壤>贫瘠土壤>低肥力土壤(<0.05);施氮对不同肥力土壤可溶性氮和微生物量氮的影响在低肥力土壤最大,而在高肥力土壤增幅最小。不同肥力土壤供氮量、氮肥利用率以及吸氮总量和吸15N量的变化均为高肥力土壤>中肥力土壤>低肥力土壤>贫瘠土壤(<0.05),其中,吸收15N量所占小麦吸收总氮的百分比大小变化为低肥力土壤>中肥力土壤>高肥力土壤>贫瘠土壤(<0.05)。相同肥力不同处理下,土壤供氮量、氮肥利用率以及小麦吸氮量和吸15N肥料的量随施氮量的增加呈先增加后降低的趋势,均以N1处理显著高于其他处理(<0.05),总体上施氮处理下小麦吸肥料氮所占吸收总氮的百分比的平均值为44%;各肥力土壤中肥料损失量均为贫瘠土壤>低肥力土壤>中肥力土壤>高肥力土壤(<0.05),而且氮肥损失量均随施氮量的增加而增加,在N2处理最大;土壤活性氮组分与土壤供氮、氮肥利用率、小麦吸氮之间均具有显著的正相关关系(<0.05)。【结论】在高肥力土壤上添加适宜氮量(135 kg·hm-2)利于土壤中活性氮组分的转化,能更好地协调土壤供氮与作物需氮间的关系,提高氮肥利用率,减少氮素在土壤中的损失。
施氮量;不同肥力土壤;土壤矿质氮;土壤可溶性有机氮;土壤微生物量氮;氮肥利用率
0 引言
【研究意义】氮作为生命体的核心元素,是一个限制因子,它的活性组分含量以及其有效性对于土壤肥力和生产力息息相关[1]。诸多研究表明,目前人们对于氮肥的施用量是其需求的两倍,这已经严重影响到了陆地生态系统的结构与功能[2],导致氮素损失严重,并引发一系列生态环境问题[3-4],也造成土壤养分不均衡。化肥与有机肥合理配施是提高粮食产量和土壤肥力的主要措施之一[4]。因此,如何协调土壤活性氮组分的转化以及氮肥利用率值得关注。【前人研究进展】在土壤氮循环过程中,微生物起着至关重要的作用,微生物量氮既是土壤可溶性氮的库,又是可溶性氮的源[5],反之,可溶性氮也可作为微生物量氮的源和汇,同时又可以作为土壤供氮能力的估算和肥料管理的指示[6]。土壤微生物可释放部分氮素供作物吸收利用,研究表明,土壤微生物量氮含量与作物吸氮量显著相关[7],但也有研究发现,土壤微生物可能与作物对养分有着竞争,进而影响作物对氮的吸收[8]。长期有机无机配施的土壤上具有较高的土壤微生物量氮和可溶性氮等活性组分的含量[9],但也有研究发现有机肥的施用降低了土壤可溶性氮及微生物量氮的含量[10]。此外,不同施氮量对土壤微生物量的研究结果也不一致[11-12],同时也有研究表明施氮对土壤活性氮组分没有影响[13],或者降低[14],或者增加[15]。【本研究切入点】土壤可溶性氮和微生物量氮在养分的固定-释放过程中起着重要的作用,是土壤供氮最直接的表现,因此,土壤的活性氮组分可以间接反映作物的氮肥利用率,以此来衡量土壤供氮能力。但之前研究多集中在氮肥或者有机肥施入土壤后在活性氮组分的转化上面,而对协调氮肥利用率的问题则研究较少,而且在不同肥力土壤上施用不同用量氮肥后氮素在土壤的转化也鲜有报道。【拟解决的关键问题】研究施氮量对不同肥力土壤活性氮组分的转化以及氮肥利用率,以探明长期不同管理措施下在不同肥力土壤的土壤活性氮组分与作物需氮间的关系,达到提高氮肥利用率,减少氮素流失的目的。
1 材料与方法
1.1 研究区域概况
本研究供试土壤采自于沈阳农业大学棕壤肥料长期定位试验地(1979年开始定位试验)。该地处于松辽平原南部的中心地带,北纬40°48′,东经123°33′,属于温带湿润-半湿润季风气候,年降雨量为574—684 mm。年蒸发量平均为1 435.6 mm,平均气温7.0—8.1℃,10℃以上积温3 300—3 400℃,无霜期为148—180 d,全生育期130—150 d。该地区春季降雨量少,6—8月雨量充沛,是作物生长的旺季。生长季降雨量平均为547 mm,平均气温为20.7℃,适于作物生长。作物轮作方式主要为玉米-玉米-大豆。土壤为发育在第四纪黄土性母质上的简育湿润淋溶土(耕作棕壤)。其基本理化性质见表1。

表 1 37年长期不同施肥处理土壤的基本理化性质
表中数据为平均值±标准差(=3),数据后不同字母表示差异显著。下同
Values were means ± SD (=3). Values with different letters indicated statistically significantly different at<0.05 level. The same as below
1.2 试验设计
试验研究因素包括不同土壤肥力和不同施氮量两个因素,采用盆栽试验,盆钵规格为15 cm×20 cm,每盆装土5 kg,小麦供试品种为辽春18号,供试土壤为37年棕壤长期定位表层土,土壤于2015年4月30日采集,自然风干后过1 cm筛,共4种肥力土壤:贫瘠土壤(NF)、低肥力土壤(LF)、中肥力土壤(MF)和高肥力土壤(HF),每种肥力土壤上均设3个氮水平:0 kg·hm-2(N0)、135 kg·hm-2(N1)、180 kg·hm-2(N2),每个处理均施磷肥(P2O5为135 kg·hm-2)、施钾肥(K2O为135 kg·hm-2),供试氮肥为15N标记硫酸铵(丰度为10%)、磷肥为过磷酸钙、钾肥为硫酸钾。试验采用二因素随机区组设计,每个处理重复3次,小麦生长期间,每隔1—2 d灌一次水(重量法),保持到田间持水量的65%—70%。于2015年5月20日开始播种。
1.3 样品采集及方法
试验于小麦生长旺盛时期(孕穗期,2015年6月27日)采集植物样和土样,每盆所取土壤分为两份,一份鲜样保存在4℃冰箱,用于土壤可溶性物质和土壤微生物量的测定,另一份风干,用于测定土壤中15N的丰度、土壤基本理化性质等;采集的植物样粉碎过筛,用于测定植物样本中吸收的15N的丰度以及植物中的全氮。
土壤微生物量氮采用0.5 mol·L-1K2SO4浸提(水﹕土= 4﹕1)-氯仿熏蒸法[16-17],SMBN=(Nfumigated-Nunfumigated)/ kEN,其中Nfumigated表示熏蒸的全氮含量,Nunfumigated表示未熏蒸的全氮含量,kEN=0.54[17]。上述未熏蒸的浸提液经0.45 μm滤膜过滤后,滤液中的土壤可溶性总氮(STSN)用碱性过硫酸钾氧化——AA3自动分析仪法(Bran-Luebbe,Germany),滤液中NO3--N和NH4+-N含量即为土壤矿质氮,滤液中可溶性总氮与矿质氮之差即为土壤可溶性有机氮[18-19]。土壤其他项目的测定均采用常规分析方法。
植物全氮用H2SO4-H2O2消煮,半微量凯氏定氮[20];蒸馏后馏出液酸化浓缩用于15N丰度测定[21],15N丰度测定仪器用菲尼根MAT251超精度气体同位素质谱仪。
植株吸氮来自于肥料的基肥的比例(%)=(基肥处理植株15N原子百分超-15N自然丰度原子百分超)×100/肥料15N原子百分超
土壤残留来源于肥料的比例(%)=(基肥处理土壤15N原子百分超-15N自然丰度)/肥料15N原子百分超
植株吸15N量=植株全氮×植株吸收的N来源于肥料的比例
土壤供氮量=植株全氮-植株吸15N量
肥料损失量=施氮量-植株吸15N量-土壤中残留肥料氮量
氮肥利用率(%)=100×植株吸15N量/施氮量
图表中数据均为3次重复处理的平均值,用LSD进行多重比较,用Pearson进行相关分析,所有数据处理均采用SPSS Window version 19.0(SPSS Inc.,Chicago,USA)进行统计分析。
2 结果
2.1 不同施氮量对不同肥力土壤可溶性氮含量的影响
2.1.1 对土壤矿质氮含量的影响 不同施氮量的土壤矿质氮含量在贫瘠土壤、低肥力土壤、中肥力土壤和高肥力土壤的变化范围分别是26.7—101.1、69.9—115.9、178.4—252.6、231.4—303.4 mg·kg-1,总体来说,不同施氮量下矿质氮的大小变化均为高肥力土壤>中肥力土壤>低肥力土壤>贫瘠土壤,且各肥力土壤之间差异显著(<0.05),而且施氮对各肥力土壤矿质氮的增幅变化均为贫瘠土壤>低肥力土壤>中肥力土壤>高肥力土壤。与N0相比,N1对各肥力处理土壤矿质氮的增幅最大,平均为42%;随施氮量的增加,各肥力土壤矿质氮含量均在N1处理最大,且施氮(N1和N2)能显著增加土壤矿质氮含量(<0.05)(图1)。
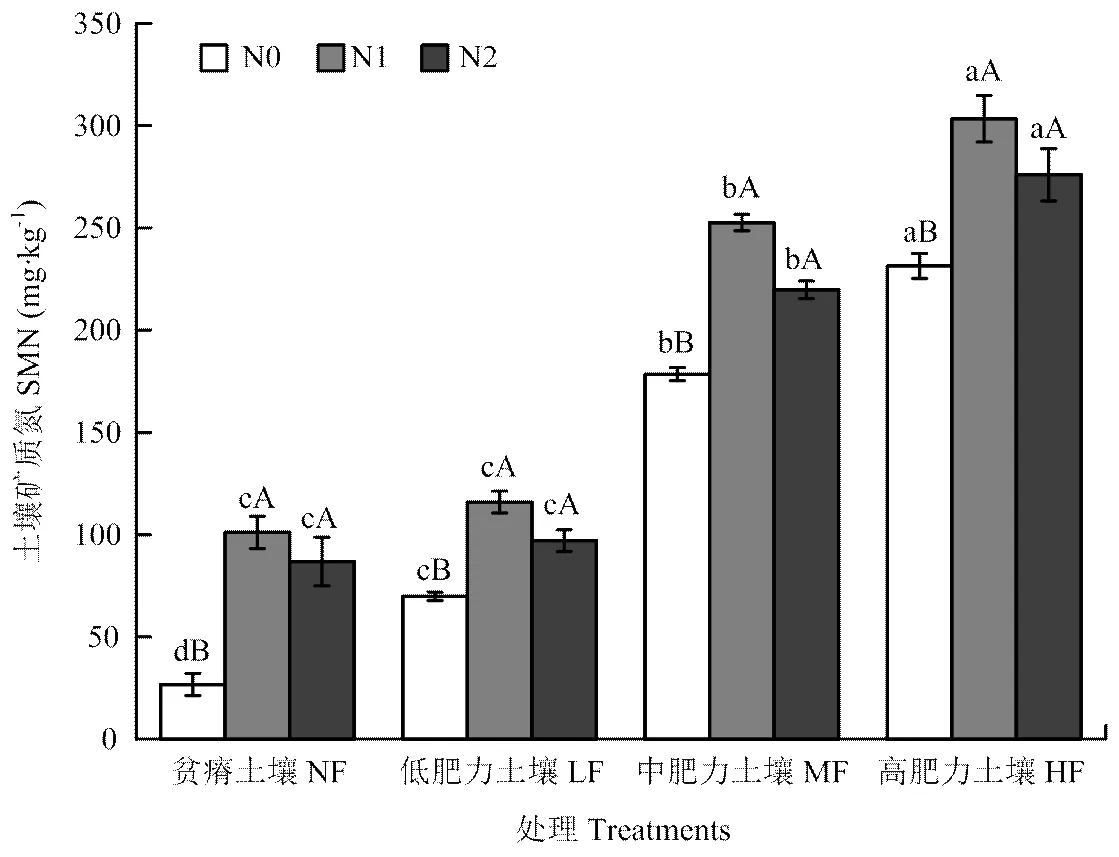
图中不同大写字母表示不同施氮量间差异显著,不同小写字母表示不同肥力土壤间差异显著。下同
2.1.2 对可溶性有机氮含量的影响 不同施氮量的土壤可溶性有机氮含量在贫瘠土壤、低肥力土壤、中肥力土壤和高肥力土壤的变化范围分别是15.4—22.3、21.3—30.6、21.3—71.4和28.1—86.5 mg·kg-1,总体来说,不同施氮量下可溶性有机氮的变化均为高肥力土壤>中肥力土壤>低肥力土壤和贫瘠土壤,且各肥力土壤间差异显著(<0.05),而且施氮对各肥力土壤可溶性有机氮的增幅变化为高肥力土壤>中肥力土壤>贫瘠土壤>低肥力土壤。与N0相比,N1对各肥力处理土壤可溶性有机氮的增幅最大,平均为60%;随施氮量的增加,各肥力土壤可溶性有机氮含量均在N1处理最大,且施氮(N1和N2)能显著增加土壤可溶性有机氮含量(<0.05)(图2)。
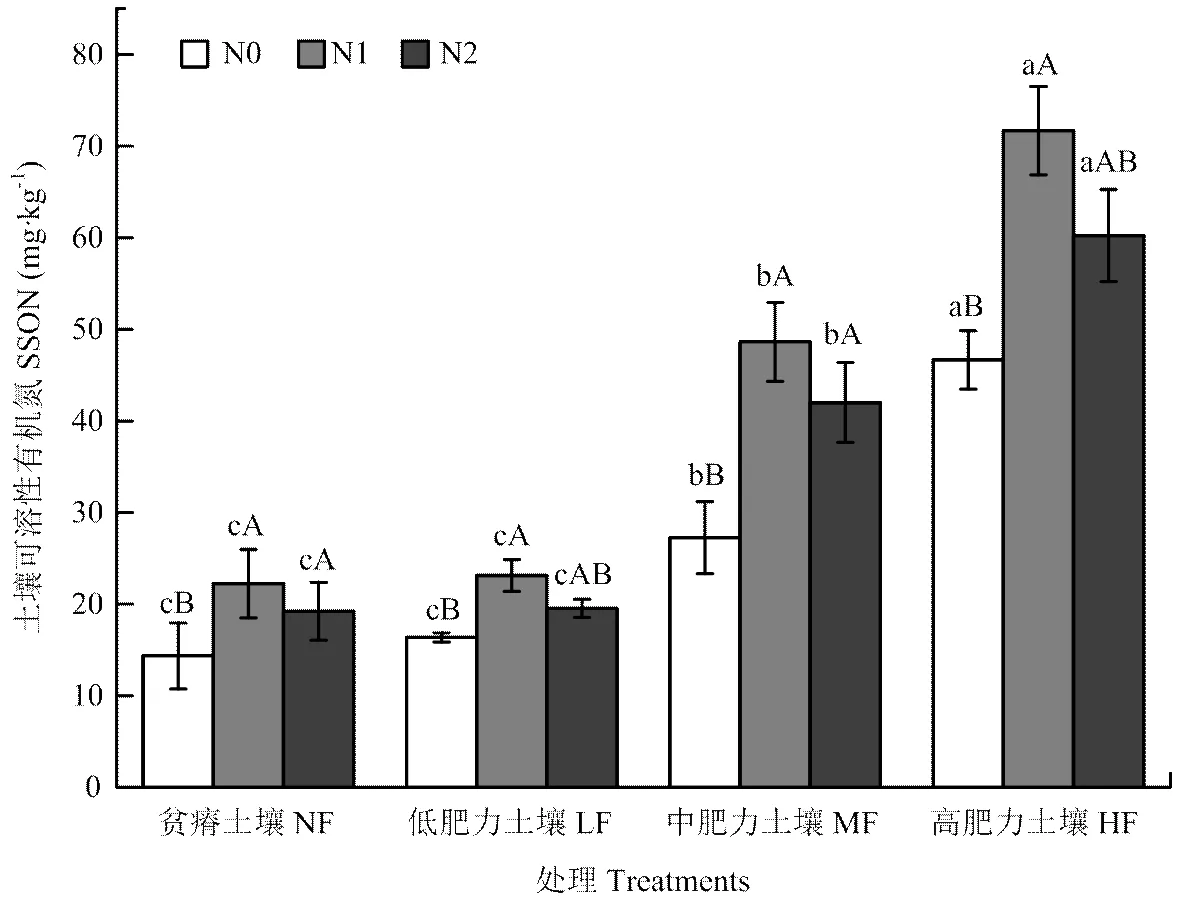
图2 施氮量对不同肥力土壤可溶性有机氮含量的影响
2.2 不同施氮量对不同肥力土壤微生物量氮含量的影响
不同施氮量的土壤微生物量氮含量在贫瘠土壤、低肥力土壤、中肥力土壤和高肥力土壤的变化范围分别为27.6—31.4、13.5—37.0、28.1—50.4和30.2—76.5 mg·kg-1,总体来说,不同施氮量下微生物量氮的变化均为高肥力土壤>中肥力土壤>贫瘠土壤>低肥力土壤,且各肥力土壤间差异显著(<0.05)。与N0相比,N1显著降低了各肥力土壤微生物量氮的含量,降低幅度为高肥力土壤>中肥力土壤>贫瘠土壤>低肥力土壤,而N2处理下微生物量氮含量只在低肥力土壤上显著增加(<0.05);随施氮量的增加,各肥力土壤微生物量氮含量均先降低后增加,总体在N1处理最小,比N0处理分别平均降低了3.8、1.2、5.3和14.6 mg·kg-1(图3)。

图3 施氮量对不同肥力土壤微生物量氮含量的影响
2.3 不同施氮量对不同肥力土壤供氮量、植株吸氮量、氮肥损失率及氮肥利用率的影响
不同施氮量下各肥力土壤供氮量均高于贫瘠土壤,为高肥力土壤>中肥力土壤>低肥力土壤,且各肥力土壤间差异显著(<0.05),各肥力土壤的土壤供氮量分别平均为27.7、62.1、52.4和38.2 mg·kg-1,以高肥力土壤为最大;相同肥力的不同施氮量下,土壤供氮量随施氮量的增加呈先增加后降低的趋势,均以N1处理显著高于其他处理(<0.05)。
不同施氮处理下各肥力土壤中小麦吸氮量以及吸15N肥料的量均为高肥力土壤>中肥力土壤>低肥力土壤>贫瘠土壤,且各肥力土壤间差异显著(<0.05),其中,吸收肥料的量所占小麦吸收总氮的百分比分大小变化为低肥力土壤>中肥力土壤>高肥力土壤>贫瘠土壤(<0.05),分别为48.7%、45.1%、42.7%和34.9%;小麦吸氮量和吸15N肥料的量以及小麦吸肥料所占吸收总氮的百分比均随施氮量的增加呈先增加后降低的趋势,在N1处理最大,总体上施氮处理下小麦吸肥料所占吸收总氮的百分比的平均值为44%。
不同施氮处理下各肥力土壤中肥料损失量均为贫瘠土壤>低肥力土壤>中肥力土壤>高肥力土壤(<0.05),各肥力土壤氮肥损失量分别平均为23.5、16.8、14.1和12.4 mg·kg-1;各肥力土壤氮肥损失量均随施氮量的增加而增加,在N2处理最大,比N1平均增加了1.8 mg·kg-1。
不同施氮量下各肥力土壤氮肥利用率的变化均为高肥力土壤>中肥力土壤>低肥力土壤>贫瘠土壤(<0.05);相同肥力的不同施氮量下,氮肥利用率随施氮量的增加呈先增加后降低的趋势,均以N1处理显著高于其他处理(<0.05)(表2)。

表2 施氮量对不同肥力土壤植株吸氮量、土壤供氮量、植株吸15N量、氮肥损失量以及氮肥利用率的影响
2.4 不同肥力土壤可溶性氮、微生物量氮跟土壤供氮、作物吸氮以及氮肥利用率之间的关系土壤可溶性氮、微生物量氮跟土壤供氮、小麦吸氮、吸15N量、氮肥损失量及氮肥利用率之间均具有显著的正相关关系(<0.01或<0.05)(表3)。

表3 不同施氮处理下土壤可溶性氮、微生物量氮与土壤供氮、小麦吸氮、吸15N量、氮肥损失量及氮肥利用率之间的相关性
**表示在0.01水平上显著相关,*表示在0.05水平上显著相关
Asterisks indicated 0.05 level significances (*<0.05) and 0.01 level significances (**<0.01)
3 讨论
3.1 不同肥力下施氮对土壤可溶性氮和微生物量氮的影响
可溶性氮是土壤有效养分中最活跃和最易被降解的组分之一。本研究中,施氮量和长期不同肥力土壤对土壤可溶性氮都有显著的影响,并且随施氮量的增加,可溶性氮呈先增加后降低的趋势(图1、图2)。本研究结果表明,施入土壤中的氮肥除被作物吸收之外,还有一部分残留在土壤中,而土壤中残留的化肥氮主要转化为未知氮和氨基酸氮,而氨基酸氮是可溶性氮的组分之一,使得施氮增加了土壤中可溶性氮的含量;此外,由于施用氮肥增加了植物通过根系归还土壤的有机物数量[22-23],进而增加土壤中有机质含量,增加了微生物活性,释放出大量可溶性氮,同时氮肥的施用也刺激了土壤中原有机质的降解[24],形成可溶性有机物。但高量氮肥(N2)显著降低了可溶性氮含量,因为高氮的输入使得有更多的硝态氮残留在土壤中,使得矿质氮总量始终高于可溶性有机氮的含量,而对作物来说铵态氮和可溶性有机氮能够优先被吸收[25],因此硝态氮的累积可能会抑制作物对氮素的吸收,降低可溶性有机氮的含量,另外,由于生物作用,化肥可能会通过非生物过程转化成有机氮[26],但过量的氮会导致土壤酸化和有机氮的溶解[27],同时高氮增加了碳的损失,特别是作物残留物没有返回到土壤中,造成地下生物量小[28],可溶性氮的来源减少。但也有研究表明氮用量的增加对地下部分生物量的影响很小[29]。
土壤微生物控制着土壤中的养分供应与转化,本研究表明随施氮量的增加,土壤微生物量氮先降低后增加(图3)。与N0相比,施氮甚至降低了土壤微生物量氮的含量。因为本试验的样本均采集于小麦生长旺盛期(孕穗期,施肥后40 d),此时期小麦急需养分,矿化作用增强,增加了对氮素的吸收;由于竞争作用,使得以供微生物同化的氮素减少[30],降低了微生物量氮的含量,Mazzarino等[31]也表明施用氮肥增加土壤微生物量氮,但是在20—40 d之内明显降低;氮添加导致土壤矿质氮含量的增加,跟土壤有机质反应造成不利于微生物生长的顽固化合物的积累[32];此外,随施氮量土壤微生物量氮与可溶性氮呈相反的变化趋势,这更加说明适量氮肥(N1)能够增加作物跟微生物的竞争,而高氮(N2)因为硝态氮的富集,降低了作物的吸收,使得微生物更易吸收低分子量有机组分[33]。
低肥力土壤、中肥力土壤和高肥力土壤的可溶性氮含量均高于贫瘠土壤(NF)处理(图1、图2),已有诸多在长期定位的研究表明,有机肥的施入能够明显提高土壤微生物量氮和可溶性氮的含量及其比例[7-8],调节土壤有效养分对作物的供给关系,这是可能由于本研究中长期施入有机肥的高肥力和中肥力土壤的理化性质要显著好于贫瘠土壤和低肥力土壤(表1),使得植物更善于吸收利用土壤中的养分。但贫瘠土壤(NF)的土壤微生物量氮含量要显著高于低肥力土壤(图3),可能是由于长期施用化肥对微生物有一定的毒害作用[34],本文中长期施用化肥的低肥力土壤中pH较低(表1),与其他肥力土壤相比,不利于土壤微生物的生存,降低了土壤微生物的群落大小,导致其在外加氮肥后固持和释放的养分含量减少。随着原土壤中有机肥施用量的增加土壤微生物量氮和可溶性氮含量均在高肥力土壤达到最大,并远大于低肥力土壤,且在长期有机肥配施无机肥土壤的中肥力土壤和高肥力土壤上提升效应更为明显(图1、图2),因为长期有机肥的输入不仅改善了土壤的理化性质[35-36],而且如表1所示本试验土壤的有机质含量,同样在长期施用有机肥的中肥力土壤和高肥力土壤上具有较大碳储量,这也为微生物提供了充足的碳源,增加了微生物的活性与周转,使得显著提高了微生物量及其分泌的可溶性有机氮的量。此外,施入的有机肥本身含一定数量的矿质氮和可溶性有机氮等活性组分[37],同时均衡施肥间接促进作物生长,增加根茬残留[38],增强微生物活性,促进其对新鲜有机物质的固定[39],这也是造成微生物量氮和可溶性氮在化肥配施有机肥处理更大的另一原因。但也有研究表明长期施用有机肥的土壤中碳储量并没有显著增加[40],因为有机肥过多同样也会抑制了作物和微生物的生长,限制养分的综合利用[41]。
综合来看,施氮对土壤可溶性氮和微生物量氮在低肥力土壤增幅较大,而在高肥力土壤上增幅较低。可能是长期施用化肥降低了土壤肥力,使得土壤养分供应较低,而氮肥可以增加作物残留碳氮的输入[42],因此作物和微生物对外源氮的吸收较多。长期高量有机肥配施化肥极好地改善了土壤肥力,矿化能力较高,土壤养分供应充足,作物和微生物首先从土壤中吸收养分,同时在富含有机质的土壤中,额外添加氮肥会造成潜在氮饱和,从而降低酶活性[43],影响有机质的矿化与微生物活性。
3.2 不同肥力土壤可溶性氮和微生物量氮与土壤供氮效应的关系
本研究表明,各肥力土壤供氮量和氮肥利用率均在贫瘠土壤(NF)最小,高肥力土壤最大(>0.05)。这是因为有机肥的长期施用,较好地改善了土壤肥力,显著增加了土壤有效养分的含量以及生物活性有关[44],尤其是长期施入高量有机肥的高肥力土壤上的有效养分显著高于其他肥力的土壤(表1),Abbasi等[45]也表明氮肥与有机肥配施下氮的有效性更高,而且有机肥的长期施入还改善了土壤磷素和钾素等的含量[35],使土壤养分供应更合理更均衡,这也是长期有机肥配施无机肥土壤供氮和氮肥利用率较高的另一原因。
小麦吸收外加氮肥的量所占小麦吸收总氮的百分比大小变化为低肥力土壤>中肥力土壤>高肥力土壤>贫瘠土壤,而肥料损失量却与之相反(表2)。可见在低肥力土壤中,作物吸收的养分主要来源于外加氮源,因为长期施用化肥造成土壤肥力较低,有机质矿化作用较低,养分释放比较缓慢;而在土壤结构以及土壤肥力较好的有机肥配施化肥处理下,作物吸收的养分主要来源于土壤,因此外加氮源有可能会造成养分损失。而贫瘠土壤由于土壤肥力较低,养分供应不均衡,而且较差的土壤结构使得氮素的生物和非生物固持能力较差,氨化作用比较强烈,大量的氮素挥发,对作物和微生物吸收养分产生了限制,因此在孕穗期平均有84.16%的标记氮肥损失。有研究表明,氮素损失主要发生在氮肥施入后的十几天之内[46],因此在这个前提之下,假设本试验中的氮素损失大部分发生在孕穗期以前,由此说明长期有机肥配施无机肥的土壤显著提高了作物孕穗期以前土壤对氮素固持,减少了养分的损失,以供作物的生长旺盛时期需要。
从施氮量方面看,土壤供氮量和氮肥利用率均在N1处理最大值,在N2却显著降低,同时其肥料损失率也最大(表2)。总体上施氮处理下小麦吸肥料所占吸收总氮的平均值为44%,之前在一个7年的长期试验研究表明小麦吸收来源于肥料中的氮为30%—57%[47]。孕穗期的小麦处在生长旺盛期,需要大量的氮素,不仅吸收来自于外加的氮肥,同时也吸收了大量的土壤中的氮,而此时随施氮量土壤可溶性氮的含量与微生物量氮含量变化相反,表明适量氮肥(N1)的施用增加了微生物量氮向可溶性氮的转化,从而为作物提供了充足的氮源,以供作物利用,但过量施氮则会造成肥料的损失,增加微生物与作物的竞争性,而且高量氮肥的施用会超出作物的需求导致氮饱和,从而限制作物的进一步生长[48]。
此外,本研究也表明土壤可溶性氮和微生物量氮与土壤供氮以及氮肥利用率有着显著的相关关系(<0.05),说明土壤中的活性氮组分跟作物对养分的吸收密切相关,能够间接反映土壤的肥力与效力,特别的是,肥料损失量跟各土壤活性氮组分之间呈正相关关系,说明氮肥利用率增加的同时也刺激了土壤中的养分循环,如氨挥发、硝化与反硝化作用也加强,潜在地增加了养分的损失。总的来说,长期有机无机配施的中、高肥力土壤上增施适量的氮肥不仅可以增加植物吸收氮肥的能力,提高了氮肥利用率,还对土壤中的原有机质有激发作用,从而释放出更多的有效养分,供作物吸收利用,进而使土壤供氮与作物需氮相一致。
4 结论
高肥力土壤的土壤供氮量、氮肥利用率以及土壤活性氮组分的含量都更高。低肥力土壤的土壤微生物量氮含量最低,而贫瘠土壤的可溶性氮含量最低,并且肥料损失率也最高;随施氮量的增加土壤可溶性氮呈先增加后降低的趋势,而微生物量氮则与之相反,并且土壤供氮量和氮肥利用率在适量(N1)施氮下更高,而在高氮(N2)下肥料损失量最高;额外添加氮肥,对低肥力土壤的土壤活性氮组分含量的增幅最大,而对高肥力土壤增幅最低,说明在具有良好土壤结构的土壤中添加外源氮,不利于养分的保持,会降低肥料氮利用率,有可能会造成养分损失;此外,土壤活性氮组分和土壤供氮以及氮肥利用率之间有着显著的相关关系,说明高肥力土壤中施入氮肥后,氮素更易于向活性氮组分转化以及活性氮组分之间的互相转化,以便植物吸收利用。因此,在高肥力土壤上适量施氮,利于作物在生长旺盛期吸收土壤中和肥料中的氮素,减少养分损失,协调了土壤供氮状况与作物需氮之间的矛盾。
References:
[1] Knicker H. Soil organic n-an under-rated player for c sequestration in soils?, 2011, 43(6): 1118-1129.
[2] Galloway J N, Townsend A R, Erisman J W, Bekunda M, Cai Z, Freney J R, Martinelli L A, Seitzinger S P, Sutton M A. Transformation of the nitrogen cycle: Recent trends, questions, and potential solutions., 2008, 320(5878): 889-892.
[3] Lei B, Xu Y, Tang Y, Hauptfleisch K. Shifts in carbon stocks through soil profiles following management change in intensive agricultural systems., 2015, 6(3): 304-314.
[4] Willekens K, Vandecasteele B, Buchan D, Neve S D. Soil quality is positively affected by reduced tillage and compost in an intensive vegetable cropping system., 2014, 82(7): 61-71.
[5] Iyyemperumal K, Israel D W, Shi W. Soil microbial biomass, activity and potential nitrogen mineralization in a pasture: Impact of stock camping activity., 2007, 39(1): 149-157.
[6] Sharifi M, Zebarth B, Burton D, Grant C, Cooper J. Evaluation of some indices of potentially mineralizable nitrogen in soil., 2007, 71(4): 1233-1239.
[7] Zhou J, Li S, Chen Z. Soil microbial biomass nitrogen and its relationship to uptake of nitrogen by plants., 2002, 12(3): 251-256.
[8] Singh S, Ghoshal N, Singh K. Synchronizing nitrogen availability through application of organic inputs of varying resource quality in a tropical dryland agroecosystem., 2007, 36(2/3): 164-175.
[9] Liang B, Yang X, He X, Zhou J. Effects of 17-year fertilization on soil microbial biomass c and n and soluble organic c and n in loessial soil during maize growth., 2011, 47(2): 121-128.
[10] Yao H, Jiao X, Wu F. Effects of continuous cucumber cropping and alternative rotations under protected cultivation on soil microbial community diversity., 2006, 284(1): 195-203.
[11] Geisseler D, Scow K M. Long-term effects of mineral fertilizers on soil microorganisms – a review., 2014, 75: 54-63.
[12] Kallenbach C, Grandy A S. Controls over soil microbial biomass responses to carbon amendments in agricultural systems: A meta-analysis., 2011, 144(1): 241-252.
[13] Rochette P, Gregorich E. Dynamics of soil microbial biomass c, soluble organic c and co2evolution after three years of manure application., 1998, 78(2): 283-290.
[14] Chantigny M H, Angers D A, Prévost D, Simard R R, Chalifour F P. Dynamics of soluble organic c and c mineralization in cultivated soils with varying n fertilization., 1999, 31(4): 543-550.
[15] 段鹏鹏, 丛耀辉, 徐文静, 张玉玲, 虞娜, 张玉龙. 氮肥与有机肥配施对设施土壤可溶性氮动态变化的影响.中国农业科学, 2015, 48(23): 4717-4727.
Duan P P, Cong Y H, Xu W J, Zhang Y L, Yu N, Zhang Y L. Effect of combined application of nitrogen fertilizer and manure on the dynamic of soil soluble N in greenhouse cultivation., 2015, 48(23): 4717-4727. (in chinese)
[16] Brookes P C, Landman A, Pruden G, Jenkinson D. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil., 1985, 17(6): 837-842.
[17] Vance E, Brookes P, Jenkinson D. An extraction method for measuring soil microbial biomass c., 1987, 19(6): 703-707.
[18] Cabrera M, Beare M. Alkaline persulfate oxidation for determining total nitrogen in microbial biomass extracts., 1993, 57(4): 1007-1012.
[19] Norman R J, Edberg J C, Stucki J W. Determination of nitrate in soil extracts by dual-wavelength ultraviolet spectrophotometry., 1985, 49(5): 1182-1185.
[20] Patra D D, Bhandari S C, Misra A. Effect of plant residues on the size of microbial biomass and nitrogen mineralization in soil: Incorporation of cowpea and wheat straw., 1992, 38(1): 1-6.
[21] Paul J, Beauchamp E. Short communication: Soil microbial biomass c, n mineralization, and n uptake by corn in dairy cattle slurry-and urea-amended soils., 1996, 76(4): 469-472.
[22] Lemke R L, Vandenbygaart A J, Campbell C A, Lafond G P, Grant B. Crop residue removal and fertilizer n: Effects on soil organic carbon in a long-term crop rotation experiment on a udic boroll., 2010, 135(1/2): 42-51.
[23] Russell A E, Cambardella C A, Laird D A, Dan B, Jaynes, Meek D W. Nitrogen fertilizer effects on soil carbon balances in midwestern u.S. agricultural systems., 2009, 19(5): 1102-1113.
[24] Gärdenäs A I, Ågren G I, Bird J A, Clarholm M, Hallin S, Ineson P, Kätterer T, Knicker H, Nilsson S I, Näsholm T. Knowledge gaps in soil carbon and nitrogen interactions – from molecular to global scale., 2011, 43(4): 702-717.
[25] Gioseffi E, Neergaard A d, Schjørring J K. Interactions between uptake of amino acids and inorganic nitrogen in wheat plants., 2012, 9(4): 1509-1518.
[26] Huygens D, Boeckx P, Templer P, Paulino L, Van Cleemput O, Oyarzún C, Müller C, Godoy R. Mechanisms for retention of bioavailable nitrogen in volcanic rainforest soils., 2008, 1(8): 543-548.
[27] Song H, Guo J, Ren T, Chen Q, Li B, Wang J. Increase of soil ph in a solar greenhouse vegetable production system., 2012, 76(6): 2074-2082.
[28] Hamer U, Potthast K, Makeschin F. Urea fertilisation affected soil organic matter dynamics and microbial community structure in pasture soils of southern ecuador., 2009, 43(2): 226-233.
[29] Lu M, Yang Y, Luo Y, Fang C, Zhou X, Chen J, Yang X, Li B. Responses of ecosystem nitrogen cycle to nitrogen addition: A meta-analysis., 2011, 189(4): 1040-1050.
[30] Babujia L C, Hungria M, Franchini J C, Brookes P C. Microbial biomass and activity at various soil depths in a brazilian oxisol after two decades of no-tillage and conventional tillage., 2010, 42(12): 2174-2181.
[31] Mazzarino M, Szott L, Jimenez M. Dynamics of soil total c and n, microbial biomass, and water-soluble c in tropical agroecosystems., 1993, 25(2): 205-214.
[32] Janssens I, Dieleman W, Luyssaert S, Subke J A, Reichstein M, Ceulemans R, Ciais P, Dolman A J, Grace J, Matteucci G. Reduction of forest soil respiration in response to nitrogen deposition., 2010, 3(5): 315-322.
[33] Christou M, Avramides E J, Roberts J P, Jones D L. Dissolved organic nitrogen in contrasting agricultural ecosystems., 2005, 37(8): 1560-1563.
[34] Hopkins D W, Shiel R S. Size and activity of soil microbial communities in long-term experimental grassland plots treated with manure and inorganic fertilizers., 1996, 22(1): 66-70.
[35] Diacono M, Montemurro F. Long-term effects of organic amendments on soil fertility. A review., 2010, 30(2): 401-422.
[36] Sradnick A, Murugan R, Oltmanns M, Raupp J, Joergensen R G. Changes in functional diversity of the soil microbial community in a heterogeneous sandy soil after long-term fertilization with cattle manure and mineral fertilizer., 2013, 63: 23-28.
[37] Khalili B, Nourbakhsh F. Vertical distribution of soluble organic nitrogen, nitrogen mineralization, nitrification, and amidohydrolase activities in a manure-treated soil., 2012, 175(2): 265-272.
[38] Kanchikerimath M, Singh D. Soil organic matter and biological properties after 26 years of maize–wheat–cowpea cropping as affected by manure and fertilization in a cambisol in semiarid region of india., 2001, 86(2): 155-162.
[39] Pan G, Zhou P, Li Z, Smith P, Li L, Qiu D, Zhang X, Xu X, Shen S, Chen X. Combined inorganic/organic fertilization enhances n efficiency and increases rice productivity through organic carbon accumulation in a rice paddy from the tai lake region, china., 2009, 131(3/4): 274-280.
[40] Six J, Conant R, Paul E A, Paustian K. Stabilization mechanisms of soil organic matter: Implications for c-saturation of soils., 2002, 241(2): 155-176.
[41] Gu Y, Zhang X, Tu S, Lindström K. Soil microbial biomass, crop yields, and bacterial community structure as affected by long-term fertilizer treatments under wheat-rice cropping., 2009, 45(3): 239-246.
[42] Malhi S, Nyborg M, Solberg E, McConkey B, Dyck M, Puurveen D. Long-term straw management and n fertilizer rate effects on quantity and quality of organic c and n and some chemical properties in two contrasting soils in western canada., 2011, 47(7): 785-800.
[43] DeForest J L, Zak D R, Pregitzer K S, Burton A J. Atmospheric nitrate deposition, microbial community composition, and enzyme activity in northern hardwood forests., 2004, 68(1): 132-138.
[44] Duong T T, Verma S L, Penfold C, Marschner P. Nutrient release from composts into the surrounding soil., 2013, 195/196: 42-47.
[45] Abbasi M K, Khizar A. Microbial biomass carbon and nitrogen transformations in a loam soil amended with organic-inorganic n sources and their effect on growth and n-uptake in maize., 2012, 39: 123-132.
[46] Cai G X, Chen D L, Ding H, Pacholski A, Fan X H, Zhu Z L. Nitrogen losses from fertilizers applied to maize, wheat and rice in the north china plain., 2002, 63(2): 187-195.
[47] Malhi S, Soon Y, Brandt S. Effect of growing season rainfall and tillage on the uptake and recovery of 15n-labelled urea fertilizer by spring wheat in a semi-arid environment., 2009, 89(4): 403-411.
[48] Aber J, McDowell W, Nadelhoffer K, Magill A, Berntson G, Kamakea M, McNulty S, Currie W, Rustad L, Fernandez I. Nitrogen saturation in temperate forest ecosystems., 1998, 48(11): 921-934.
(责任编辑 杨鑫浩,岳梅)
Effect of Nitrogen Application Rates in Different Fertility Soils on Soil N Transformations and N Use Efficiency Under Different Fertilization Managements
YANG Xin-yi,LIU Xiao-hu, HAN Xiao-ri
(College of Land and Environmental Science, Shenyang Agricultural University, Shenyang 110866)
【Objective】 The objective of this study is to research the effect of different nitrogen (N) application rates on soil labile N pools transformations (soil mineral N-SMN; soil soluble N-SSON; soil microbial biomass N-SMBN) and N use efficiency in soils after application of N fertilizer at wheat (L.) booting stage. 【Method】 A pot experiment with15N isotopic tracer technique was conducted to study the soil labile N pools and the effect of supply N in different fertilization managements for 37 years (poor soil-NF: no application of fertilizer; low fertility soil-LF: inorganic fertilizer; moderate fertility soil-MF: low rate of organic fertilizer with inorganic fertilizer; high fertility soil-HF: high rate of organic fertilizer with inorganic fertilizer) after application of three different application rates of N (N0: 0 kg·hm-2, N1: 135 kg·hm-2, N2: 180 kg·hm-2) in soil and their relationships. 【Result】 SMN and SSON were the highest in the N1 treatment and then decreased with the application rate of N, but SMBN performed opposite tendency with the application rate of N, they werefirstly decreased and then increased, and the highest in the N2 treatment.In the same application rate of N, SMN and SSON generally decreased in the order: high fertility soil>moderate fertility soil>low fertility soil>poor soil, while SMBNgenerally decreased in the order: high fertility soil>moderate fertility soil>poor soil>low fertility soil (<0.05). The increased amplitude of SMN, SSON and SMBN after addition of N into soils with different fertilities were the highest in the low fertility soil treatments, and were the lowest in the high fertility soil treatments. The soil N supply, NUE, N uptake by wheat and assimilated15N-labeled fertilizer generally decreased in the order: high fertility soil>moderate fertility soil>low fertility soil>poor soil (<0.05), respectively. The percentage of N from ammonium sulfate fertilizer by wheat to total N uptake by wheat generally decreased in the order: low fertility soil>moderate fertility soil>high fertility soil>poor soil (<0.05). In the same soil fertility, the soil N supply, NUE, N uptake by wheat and assimilated15N-labeled fertilizer were firstly decreased and then increased with the application rate of N, and were the highest in the N1 treatment (<0.05), as a whole, N from ammonium sulfate fertilizer by wheat/total N uptake ratio averaged 44%; meanwhile, the loss of15N-labeled fertilizer generally decreased in the order: poor soil>low fertility soil>moderate fertility soil>high fertility soil (<0.05). Furthermore, significant positive relationships were found between soil labile N pools and the soil N supply, NUE, N uptake by wheat and assimilated15N-labeled fertilizer (<0.05). 【Conclusion】 In this experiment, appropriate application rate of N fertilizer (N3, 135 kg·hm-2) in high fertility soil is beneficial to soil labile N pools transformations and has a high ability to synchronize the relationship between soil N supply and N requirements of crops, and increased the NUE, decreased the loss of fertilizer, so it may be an effective strategy for maintaining long-term soil fertility.
application rate of N; different fertility soils; soil mineral N; soil soluble organic N; soil microbial biomass N; N use efficiency
2016-03-01;接受日期:2016-04-29
国家自然科学基金(31471940)、国家现代农业产业技术体系水稻产业辽宁创新团队建设(辽农科[2013]271号)
杨馨逸,E-mail:15802414046@163.com。通信作者刘小虎,E-mail:liuxiaohu-mail@163.com。通信作者韩晓日,E-mail:hxr@syau.edu.cn
