西部散养肉牛病毒性腹泻病毒流行及遗传变异
2016-11-14范学政朱元源邹兴启张乾义赵启祖
陈 锐,范学政,朱元源,邹兴启,徐 璐,张乾义,王 琴,赵启祖
西部散养肉牛病毒性腹泻病毒流行及遗传变异
陈 锐,范学政,朱元源,邹兴启,徐 璐,张乾义,王 琴,赵启祖
(中国兽医药品监察所,北京100081)
【目的】牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)是一种可导致养牛业出现重大经济损失的常见病原体。该文以中国西部散养肉牛为研究对象,拟通过血清学方法和生物信息分析,评估BVDV在中国散养肉牛中的整体流行状况,探究国内流行的BVDV基因多样性,为制定针对BVDV的合理防控措施和疫苗的研发提供理论依据与素材。【方法】2014—2015年分别从云南、新疆、甘肃和内蒙古4省(区)采集散养肉牛的血清样本共1 332份,利用BVDV抗体检测试剂盒进行检测,统计不同地区散养肉牛BVDV抗体阳性率。将抗体阴性的血清样本进行BVDV抗原检测,抗原阳性或可疑血清接种MDBK细胞,连续盲传五代分离病毒。根据BVDV 5'-UTR保守序列设计引物,经RT-PCR扩增5'-UTR序列并测序。利用Sequencher4.2、BLAST、ClustalX、MEGA5.2等软件对序列进行生物信息学分析,绘制流行毒株系统进化树,确定分离毒株的基因型。【结果】4省(区)散养肉牛BVDV整体抗体阳性率为33.93%。血清抗体阳性率从高到低依次为内蒙71.43%,新疆57.69%,甘肃第16.54%,云南10.0%。BVDV抗原整体阳性率为1.58%,新疆抗原阳性率最高。研究共分离13株BVDV流行毒株,分别命名为甘肃120、内蒙1369、伊犁霍清12953、伊犁霍清12960、伊犁霍清12981、博州精河13001、博州精河13023、博州精河13033、新疆奇台13041、新疆奇台13042、新疆奇台13191、新疆奇台13220、新疆奇台13251。进化树分析显示新疆地区散养肉牛中流行的主要是BVDV-1q和BVDV-1f,内蒙地区流行的主要是BVDV-1m,甘肃地区流行的是一种新的基因亚型BVDV-1u。【结论】通过血清学方法检测发现,虽然4个省(市、自治区)散养肉牛整体抗体阳性率低于国内平均水平,但情况却不尽相同。内蒙古和新疆抗体高阳性率表明BVDV在这些地区散养肉牛中已经广泛流行,必须采取适当措施将其危害性降到最低。从基于5'-UTR序列绘制的系统进化树可以看出,不同地区散养肉牛感染的BVDV基因亚型有所不同。总体看来,BVDV在散养肉牛中的分布呈现多样性,跨物种、跨地域传播和高突变性等特点,这些都使疫苗免疫策略面临严峻的挑战。研究通过对各地区散养肉牛的随机大量采样、检测和分析,客观评价BVDV在散养肉牛中的流行情况,为更好的制定预防策略提供参考依据。
BVDV;散养肉牛;ELISA;阳性率;基因分型
0 引言
【研究意义】牛病毒性腹泻病(BVD)是危害养牛业的重大经济性疾病之一,在世界各国普遍流行[1]。感染牛通常表现为发热、不同程度的腹泻、免疫抑制或白细胞减少并时常伴有继发感染,母畜妊娠期间感染甚至会流产或产下病毒血症牛(即持续性感染牛,PI牛),因此会对牛的生产性能和繁殖性能造成严重影响。近几年来,随着中国社会经济的快速发展,居民生活质量的不断提高,肉牛产业进入了快速发展的阶段。虽然肉牛养殖规模化程度在不断提升,但是散养户及小规模养牛户仍是目前国内肉牛养殖业的主体。据报道[2-3],中国西北地区的甘肃、新疆,北部的内蒙古以及南部的云南肉牛的存栏量位居全国前列,其经济收益也在当地居民总收入中占重要比例。随着重大动物疫病的逐步控制,这些慢性消耗性疫病对养殖业的影响逐渐显现,为了有效预防控制BVDV,需要对其流行状况进行调研。【前人研究进展】牛病毒腹泻性病毒(BVDV)是由囊膜包被的核衣壳及核酸组成,是黄病毒科瘟病毒属的代表种[4],于1954年在细胞培养物中首次被分离并命名。根据病毒对培养细胞有无致病变性,可以将BVDV分为致细胞病变型(CP)和非致细胞病变型(NCP)两个生物型。同时,基于5′-UTR、Npro或E2基因的部分序列,可将BVDV分为BVDV-1和BVDV-2两个基因型。一些研究发现不同基因型BVDV病毒能够产生交叉保护力[5-7],但也有一些研究论证了BVDV基因型与分离毒株间只存在部分交叉免疫保护[8]。到目前为止,至少发现了17种BVDV-1(1a—1t)[9-12]亚型和4种BVDV-2(2a—2d)[13-14]亚型。国内报道主要流行的是BVDV-1b,BVDV-1m,BVDV-1q[15]。【本研究切入点】由于散养肉牛分布不集中、流动快、混群饲养等原因,有关中国散养肉牛中BVD流行状况和流行毒株的报道寥寥无几。2014—2015年,对云南、新疆、甘肃和内蒙古4省(区)健康散养肉牛流行性腹泻病进行监测,共采集血清样本1 332份。【拟解决的关键问题】本研究首次以不同地区散养肉牛为调查对象,拟通过血清学检测方法对新疆、甘肃、内蒙和云南4个地区散养肉牛中BVD的流行情况进行摸底,大致掌握这些地区散养肉牛BVDV感染状况,为评估全国散养肉牛BVDV感染水平以及制定合理的预防程序提供理论依据。同时,对分离病毒进行基因分型,来帮助阐明不同毒株间的遗传演化关系,追溯病毒传播来源和预测预报病毒的流行趋势,从而为BVDV疫苗的研制积累素材。
1 材料与方法
试验于2014年至2015年6月在中国兽医药品监察所检测技术研究室实验室完成。
1.1 样品收集与保存
2014—2015年从中国云南、新疆、甘肃和内蒙古4省(区)采集多批散养肉牛血液,共收集1 332份血清样本(表1)。其中云南样品主要来自保山瓦马、保山旧城和大理云龙;新疆样品采集于伊犁霍清、奇台和博州精河;甘肃样品来自河西走廊地区;内蒙古样品来自锡盟草原。血液样本4 000 r/min离心15 min,取上清于灭菌的1.5 mL离心管中,-20℃保存备用。

表1 4个省(区)采集的健康散养肉牛血液样品
1.2 BVDV抗体和抗原ELISA检测
利用商品化BVDV抗体检测试剂盒(IDEXX,99-44000)对每批血清样本进行检测,计算 S/P值,算出样本阳性率。S/P值小于0.20的被检样品判定为BVDV抗体阴性,S/P值大于或等于0.20但小于0.30的被检样品判定为BVDV抗体可疑,S/P值大于或等于0.30的被检样品,判定为BVDV抗体阳性。
研究已经证明了抗体阳性率与抗原阳性率之间是负相关的关系[15],血清抗体水平高的样品,抗原检测均为阴性,血清抗体阴性或可疑的样品,抗体检测为阳性居多,研究中进一步证明了这一点。本研究选择了S/P≤0.6的阳性血清以及抗体阴性的血清样本进行BVDV抗原检测(IDEXX,99-43830)。
1.3 病毒分离
将0.5 mL BVDV阳性或可疑血清样本接种单层MDBK细胞,37℃吸附1 h后弃去,加入5 mL 2%FBS 的MEM维持液(含100 IU·mL-1青霉素,100 μg·mL-1链霉素)在5%CO2培养箱中继续培养3 d。反复冻融3次,收获病毒上清液。连续盲传5代,利用IDEXX抗原检测试剂盒鉴定是否分离到病毒。
1.4 RT-PCR
1.4.1 对抗原阳性的细胞培养液抽提病毒基因组总RNA(QIAGEN,74104)。
1.4.2 利用SuperScript@III反转录试剂盒(invitrogen,18080-044)进行反转录(RT)获得病毒cDNA。
1.4.3 基于BVDV 5'UTR设计分型引物[14],上游引物:5′-CATGCCCATAGTAGGAC;下游引物:5′-CCA TGTGCCATGTACAG。
1.4.4 聚合酶链式反应。PCR反应体系50 μL:cDNA模板2 μL,上、下游引物各2.5 μL, PrimeSTAR @Max DNA Polymerase(2×)25 μL,灭菌蒸馏水18 μL。
PCR反应条件:98℃变性10 s,55℃退火10 s,72℃延伸20 s,30个循环,72℃延伸10 min。反应结束后加入10 μL 6×Loading Buffer,然后将PCR产物在0.8%琼脂糖凝胶中(5%Goldview核酸染料),120 V电压电泳30 min,然后在凝胶成像系统中观察结果并拍照保存,回收280 bp左右片段,胶回收纯化。
1.5 测序
将纯化的PCR产物采用正反双向测序,利用Sequencher 4.2分析软件进行比对分析,获得不同分离毒株的5′-UTR序列。
1.6 构建系统进化树
利用Clustal X生物信息软件对序列进行同源性分析,然后通过Mega5.0构建系统进化树,分析分离病毒的遗传演化关系。
2 结果
2.1 血清抗体阳性率
从4个省(区)采集血清样本共1 332份,其中抗体阳性血清共452份,可疑样本10份,阳性率为33.93%。但不同省(区)血清的BVDV抗体阳性率存在较大差异,其中云南仅为10%,而内蒙古高达71.43%(表2)。

表2 4个省(区)散养肉牛BVDV Ab阳性率
2.2 血清抗原阳性率
对4个省(区)筛选后的血清样本进行抗原检测,共检出21份抗原阳性血清,17份可疑血清,阳性率为1.58%。其中,新疆血清阳性率最高(表3)。
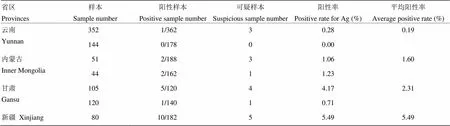
表3 不同省区散养肉牛BVDV Ag阳性率
2.3 病毒分离
将21份抗原阳性血清和17份可疑血清分别接种单层MDBK细胞后,连续盲传5代。收获后通过IDEXX抗原检测试剂盒进行检测。阳性样本进行RT-PCR,送测序。其中,11份新疆血清、1份内蒙血清和1份甘肃血清分离得到病毒,并测序成功。许多抗原阳性样本病毒分离不成功的原因可能是在运输和储存过程中血清被污染导致病毒降解,以致传代过程中病毒丢失。
2.4 构建系统发育树
BVDV 5'UTR包含保守序列和高变序列,可以作为BVDV基因分型的依据[15]。从基于5'UTR序列构建的系统进化树(图1)可以看出,所有分离毒株均为BVDV-1型。其中,新疆地区散养肉牛中主要流行BVDV-1q(8/11,77.78%)和BVDV-1f(3/11,22.22%)。内蒙地区流行的毒株为BVDV-1m。甘肃地区流行的毒株是一种新的亚型BVDV-1u,该亚型目前还没得到权威认可,但中国已于2012年、2013年[15]在多个省(市、区)多个物种中分离到此毒株。所有这些分离毒株的同源性达81%—99%。另外,临床分离的1q、1f、1m和1u与其参考序列的同源性分别为94%—97%、93%—94%、94%—99%和95%—96%。
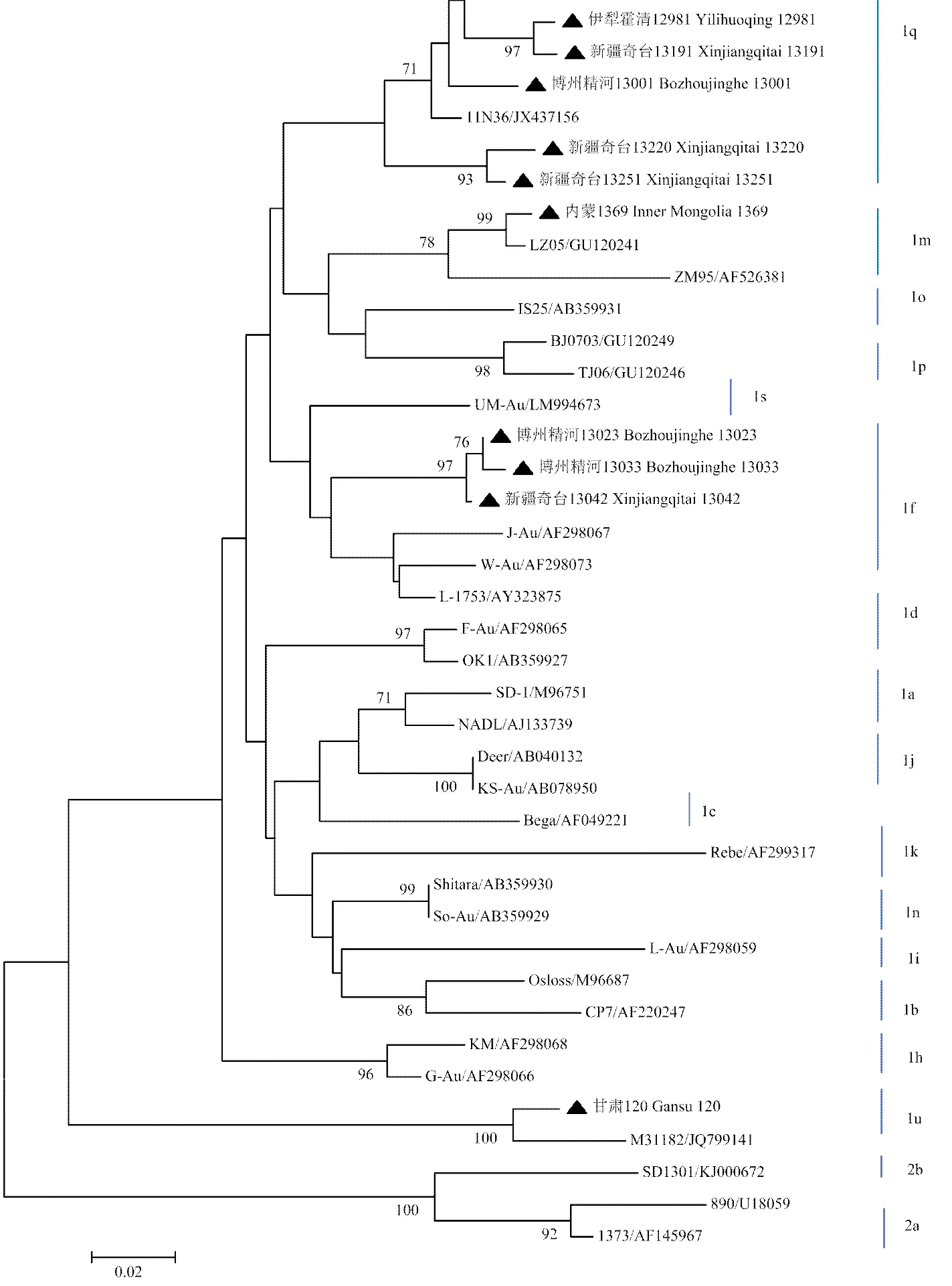
图1 基于5′UTR序列(288 bp)利用邻位法构建的遗传进化树
3 讨论
从整体血清BVDV抗体阳性率来看,33.93%与DENG等[15]对中国奶牛、肉牛、牦牛和水牛4个不同品种牛调查的58.09%(801/1379,2015年)结果偏低。一方面是由于样本采集对象和采集时间有差异,另一方面是样本采集区域的不重叠性(其报道的河南、辽宁和江苏的阳性率均达到80%以上)。此外,王淑娟等[16]对新疆等11个省(市)的奶牛场血清学调查显示BVDV抗体总阳性率达69.1%,明显高于本研究中散养肉牛的33.93%,这表明散养肉牛整体BVDV感染水平较规模化奶牛场较轻。但是,王文等[17]通过对采自新疆10个地区大型牛场和散养户牛群血清进行BVDV 抗体检测,结果显示这些地区牛群中都不同程度的存在BVDV的感染,最高阳性率达100%,最低阳性率为55%,平均阳性率为86.7%,而本调查中新疆地区散养肉牛56.79%的阳性率也在本范围中。内蒙古作为中国四大牧区之一,是奶制品重要的输出地,奶牛饲养量在全国居于首列。同时,内蒙与多个省(市)毗邻,动物跨省交易频繁,这些都为BVDV的传播创造了条件。2013年,童钦等[18]对6个集约化奶牛场的509份血清进行了BVDV抗体检测,平均阳性率为58.35%。2014年,李智勇等[19]对内蒙古地区17个大、中、小奶牛场的2 391份血清样品进行了BVDV 抗体检测,平均阳性率为88.9%(2125/2391),14个奶牛场的抗原阳性率为3.6%(8/222)。2015年,姚伟[20]对辽宁地区规模化奶牛场血清型调查结果显示,BVDV抗体平均阳性率为74.0%。这些数据充分表明内蒙古及周边地区奶牛BVDV感染已十分严重,这无疑对散养肉牛生存环境造成巨大挑战。甘肃省与以往报道情况一致,BVDV相对较洁净。云南省整体阳性率较低,但两批血清样品BVDV抗体阳性率差异较大。这是由于2014年12月采集的362份样品来自保山瓦马和保山旧城,2015年8月采集的178份样品来自大理云龙,同一省份不同地区散养肉牛BVDV感染情况有所不同。
BVDV作为单股RNA病毒,具有很高的突变率。因此,不同国家甚至同一国家的不同区域BVDV基因型分布有很大差异。在美国主要流行的是BVDV-1a、BVDV-1b和BVDV-2a[21],欧洲许多国家主要流行1a、1b、1d、1e和1f[22-23],日本和韩国主要流行BVDV-1b[24-25],澳大利亚则主要流行BVDV-1c[26]。中国地域辽阔,疾病流行情况十分复杂,BVDV-1和BVDV-2的许多亚型已在不同物种中被发现,并呈现多样性分布。本研究在新疆地区分离到的病毒主要为BVDV-1q和BVDV-1f亚型,此前高善典等在该地区双峰驼中分离到BVDV-1q[27],这说明BVDV-1q已经在新疆地区跨物种传播。而BVDV-1f首次在该地区检测到,ZHONG等[28]早前在新疆七个地区商品化肉牛和奶牛中分离到的主要是BVDV-1b和BVDV-1c亚型毒株,通过BLAST比对发现这些序列与斯洛文尼亚分离到的BVDV-1f毒株有很高的同源性,所以不排除BVDV通过贸易或其它途径实现了跨境传播,亦可能是原有毒株发生了突变。甘肃地区分离到的是一种新基因亚型BVDV-1u,该型毒株最早于2012年分离于四川成都(NCBI:JQ799141),后DENG等[15]在广西、湖北、青海等地分离到该亚型毒株。甘肃与四川、青海毗邻,散养肉牛流动性大且牲畜交易频繁,所以不难解释甘肃肉牛中可以分离到BVDV-1u毒株。内蒙地区分离的毒株属于BVDV-1m亚型,该亚型在中国很多省(市)已经分离到,是目前国内BVDV最流行的亚型之一。DENG等[15,29]分别从内蒙地区的肉牛血清和胎牛血清中分离到过BVDV-1m,同时在内蒙相邻的黑龙江、吉林、辽宁和宁夏等地[29-30]也都分离到了BVDV-1m毒株,所以可以确定BVDV-1m是内蒙地区的主要流行毒株且该毒株较稳定,变异程度低。
散养肉牛整体BVDV感染水平较规模化奶牛场轻,但不同省(市)差异明显,要整体布控重点防范。同时,BVDV流行毒株的异质性也应引起重视。在欧洲,主要采取持续感染牛的筛选与淘汰措施净化牛群[31-32],而美国则倾向于通过免疫接种控制该疾病[26]。根据中国目前国情,加之成本效益分析,疫苗免疫是首选方法,研制出针对中国BVDV流行毒株的疫苗任务紧迫。此外,也要加强散养肉牛的管理,尽量避免牛羊等动物的混群放养,切断病毒跨物种传播的途径。
4 结论
通过血清学方法检测发现,虽然4个省(市、自治区)散养肉牛整体抗体阳性率低于国内平均水平,但情况却不尽相同。内蒙古和新疆抗体高阳性率表明BVDV在这些地区散养肉牛中已经广泛流行,必须采取适当措施将其危害性降到最低。从基于5′-UTR序列绘制的系统进化树可以看出,不同地区散养肉牛感染的BVDV基因亚型有所不同。总体看来,BVDV在散养肉牛中的分布呈现多样性,跨物种、跨地域传播和高突变性等特点,这些都使疫苗免疫策略面临严峻的挑战。本试验研究的意义在于通过对各地区健康散养肉牛的随机大量采样、检测和分析,来客观评价BVDV在散养肉牛中的流行情况,为更好的制定预防策略提供参考依据。
致谢:感谢金宇保灵、新疆田康、中牧兰州实验动物检验室及保山生物药厂的赵丽霞、王焰、马爱荣和彭正启在本次试验采样过程中提供的诸多帮助!
References:
[1] HOUE H. Epidemiological features and economical importance of bovine virus diarrhoea virus (BVDV) infections., 1999, 64: 89-107.
[2] 刘丽青. 新疆规模化养殖循环经济分析[D]. 乌鲁木齐:新疆农业大学, 2013.
LIU L Q. The analysis of circular economy for large-scaled livestock production in Xinjiang[D]. Urmuqi:Xinjiang Agricultural University, 2013. (in Chinese)
[3] 杜宏. 内蒙古肉牛产业发展研究[D]. 呼和浩特:内蒙古农业大学, 2013.
DU H. The research of beef-cattle industry development in Inner Mongolia[D]. Huhhot: Inner Mongolia Agricultural Univercity, 2013. (in Chinese)
[4] BAKER J A, YORK C J, GILLEPSIE J, MITCHELL G B. Virus diarrhea in cattle., 1954, 15: 525-531.
[5] CASTRUCCI G, AVELLINI G, CILLI V, PEDINI B, MCKERCHER D, VALENTE C. A study of immunologic relationships among serologically heterologous strains of bovine viral diarrhea virus by cross immunity tests., 1975, 65: 65-72.
[6] FAIRBANKS K, SCHNACKEL J, CHASE C. Evaluation of a modified live virus type-1a bovine viral diarrhea virus vaccine (Singer strain) against a type-2 (strain 890) challenge., 2003, 4: 24-34.
[7] KELLING C L, HUNSAKER B D, STEFFEN D J, TOPLIFF C L, ABDELMAGID O Y, ESKRIDGE K M. Characterization of protection from systemic infection and disease by use of a modified-live noncytopathic bovine viral diarrhea virus type 1 vaccine in experimentally infected calves., 2005, 66: 1785-1791.
[8] FULTON R W, BRIGGS R E, RIDPATH J F, SALIKI J T, CONFER A W, PAYTON M E, DUFF G C, STEP D, WALKER D. Transmission of bovine viral diarrhea virus 1b to susceptible and vaccinated calves by exposure to persistently infected calves., 2005, 69: 161-169.
[9] BECHER P, FISCHER N, GRUNDHOFF A, STALDER H, SCHWEIZER M, POSTEL A. Complete genome sequence of bovine pestivirus strain PG-2, a second member of the tentative pestivirus species giraffe., 2014, 2: e00376-14.
[10] HORNBERG A, FERNÁNDEZ S R, VOGL C, VILCEK S, MATT M, FINK M, KÖFER J, SCHÖPF K. Genetic diversity of pestivirus isolates in cattle from Western Austria., 2009, 135: 205-213.
[11] VILCEK S, DURKOVIC B, KOLESÁROVÁ M, GREISER-WILKE I, PATON D. Genetic diversity of international bovine viral diarrhoea virus (BVDV) isolates: identification of a new BVDV-1 genetic group., 2004, 35(5): 609-615.
[12] VILČEK Š, PATON D, DURKOVIC B, STROJNY L, IBATA G, MOUSSA A, LOITSCH A, ROSSMANITH W, S VEGA, SCICLUNA M. Bovine viral diarrhoea virus genotype 1 can be separated into at least eleven genetic groups., 2001, 146: 99-115.
[13] MONINI M, CAPPUCCINI F, BATTISTA P, FALCONE E, LAVAZZA A, RUGGERI F. Molecular characterization of bovine rotavirus strains circulating in northern Italy, 2003–2005., 2008, 129: 384-389.
[14] RIDPATH J F, BOLIN S R. Differentiation of types 1a, 1b and 2 bovine viral diarrhoea virus (BVDV) by PCR., 1998, 12: 101-106.
[15] DENG M, JI S, FEI W, RAZA S, HE C, CHEN Y, CHEN H, GUO A. Prevalence study and genetic typing of bovine viral diarrhea virus (BVDV) in four bovine species in China., 2015, 10: e0121718.
[16] 王淑娟, 王华, 宋晓晖, 孙成友, 徐天刚, 刘春菊, 张永强, 赵永刚, 刘海生, 王志亮. 牛病毒性腹泻/黏膜病的诊断流行病学调查及防控. 中国兽医杂志, 2014, 50(3): 38-40.
WANG S J, WANG H, SONG X H, SUN C Y, LIU C J, ZHANG Y Q, ZHAO Y G, LIU H S, WANG Z L. Diagnosis epidemiological investigation and prevention of bovine viral diarrhea/mucosal disease., 2014, 50(3):38-40. (in Chinese)
[17] 王文, 张娟, 员丽娟, 季新成. 牛病毒性腹泻病毒血清抗体检测. 动物医学进展, 2011, 32(9): 51-53.
WANG W, ZHANG J, YUAN L J, JI X C. Detection of serum antibody on bovine viral diarrhea virus., 2011, 32(9):51-53. (in Chinese)
[18] 童钦, 吕晓妍, 王炜, 项键. 内蒙古牛病毒性腹泻病毒血清学调查. 中国农学通报, 2013, 29(5): 26-29.
TONG Q, LÜ X Y, WANG W, XIANG J. Seroepidemiological survey on bovine viral diarrhea virus infection in Inner Mongolia., 2013, 29(5): 26-29. (in Chinese)
[19] 李智勇, 石顺利, 王艳杰, 陈德浩, 李平安, 关平原. 内蒙古地区奶牛病毒性腹泻/黏膜病血清流行病学调查. 畜牧与饲料科学, 2014(3): 106-108.
LI Z Y, SHI S L, WANG Y J, CHEN D H, LI P A, GUAN P Y. Serum epidemiology investigation of bovine viral diarrhea-mucosal disease in Inner Mongolia Area., 2014(3): 106-108. (in Chinese)
[20] 姚伟. 辽宁地区规模化奶牛场牛病毒性腹泻-黏膜病血清学调查. 现代畜牧兽医, 2015(4): 36-40.
YAO W. Serologic study on bovine viral diarrhea in dairy cattle from scale dairy farms in Liaoning., 2015(4): 36-40. (in Chinese)
[21] RIDPATH J F, LOVELL G, NEILL J D, HAIRGROVE T B, VELAYUDHAN B, MOCK R. Change in predominance of Bovine viral diarrhea virus subgenotypes among samples submitted to a diagnostic laboratory over a 20-year time span., 2011, 23: 185-193.
[22] GIAMMARIOLI M, CEGLIE L, ROSSI E, BAZZUCCHI M, CASCIARI C, PETRINI S, DE MIA G M. Increased genetic diversity of BVDV-1: recent findings and implications thereof., 2015, 50: 147-151.
[23] TOPLAK I, SANDVIK T, BARLIČ-MAGANJA D, GROM J, PATON D J. Genetic typing of bovine viral diarrhoea virus: most Slovenian isolates are of genotypes 1d and 1f., 2004, 99: 175-185.
[24] ABE Y, TAMURA T, TORII S, WAKAMORI S, NAGAI M, MITSUHASHI K, MINE J, FUJIMOTO Y, NAGASHIMA N, YOSHINO F. Genetic and antigenic characterization of bovine viral diarrhea viruses isolated from cattle in Hokkaido, Japan., 2016, 78(1): 61-70.
[25] OEM J K, CHUNG J Y, ROH I S, KIM H R, BAE Y C, LEE K H, JIN Y H, LEE O S. Characterization and phylogenetic analysis of Bovine viral diarrhea virus in brain tissues from nonambulatory (downer) cattle in Korea., 2010, 22: 518-523.
[26] LANYON S, REICHEL M. Bovine viral diarrhoea virus (‘pestivirus’) in Australia: to control or not to control?, 2014, 92: 277-282.
[27] GAO S, LUO J, DU J, LANG Y, CONG G, SHAO J, LIN T, ZHAO F, BELÁK S, LIU L. Serological and molecular evidence for natural infection of Bactrian camels with multiple subgenotypes of bovine viral diarrhea virus in Western China., 2013, 163: 172-176.
[28] ZHONG F, LI N, HUANG X, GUO Y, CHEN H, WANG X, SHI C, ZHANG X. Genetic typing and epidemiologic observation of bovine viral diarrhea virus in Western China., 2011, 42: 204-207.
[29] ZHANG S Q, TAN B, GUO L, WANG F X, ZHU H W, WEN Y J, CHENG S. Genetic diversity of bovine viral diarrhea viruses in commercial bovine serum batches of Chinese origin., 2014, 27: 230-233.
[30] XUE F, ZHU Y M, LI J, ZHU L C, REN X G, FENG J K, SHI H F, GAO Y R. Genotyping of bovine viral diarrhea viruses from cattle in China between 2005 and 2008., 2010, 143: 379-383.
[31] BARRETT D J, MORE S J, GRAHAM D A, FLAHERTY J O’, DOHERTY M L, GUNN H M. Considerations on BVD eradication for the Irish livestock industry., 2011, 64: 1-10.
[32] VARGAS D S, JAIME J, VERA V J. Perspectives to control bovine viral diarrhea virus (BVDV)., 2009, 22: 677-688.
(责任编辑 林鉴非)
Prevalence Study and Phylogenetic Analysis of Bovine Viral Diarrhea Virus in Free-roaming Beef Cattle in Western China
CHEN Rui, FAN Xue-zheng, ZHU Yuan-yuan, ZOU Xing-qi, XU Lu, ZHANG Qian-yi, WANG Qin, ZHAO Qi-zu
(China Institute of Veterinary Drugs Control, Beijing 100081)
【Objective】Bovine viral diarrhea virus(BVDV) is commonly recognized as an important pathogen for the cattle and causes significant economic losses in the cattle industry worldwide. To assess the overall prevalence of BVDV in Chinese free- roaming beeves, the free-roaming beeves in the Western China were used in the present study by the methods of serological and bioinformatic analysis. Then, the genetic diversity of BVDV was analyzed. This study will provide a theoretical basis for the development of reasonable prevention and control, and for the vaccine development. 【Method】 A total of 1 332 sera were collected in Yunnan, Xinjiang, Gansu and Inner Mongolia from 2014 to 2015. These samples were analyzed by the commercial antibody (Ab) detection kits, and the Ab positive rate of BVDV in various regions were summarized up. Meanwhile, the positive or suspicious samples, whose S/P were less than 60%, were further detected by the Ag detection kit. Then, to isolate BVDV, the positive samples were inoculated into the MDBK cells and passaged by five generations. In addition, the primer designed based on the 5′-UTR of BVDV which has low frequency variability was used to analyze the genetic diversity of BVDV. Then the nucleotide sequences were analyzed by the bioinformatic softwares, including Sequencher4.2, BLAST, ClustalX and MEGA5.2. Finally, the genotypes and phylogenetic analysis of sequenced BVDV were confirmed based on the primers.【Result】Results showed that the average Ab positive rate of BVDV was 33.93% in the four detected provincial regions. Among them, that in the Inner Mongolia was the highest (71.43%), that in Xinjiang taking the second place (57.69%), that in Gansu was the third (16.54%) and that in Yunnan was the lowest (10.0%). The average Ag positive rate of BVDV was only 1.58%, that in Xinjiang was the highest. In this study, a total of 13 BVDV strains were isolated, they were named as Gansu 120, Mongolia 1369, Yilihuoqing 12953, Yillihuoqing 12960, Yilihuoqing 12981, Bozhoujinghe 13001, Bozhoujinghe 13023, Bozhoujinghe 13033, Xinjiangqitai 13041, Xinjiangqitai 13042, Xinjiangqitai 13191, Xinjiangqitai 13220, and Xinjiangqitai 13251, respectively. The polygenetic analysis indicated that these isolates could be mainly classified into four subtypes: BVDV-1q and BVDV-1f (isolated in Xinjiang), BVDV-1m (isolated in Inner Mongolia) and BVDV-1u which was a new subtype isolated in Gansu.【Conclusion】The serological analysis indicated that, although the free-range beef cattle overall Ab positive rate in the four provinces (autonomous regions) was lower than the national average, their situation was different. The high Ab positive rate of Inner Mongolia and Xinjiang indicated that BVDV is prevalent in the free-roaming beeves, and it is essential to minimize the damage by valuable controlling methods. The phylogenetic tree based on 5′-UTR sequence indicated that various genotypes of BVDV were existed in various regions. Overall, the diversity, cross-species transmission, cross-regional transmission and high mutation rate of BVDV make a great challenge for the immunity of vaccine. The significance of this study is to evaluate the prevalence of BVDV in free-range beef cattle through the method of healthy cattle random sample detection and analysis in various regions, and provide the reference for the prevention strategies.
bovine viral diarrhea virus (BVDV); free-roaming beef cattle; enzyme linked immunosorbent assay (ELISA); positive rate; genotyping
2015-12-31;接受日期:2016-06-05
农业部公益性行业(农业)科研专项(P2015003086)
陈锐,Tel:17090086568;E-mail:chenrui2635@163.com。通信作者赵启祖,Tel:13810789573;E-mail:zhaoqizu@163.com
