不同pH下低甲酯苹果果胶凝胶模型建立及基于流变学的凝胶机理分析
2016-11-14韩万友董桂茹屈玉玲孟永宏郭玉蓉
韩万友,董桂茹,屈玉玲,孟永宏,郭玉蓉,邓 红
不同pH下低甲酯苹果果胶凝胶模型建立及基于流变学的凝胶机理分析
韩万友,董桂茹,屈玉玲,孟永宏,郭玉蓉,邓 红
(陕西师范大学食品工程与营养科学学院,西安 710100)
【目的】采用柠檬酸-磷酸氢二钠缓冲溶液制备不同pH的低甲酯苹果果胶(LMP)凝胶,建立凝胶强度及破裂强度的数学模型,并依据流变学测定的储存剪切模量及损耗剪切模量解释不同pH范围的凝胶机理,为低甲酯苹果果胶在不同pH环境中的应用提供参考。【方法】采用质构仪测定LMP凝胶的凝胶强度及破裂强度,采用Mate lab 10.0模拟建立数学模型。利用流变仪在1 Hz条件下测定凝胶的储存剪切模量及损耗剪切模量。结合储存剪切模量与损耗剪切模量在图形中的交点寻找溶胶-凝胶转变点,确定形成凝胶的pH范围;依据储存剪切模量与损耗剪切模量在图形中的变化,并结合果胶的结构特征、形成凝胶的作用力分析不同pH下的凝胶机理。【结果】不同pH的LMP凝胶强度及破裂强度模型均遵循多项式规律,在pH 3.50附近凝胶强度达到最佳。pH在1.78—3.10时,依靠半乳糖醛酸未解离羧基基团或羟基间的氢键及甲氧酯基团之间的疏水相互作用,使得溶胶向凝胶转变。同时,随着果胶溶液pH的逐渐增大至3.10时,连续解离的羧基负离子与钙离子间逐渐形成钙桥,几种作用力的共同作用使得凝胶强度随着pH的增加而增大。储存弹性模量增加较为明显,凝胶强度增加到21.19 g,但由于连续解离的羧基负离子达不到形成稳定蛋壳结构所需要的量,凝胶质地偏软,凝胶形态不稳定;pH为3.10—4.20时,连续解离的羧基负离子的量达到最佳量,满足了与Ca2+间形成稳定的钙桥作用的所需量,凝胶趋于稳定,达到22.00 g左右,此状态下的凝胶弹性较好,凝胶稳定;pH为4.20—6.62时,由于pH的升高导致果胶分子间静电排斥逐渐加强,果胶发生解聚,无法形成钙桥,溶胶凝胶转变点消失,逐渐不能形成凝胶。【结论】LMP形成凝胶的pH范围为1.78-6.30。凝胶在pH为1.78—3.10时,果胶可在强酸性条件下形成凝胶,适用于对酸度要求较高的食品及药品中;pH为3.10—4.20时,凝胶强度最佳,凝胶最稳定,可满足对食品胶凝质地要求较高的食品。
低甲酯苹果果胶;pH;凝胶强度;流变学;弹性模量;数学模型;凝胶机理
0 引言
【研究意义】低甲酯果胶(Low Methoxyl Pectin,LMP)是由D-半乳糖醛酸残基经α-1-4糖苷键相连接聚合而形成的多聚半乳糖醛酸,其酯化度低于50%[1]。影响LMP凝胶的因素较多,如钙离子、酰胺化、pH、固形物含量等[2]。pH是影响LMP凝胶的一个重要因素,如LMP在酸性范围内能够形成凝胶,但不同的pH范围,其凝胶强度、破裂强度及其实际应用均不同。当pH在3.00以下时,LMP在药物传送中应用广泛,如LMP在胃给药时,利用胃环境下的低pH形成凝胶,而结肠恰好具有较高的pH和合适的果胶酶,因此LMP凝胶能保证制剂中药物在结肠中的特异性释放[3]。pH范围在3.00—6.00时,多数食品胶体的凝胶性能较差,而LMP形成的凝胶具有最大稳定性,根据不同的pH对应不同的凝胶需求,可指导LMP在焙烤食品的耐热果酱、凝固型酸奶等食品中的应用[4]。此外,LMP还可以作为有不同pH要求的食品的稳定剂,果汁等饮料的增稠剂等[5]。因此,建立不同pH下的凝胶模型对LMP在食品、制药等领域的应用具有实际指导意义。【前人研究进展】国际上,LMP的研究大多集中于钙离子[6-8]、pH[9]、甲酯化[10]、酰胺化[11]、固形物含量[12]等对LMP凝胶形成的影响。国内主要集中于研究LMP的不同提取方法。如传统的酸提取[13]、碱提取[14]、酶提取[15]、微生物法[16]、微波辅助提取法[17-18]、超声波辅助提取法[19]等。近年来,国内一些研究人员也针对各因素对LMP凝胶的影响进行了研究,如王海波[20]等采用质构仪研究不同因素下低甲酯果胶凝胶脆度、硬度、弹性等;赵江[21]对低甲酯果胶形成凝胶的条件进行了优化。【本研究切入点】pH对LMP凝胶机理分析不明确,一定pH范围内的LMP凝胶模型尚未建立,应用中较难根据不同的凝胶强度需求选用不同pH条件。【拟解决的关键问题】采用Mate lab对LMP溶液pH在1.78—6.62范围内的凝胶强度及破裂强度的变化趋势进行拟合,建立凝胶的数学模型;并结合流变学性质及化学分析,探究不同pH下LMP凝胶形成机理,为实际应用中根据物性和使用条件,制备合适强度的LMP凝胶提供依据。
1 材料与方法
试验于2015年3—7月在陕西师范大学食品工程与营养科学学院陕西省食品绿色加工与安全控制工程实验室进行。
1.1 试验材料
LMP购买于山东安德利有限公司,其物理化学性质见表1。二水合氯化钙、柠檬酸、磷酸氢二钠均为分析纯,购买于西安晶博生物有限公司。蔗糖为食品级,购买于华润万家超市,生产厂家为南宁糖业股份有限公司。
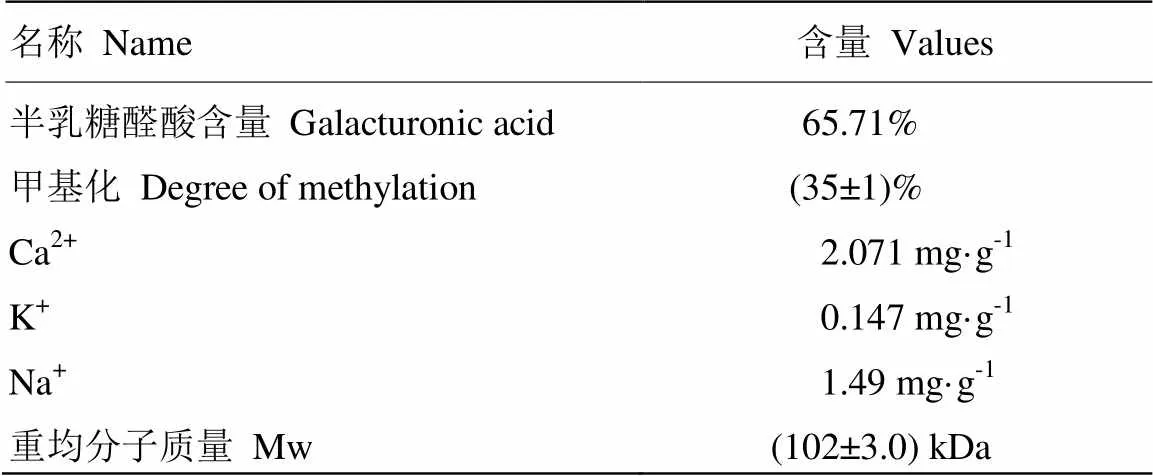
表1 LMP的物理化学性质
1.2 试验仪器
梅特勒-托利多PHS-3C pH计;DF-101S集热式恒温加热磁力搅拌器;梅特勒-托利多PL203电子天平;科伟数显电热恒温水浴锅;上海思尔达科技有限公司乌氏黏度计;北京普析通用仪器公司TAS- 990AFG型火焰原子吸收分光光度计;英国stable micro system TA.XT.Plus型质构仪;美国TA公司AR- G2型流变仪。
1.3 凝胶制备方法
称取1.500 g LMP粉溶于所需pH的柠檬酸-磷酸氢二钠缓冲溶液,在磁力搅拌器下搅拌使其充分溶解,制得pH范围在1.78—6.62的果胶溶液。分别将不同pH的果胶溶液加热到80℃后加入含量为40 g/100 mL的蔗糖,并不断搅拌,其后与预先加热到80℃的钙离子溶液混合,使得添加的钙离子含量为40.00 mg·g-1,并不断搅拌使其均匀混合。制备完成后将混合溶液倒入用塑封胶带加高的专用玻璃杯中,室温下放置24 h后,用金属丝刀切去加高部分,于质构仪上测定其凝胶强度及破裂强度,每个样品选取3个不同点分别测定,取其平均值。
1.4 参数测定方法
1.4.1 凝胶强度及破裂强度测定方法 凝胶强度及破裂强度参照ISO/GMIA明胶国际标准测试方法[22]。质构仪测定参数:探头P 0.5凝胶强度专用探头,测试距离:4 mm,初始速度:1.0 mm·s-1,测定速度:1.0 mm·s-1,返回速度:1.0 mm·s-1,触发类型:5 g,数据采集率:500 pps。凝胶强度为质构仪探头下压至4 mm深的凹痕所需要的重量,以g表示。破裂强度为质构仪探头下压时,在胶破裂前负载急剧上升,破裂后则急剧下降。负载的最大值定义为破裂强度,单位为g。
1.4.2 弹性模量测定方法 采用AR-G2流变仪(美国TA仪器公司)进行流变分析。使用锥板(直径40 mm;锥度1°;狭缝距离为1 mm),温度由圆锥平面的珀耳帖系统控制。在1%应变(线性黏弹区内)的应变条件下进行小变形振荡扫描分析储存剪切模量(G’)及损耗剪切模量(G’’)。80℃加样品于测试台上后,以2℃·min-1的速度下降至10℃,频率为1 Hz。
2 结果
2.1 不同pH下的凝胶强度模型及凝胶形态
图1为果胶溶液在不同pH下的凝胶强度拟合曲线及3个不同pH下的凝胶形态。由图1曲线可知,果胶溶液pH在3.10以下时,所对应的凝胶强度从8.95 g上升到21.19 g,若对此段进行拟合,可以得出其斜率为10.52,截距为-8.84,凝胶强度随pH的增加,增加幅度较大,说明果胶溶液pH越靠近果胶的等电点,凝胶强度增加越明显。LMP在此pH下可广泛应用于酸乳制品、油炸膨化食品的胶凝剂以及酸性果酱中,可以使产品获得稳定的黏稠性以增强口感。图1-a表示果胶溶液pH在2.47时形成的凝胶,此pH下的凝胶可代表pH 3.10以下时的凝胶:凝胶颜色光亮,色泽均匀,但凝胶质地较软,容易破裂成块,此阶段下的LMP既可应用于对酸性要求较高的食品中,又可以作为以胃给药的药物制剂的外衣;当果胶溶液pH在3.10—4.20时,凝胶强度在22.00 g附近波动,说明pH的变化对凝胶强度影响较小,凝胶达到最佳,此pH范围内所形成的凝胶形态可用图1-b代表:凝胶颜色较深、色泽光亮,质地均匀,且凝胶从容器中倒出时不易破裂。当果胶溶液pH在4.20—6.62时,凝胶强度从21.00 g逐渐下降到不能形成凝胶为止,此pH范围内形成的凝胶可以用图1-c(pH 6.30)代表:凝胶颜色随着pH的升高逐渐偏暗,质地不如a、b均匀,颜色偏暗,若凝胶放置时间稍长易塌陷。
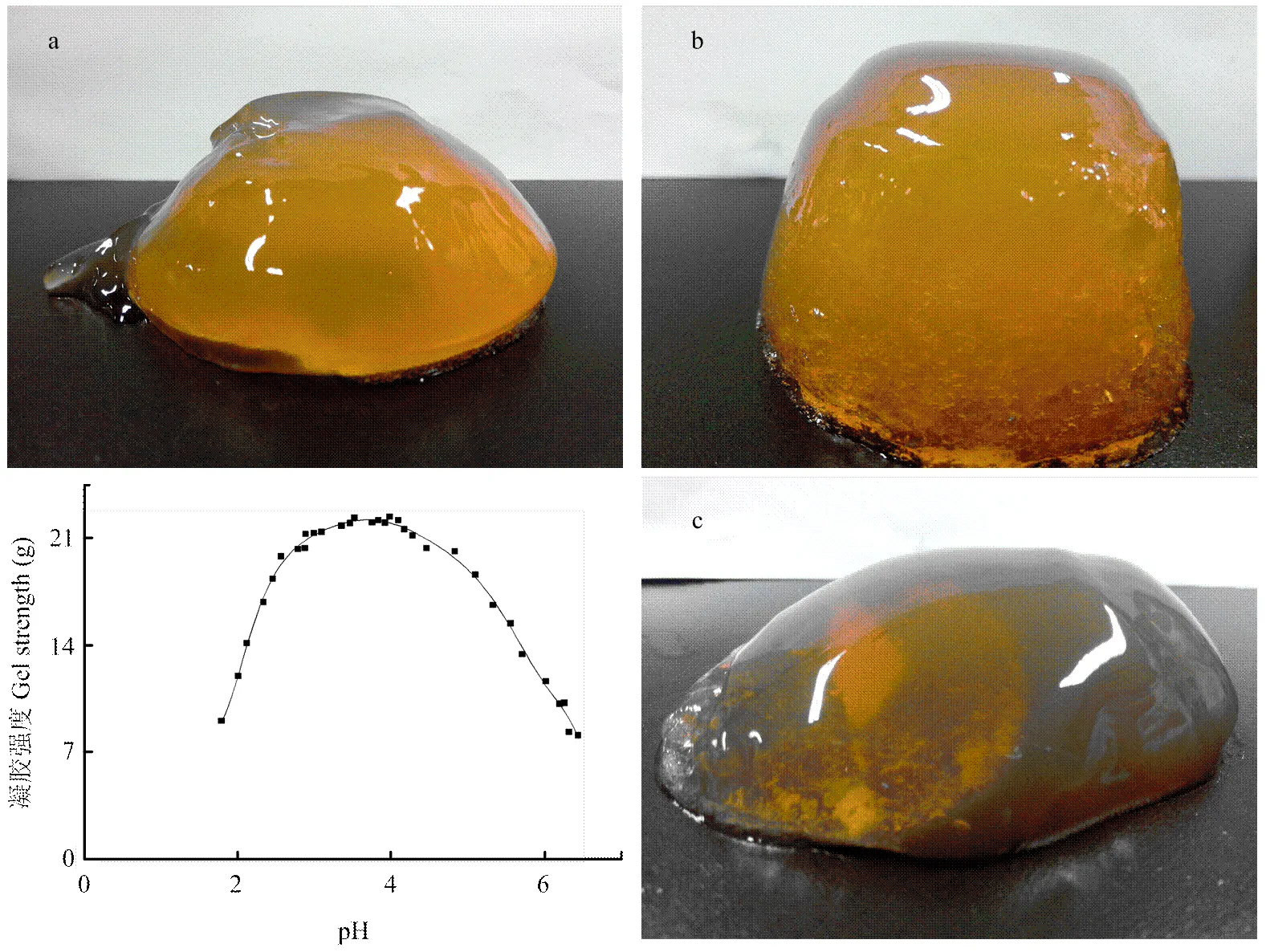
图1 不同pH下的凝胶强度拟合曲线及凝胶形态
不同pH下的凝胶强度拟合模型为:

式中,代表凝胶强度,代表pH;式中所对应的、—的值及凝胶强度模型对应的矫正2值及值见表2。

表2 凝胶强度模型参数值
拟合模型矫正的2值为0.9921,模型拟合近似度接近于1,说明拟合模型较为真实。根据方差分析可知,若Prob>F的值小于0.05认为差异显著,小于0.01则差异极显著。
2.2 不同pH下的破裂强度模型
图2为破裂强度拟合曲线,当pH小于3.10时,破裂强度从8.48 g上升至22.61 g。此阶段的凝胶破裂时,质构仪探头下压的距离较短,破裂成块不均匀。pH在3.10附近破裂强度达到最大值,为22.90 g。此阶段的凝胶能稳定放置于质构仪平台上,质构仪探头下压时,凝胶均匀破裂成块。pH范围在4.20—6.50时,破裂强度从22.00 g逐渐下降到不能形成凝胶为止,此阶段的凝胶易破裂,破裂处有溢水现象出现。
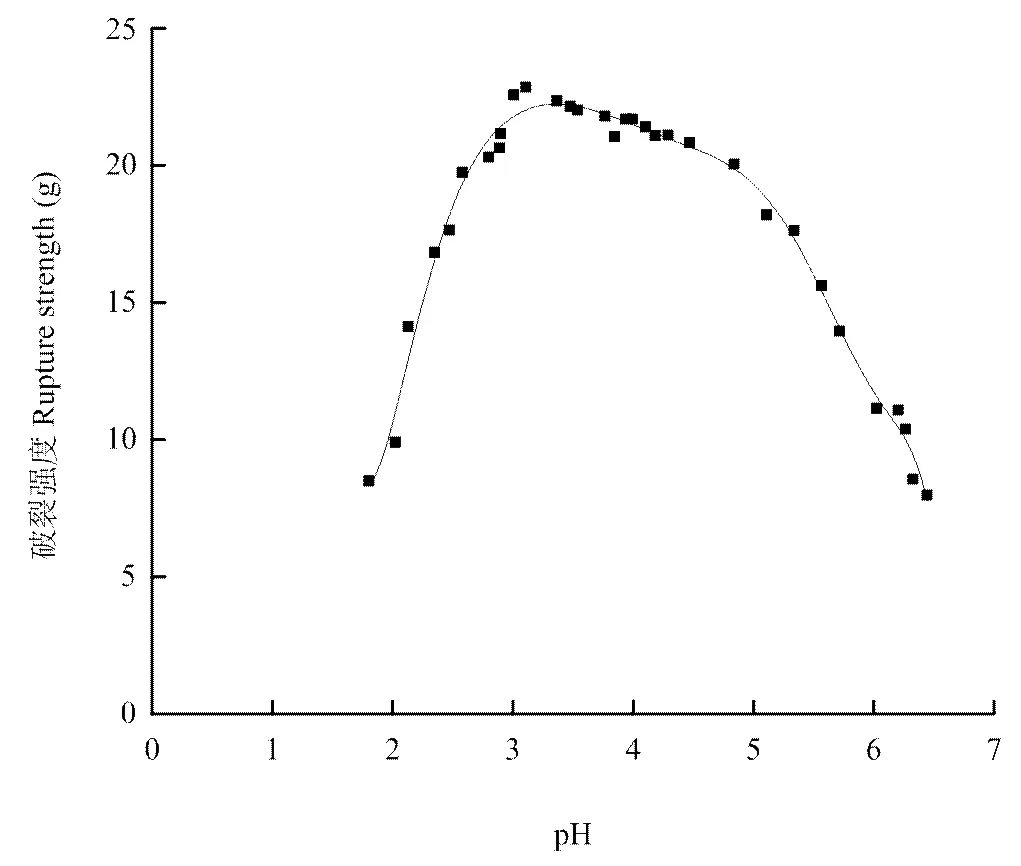
图2 不同pH下的破裂强度拟合曲线
不同pH下的破裂强度拟合模型:

式中,代表破裂强度,代表pH;式中所对应的、—的值及破裂强度模型对应的2值及值见表3。根据方差分析结果可知,矫正的矫正2值为0.992;Prob>F的值为0,差异极显著,故LMP破裂强度的拟合模型较为准确。

表3 破裂强度模型参数值
2.3 基于流变学的不同pH下凝胶机理分析
在流变学中,G’为形变能力中储存的部分,定义为储存剪切模量,代表弹性部分;G’’为形变能力中损失的部分,定义为损耗剪切模量,代表黏性部分,二者统称为弹性模量。若G’’<G’,表示弹性占主要部分,为凝胶体;若G’’>G’,代表黏性占主要部分,为流体;若G’’=G’,代表弹性和黏性相等,为溶胶—凝胶转变点[23-24]。
2.3.1 pH范围在1.78—3.10下的凝胶机理分析 图3表示果胶溶液pH在1.78及3.10下的储存剪切模量及损耗剪切模量,二者可代表pH在1.78—3.10下的流变学性质。在此pH范围内,随着pH的增加,弹性模量增加,且储存弹性模量较损耗弹性模量增加较为显著,果胶溶液由流体转变为凝胶体较为显著。当pH为1.78时,由于果胶的pH小于pKa(该LMP的pKa为3.50),伴随着羧基质子化,果胶由双螺旋向三螺旋构象转换,果胶分子间出现交联作用。三螺旋果胶链之间通过如图4-a代表的未离解的羧基之间的氢键交联[25],从而在30℃附近出现溶胶—凝胶转变点,与其所对应的凝胶强度为9.00 g,凝胶强度较弱;当果胶溶液pH为3.10左右时,图4-b所代表的甲氧酯基团之间的疏水相互作用及图4-a代表的未离解的羧基之间的氢键共同作用,使得弹性模量增加较为明显,溶胶—凝胶转变点所对应的温度升高为45℃左右,凝胶强度增大,所对应的凝胶强度为21.00 g左右。此pH范围内,虽然果胶的电荷密度低,钙离子仍会促进凝胶。但由公式(1)计算可知,解离的羧基负离子浓度为0.022 mol·L-1,达不到形成稳定蛋箱结构所需的电负性羧基的最佳量,形成钙桥的作用较弱[26]。尽管凝胶强度随着pH的增大而增加,但未达到最佳凝胶强度。
pH=pKa+log(3)
式中,pH表示果胶溶液的pH,pKa为该LMP的酸度系数,-表示解离的D-半乳糖醛酸羧基负离子的浓度,-代表溶液中氢离子浓度,代表果胶溶液中D-半乳糖醛酸浓度。

图3 pH在1.78及3.10下的弹性模量

a为未离解的羧基基团之间的氢键,b为疏水相互作用,c为钙桥作用
2.3.2 pH范围在3.10—4.20下的凝胶机理分析 图5表示果胶溶液pH继续增加为3.50及4.20时,所对应的弹性模量。图中显示,储存剪切模量均高于损耗剪切模量,说明制备过程中已形成凝胶,故不存在溶胶—凝胶转变点。此阶段pH对凝胶的影响解释为,除图4-a代表的未离解的羧基之间的氢键及图4-b所代表的甲氧酯基团之间的疏水相互作用共同作用外,随着pH不断增加,果胶的pH大于pKa,连续解离的电负性的羧基数量逐渐增加,使得钙离子与果胶间的作用开始明显加强,形成了图4-c中的“蛋壳模型”[27]。并且此作用下的凝胶形成被认为可以分为两个过程,首先,温度较高时,果胶链间由于强烈的静电产生二聚作用与钙离子间形成了疏水相互作用力;其次,在温度降低时又形成了氢键,从而增强了凝胶强度及破裂强度[28-29]。
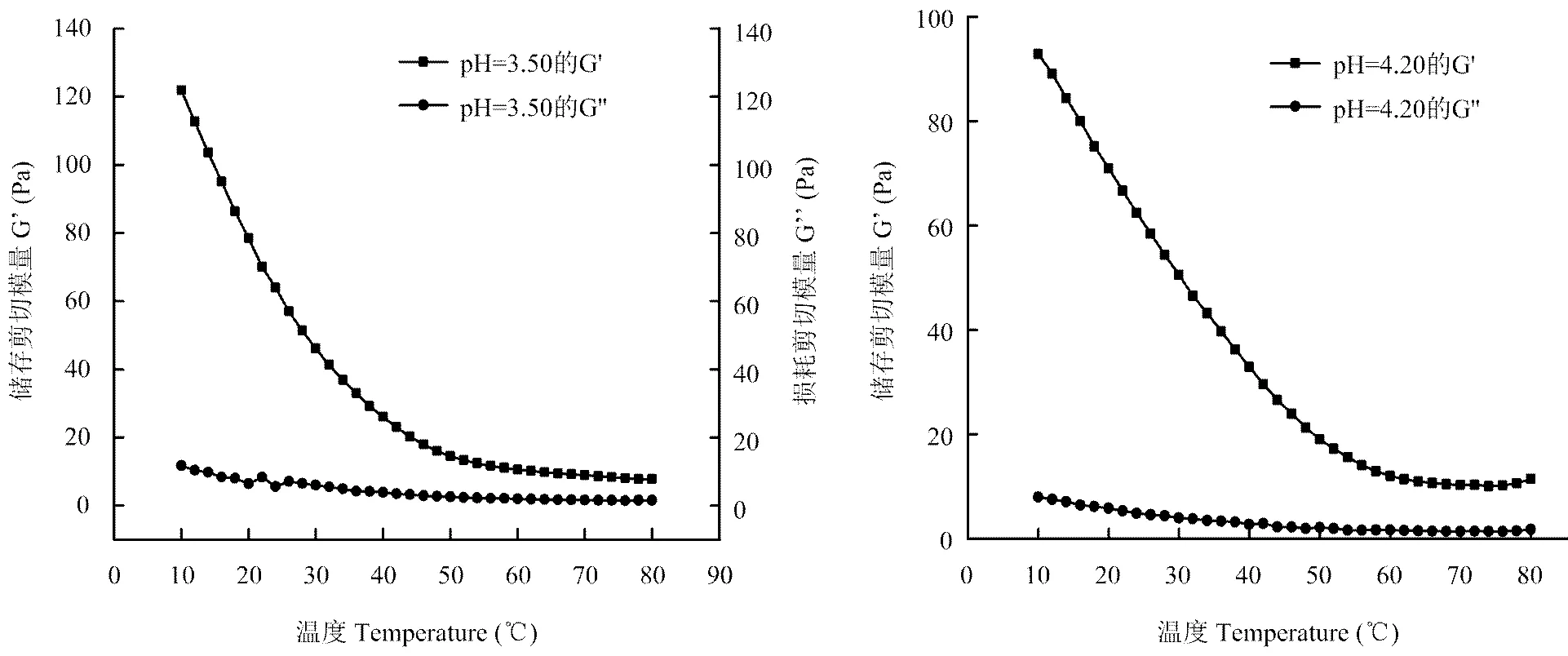
图5 pH在3.50及4.20下的弹性模量
2.3.3 pH范围在4.20-6.62下的凝胶机理分析 图6表示当果胶溶液pH调整为6.30时,会出现溶胶—凝胶转变点,此pH下所对应的凝胶强度为8.22 g。而当pH继续增加到6.62时,果胶始终为流体状态,不会出现溶胶—凝胶转变点,无法形成凝胶。对pH接近中性无法形成凝胶的解释为:当果胶溶液的pH增加到6.62时,由公式(1)计算可知,-=/(1+10-9.74),表明游离的羧基负离子浓度达到最大值,并且与溶液中的金属阳离子形成羧基盐,此时果胶分子间的静电斥力增加较为显著,导致果胶分子间随着pH的升高而逐渐解聚、脱脂化,使得钙离子与连续解离的羧基负离子结合愈加困难。同时,随着连续解离的羧基负离子的量逐渐增大,图4-a代表的未离解的羧基之间的氢键交联作用逐渐消失,4-b所代表的甲氧酯基团之间的疏水相互作用较弱,故而逐渐无法形成凝胶。

图6 pH在6.30及6.62下的弹性模量
3 讨论
王卫平[30]报道LMP形成凝胶的pH范围为2.60—6.80。Lootens[31]等研究的pH对LMP凝胶的影响及机理解释表明,当果胶溶液pH低于3.0时,低甲酯果胶凝胶减弱,在3.50附近储存剪切模量最大,凝胶最强。但是,关于LMP在不同pH阶段凝胶强弱均未给出衡量依据,仅根据流变学性质无法直观的反应凝胶强度,对其应用没有实际参考意义。本研究通过流变仪寻找到溶胶—凝胶转变点的pH分别为1.78和6.30,在此pH范围内能够形成凝胶。并建立了此阶段凝胶强度及破裂强度的数学参考,根据质构仪测定其凝胶强度及破裂强度,对凝胶的强弱给出判别依据。当果胶溶液pH低于1.78时,由于酸性较强,导致果胶解聚,无法形成凝胶,并会出现白色片状物质。果胶溶液pH在1.78—6.62范围内时,不同pH阶段,氢键、疏水相互作用、钙桥3种作用力呈现不同作用,从而形成强度不同的凝胶。并且发现因为pH的变化影响了连续解离的羧基负离子的量,使得钙桥作用对pH产生明显依赖作用。当果胶溶液pH高于6.62时,果胶分子间由于静电排斥作用发生解聚,无法形成凝胶,此pH的果胶溶液呈现豆沙状,并伴随出水现象。
目前市场上销售的LMP大都通过酸提法制得,因此,在实际应用中应根据实际情况考虑果胶添加后溶液pH的变化。在制备LMP凝胶时,钙离子溶液的添加应于果胶溶液加热后,边搅拌边添加,以预防凝胶的形成。除此之外,本研究在计算连续解离的羧基负离子的浓度时,采用了数学估算法。因为LMP为高分子物质,无法精确计算,而为了科学的反应pH高于6.62以后无法形成凝胶的机理时,采用估算法计算羧基负离子的浓度,解释为静电排斥作用使果胶解聚。
4 结论
LMP在不同pH范围内的凝胶强度及破裂强度的拟合模型均为多项式。果胶溶液pH在1.78—3.10时,依靠半乳糖醛酸未解离羧基基团或羟基间的氢键及甲氧酯基团之间的疏水相互作用,使得溶胶向凝胶转变,凝胶强度及破裂强度均逐渐增大,达到21.19 g,凝胶颜色均匀,但容易破裂成块;果胶溶液pH在3.10—4.20时,连续未酯化的半乳糖醛酸残基与Ca2+间形成形成钙桥,凝胶趋于稳定,凝胶强度及破裂强度均在22.00 g附近波动,凝胶颜色均匀、色泽光亮、质地均匀;果胶溶液pH在4.20—6.62时,果胶分子间产生静电斥力,从而使果胶发生解聚、脱脂化反应,电负性的羧基负离子与钙离子结合愈加困难,直至pH在6.62时无法形成凝胶。
References:
[1] Lutz R, Aserin A, Wicker L, GARTI N. Structure and physical properties of pectins with block-wise distribution of carboxylic acid groups., 2009, 23(3): 786-794.
[2] 韩健, 王永春, 黄震. 果胶凝胶在生物医学应用上的研究进展. 农产品加工, 2015, 378(2): 58-60.
Han J, Wang Y C, Huang Z. Advances in biomedical applications of pectin gels., 2015, 378(2): 58-60. (in Chinese)
[3] 奚苗苗, 张筱芳, 张三奇. 果胶及果胶钙在结肠靶向给药系统中的应用. 西北药学杂志, 2005(4): 183-184.
XI M M, Zhang X F, Zhang S Q. Application of pectin and pectin calcium for colon-targeting drug delivery system pectin-based systems drug delivery system., 2005(4): 183-184. (in Chinese)
[4] 陈娜. 天然食用胶体-果胶应用及发展前景. 食品安全导刊, 2013(9): 46-47.
Chen N. Application and development of natural edible colloid pectin., 2013(9): 46-47. (in Chinese)
[5] 刘文, 董赛丽, 梁金亚. 果胶的性质、功能及其应用. 三门峡职业技术学院学报, 2008(2): 118-121.
LIU W, DONG S L, LIANG J Y. The nature, function and application of pectin.hnic, 2008(2): 118-121. (in Chinese)
[6] Ngouémazong D E, Jolie R P, Cardinaels R, FRAEYE I, LOEY A, MOLDENAERS P, HENDRICKX M. Stiffness of Ca2+-pectin gels: combined effects of degree and pattern of methylesterification for various Ca2+concentrations., 2012, 348(3): 69-76.
[7] NGOUEMAZONG D E, NKEMAMIN N F, CARDINAELS R, JOLIE R P, FRAEYE I, LOEY A, MOLDEBAERS P, HENDRICKX M. Rheological properties of Ca2+-gels of partially methylesterified polygalacturonic acid: Effect of “mixed” patterns of methylesterification., 2012, 88(1): 37-45.
[8] NGOUEMAZONG D E, TENGWEH F F, FRAEYE I, DUVETTER T, CARDINAELS R, LOEY A V, MOLDENAERS P, HENDRICKX M. Effect of de-methylesterification on network development and nature of Ca2+-pectin gels: Towards understanding structure-function relations of pectin., 2012, 26(1): 89-98.
[9] ALBA K, KASAPIS S, KONTOGIORGOS V, DUVETTER T, CARDINAELS R, LOEY A V, MOLDENAERS P, HENDRICKX M. Influence of pH on mechanical relaxations in high solids LM-pectin preparations., 2015, 127: 182-188.
[10] NGOUEMAZONG D E, TENGWEH F F, FRAEYE I, DUVETTER T, CARDINAELS R, LOEY A V, MOLDENAERS P, HENDRICKX M. Effect of de-methylesterification on network development and nature of Ca2+-pectin gels: Towards understanding structure-function relations of pectin., 2012, 26(1): 89-98.
[11] CAPEL F, NICOLAI T, DURAND D, BOULENGUER P, LANGENDORFF V. Calcium and acid induced gelation of (amidated) low methoxyl pectin., 2006, 20(6): 901-907.
[12] BEHROUZIAN F, RAZAVIS S M A, KARAZHIYAN H. Intrinsic viscosity of cress () seed gum: effect of salts and sugars., 2014, 35: 100-105.
[13] 陈豆弟, 张露, 代红灵. 果胶提取工艺的研究进展. 饮料工业, 2012, 15(2): 8-11.
CHEN D D, ZHANG L, DAI H L.Advances in study on pectin extraction processes,, 2012, 15(2): 8-11. (in Chinese)
[14] 李永春, 赵美荣, 朱月. 低酯果胶制备方法的研究进展. 赤峰学院学报(自然科学版), 2012, 28(20): 104-107.
LI Y C, ZHAO M R, ZHU Y. Advances in preparation of low ester pectin.(, 2012, 28(20): 104-107. (in Chinese)
[15] 戴余军, 丁文, 石会军. 纤维素酶提取柑桔皮果胶工艺条件的研究. 河北农业大学学报, 2011, 34(2): 71-74.
DAI Y J, DING W, SHI H J. Research on the process of extraction pectin from orange peel using the cellulose., 2011, 34(2): 71-74. (in Chinese)
[16] PTICHKINA N M, MARKINA O A, RUMYANTSEVA G N. Pectin extraction from pumpkin with the aid of microbial enzymes., 2008, 22(1): 192-195.
[17] WANG S, CHEN F, WU J, WANG Z F, LIAO X J, HU X S. Optimization of pectin extraction assisted by microwave from apple pomace using response surface methodology., 2007, 78(2): 693-700.
[18] 余先纯. 纯响应面优化微波加热法提取橘皮果胶. 食品研究与开发, 2012, 33(3): 64-67.
YU X C. Response surface optimize on extraction of pectin from orange peels with microwave heating., 2012, 33(3): 64-67. (in Chinese)
[19] 邓刚, 焦聪聪, 许杭琳. 超声辅助提取佛手废渣果胶的工艺优化. 食品科学, 2011, 32(14): 103-107.
DENG G, JIAO C C, XU H L. Optimization of ultrasonic-assisted extraction for pectin from bergamot residue., 2011, 32(14): 103-107. (in Chinese)
[20] 汪海波. 低酯果胶的凝胶质构性能研究. 食品科学, 2006, 27(12): 123-129.
WANG H B. Study on gelling characteristics to low methoxyl pectin., 2006, 27(12): 123-129. (in Chinese)
[21] 赵江. 低酯果胶凝胶形成条件的优化研究. 河南工业大学学报(自然科学版), 2009, 30(2): 8-11.
ZHAO J. Study on optimizing of gelatin forming conditions of low methoxyl pectin., 2009, 30(2): 8-11. (in Chinese)
[22] International Organization for Standerdization. Adhesives-animal glues- methods for sampling and testing[S]. ISO 9665: 1998.
[23] WINTER H H, MOURS M. Rheology of polymers near liquid-solid transitions., 1997(134): 165-234.
[24] CHAMBON F, WINTER H H. Stopping of crosslinking reaction in a PDMS polymer at the gel point., 1985, 13(6): 499-503.
[25] GILSENAN P M, RICHARDSON R K, MORRIS E R. Thermally reversible acid-induced gelation of low-methoxy pectin., 2000, 41(4): 339-349.
[26] FRAEYE I, COLLE I, VANDEVENNE E, DUVETTER T, BUGGENHOUT S V, MOLDENAERS P, LOEY A V, HENDRICKX M. Influence of pectin structure on texture of pectin-calcium gels., 2010, 11(2): 401-409.
[27] MORRIS E R, POWELL D A, GIDLEY M J, REES D A. Conformations and interactions of pectins: I. Polymorphism between gel and solid states of calcium polygalacturonate., 1982, 155(4): 507-516.
[28] CARDENAS A, GOYCOOLEA F M, RINAUDO M. On the gelling behaviour of ‘nopal’ (Opuntia ficus indica) low methoxyl pectin., 2008, 73(2): 212-222.
[29] STEPHEN A M. Food polysaccharides and their applications., 1995, 1(2): 25-85.
[30] 王卫平. 食品改良剂: 亲水胶体的性质及应用(之五)-果胶.食品与发酵工业, 1996(4): 81-84.
WANG W P. The properties and applications of hydrophilic colloid (five) – pectin., 1996(4): 81-84. (in Chinese)
[31] LOOTENS D, CAPEL F, DURAND D, NICOLAI T, BOULENGUER P, LANGENDORFF V. Influence of pH, Ca concentration, temperature and amidation on the gelation of low methoxyl pectin., 2003, 17(3): 237-244.
(责任编辑 赵伶俐)
Gel Model and Mechanism of Low-Methoxyl Apple Pectin for Various pH
HAN Wan-you, DONG Gui-ru, QU Yu-ling MENG Yong-hong, GUO Yu-rong, DENG Hong
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710100)
【Objective】The mathematical model of LM apple pectin gel strength which were prepared by citric acid - disodium hydrogen phosphate buffer solution were established with pH 1.78-6.62 and the mechanism of gelling was analyzed by data of rheology. The results of this study will provide a theoretical reference for the application of LMP in different pH environments. 【Method】Gel strength, rupture strength and rheological properties were measured by texture analyzer and rheometer, respectively. A model was established with Mate lab 10.0. According to the sol-gel transition point in graphs which was combined with storage shear modulus and loss shear modulus intersections in the graph, the pH range of gels could be determined. The mechanism of gels under different pH was analyzed on the basis of changes in storage shear modulus and loss shear modulus in the graph and the structure characteristics.【Result】The model of gel strength was followed by the polynomial law. In the range of pH 1.78-3.10, hydrophobic interactions between methoxyl ester groups and hydrogen bonds among undissociated carboxyl groups were formed which resulted in the sol to gel transition and gel strength to 21.19 g. When the pH of pectin solution was about 3.10, hydrophobic interactions between methoxyl ester groups and hydrogen bonds between undissociated carboxyl groups were formed. So that the elastic modulus increased significantly, the gel strength was about 21.00 g. In this pH range, although the pectin charge density was low, Ca2+was still promoted the gel. However, the dissociation of carboxyl anion concentration could not reach the optimal amount of electronegativity carboxyl to form a stable “egg box”, gels were not so stable. In the range of pH 3.10-4.20, Calcium Bridge were formed between galacturonic acid residues and Ca2 +, which made gel tend to be stable and gel strength near to 22.00 g. In the range of pH 4.20-6.62, the electrostatic repulsion was predominant between pectin chains, which generated pectin gradually depolymerization because of free dissociated -COO-reached a maximum.【Conclusion】In the pH range of 1.78-6.30, LMP could form gels. When pH was in the range of 1.78-3.10, the pectin could be used at strongly acidic conditions and suitable for higher acidity of foods and medicines. When pH was in the range of 3.10-4.20, the stable gels could meet the food requirements of higher food gel texture. The results of this study have practical significance for the application of low methyl ester pectin in food with different pH ranges.
LM-apple pectin; pH; gel strength; rheological; elastic modulus; mathematical model; gel mechanism
2016-01-08;接受日期:2016-04-27
国家现代农业产业技术体系建设专项(CGRS-28)
韩万友,E-mail:wy562510@outlook.com。通信作者孟永宏,E-mail:mengyonghong@snnu.edu.cn
