塔杨松散型均质胚性愈伤组织培养体系
2016-11-10刘艳军杨静慧秦艳筠
刘艳军 张 超 杨静慧* 李 冰 刘 婷 秦艳筠
(1.天津农学院园艺园林学院,天津 300384; 2.日本筑波大学生命与环境科学学院,筑波 305-8572)
塔杨松散型均质胚性愈伤组织培养体系
刘艳军1张 超2杨静慧1*李 冰2刘 婷1秦艳筠1
(1.天津农学院园艺园林学院,天津 300384;2.日本筑波大学生命与环境科学学院,筑波 305-8572)
为了获得塔杨(Populus×canadensisMoench ‘Tower’)松散型、均质、胚性愈伤组织(LHEC),以塔杨试管苗叶片为外植体,通过不同浓度激素(BA、KT、2,4-D)、蔗糖和无机盐处理,建立了松散型愈伤组织(LC)诱导—继代培养—胚性愈伤诱导的高效体系。结果显示:塔杨叶片在低蔗糖和低无机盐(1/4MS+2 mg·L-12,4-D+1 mg·L-1BA+10 g·L-1)的培养基上培养可以诱导出完全的LC(诱导率100%)。LC在继代培养基(MS+2.0 mg·L-12,4-D+2.0 mg·L-1BA+Vc100 mg·L-1+30 g·L-1)上进行2~3次转接后,再转移到LHEC培养基(MS+0.5 mg·L-12,4-D+3 mg·L-1BA+Vc100 mg·L-1+40 g·L-1蔗糖)上培养4~5周(每7天转接1次),即可诱导出具有许多球状体(原胚状体)的松散型胚性愈伤组织。此外,适当的2,4-D与BA浓度比例,可以使LC保持细胞的松散特性、不形成根、无褐变,生长快;含有30 g·L-1蔗糖的培养基利于LC生长和LHEC的形成;维生素C能较好的抑制继代培养中的褐变;BA有利于形成LC,而KT有利于紧密型愈伤组织的形成,同时BA处理的愈伤组织生长较KT处理的快;当2,4-D浓度为0.5~1 mg·L-1时,随着BA浓度的增加,LHEC的数量也随之增加,当BA为3 mg·L-1时,LHEC数量达到最大值100%。本文还对影响愈伤组织胚性化的主要因素进行了讨论。提出的各项建议对均质胚性愈伤组织LHEC的培养有重要的指导意义。
蔗糖;培养体系;无机盐;激素;胚状体
塔杨(Populus×canadensisMoench)是我国近年来新引进的杨树杂交品种,塔杨为加杨的一个变种,是从加杨品种中经过现代生物技术人工选育出的杨树新品种,属于黑杨派。其具有生长快、树形美观、抗逆性强等特点[1]。杨树作为重要的林业资源,不仅是重要的观赏树种,还具有经济价值,在水土保持和维护生态平衡等方面也发挥着重要的作用。由于杨树的速生特性[2~3]和经济价值较高等特点,使杨树育种得到了广大研究者和生产者的重视,培育具有优良性状的杨树品种一直是育种工作者所追求的目标[4~6]。近年来,采用体细胞和组织培养进行离体诱变育种技术在许多物种上获得了应用[7~9]。在以往的体细胞诱变育种中所采用的胚性愈伤组织多为结构紧密的胚性愈伤团[10~11],由于这种愈伤团仅仅在其表面分散一些胚性细胞[12],其内部多已分化,这些组织基本不具有分裂能力,很难诱导出胚状体,甚至在长时间培养后褐变、死亡。所以,采用这类愈伤组织作为诱变对象往往诱变效率低,不能充分发挥胚性愈伤组织诱变育种的优势。而均质的松散型的胚性愈伤组织内部的细胞氧气及营养等供应充足,内、外细胞均处于活跃状态,易于诱变;其次,构成该愈伤组织的各个细胞处于相同的生理生长状态,是理想的细胞试验系统,可以保证试验处理的均等性或同一性;第三,其易于分离,可直接用于悬浮培养,并可大大简化液体悬浮培养程序。因此,均质的、松散型胚性愈伤组织能够克服上述愈伤组织的不足[13],其构成的每一个细胞都是一个独立的个体,诱变率高,可以形成许多不同的单细胞植物体,并能用于细胞学基础研究(如细胞对各种胁迫的反应)、细胞多倍体育种、细胞诱变育种和悬浮培养的前期培养。本研究的目的是建立塔杨松散型的、均质的胚性愈伤组织诱导体系,为进一步的体细胞学研究、诱变育种等奠定基础。
1 材料与方法
1.1 试验材料
本试验所用塔杨由天津农学院园林植物实验室提供。
1.2 试验方法
1.2.1 塔杨试管苗的准备
采集当年生的塔杨嫩枝,用流动的自来水冲洗枝条5 min后用20 g·L-1的次氯酸钠消毒20 min,再用0.01 g·L-1的升汞溶液消毒2 min。消毒后,将枝条用无菌水反复冲洗、接种到含有20 g·L-1蔗糖和30 g·L-1琼脂的1/2MS培养基上。长出芽后,在相同的培养基上继代培养,并取长到5 cm左右的短枝备用。
1.2.2 塔杨松散型愈伤组织的诱导
取上述短枝上的叶片,剪成0.5~1 cm的大小(每片上带有叶脉或少量叶柄),接种到不同的诱导培养基中进行松散型愈伤组织的诱导。每个培养皿为一个处理,其中放15~20片;5次重复。每周观察1次愈伤组织的生长情况。培养温度为23~25℃,暗培养(黑暗、无光照)。培养4~5周后,选择松散型愈伤组织进行继代培养。
1.2.3 塔杨松散型愈伤组织的继代培养
将上述获得的松散型愈伤组织转入继代培养基。在转接愈伤组织时,一定要去掉外植体,并只选择结构松散、絮状的松散愈伤组织,小心地将其成块转移,避免弄碎,转移的愈伤组织块要3~5 mm3。每处理10~15个愈伤组织块;5次重复。培养条件为20~23℃,每天24 h全光照,光照强度为2 000 lx。
1.2.4 塔杨松散型胚性愈伤组织的诱导
上述松散型愈伤组织经过2~3次的继代培养后(每7~10天继代一次),再转入松散型胚性愈伤组织培养基。此次转移的愈伤组织块质地开始变硬,转移时应尽量将变硬的愈伤组织块整体转移,避免分散、变小。每处理10~15个愈伤组织块,5次重复。然后,用同样的培养基每7~10天转接一次。转接时尽量切取愈伤组织块外围的愈伤组织,避免带入组织内部褐变的部分。其中Vc是在培养基融化后50℃时加入培养基(Vc需提前抽滤灭菌)。转接后,每7天观察记录一次。培养条件同继代培养。
2 结果与分析
2.1激素、无机盐和蔗糖对塔杨松散型愈伤组织LC的诱导
表1的结果显示,用MS培养基培养时(蔗糖浓度30 g·L-1),选用BA、KT、2,4-D等激素的各种浓度组合都不能诱导出LC(表1:配方1-1~1-13),诱导出的都是绿色、紧密型的愈伤组织。这说明在诱导LC过程中激素不是关键因素。当仅仅降低培养基中无机盐含量到1/4MS或仅仅降低蔗糖的含量至10 g·L-1时,也不能诱导出LC(表1:配方1-14~1-17)。只有当蔗糖浓度降低至10 g·L-1和无机盐含量降低到原浓度的1/4时(1/4MS)才能获得LC,获得率为85%~100%(表1:配方1-18~1-22)。说明培养基的渗透压对形成愈伤的种类影响较大。可能是影响到了愈伤组织的结构,如MS培养基或高蔗糖(30 g·L-1)培养基都诱导出的是紧密型愈伤组织。这种紧密型愈伤组织细胞排列紧密,细胞间隙较小,组织中细胞大小不一,并分化出导管等细胞,外观深绿色,是一些质地十分坚硬的大块状愈伤组织(图1)。这类组织很难分化出胚性愈伤和很难诱导出体细胞胚。而降低渗透压后形成的LC细胞较小,多为圆球形,排列疏松,胞间隙明显;外观为淡黄色或黄绿色,组织质地松软(图2)。这类组织容易分化出胚性愈伤组织。
表1还显示,在降低渗透压后,所有培养基都能诱导出LC,但愈伤组织的细胞类型、生长、稳定性等都存在较大的差异。首先在没有加入细胞分裂素BA的培养基中虽然可以诱导出LC,但在其愈伤上很快长出较多的不定根,随着培养时间的增长,不定根数量也增加,同时诱导出的愈伤组织也逐渐变得紧密,甚至褐变、死亡(表1:配方1-18)。BA能使不定根消失(表1:配方1-19~1-21)。这可能与杨树内源激素中生长素含量较高,加入BA后抑制了其内源生长素的作用,从而抑制了根的生长。

表1 激素、无机盐和蔗糖对塔杨松散型愈伤组织的诱导

图1 紧密型愈伤组织显微结构和外观形态 A.显微照片(10×40);B.外观Fig.1 The compact callus microstructure and morphology A.Micrograph(10×40); B.Appearance
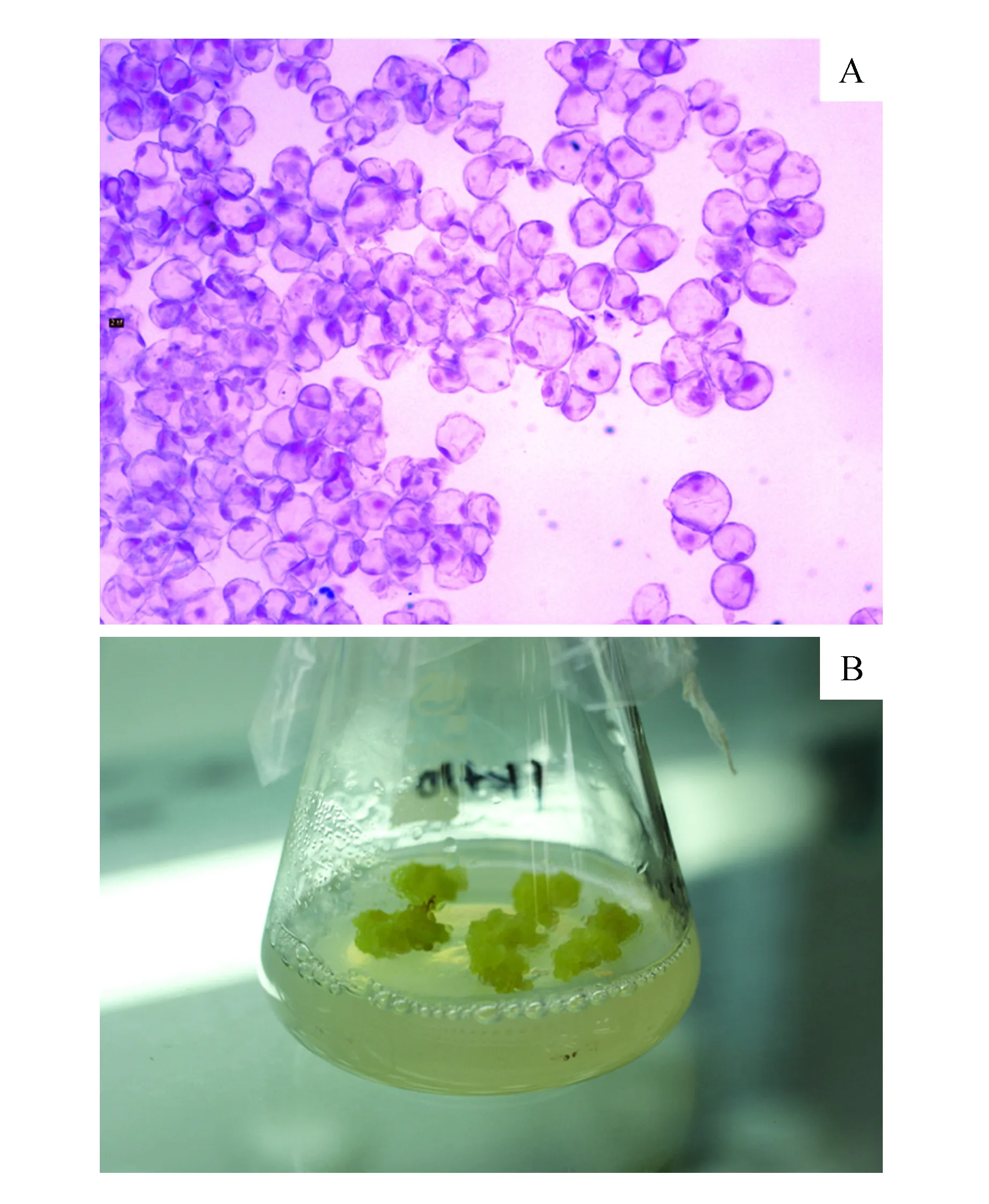
图2 松散型愈伤组织显微结构和外观形态 A.显微照片(10×40);B.外观Fig.2 The loose callus microstructure and morphology A.Micrograph(10×40); B.Appearance
在低渗透压下,当生长素2,4-D浓度较低时,愈伤组织生长速度较慢,且所诱导的愈伤组织中夹杂着紧密型愈伤组织,尤其是在靠近叶片边缘的部位出现较多的紧密型愈伤(表1:配方1-19~1-20)。当2,4-D和BA浓度都较高时,愈伤组织除出现一定数量的不定根外,颜色会逐渐变黄、变褐(表1:配方1-22)。只有当2,4-D与BA浓度比例合适时(配方1-21)才使形成的愈伤组织保持细胞的松散特性、无不定根、无褐变,始终保持正常的生长。
因此,配方1-21(1/4MS+2.0 mg·L-12,4-D+1.0 mg·L-1BA+10 g·L-1蔗糖)培养基最好,为诱导塔杨LC的最佳培养基配方。
2.2继代培养中激素、蔗糖和维生素C对塔杨LC生长的影响
在诱导出LC后,如果不及时转移到新培养基上,愈伤组织会很快褐变、死亡,有些逐渐变成透明状,并解体死亡。此外,上述诱导的LC是在较低的渗透压(10 g·L-1蔗糖和1/4MS)下诱导的,需转移到渗透压较高的培养基上,以利于胚性细胞的形成。因此,需经过2~3次的继代培养,才能诱导出稳定的、均质的、松散型愈伤组织。
表2显示,在蔗糖为30 g·L-1时,细胞质浓度增大,质地变硬,多数愈伤组织生长较快。但当采用50 g·L-1时,出现愈伤组织生长减慢的现象(表2:2-6和2-8)。此外,在无维生素C(Vc)的培养基中,愈伤组织培养时间较长时会出现较严重的褐变现象(表2:2-1、2-2、2-3),Vc能较好的抑制褐变(表2:2-4、2-5、2-6)。愈伤组织生长时会产生的一些次生代谢物和内源乙烯[14~15],Vc能抑制这些物质的产生或降低其作用,同时Vc对愈伤组织的生长也有一定的促进作用。第三, BA更有利于形成松散型愈伤组织,而KT更有利于形成紧密型愈伤组织,同时KT处理的愈伤组织生长速度较慢(表2:2-4、2-7、2-8)。
综上所述,诱导塔杨形成松散型的、均质的愈伤组织的最佳培养基配方应含有30 g·L-1蔗糖和VC及适宜浓度的BA,即配方2-5(MS+2.0 g·L-12,4-D+2.0 mg·L-1BA+Vc 100 mg·L-1+30 g·L-1蔗糖)。
2.3不同浓度BA和2,4-D对塔杨松散型胚性愈伤组织的诱导
诱导出的松散型愈伤组织在配方2-5的培养基中继代2~3次后,如果继续培养,则几乎全部的愈伤组织均处于快速生长状态,同时愈伤组织结构开始变硬、变紧密,颜色变为白色,最后形成为结构紧密的白色愈伤组织块。如果不进行培养条件的调整,这些愈伤组织会不断增大,最后其内部褐变或木栓化,只有外部几层细胞继续分裂增殖。这种愈伤组织是不能分化和再生的。为此,我们将配方2-5上培养获得的白色松散型、均质的、质地变硬的愈伤组织转接到新的培养基中(表3)观察其生长。
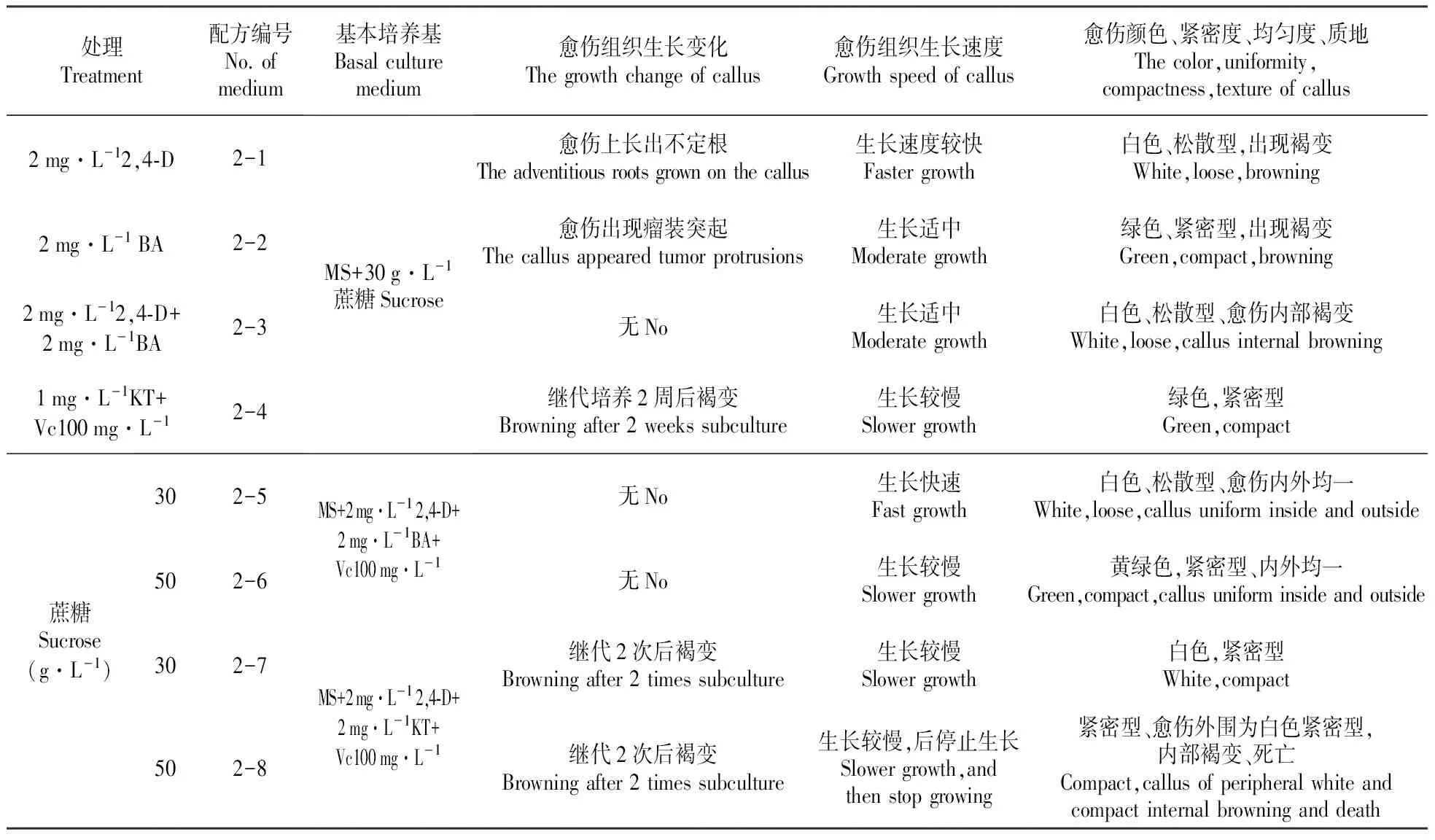
表2 激素、蔗糖和维生素C对塔杨继代培养中散松型愈伤组织生长的影响
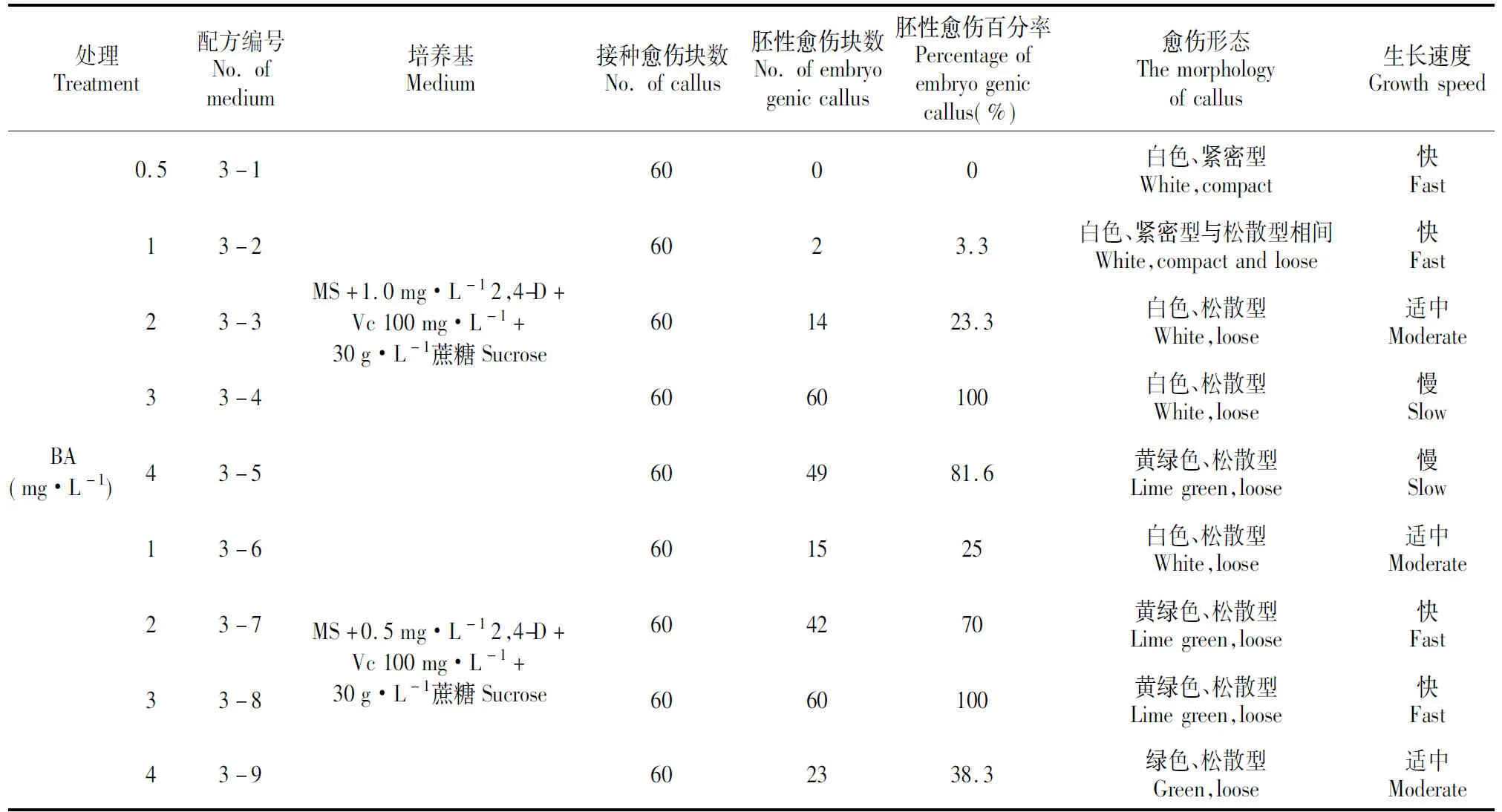
表3 不同浓度BA和2,4-D对塔杨松散型胚性愈伤组织的诱导
从表3可以看出,在2,4-D浓度为0.5~1 mg·L-1时,随着BA浓度的增加,胚性愈伤组织的数量也随之增加;当BA为3 mg·L-1时,胚性愈伤组织百分率达到最大值100%;以后,随着BA浓度的增加而下降。表3中配方3-4和配方3-8的培养都能使愈伤组织百分率达到100%。但是,配方3-4培养的愈伤组织生长较慢,另外,由于低浓度2,4-D更有利于愈伤组织的分化和胚状体的形成[16]。所以,选择配方3-8(MS+0.5 mg·L-12,4-D+3 mg·L-1BA+Vc100 mg·L-1+40 g·L-1蔗糖)作为胚性愈伤组织诱导的最佳培养基配方。
当用配方3-8转接培养5~8次后,松散的塔杨愈伤组织开始转变为较硬的愈伤组织,而且颜色也从白色絮状逐渐过渡到乳白色、黄色,最后为嫩绿色。此时的愈伤组织中有许多球状体(即为原胚状体)[17],结构松散,当以上特征愈伤组织出现时,塔杨的胚性愈伤组织诱导完成。
3 讨论
胚性愈伤组织的诱导受到激素、温度、培养基的渗透压、继代时间、抗氧化试剂、初始愈伤组织的状态、愈伤组织分割的大小和形态、外植体的选择和放置方式等的影响。在我们的试验中发现细胞分裂素是胚性愈伤组织形成的关键,适当浓度的细胞分裂素有利于胚性愈伤组织的形成,与李雪梅的研究相反[20],与郭玲玲等的研究也有所不同,她认为与生长素的含量有关[21];低温利于愈伤组织向胚性愈伤组织转化,与傅杰、王丽等人的研究一致[18~19];降低培养基中蔗糖和无机盐的浓度,可以增加胚性愈伤组织的比例,可能与降低蔗糖转运蛋白基因VvSUC12的表达有关[22];及时的较快的继代培养有利于愈伤组织的胚性化,可能与增加其过氧化物酶、酸性磷酸酯酶的活性有关[23];抗氧化试剂的添加如Vc有利于愈伤组织的胚性化,与刘福平等的研究一致[24]; 过于松软的初始愈伤组织很难获得胚性愈伤,过于紧密的初始愈伤组织虽然容易胚性化,但不利于均质胚性愈伤组织的形成;适宜大小的愈伤组织利于其胚性化,如塔杨以3~5 mm3大小最为适宜;选择幼嫩部位或含有分生组织较多的部位作为外植体易获得胚性愈伤组织;外植体和转接的愈伤组织放置时具有明显的“位置效应”,即不能埋进培养基,仅放置在培养基的表面(既与培养基接触,又留有一定的空隙)的LC诱导率高。此外,光照、植物品种、外植体的生理状态及培养基中的营养,如有机成分的添加等都对愈伤组织的胚性化有不同程度的影响。
总之,在诱导植物愈伤组织向胚性愈伤转变过程中,不同种类的植物存在较大的差异,要根据上述影响因素具体情况具体分析,找出制约的关键因素,从而获得理想的诱导效果。
4 结论
综上所述,诱导塔杨松散型胚性愈伤组织的方法为:采用塔杨试管苗叶片为外植体,在1/4MS+2.0 mg·L-12,4-D+1.0 mg·L-1BA+10 g·L-1蔗糖培养基上进行松散型愈伤组织的诱导, 然后转入MS+2.0 mg·L-12,4-D+2.0 mg·L-1BA+Vc100 mg·L-1+30 g·L-1蔗糖的培养基上进行继代培养2~3次,最后转到MS+0.5 mg·L-12,4-D+3 mg·L-1BA+Vc100 mg·L-1+40 g·L-1蔗糖的培养基上,进行松散型的胚性愈伤组织的诱导,转接3~5次后即可诱导出塔杨的松散型的胚性愈伤组织。
1.杨静慧,刘艳军,李建科,等.观赏塔杨组织培养工厂化育苗[J].天津农学院学报,2012(4):9-23.
2.金培林,晓红,张连才,等.速生杨树优良品种选育[J].科技创新导报,2010(32):237.
3.钮开明.杨树速生丰产林栽培实用技术[J].现代农业科技,2008(1):27.
4.周忠诚,袁继池,肖文萍,等.杨树常规杂交育种技术体系的改进[J].中国新技术新产品,2013,16:181-182.
5.唐璇.黑杨派杨树杂交F1代的早期选择与评价[D].武汉:华中农业大学,2012:6-72.
6.张健夫,周大猛.旱丰18号杨树的杂交育种[J].东北林业大学学报,2009,37(10):8-9.
7.蒋姝,孟金贵,崔光芬,等.植物离体诱变及在百合育种中的应用[J].中国农学通报,2012(4):69-73.
8.王良群,刘勇,武秀兰,等.高粱体细胞克隆变异化学诱导方法研究[J].中国农学通报,2010(22):62-64.
9.张硕,张明方,杨景华.体细胞无性系变异技术在园艺植物育种中的应用[J].北方园艺,2006(5):48-50.
10.谢海燕,毛碧增,单兰兰,等.狗牙根颖果胚性愈伤组织的诱导和胚性细胞的超微结构及植株再生[J].植物生理与分子生物学学报,2004,30(2):209-215.
11.尤培雷,许杰,钱忠英.黄秋葵愈伤组织的产生及其切片观察[J].上海农业学报,2007,23(3):92-95.
12.曲复宁,李丽霞,张敏,等.仙客来(CyclamenpersicumMill)胚性愈伤形态和组织结构的动态观察[J].烟台大学学报,2003,16(1):54-59.
13.苗博瑛,刘艳军,杨静慧.黑莓松散型胚性愈伤组织的诱导[J].山西农业科学,2014,42(3):209-212,216.
14.郑利英,张斌,秦公伟,等.不同透气性容器对西洋参胚性愈伤组织诱导的影响及与乙烯的关系研究[J].时珍国医国药,2013,24(11):2794-2795.
15.邵利,崔堂兵,赵树进.何首乌根和茎愈伤组织的二苯乙烯苷含量[J].华南理工大学学报:自然科学版,2010,38(9):147-150.
16.姜凤英,冯辉.植物生长调节剂对羽衣甘蓝小孢子胚发生的影响[J].园艺学报,2006,33(3):642-644.
17.廖婧,方炎明,虞木奎.麻栎茎段体胚发生和组织学观察初报[J].植物研究,2011(5):575-578.
18.傅杰,吴耀武,陈漱阳,等.小麦远缘杂种幼胚胚状体的发生、发育及低温对愈伤组织分化能力的影响[J].实验生物学报,1996,29(4):313-323.
19.王丽,陈耀锋,张月琴,等.低温与植物生长调节剂预处理对小麦成熟胚培养特性的影响[J].西北植物学报,2013,33(5):1041-1046.
20.李雪梅,刘熔山.小麦幼穗胚性愈伤组织诱导及分化过程中内源激素的作用[J].植物生理学通讯,1994,30(4):255-260.
21.郭玲玲,苗书魁,计巧灵,等.‘范妮’亚麻高频率体细胞胚胎发生及组织学观察[J].植物研究,2011,31(3):306-312.
22.陈思,曾磊,陈尚武,等.蔗糖转运蛋白基因VvSUC12和VvSUC27在葡萄胚性和非胚性愈伤组织中的差异表达[J].生物工程学报,2010,26(4):530-537.
23.刘福平,陈淳,许传俊.过氧化氢与蝴蝶兰胚性愈伤组织诱导[J].园艺学报,2009,36(9):1339-1344.
24.刘航空,韩明玉,禹婷,等.影响油桃叶片产生胚性愈伤组织的因素[J].果树学报,2006,23(3):370-374.
CultureSystemonLoose,Homogeneous,EmbryogenicCallusofPopulus×canadensisMoench‘Tower’
LIU Yan-Jun1ZHANG Chao2YANG Jing-Hui1*LI Bing2LIU Ting1QIN Yang-Jun1
(1.College of Horticulture and Landscape,Tianjin Agricultural University,Tianjin 300384;2.College of Environmental Science,University of Tsukuba in Japan,Tsukuba 305-8572)
To get loose, homogeneous, embryonic callus(LHEC) fromPopulus×canadensisMoench ‘Tower’, an efficient system was set up from the loose callus induction(LC) to successive transfer culture and embryonic callus induction with leaves of seedlings in tube and different kinds and concentration of hormones(BA,KT,2,4-D), sucrose and inorganic salt. The loose, homogeneous callus(LC) was induced completely(induction rate of 100%) with leaves and on the culture medium of low sugar and low inorganic salt(1/4MS+2 mg·L-12,4-D+1 mg·L-1BA+10 g·L-1sugar). The globule embryonic callus(formerly embryoid) was induced after LC was transferred for 2-3 times on successive culture medium(MS+2.0 mg·L-12,4-D+2.0 mg·L-1BA+Vc 100 mg·L-1+30 g·L-1), then transferred onto the medium of LHEC(MS+0.5 mg·L-12,4-D+3 mg·L-1BA+Vc 100 mg·L-1+40 g·L-1sucrose), and cultivated for 4-5 weeks(one time transfer every seven days). The cells of LC was kept in the characteristics of loose without roots, browning and with fast growth under the appropriate concentration of 2,4-D and BA. LC grew better and LHEC was produced more in medium containing 30 g·L-1sucrose. Vitamin C suppressed browning of LC in subculture. BA was conducive to the formation of LC, but KT was beneficial to the formation of compact callus, while the callus growth was faster by treatment of BA than by KT. When the concentration of 2,4-D was 0.5-1 mg·L-1, the number of LHEC was increased with the increase of BA concentration. The number of LHEC reached to the maximum of 100%, when BA was 3 mg·L-1. The main factors were discussed in callus embryogenic.
sucrose;culture system;inorganic salt;hormone;embryoid
国家农业科技成果转化基金(2012GB2A100015)和天津市科委重大科技专项(12ZCDZNC04800)
刘艳军(1970—),男,高级实验师,主要从事园艺植物组织培养和分子育种研究。
* 通信作者:E-mail:ajinghuiyang2@aliyun.com
2015-05-27
S792.181
A
10.7525/j.issn.1673-5102.2016.01.017
