梭梭幼苗个体生长规律与死亡率关系研究
2016-11-10唐立松乔瑞平
田 媛 唐立松 乔瑞平,3
(1.博天环境集团股份有限公司,北京 100082; 2.中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室,乌鲁木齐 830011; 3.北京博天环境设计研究院有限公司,北京 100081; 4.中国科学院阜康荒漠生态系统研究站,阜康 831500)
梭梭幼苗个体生长规律与死亡率关系研究
田 媛1唐立松2,4乔瑞平1,3
(1.博天环境集团股份有限公司,北京 100082;2.中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室,乌鲁木齐 830011;3.北京博天环境设计研究院有限公司,北京 100081;4.中国科学院阜康荒漠生态系统研究站,阜康 831500)
以古尔班通古特沙漠南缘建群种梭梭的一年生幼苗为研究对象,对幼苗生长和周边环境因子进行了全生长期的连续监测,以期探明一年生梭梭的生长、存活规律。结果表明:梭梭幼苗在水分条件较好的早春生长迅速,但随着降水的减少,7月幼苗地上地下部分都出现了不同程度的凋落,8月恢复生长。在整个生长期中,幼苗死亡率呈现下降趋势,这说明较高的死亡率使得梭梭幼苗快速生长以抢占更多资源;当遭遇干旱时,幼苗又通过同化枝凋落迅速建立了根系供水与地上部分需水之间的新平衡,从而降低了死亡率。同时,幼苗以牺牲地上部分生长为代价将更多的光合产物转向根系,使得幼苗能够获得更多的水分保证生存。
梭梭幼苗;死亡率;根系;水分;生物量
环境因素主要通过影响种子萌发、叶片生长及对环境适应的方式来影响植物的分布范围[1],完成生活史并成功定居是植物适应当地环境的标志[2]。幼苗期是植物生活史中最脆弱的阶段,植物幼苗的生长发育和顺利定居是决定各种群能否完成自然更新的重要阶段,而种群更新又是决定群落演替方向和植被能否恢复的重要过程[3~4]。幼苗的生长由于物种和生态系统的不同受到许多因子的影响,主要为温度、光照、水分等[5]。
同时,植物的形态结构也与水分利用效率以及植物水分关系密切相关,不同功能型的植物避免干旱的途径也不同[6~7]。梭梭(Haloxylonammodendron)是古尔班通古特沙漠盐生、旱生荒漠植物群落的建群种,从种子萌发到幼苗能生长的第一年,是梭梭生活史中最脆弱、死亡率最高的阶段[8~9]。
对不同地域的梭梭研究表明,降水是决定梭梭养分循环、光合生长、群落生产力和更新的重要因素[10~12]。降水的变化会导致梭梭幼苗个体形态与用水策略的改变[13~14],成年梭梭能通过个体形态的调节维持碳水平衡和生理生态的各项指标来渡过干旱[15~16]。但由于降水的不可预测性与野外实验操作的困难,对自然状态下,一年生梭梭幼苗个体的生长规律,种群的存活等适应性表现尚缺乏系统、定量的研究。本文以生长在古尔班通古特沙漠南缘中的当年生梭梭幼苗为研究对象,在全年生长季中定期监测幼苗的生长、生存的各项关键指标及周边环境因子的变化,研究梭梭幼苗在自然条件下的生长情况。并与同地点多年生梭梭生长进行对比,以期探明梭梭定居过程中的生长规律、存活策略及其有效性,为认识梭梭群落的更新演替提供理论依据。
1 材料与方法
1.1 研究区概况
实验在位于中国科学院阜康荒漠生态系统国家野外科学试验研究站(44°22′N,87°55′E,海拔448 m)附近的古尔班通古特沙漠南缘开展。该区年降水量为160 mm,年潜在蒸发量1 000 mm左右,降水季节分配比较均匀,春夏季稍多,冬季稳定积雪日数保持在100~160 d,积雪厚度多在20 cm以上,春季3~5月份,融雪与降雨量之合,占全年总水量的65%以上,是土壤水分最为丰富的时期。
1.2 样地设计与管理
在古尔班通古特沙漠南缘,选取25 m×25 m平坦且无大型植株的丘间地(梭梭天然分布地),于2012年3月积雪融化前人工播种梭梭种子。播种方法:成行列播种,在每个行列交叉处积雪上下种约10粒,然后覆沙土。实验所用梭梭种子是2011年秋季采集,在经过初步筛选后,保存在-18℃的冰箱中至来年3月初播种前。
1.3 观测方法
1.3.1 土壤重量含水率
从2012年4月5号~2012年9月2号,以10 d为取样周期,且取样深度随梭梭幼苗根系长度增加而加深,从开始的40 cm增加到后期的70 cm。每次分别在样地的东、南、西、北、中5个位置以内径5 cm土钻取样,0~10 cm每5 cm取一个样,10~70 cm每10 cm取一个样,用烘干法测定土壤含水率。
1.3.2 梭梭生长动态监测
4月中旬,开始梭梭生长监测,持续到9月初梭梭幼苗同化枝开始脱落为止,监测时段为4月15日~9月2日,同样每10 d进行一次监测。每次选取株高和冠幅具有代表性的8株梭梭幼苗,在离植株根茎为15 cm处挖开半圆型坑,沿坑壁将根系慢慢从上到下将幼苗根系完整的取出,测量梭梭幼苗的株高与根长,随后带回实验室,用水洗去附着在幼苗上的泥土,对地上和地下部分分别进行扫描,测定光合面积和根系表面积。因为梭梭幼苗地上部分的同化枝到7月中旬才开始出现木质化,并且只有主干少量木质化,所以我们用地上部分面积代表同化枝面积。扫描后的样品,放入烘箱105℃杀青2 h,65℃烘干48 h,用天平称取其地上及地下生物量。
1.3.3 幼苗死亡率监测
在4月初,给萌发出土的所有梭梭幼苗编号并记录,同样以10 d为周期,按幼苗编号监测其死亡数量,直至9月初,梭梭幼苗死亡率用以下公式计算:
(1)
式中,Dm是月平均死亡率,Nm是相邻两月梭梭存活幼苗总数的差值,即幼苗死亡数量,N是幼苗萌发时的总量。
1.3.4 气象因子
气象因子的监测由自动气象站完成,测量项目包括气温、相对湿度、风速、总辐射与降水量等。每30秒测量一次,每30分钟取一个平均值,数据由CR10数据采集器(Campbell Scientific Cor,USA)记录。
1.3.5 数据分析
利用SPSS17.0进行数据分析,计算平均值和标准方差,单因素方差分析(ANOVA)用于处理间差异的显著性检验,平均值的标准方差用误差棒示。
2 结果与分析
2.1 梭梭幼苗生长期环境因子
图1给出了2012年全年生长期各月土壤平均含水率和气温的变化。图1a显示了4~8月梭梭主根区(0~60 cm)土壤的水分变化,其中,4、5月份的土壤水分充沛,土壤水含量在3.5%~4%,6月土壤含水率显著下降至2%左右(P<0.05),到了7~8月,干旱程度越发加剧,各个土层的含水率几乎都低于1.5%。同时,在生长期中,各月10:00~19:00平均气温呈阶梯式上升,7月最高,为37.2℃,8月略有下降(图1b)。
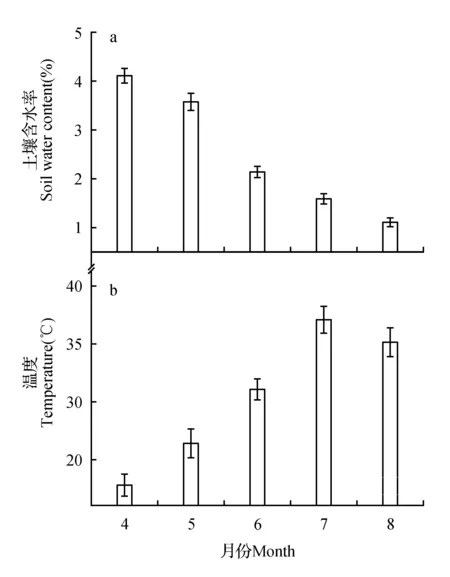
图1 生长期梭梭幼苗主根区域土壤含水率(a)和月平均白天温度(b)Fig.1 Dynamic changes of H.ammodendron seedling root region soil water content(a) and monthly mean daytime temperature(b)
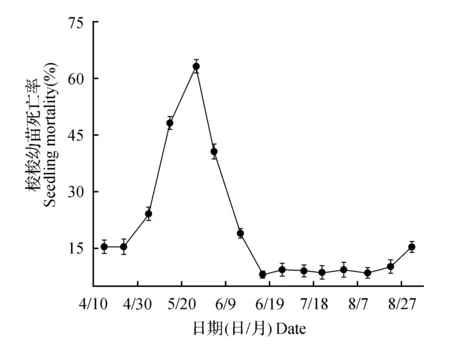
图2 生长期梭梭幼苗死亡率的变化动态Fig.2 Dynamic changes of H.ammodendron seedling mortality in the whole growing period
2.2 梭梭幼苗生长期环境因子
图2显示了梭梭幼苗全年生长期死亡率的变化动态,在4月底幼苗死亡率从15.15%开始显著增加,直至5月底达到峰值63.03%,随后在6月中下旬又急剧下降至7.95%(P<0.05),幼苗死亡率在6月中下旬到8月底都基本在10%左后略有波动。如图2所示,梭梭幼苗的死亡高峰期并非发生在最干旱炎热的7、8月,而是发生在幼苗萌生初期。
2.3 生长期梭梭幼苗地上部分变化动态

图3 生长期梭梭幼苗株高(a)、地上部分表面积(b)和地上生物量(c)的变化动态Fig.3 Dynamic changes of H.ammodendron seedlings plant heights(a), area of aboveground parts(b) and biomass of aboveground(c) in the whole growing period
图3显示了全年生长期中梭梭幼苗地上高度(a)、表面积(b)和生物量(c)的变化情况。幼苗株高从4月萌发起至6月初增加迅速,尤其在5月地上高度显著增加,6月中下旬株高生长开始减缓并略有波动(P<0.05)。进入7月,显著下降(P<0.05),从6.75 cm降至3.58 cm,几乎下降了一半(图3a)。从图3b、c中看出,幼苗地上部分表面积和生物量生长表现出和株高生长相似的趋势,即在水分最充沛的4~6月上旬持续生长,以5月底6月初生长最为迅速(P<0.05),在6月中旬达到最大,分别为3.6 cm2·株-1、0.18克·株-1。随后幼苗地上部分表面积和生物量在7月中旬显著下降直至最低值(P<0.05),虽然在8月恢复生长,但始终处于较低水平。图3表明梭梭幼苗同化枝在7月出现了比较严重凋落现象,同化枝的凋落,使幼苗株高、地上表面积和生物量都显著降低。

图4 生长期梭梭幼苗根长(a)、地下部分表面积(b)和地下生物量(c)的变化动态Fig.4 Dynamic changes of H.ammodendron seedlings rooting depths(a),area of underground parts(b) and biomass of underground(c) in the whole growing period
2.4 生长期梭梭幼苗地下部分变化动态
图4显示了全年生长期中梭梭幼苗根系长度(a)、表面积(b)和生物量(c)的变化情况。其中幼苗根系在全年生长期中基本保持持续加深,略有波动(图4a)。而根系表面积与生物量则在幼苗萌生前期持续增长后在7月中上旬出现下降,随后又各自迅速生长至峰值,分别为5.48 cm2·株-1与0.10 克·株-1,同时,5月下旬至6月中旬与7月中下旬也是根系表面积和生物量的两个迅速生长期(图4b,c;P<0.05)。图4表明,幼苗在全年生长期中的7月中上旬地上地下部分都会出现一定程度的凋落,但地上部分在恢复生长后一直处于较低水平,而根系在凋落后会迅速生长直至当年峰值。
2.5梭梭幼苗地上和地下部分生物量及死亡率月变化动态
图5显示了全年生长期中各月地上地下生物量和死亡率的增长情况。图5a显示,幼苗地上地下生物量在4、5、6水分较为充沛时呈现相似的增长趋势,6月增幅最大,且地上部分生物量分配比率高于地下生物量分配比率。7月水分开始匮乏,幼苗地上地下生物量都出现不同程度的减少,其中地下生物量减少量远低于地上生物量减少量。而在水分更加匮乏的8月幼苗地上地下部分都恢复生长,且地下生物量的分配比率也高于地上部分分配比率。在全年生长期中,幼苗死亡率在水分较为充沛的4、5月处于较高水平,5月达到29.67%的最高增幅。而在水分开始匮缺的6、7月,幼苗死亡率开始下降并出现负增长,而在更为干旱的8月,幼苗死亡率只上升了0.58%。图5暗示,在较好的水分条件下,大量死亡会促使梭梭迅速生长以抢占更多资源,而在遭遇干旱时,幼苗会通过同化枝凋落及调节地上地下生物量分配比例来适应水分的匮缺维持生存生长。
图6展示了相同生境中四年生梭梭地上地下生物量年增长量与相对应的生境年际降雨情况。如图所示,多年生梭梭在雨水较为充沛的年份,地上地下部分均迅速生长;当遇到欠水年时,地上地下生物量均出现不同程度的凋落,且地下部分凋落较少;随着2013丰水年的到来,四年生梭梭恢复生长,且地下部分生物量增长量远高于地上部分生物量增长量。多年生梭梭生长也暗示,随着生境水分的变化,梭梭会调节其生产力的分配比率,以适应降水多变的生境。
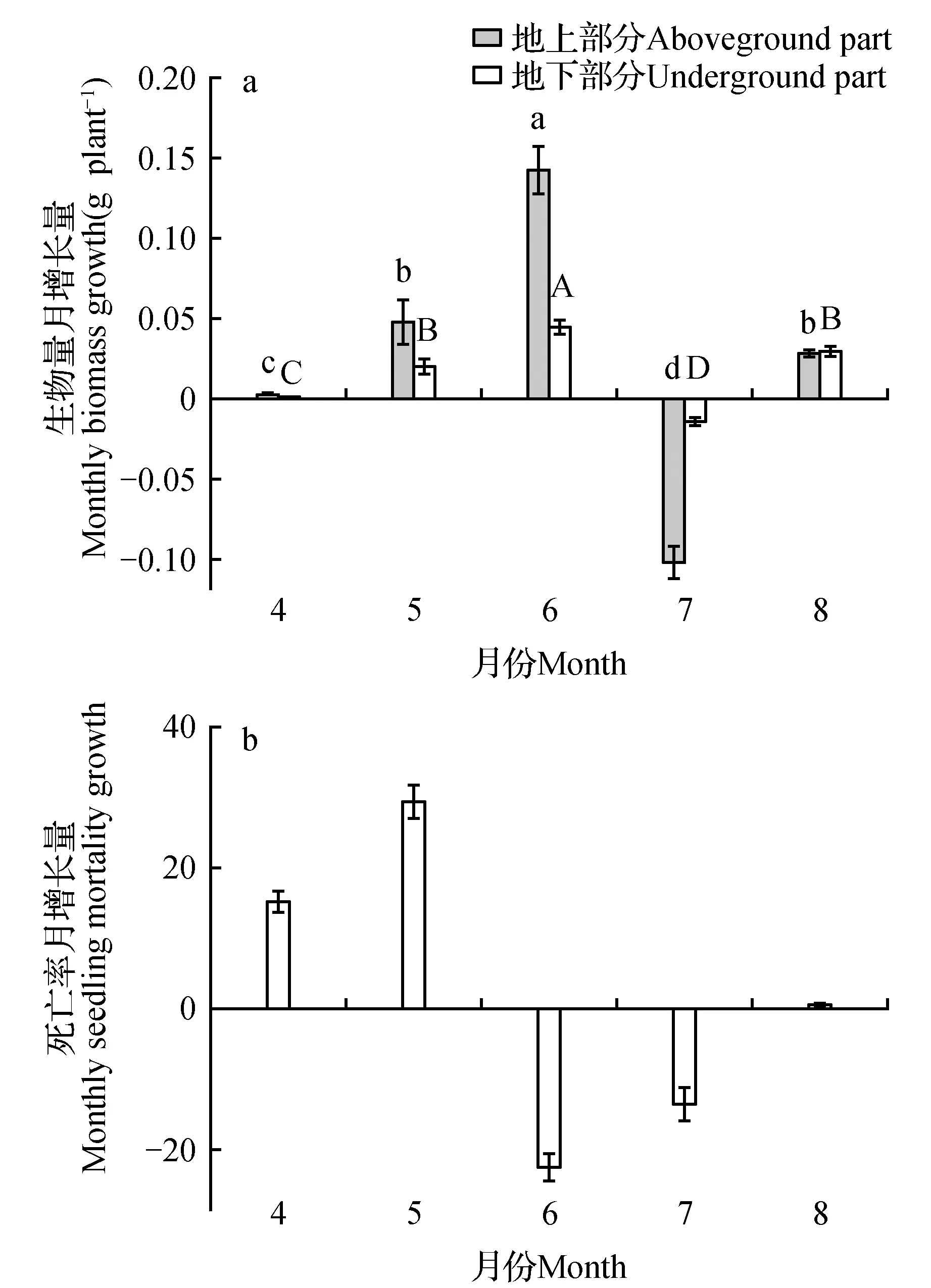
图5 梭梭幼苗地上和地下生物量(a)和死亡率(b)月增长量Fig.5 Monthly biomass growth and seedling mortality of H.ammodendron seedlings aboveground and underground parts

图6 四年生梭梭地上和地下生物量年增长量(a)和年降雨情况(b)Fig.6 Annual biomass increases(a) and annual rainfall(b) in aboveground and underground of four-year H.ammodendron
3 讨论
在水分胁迫下植物可通过生物量分配的变化来获取更多的水分以适应干旱逆境胁迫[17]。不同器官之间生物量分配与植物的干旱适应能力密切相关[18],荒漠灌木可以通过调节根系向着最优(最有利)表现型发展,从而最大程度地获取水分[19]。
马全林等发现风沙土土壤含水率低于0.82%,梭梭死亡;在0.82%~1.30%,梭梭处于退化状态;高于1.30%,梭梭生长正常[20]。本研究中,在水分条件较好时,梭梭较高的死亡率会促进其地上地下部分的迅速生长。当遭遇干旱胁迫后,根系持续的加深并不能缓解土壤与大气干旱带来的水分缺失,原有的地下部分(根系)供水与地上部分(同化枝)耗水之间的平衡被打破。进而同化枝出现凋落以减少水分消耗,同时,光合产物减少,造成了地下部分生物量的减少。但此时梭梭幼苗居高的死亡率迅速降低了50%以上,表明同化枝的凋落使梭梭幼苗可以维持供水与耗水之间的平衡,进而保证了存活同化器官的活性,并且有效地降低了梭梭幼苗的死亡率。在Du的研究中,植被生长策略主要是通过改变植株形态来减少水分散失,增加水分吸收以延迟植物脱水,干旱会限制植物的地上器官的生长发育[21]。这与我们的实验中梭梭幼苗在干旱期的表现一致,同时多年生梭梭的生长也符合这一规律。说明梭梭在生长期会将自身根系碳投入与土壤水分养分的收益权衡相契合,是植物提高植物资源获取能力的一个重要策略。
4 结论
由此可见:(1)梭梭幼苗主要利用降水形成的浅层土壤水维持生长生存;梭梭各个尺度上原有的碳水平衡,都受到降水变化的扰动;(2)有效的形态调节和光合产物的合理分配是其维持生存适应干旱胁迫的关键;主要表现为植株形态可塑性的改变、地上部分生物量累积和光合器官面积的调整及光合产物在根冠之间比例分配的变化。本研究加深了对环境水分条件变化下荒漠植物响应与适应对策的认识,表明不同水平调节适应机制之间存在着内协调性。
1.Thompson P A.Germination ofLycopuseuropaeusin response to fluctuating temperatures and light[J].Journal of Experimental Botany,1969,20:1-11.
2.Gutterman Y.Environmental factors and survival strategies of annual plant species in the Negev desert,Israel[J].Plant Species Biology,2000,15:113-125.
3.Baskin C C,Baskin J M.Seeds:ecology,biogeography,and evolution of dormancy and germination[M].San Diego(CA):Academic Press,1998:78-85.
4.Haprer J L.Population Biology of Plants[M].New York:Academic Perss,1977:122-152.
5.Boyer J S.Plant productivity and environment[J].Science,1982,218:443-448.
6.Molles M.Ecology:concept sand applications[M].New York:Mc Graw-Hill Companies,Inc,2001:344-345.
7.Sperry J S,Hacke U G.Desert shrub water relations with respect to soil characteristics and plant functional type[J].Functional Ecology,2002,6:367-378.
8.李娜,孙涛,毛子军.长期极端高温胁迫对樟子松幼苗生物量及非结构性碳水化合物的影响[J].植物研究,2014,34(2):212-218.
9.田媛,李建贵,赵岩.梭梭幼苗死亡与土壤和大气干旱的研究[J].中国沙漠,2010,30(4):878-884.
10.Su Peixi,Zhao Aifen,Zhang Lixin,et al.Characteristic in photosynthesis,transpiration and water use efficiency ofHaloxylonammodendronandCalligonummongolicumof desert species[J].Acta Bot Boreal.-Occident Sin,2003,23(1):11-17.
11.杨淇越,赵文智.梭梭叶片气孔导度与气体交换对典型降水事件的响应[J].中国沙漠,2014,34(2):419-425.
12.郭京衡,曾凡江,李尝君,等.塔克拉玛干沙漠南缘三种防护林植物根系构型及其生态适应策略[J].植物生态学报,2014,38(1):36-44.
13.刘国军,张希明,吕朝燕,等.不同供水条件下梭梭幼苗生长动态研究[J].中国沙漠,2012,32(2):388-394.
14.郭京衡,曾凡江,李尝君,等.塔克拉玛干沙漠南缘三种防护林植物根系构型及其生态适应策略[J].植物生态学报,2014,38(1):36-44.
15.许皓,李彦,邹婷,等.梭梭生理与个体用水策略对降水改变的响应[J].生态学报,2007,27(12):5019-5028.
16.李彦,许皓.梭梭对降水的响应与适应机制——生理、个体与群落水平碳水平衡的整合研究[J].干旱区地理,2008,31(3):313-323.
17.Shan L S,Zhang X M,Wang Y K,et al.Influence of moisture on the growth and biomass allocation inHaloxylonammodendronandTamaracksramosissimaseeding in the shelterbelt along the Tarim Desert Highway,Xinjiang.China[J].Chinese Science Bulletin,2008,53:93-101.
18.Yin C Y,Wang X,Duan B L,et al.Early growth dry matter allocation and water use efficiency of two sympatricPopulusspeciesas a affect by water stress[J].Environmental and Experimental Botany,2004,53:315-322.
19.Schwinning S,Ehleringer J R.Water use trade-offs and optimal adaptations to pulse-driven arid ecosystems[J].Journal of Ecology,2001,89:464-480.
20.马全林,王继和,朱淑娟.降水、土壤水分和结皮对人工梭梭林的影响[J].生态学报,2007,27(12):5057-5067.
21.Du N,Guo W,Zhang X,Wang R.Morphological and physiological responses ofVortexnegundoL.var.heterophylla(French.) Rehd to drought stress[J].Acta Physiologies Planetarium,2010,32(5):839-848.
RelationshipsbetweentheMortalityandMorphoallaxisofHaloxylonammodendronSeedling
TIAN Yuan1TANG Li-Song2,4QIAO Rui-Ping1,3
(1.Poten Environment Group Co.,Ltd,Beijing 100082;2.State Key Laboratory of Desert and Oasis Ecology,Xinjiang Institute of Ecology and Geography,Chinese Academy of Sciences,Urumqi 830011;3.Poten(Beijing) Environment Design & Research Institute Co.,Ltd.,Beijing 100081;4.Fukang Stations of Desert Ecology,Chinese Academy of Sciences,Fukang 831500)
We studied the growth ofHaloxylonammodendronseedlings to reveal their growth traits and adaptabilities in the southern edge of Gurbantunggut Desert. The the seedlings grew well from early spring when the soil water content was high. With the consumption of soil moisture, the above- and below-ground part of the plant began to fall off, and then both parts recovered growing in August. Seedling mortality showed a downward trend in the whole growth period.H.ammodendronseedling could occupy more resource through rapid growth because of the high mortality rate. The falling of the assimilating branches during the drought period could maintain balance between water supply deficit and water consume of the assimilating organs. This morphological adjustment reduced seedling mortality effectively. Also, the fact that more photosynthate was assigned toward root could ensure seedling survival and recover growth quickly at proper water conditions.
Haloxylonammodendronseedlings;mortality rate;root;water;biomass
国家自然科学基金项目(41171049)
田媛(1983—),女,博士,主要从事生态修复方向研究。
2015-05-08
S728.4
A
10.7525/j.issn.1673-5102.2016.01.012
