大鼠肺微血管内皮细胞的体外分离培养与纯化
2016-11-08梁宏伟朱雯宇王建舫
梁宏伟,冯 波,2,朱雯宇,王建舫,张 涛,穆 祥*
(1.北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室,北京 102206;2.中国农业大学动物医学院,北京 100193)
大鼠肺微血管内皮细胞的体外分离培养与纯化
梁宏伟1,冯波1,2,朱雯宇1,王建舫1,张涛1,穆祥1*
(1.北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室,北京 102206;2.中国农业大学动物医学院,北京 100193)
旨在建立一种简单易行、获得细胞纯度较高的体外分离、培养大鼠肺微血管内皮细胞的方法。取5~7日龄SD大鼠分离外周肺组织,组织植块法获得原代大鼠肺微血管内皮细胞,37 ℃、5% CO2培养箱中传代培养,采用免疫磁珠法对其进行分离纯化,并对分离纯化后的细胞进行免疫荧光及流式细胞鉴定,通过MTT比色分析法准确、安全、可靠地检测纯化后传代肺微血管内皮细胞的增殖情况。结果显示:倒置显微镜下观察单个细胞呈短梭形或多角形,汇合后呈铺路石样,单层贴壁生长,细胞分离纯化后经免疫荧光检测CD31呈阳性,流式细胞仪检测淋巴管内皮细胞表面特有标记VEGFR-3呈阴性(P=0.1,且P<0.5),且复苏后经MTT测得传代细胞的增殖情况良好。成功建立了一种分离高纯度大鼠肺微血管内皮细胞的体外培养方法。
大鼠;肺微血管内皮细胞;体外分离培养;免疫磁珠纯化
微血管内皮细胞(microvascular endothelial cells,MVECs)呈单层覆盖于微血管内表面,是构成血管内外物质交换的一道重要屏障,也是循环血流剪切力和血液中危险因素的主要靶细胞,因而最易并且最早受到伤害。研究发现,微血管内皮细胞具有功能多样性,它不仅是构成血管组织间屏障的重要成分,而且在调节免疫细胞功能[1],保证机体内环境稳定,维持正常生理和免疫功能,以及介导疾病的发生、发展和转归[2]等方面都发挥重要的作用。当前已有研究证明,MVECs是诸多细菌毒素和病毒(如疱疹病毒[3]、艾滋病毒[4]等)等致病因子攻击的主要作用细胞[5-6]。D.Manuela等报道H5N1亚型高致病性禽流感病毒可以在血管内皮细胞系和人肺微血管内皮细胞内复制[7-8],并且诱导人肺微血管内皮细胞凋亡[9]。所以对于肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs)功能和地位的研究越来越受到人们的重视。近年来人们进行了大鼠肺微血管内皮细胞(rat pulmonary microvascular endothelial cells,RPMVECs)体外培养研究,构建实验模型,对深入研究生理和病理情况下大鼠肺微血管内皮细胞的基因、表型、功能的变化及其调控机制具有重要意义。内皮细胞的培养技术始于1921年[10],起初培养技术较落后,直到1963年Y.Maruyama第一次成功培养了人脐静脉血管内皮细胞后才在技术上有所突破,成功分离了大血管内皮细胞[11],对于MVECS来说,由于受到各种条件的限制,发展相对滞后。直到1980年,P.M.Davison等才成功分离培养了MVECs[12]。虽然国内外已有许多关于RPMVECs体外分离与培养方法的报道,但传统的培养方法存在细胞游离少,生长缓慢,极易受到成纤维细胞等其他杂细胞污染[13-15]等问题,并且以往对RPMVECs的原代培养存在纯度低,难度大,成功率低,重复性差,成本高等弊端。本研究是在对原代RPMVECs经长期培养后,针对SD品系大鼠的原代PMVECs组织块培养法中常见问题加以归纳、总结,细节技术加以改进,并对所培养细胞分离纯化和鉴定,旨在提高RPMVECs体外培养方法的可靠性和重复性,而建立的一套操作简便且纯度高的系统的RPMVECs原代培养方法。
1 材料与方法
1.1试验时间、地点
试验于2015年10月至2016年3月在北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室进行。
1.2试验动物
5~7日龄SD大鼠,雌雄均可,购自中国科学院遗传所实验动物中心。
1.3主要仪器和器材
CO2培养箱(日本SANYO,型号:MCO-17AC),倒置荧光显微镜(OLYMPUS,型号:IX71-A21PH ),高速低温离心机(SIGMA 6-16K),DG-ò型酶联仪(南京电子管厂),流式细胞仪(美国 BD 公司,型号:FACSAria Ⅲ 型),细胞培养板(Costar公司,型号:3516),超菌工作台(哈尔滨东联电子技术开发有限公司,型号:DL-CF-IND)。
1.4试剂
D-Hank’s(GIBCO,批号:H2387),胎牛血清(FBS,PAA Laboratories Gmbh,批号:A04105-1121),DMEM高糖培养基(Sigma,批号:1136551),胰蛋白酶(1∶250,Gibco,批号:2750018),L-谷氨酰胺(Sigma,批号:03126),兔抗大鼠CD 31单克隆抗体(Origene,批号:TA504773),FITC标记的羊抗兔二抗(Abcam,批号:ab6785),DAPI染色液 (北京博奥森生物技术有限公司,批号:C-0033),ECGS (Millipore,批号:02-102),肝素钠(万通药业,批号:H32022088),MTT细胞增殖及细胞毒性检测试剂盒(Sigma,批号:C0009),CELLECTION PAN MOUSE IGG KIT(Invitrogen,批号:11531D),血管内皮生长因子受体3(VEGFR-3,北京博奥森生物技术有限公司,批号:bs-2202R-FITC)。
1.5RPMVECs的原代培养
取5只5~7日龄SD大鼠,麻醉后颈椎脱臼处死,75%酒精浸泡消毒,无菌取出肺,冷D-Hank’s清洗3次,在干滤纸上剪取肺边缘组织(3 mm左右),缓慢滚动去除脏层胸膜后,置于少量胎牛血清中,并剪成小于1 mm×1 mm×1 mm大小的,近于糊状的组织块。然后采用组织块植块法,用移液枪均匀涂于6孔培养板底部。将培养板倒置于37 ℃含体积分数5% CO2细胞培养箱中,使组织块贴壁 30 min后缓慢滴加20% DMEM培养基(20% FBS,2% L-谷氨酰胺、青霉素1×104U·mL-1、链霉素1×104U·mL-1、ECGS 15 μg·mL-1、1.5%肝素钠),以刚好浸没组织块为宜。于37 ℃、5% CO2恒湿恒温培养箱中培养24 h后换液,90 h弃组织块,待细胞汇合成团消化传代[9]。
1.6RPMVECs的传代培养
选取生长至完全汇合状态的培养孔,吸弃原培养基,用37 ℃预热的D-Hank’s清洗3次后每孔加入0.5 mL 0.05%胰蛋白酶(含0.005% EDTA),显微镜下观察,待细胞间连接疏松,且大部分细胞收缩变圆变亮时立即终止消化,以1 000 r·min-1室温离心5 min后弃上清,加培养基混匀,按1∶2比例接种于细胞培养板继续培养[17]。待RPMVECs传至第2~3代时分离纯化,培养至第5代左右,细胞状态最佳时用于试验研究。
1.7RPMVECs的免疫磁珠分离纯化
待细胞传到第2~3代时采用免疫磁珠纯化法[16]直接分离纯化得到RPMVECs。向盛有预洗过磁珠的离心管中加入一抗,室温下孵育30 min,磁力震动后弃去上清,重复操作一次,加入细胞悬液并混悬,2~8 ℃ 孵育20 min,用200 μL缓冲液3悬浮磁珠并重复操作一次。
1.8RPMVECs的鉴定
1.8.1抗CD 31抗体免疫荧光染色将经免疫磁珠纯化分离得到的RPMVECs接种在于预置有细胞培养专用圆形盖玻片的培养板,于培养箱中静置24 h,用预热的(37 ℃) PBS漂洗3次,加入预冷的(4 ℃)4%多聚甲醛溶液固定20 min,加入一抗兔抗大鼠CD 31抗体,4 ℃孵育过夜,阴性对照组PBS代替一抗。与FITC标记的羊抗兔IgG 37 ℃ 孵育45 min,DAPI作用10 min。最后用超纯水冲洗甘油封片,荧光显微镜下观察并拍照。
1.8.2流式细胞仪检测血管内皮生长因子受体3(vascular endothelial growth factor-3,VEGFR-3)的表达取纯化后的RPMVECs,常规法消化,2 000 r·min-1离心7 min,弃上清,PBS洗1次后重悬,制成大于1×109L-1的单细胞悬液,分至每个待测的流式管,0.1 mL·管-1,分别加入荧光标记的抗体及其相应的同型对照抗体,室温避光孵育15 min,2 000 r·min-1离心7 min后300 μL PBS重悬后上机[16]。
1.9MTT比色分析法检测传代RPMVECs的增殖情况
取纯化鉴定后对数生长期的大鼠肺微血管内皮细胞,采用常规方法将细胞冻存[17]。一段时间后,复苏[17]细胞,MTT比色法[18]测定贴壁细胞增殖活性。选取复苏后经传代培养生长为单层的 RPMVECs,常规方法消化后,接种入 96 孔培养板中,细胞密度为1×104mL-1,同时设不含细胞的空白对照孔,每组设4个重复。37 ℃、5% CO2静置培养,分别于RPMVECs传代后0、24、48、72、96 h时加入MTT,继续培养 4 h,加入Formazan溶解液,吹打至紫色结晶完全溶解后,用酶联免疫检测仪测定 570 nm 波长处的光吸收度OD值,比色时用空白孔调零,计算平均值,以时间为横坐标,平均光吸收度为纵坐标绘制细胞生长曲线[19]。
2 结 果
2.1细胞形态学观察结果
倒置显微镜下观察肺组织块贴于培养板后(图1A),24 h 开始逐渐有细胞游出(图1B),观察并记录下48 h 细胞的生长状态(图1C),90 h 左右弃组织块,观察并记录下弃组织块前后、及弃后24 h 细胞的生长状态(图1D~F),原代细胞生长5~7 d后,倒置显微镜下观察到细胞多呈梭形或三角形,细胞质丰富、胞核清晰呈卵圆形,且由原来的分散集落逐渐融合形成细胞单层,呈鹅卵石镶嵌状排列,具有微血管内皮细胞典型的铺路石样形态,如若过度融合生长会因细胞过于紧密而呈现进行性细长纺锤形。此时可将原代细胞传代,随着传代培养次数的增加细胞变为长梭形,并逐渐呈漩涡样生长或聚集生长。若传代次数过多将会导致原代RPMVECs贴壁率下降,纯度降低,则不再适宜试验研究。因此,本试验根据细胞的生长情况,当细胞传至第2~3代时采用免疫磁珠纯化法直接分离纯化,并对纯化后的细胞进行相关抗原的鉴定,以保证细胞的纯度。
2.2RPMVECs经免疫磁珠分离纯化的结果
通过磁珠纯化系统纯化细胞,用CD 31因子抗原进行筛选。光学显微镜下观察并记录RPMVECs在免疫磁珠分离纯化前、后经0、24、72 h细胞的对比形态(图2)。纯化前的细胞中混有杂细胞,经CD31免疫磁珠筛选,以确保培养出纯度高、大小均一,状态良好的RPMVECs。
2.3CD31抗原鉴定结果
CD31免疫荧光染色结果呈阳性(图3),在倒置荧光显微镜下RPMVECs的细胞质和细胞膜呈典型的黄绿色荧光,如图3L,而细胞核不着色。细胞质与细胞核间界限明显,细胞整体呈梭形或多边形。但经DAPI染色后细胞核呈典型的蓝紫色荧光,如图3M,荧光染色图片叠加后结果如图3N所示。

A.肺组织块贴于培养板;B.24 h 细胞游出;C.48 h 所游出细胞的生长状态;D.90 h弃组织块前细胞的生长状态;E.弃掉组织块后细胞的状态;F.弃组织块后24 h细胞的生长状态A.Lung tissue blocks attached to culture plate;B.24 h cells swim out;C.The growth state of the 48 h cells;D.The growth state of cells in abandoned tissues;E.The state of cells after abandoning tissues;F.The growth state of the cells after 24 hours of abandoned tissues图1 原代培养的细胞形态Fig.1 The cell morphology of primary culture

G.RPMVECs分离纯化前的生长状态;H.RPMVECs分离纯化后0 h的生长状态;I.RPMVECs分离纯化后24 h的生长状态;J.RPMVECs分离纯化后72 h的生长状态G.The growth state of RPMVECs before separation and purification;H.The growth state of RPMVECs after 0 h was isolated and purified;I.The growth state of RPMVECs after 24 h was isolated and purified;J.The growth state of RPMVECs after 72 h was isolated and purified图2 RPMVECs分离纯化前、后的结果Fig.2 The growth state of RPMVECs before and after purification
2.4细胞免疫表型的测定
由于对肺部血管内皮细胞筛选时最可能混有淋巴管内皮细胞,且淋巴管内皮细胞特有的表面标记物为VEGFR-3抗体,经流式细胞仪检测表达结果呈阴性(P=0.1,且P<0.5),则说明分离纯化后的细胞无淋巴管内皮细胞混杂,见图4。
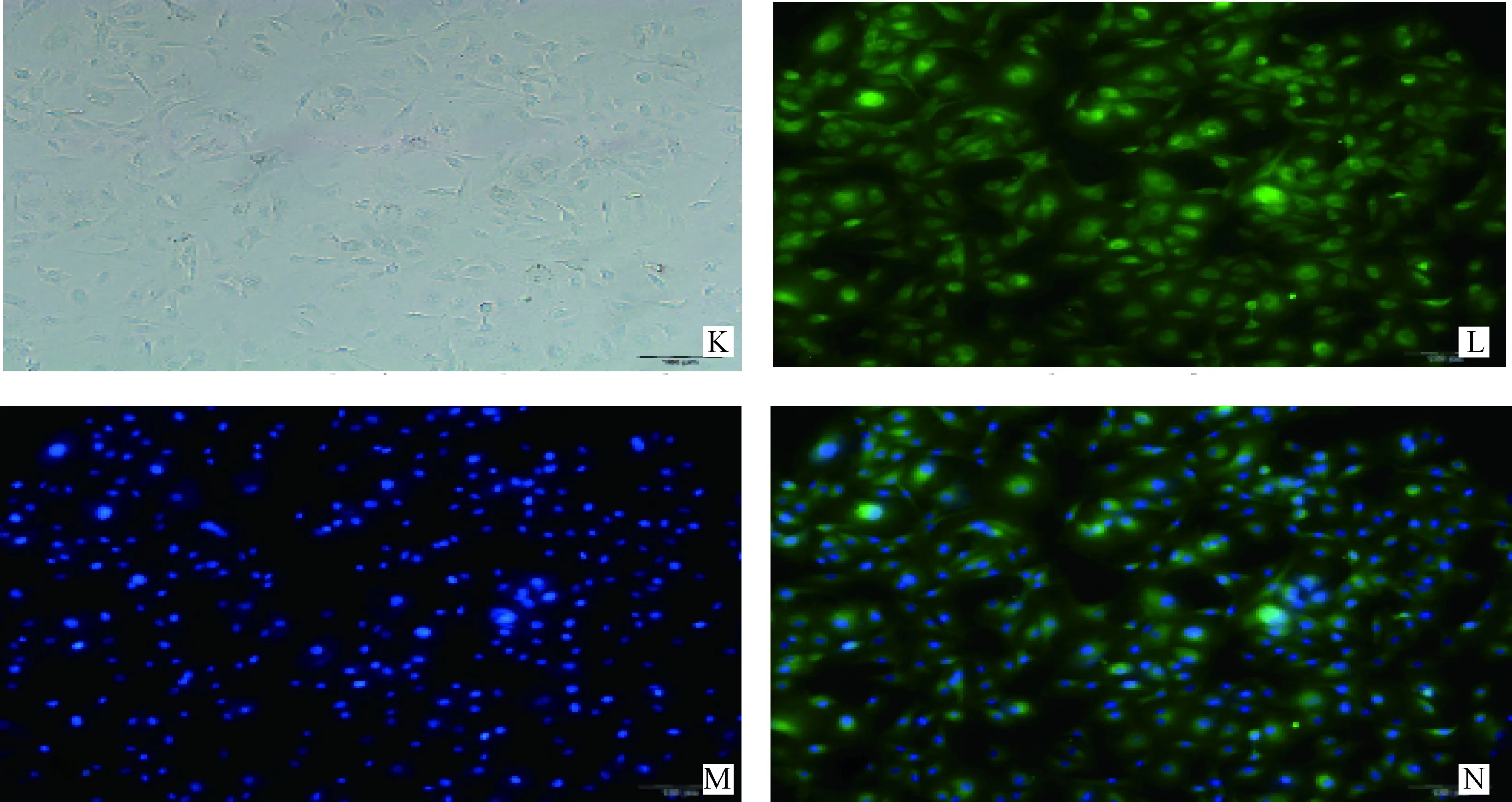
K.倒置荧光显微镜明场下RPMVECs的生长状态;L.RPMVECs细胞膜上的CD31 抗原荧光染色的结果;M.RPMVECs细胞核经DAPI荧光染色的结果;N.倒置荧光显微镜荧光激发下RPMVECs的生长状态K.Inverted fluorescence microscope RPMVECs off-court growth state;L.Results of RPMVECs membrane CD31 antigen fluorescence staining;M.Results of RPMVECs nuclei by DAPI fluorescence staining;N. Inverted fluorescence microscope fluorescence inspired RPMVECs growth state图3 CD31抗体鉴定结果Fig.3 Cell identification for CD31 antigen
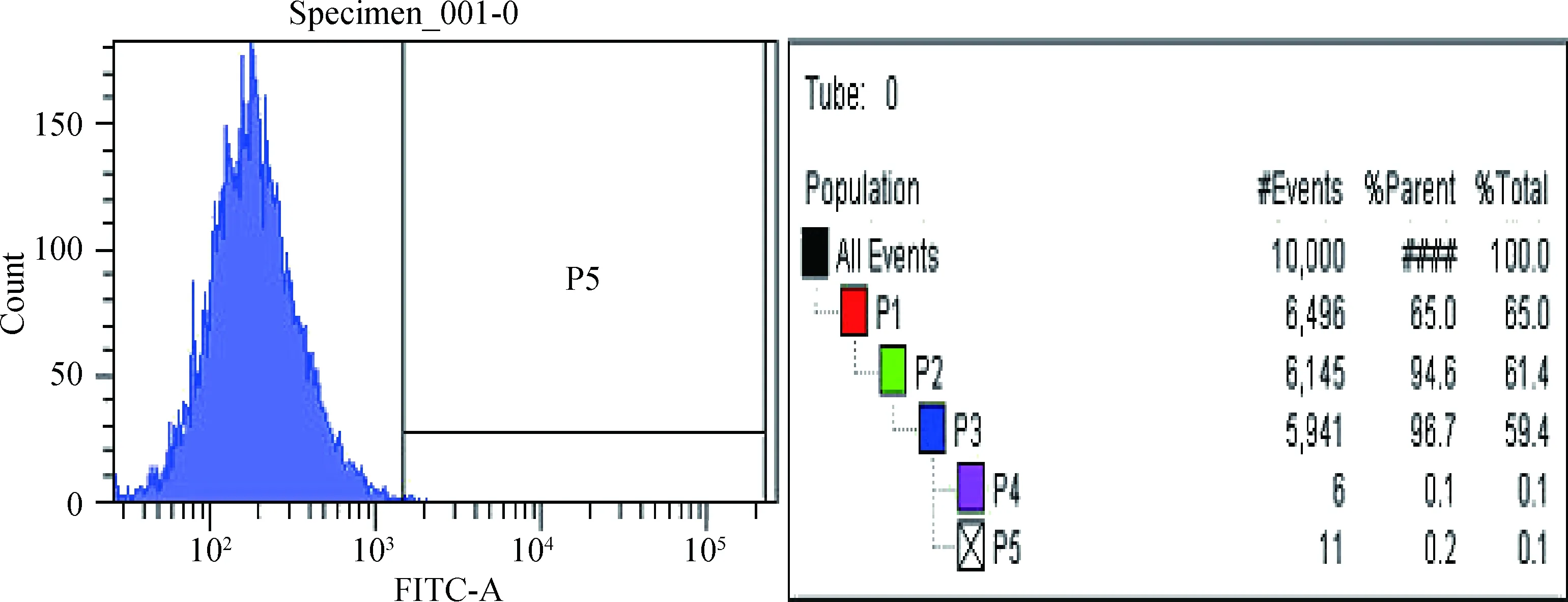
图4 VEGFR-3表达结果呈阳性的细胞占所分选细胞的比例Fig.4 The proportion of VEGFR-3 positive cells in selected cells
2.5分离纯化后RPMVECs的冻存和复苏
待RPMVECs培养至对数生长期时(图5O),采用常规方法消化细胞后严格按照梯度冻存法[22]步骤要求将细胞冻存,将冻存管迅速移入液氮容器罐内储存。为检测分离纯化后细胞的状态,取出冻存管,将细胞复苏,接种于6孔培养板中,37 ℃、5% CO2培养箱中培养,次日观察(图5P)细胞形态一致,呈卵圆形,大小均一,说明分离纯化所得细胞状态好,抗冻存能力强,换液后继续传代培养。
2.6MTT法检测纯化后传代RPMVECs的增殖情况
MTT法测定复苏后传代RPMVECs生长曲线,检测共用4 d,最后以培养时间为横轴,每日测得的细胞平均吸光度值为纵轴,单点标示出细胞每日平均吸光度值,连接各点即成生长曲线图(图6)。由图6可知,前3 d OD值与时间呈正相关,如图中0~72 h段所示,第3天细胞量经对数期达到最大值,而后OD值稍有降低,即第四天后细胞生长进入平台期,增殖速率放缓,如图中72~96 h段所示。
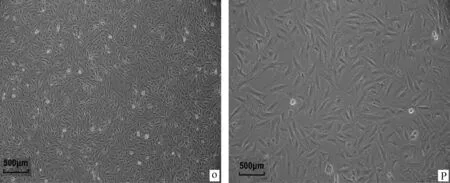
O.冻存前RPMVECs细胞形态;P.复苏后RPMVECs细胞形态O.Cell morphology of RPMVECs before cryopreservation;P.Cellular morphology of RPMVECs after resuscitation图5 分离纯化后RPMVECs的抗冻存能力Fig.5 Ability of RPMVECs against cryopreservation ofter isolation and purification
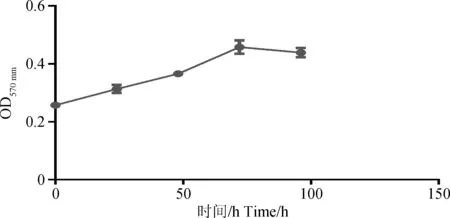
图6 MTT作用时间对RPMVECs增殖反应的影响Fig.6 Affection of MTT effect time on RPMVECs proliferation response
3 讨 论
血管内皮细胞是覆盖于血管内膜表面呈单层扁平或多角形的细胞,具有多种生物学功能:参与血管活性物质代谢;参与调节凝血、抗凝与纤溶;参与维持血管壁完整[20]。不同部位的血管内皮细胞在形态学、表型和功能等方面均有所不同。肺微血管内皮细胞在物质转运、急性肺损伤等过程中发挥重要作用,可见该细胞的体外培养成功与否,直接决定着体外研究流感病毒和内皮细胞间相互作用的关键。出于对这些生理功能及病理作用的研究,国内外开展肺微血管内皮细胞的原代培养已近20年,目前国际上对该细胞体外培养方法多为酶消化法[21-22]及组织植块法[23],本试验在原代细胞培养过程中对以往的组织植块法加以改进。
在原代RPMVECs培养过程中,大鼠外周肺组织的正确取材是成功的前提,严格剪取外周肺组织可以减少大血管内皮细胞和平滑肌细胞的污染[14]。既往的研究对外周肺组织取材的厚度并未作出明确界定,本研究参考多名学者以往的培养方法[24],将取材范围严格控制在肺叶边缘3 mm左右。以往关于原代PMVECs分离培养的文献中所介绍[20],多数是将所取肺组织剪成1 mm×1 mm×1 mm大小的组织块,60 h后去除组织块。但经多次试验,摸索发现若将组织块剪的更小,甚至接近于糊状时,缩短 PMVECs 爬出时游离的距离。众所周知组织块法培养原代内皮细胞是根据细胞迁移能力的差异而分离出RPMVECs的,但分离过程中仍有可能混有杂细胞,所以要严格把控去除组织块的时间,肺组织贴壁培养24 h 后血细胞开始游出,48 h后伴有PMVECs游出,72 h后开始游出的则是成纤维细胞,所以此前文献多报道在组织块贴壁培养60 h后将其去除[13-16],理论上若此时去除组织块,则培养板中只剩下血细胞和PMVECs,其中血细胞可通过换液和传代的过程去除,但是此方法很难保证完全无成纤维细胞的混杂,况且贴壁培养60 h即弃掉组织块,此时游出来的PMVECs数量较少,且增殖缓慢,不利于细胞生长。综合以上因素,本试验将弃组织块的时间调整到贴壁培养90 h 后,因为此时游出的PMVECs数量已远超于成纤维细胞的量,PMVECs已占明显优势,成纤维细胞的生长将明显受到抑制,而后对那些不具备典型铺路石样的细胞进行机械刮除。同时本试验对原代细胞的培养基加以改进,添加了促进内皮细胞生长因子ECGS 15 μg·mL-1和1.5%肝素钠,该种培养基在促进PMVECs 生长的同时还可较好地抑制成纤维细胞的生长。运用改良后的组织植块法大大提高了所分离原代RPMVECs的纯度和数量,降低了杂细胞的污染程度,为进一步做细胞纯化提供了有力的前提条件。
如何对培养出的贴壁内皮细胞进行分离纯化,目前缺乏公认的特异性方法和标志。“鹅卵石”或“铺路石”样形态被认为是内皮细胞的特征性细胞形态,但是文献[24]报道及本试验结果显示,传代培养细胞形态可发生变化,主要表现为梭形或多角形。因此,培养细胞除进行形态学观察判断外,必须对已得到的原代RPMVECs进行分离纯化。目前,国际上已形成的PMVECs纯化的方法主要有生物特性选择法、物理剖除法、局部消化法、差速黏附法及免疫磁珠法[16,24]。本试验中,作者采用免疫磁珠法分离纯化原代RPMVECs,该法具有分离速度快、效率高、重复性强、操作简单且不影响被分离细胞的生物学性状和功能的特性,符合实验室所用研究方法的要求。
为了获得纯度更高,更具有保种意义的原代RPMVECs,作者对分离纯化后的细胞进行鉴定,鉴定方法多为免疫组化染色Ⅷ因子、CD31相关抗原[14-16]和流式细胞仪对细胞表面受体的检测。此前对Ⅷ因子、CD31相关抗原表达的检测一直被认为是内皮细胞免疫组织化学鉴定的经典指标。但在徐顺贵等[13]的研究中PMVECs Ⅷ因子相关抗原的表达为阴性。所以本试验采用免疫组化法对CD31相关抗原进行鉴定,而由于内皮细胞表面标记CD31的高表达仅限于1~3代[24],所以作者选择第2~3代细胞经免疫磁珠分离纯化后鉴定,免疫荧光检测CD31呈阳性。E.Kukk等[25]于1996年利用受体亲和色谱法从前列腺癌细胞的胞外基质中提纯出了血管内皮生长因子C DNA,血管内皮生长因子C是近年来发现的血管内皮生长因子家族新成员,并且可特异性地与淋巴管内皮细胞上的VEGFR-3结合,是目前所知唯一具有淋巴管生成作用的因子。分离纯化肺部血管内皮细胞的过程中最可能混有淋巴管内皮细胞,且其表面特有标记为VEGFR-3抗体,所以将经CD31免疫磁珠纯化后的细胞再经流式细胞仪检测VEGFR-3抗体表达呈阴性,说明纯化所得的RPMVECs无淋巴管内皮细胞的混杂。
复苏分离纯化后的RPMVECs,根据细胞状态反映其较强的抗冻存能力,继续传代培养并采用MTT法检测细胞增殖情况。经典MTT法简便、迅速、准确、安全、价廉,已在医学和生物学等许多研究领域中用于对细胞活性、细胞增殖和细胞毒性的检测,但对于测定分离纯化后传代RPMVECs增殖情况的报道较少。其基本原理是活细胞的琥珀脱氢酶能还原MTT,形成不溶于水的蓝紫色甲臜(formazam)结晶,加入有机溶剂结晶溶解,酶标仪测定的吸光度值便可准确直观地反映活细胞的量。
4 结 论
成功建立了分离纯度高、生长快的大鼠肺微血管内皮细胞的体外培养方法,且本改良方法简便易行、可重复性强。
[1]ROSEMBLATT M,BONO M R.Functional consequences of immune cell adhesion to endothelial cells[J].CurrPharmDes,2004,32(4):109-120.
[2]SAKAO S,TARASEVICIENE S L,WOOD K,et al.Apoptosis of pulmonary microvascular endothelial cells stimulates vascular smooth muscle cell growth[J].AmJPhysiolLungCellMolPhysiol,2006,291(9):362-368.
[3]AKULA S M,WANG F Z,VIEIRA J,et al.Human Herpes virus 8 Interaction with Target Cells Involves Heparan Sulfate[J].Virology,2001,282:245-255.
[4]FEDERICO B,STEFANIA M,GUIDO S,et al.Interactions between endothelial cells and HIV-1[J].IntJBiochemCellB,2001,33:371-390.
[5]田丽芳,张涛,张爽,等.口蹄疫 146 S 对乳鼠心肌膜微血管内皮细胞分泌 IL-6 的影响[J].中国农学通报,2008,24(4):19-22.
TIAN L F,ZHANG T,ZHANG S,et al.Effect of foot and mouth disease 146 S on the secretion of IL-6 in cardiac microvascular endothelial cells of neonatal rats[J].ChineseAgriculturalScienceBulletin,2008,24(4):19-22.(in Chinese)
[6]ITO T,KOBAYASHI Y,MORITA T,et al.Virulent influenza A viruses induce apoptosis in chickens[J].VirusRes,2002,84(1-2):27-35.
[7]VIEMANN D,SCHMOLKE M,LUEKEN A,et al.H5NI virus activates signaling pathways in human endothelial cells resulting in a specific unbalanced inflammatory response[J].JImmunol,2011,186(1):164-173.
[8]ZENG H,PAPPAS C,BELSER J A,et al.Human pulmonary microvascular endothelial cells support productive replication of highly pathogenic avian influenza viruses:possible involvement in the pathogenesis of human H5N1 virus infection[J].JVirol,2012,86(2):667-678.
[9]OCANA-MACCHI M,BEL M,GUZYLACK-PIRIOU L,et al.Hemagglutinin-dependent tropism of H5N1 avian influenza virus for human endothelial cells[J].JVirol,2009,83(24):12947-12955.
[10]LEWIS W H,WEBSTER L T.Wandering cells,endothelial cells,and fibroblasts in cultures from human lymph nodes[J].JExpMed,1921,34(4):397-405.
[11]MARUYAMA Y.The human endothelial cells tissus culture[J].ZZellforschMikroskAnat,1963,60:69-79.
[12]DAVISON P M,BENSCH K,KARASEK M A.Isolation and growth of endothelial cells from the microvessels of the newborn hunman foreskin in cell culture[J].JInvestDermatol,1980,75(4):316-321.
[13]徐顺贵,吴国明,徐智,等.组织块法培养大鼠肺微血管内皮细胞的综合鉴定[J].第三军医大学学报,2007,29(1):39-42.
XU S G,WU G M,XU Z,et al.Comprehensive identification of rat pulmonary microvascular endothelial cells cultured by tissue block method[J].JournalofThirdMilitaryMedicalUniversity,2007,29(1):39-42.(in Chinese)
[14]姜文.大鼠肺微血管内皮细胞原代培养方法研究[J].中外医学研究,2011,9(10):3-4.
JIANG W.Primary culture method of rat pulmonary microvascular endothelial cells[J].ChineseAndForeignMedicalResearch,2011,9(10):3-4.(in Chinese)
[15]高润娣,曹婕,卢珊,等.小鼠肺微血管内皮细胞的培养鉴定及其血管形成功能的研究[J].中国病理生理杂志,2012,28(1):186-188,192.
GAO R D,CAO J,LU S,et al.Culture and identification of mouse pulmonary microvascular endothelial cells and Study on its function of blood vessel formation[J].ChineseJournalofPathophysiology,2012,28(1):186-188,192.(in Chinese)
[16]孙振朕,蔡在龙,朱科明,等.小鼠肺微血管内皮细胞磁珠分选法分离和原代培养[J].中国组织工程研究与临床康复,2010,14(50):9366-9369.
SUN Z Z,CAI Z L,ZHU K M,et al.Mouse pulmonary microvascular endothelial cells were isolated and cultured[J].JournalofClinicalRehabilitativeTissueEngineeringResearch,2010,14(50):9366-9369.(in Chinese)
[17]王明明,杨舒,董虹,等.白头翁汤通过保护微血管内皮细胞的完整性及PMNs迁移杀菌功能的影响[J].畜牧兽医学报,2016,47(4):836-843.
WANG M M,YANG S,DONG H,et al.Effect of Baitouweng Decoction by protecting microvascular endothelial cell integrity and PMNs migration sterilization function[J].ActaVeterinariaetZootechnicaSinica,2016,47(4):836-843.(in Chinese)
[18]LI C,SUTTIE J M.Tissue collection methods for antler research[J].EurJMorphol,2003,41(1):23-30.
[19]郭洋.治疗猪链球性脑膜炎中药方剂筛选及其作用机理的初步研究[D].长春:吉林大学,2014:27-33.
GUO Y.A preliminary study on the treatment of swine meningitis global chain screening and mechanism of traditional Chinese Medicine[D].Changchun:Jilin University,2014:27-33.(in Chinese)
[20]MEHTA D,MALIK A B.Signaling mechanisms regulating endothelial permeability[J].PhysiolRev,2006,86(1):279-367.
[21]KING J,HAMIL T,CREIGHTON J,et al.Structural and functional characteristics of lung macro-and microvascular endothelial cell phenotypes[J].MicrovascRes,2004,67(2):139-151.
[22]KOBAYASHI M,INOUE K,WARABI E,et al.A simplemethod of isolating mouse aortic endothelial cells[J].JAtherosclerThromb,2005,12:138-142.
[23]何孟栖,陈利国.血管内皮细胞原代培养方法的改良及应用[J].陕西医学杂志,2004,33(7):581-582.
HE M X,CHEN L G.Improvement of primary culture method of vascular endothelial cells and its application[J].ShanxiMedicalJournal,2004,33(7):581-582.(in Chinese)
[24]贾建桃,张慧英,王黎敏,等.肺微血管内皮细胞原代培养方法的建立[J].细胞与分子免疫学杂志,2014(7):763-766.
JIA J T,ZHANG H Y,WANG L M,et al.Establishment of primary culture method of pulmonary microvascular endothelial cells[J].ChineseJournalofCellularandMolecularImmunology,2014(7):763-766.(in Chinese)
[25]KUKK E,LYMBOUSSAKI A,TAIRA S,et al.VEGF-C receptor binding and pattern of expression with VEGFR-3 suggests a role in lymphatic vascular development[J].Development,1996,122(12):3829-3837.
(编辑白永平)
Cultivation and Purification of Rat Pulmonary Microvascular Endothelial Cellsinvitro
LIANG Hong-wei1,FENG Bo1,2,ZHU Wen-yu1,WANG Jian-fang1,ZHANG Tao1,MU Xiang1*
(1.BeijingKeyLaboratoryofTraditionalChineseVeterinaryMedicine,BeijingUniversistyofAgriculture,Beijing102206,China;2.VeterinaryMedicineinChinaAgriculturalUniversity,Beijing100193,China)
This study aims at establishing a simple method of obtaining the high-purity rat pulmonary microvascular endothelial cells isolated and culturedinvitro.Peripheral lung tissues were separated from 5 to 7 days of SD rat under sterile condition.Rat pulmonary microvascular endothelial cells was acquired by taking the tissue graft block method,digested with trypsin and then maintained at 37 ℃ in a 5% CO2humidified atmosphere.The cells were purificated using the method of immune magnetic beads,subsequently identified by the immunofluorescence and flow cytometry,and then determined by MTT colorimetric analysis to detect the original generation of pulmonary endothelial cell growth curve.Rat lung microvascular endothelial cells was successfully obtained by taking the tissue graft block method and individual cells under inverted microscope showed short fusiform or polygon and a typical paying stone appearance with single-layer adherent growth after confluence.The cells were strongly positive for CD31 factor and negative(P=0.1,andP<0.5) for lymphatic endothelial cell specific surface marker VEGFR-3 detected by immunofluorescence staining and flow cytometry respectively.In our study,a method of higher purity of rat lung microvascular endothelial cells cultureinvitrowas successfully established.
rats;pulmonary microvascular endothelial cells;isolation and cultivation in vitro;immune magnetic beads purification
10.11843/j.issn.0366-6964.2016.10.024
2016-06-15
国家自然科学基金(31272144)
梁宏伟(1990-),女,河北承德人,硕士生,主要从事中兽医药及疾病防控方面研究,E-mail: 1581926010@ qq. com
穆祥(1960-),男,江苏启东人,教授,硕士,主要从事中兽医药及疾病防控研究
S852.21
A
0366-6964(2016)10-2143-08
