镰刀菌毒素对断奶仔猪肠道IL-1β和IL-6分布和表达的影响
2016-11-08陈祥兴张崇玉黄丽波刘法孝杨维仁姜淑贞
陈祥兴,张崇玉,黄丽波,刘法孝,杨维仁*,姜淑贞*
(1.南京农业大学动物科技学院,南京 210095;2.山东农业大学动物科技学院,泰安 271000)
镰刀菌毒素对断奶仔猪肠道IL-1β和IL-6分布和表达的影响
陈祥兴1,张崇玉2,黄丽波2,刘法孝2,杨维仁2*,姜淑贞2*
(1.南京农业大学动物科技学院,南京 210095;2.山东农业大学动物科技学院,泰安 271000)
旨在探讨镰刀菌毒素对断奶仔猪肠道IL-1β和IL-6的分布和mRNA转录量的影响。选择35日龄体重为8.45 kg±0.94 kg的健康三元杂交(杜×长×大)雌性仔猪40头,随机分为2个处理组,每组20头。对照组饲喂基础饲粮,镰刀菌毒素组饲喂含有镰刀菌毒素(玉米赤霉烯酮0.90 mg·kg-1,呕吐毒素1.43 mg·kg-1,烟曲霉毒素5.85 mg·kg-1)的试验饲粮,预试期7 d,正试期35 d,试验结束每组随机选取10头仔猪进行屠宰取样。结果表明:与对照组相比,镰刀菌毒素组仔猪小肠IL-1β和IL-6的阳性细胞呈现由分散在固有层向绒毛内淋巴细胞集中的趋势,而结肠的IL-1β和IL-6阳性细胞主要分布在固有层;十二指肠IL-1β、十二指肠和空肠的IL-6以及结肠IL-1β和IL-6的mRNA转录量显著高于对照组(P<0.05),且小肠和结肠IL-1β和IL-6 mRNA转录量存在一定相关性(P<0.05)。在本试验条件下,镰刀菌毒素可通过改变肠道IL-1β和IL-6的分布和表达,影响肠道的免疫机能。
镰刀菌毒素;肠道;IL-1β;IL-6;仔猪
镰刀菌通常以寄生或者腐生的方式侵入到植物体,在繁殖的过程中产生镰刀菌毒素,对粮食以及饲料有极大的危害。与动物生产以及健康密切相关的镰刀菌毒素包括单端孢霉烯族化合物(trichothecenes)、玉米赤霉烯酮(ZEN)和烟曲霉毒素(FUM)。在全球范围内,谷粒和动物饲料通常会受到单端孢霉烯族化合物、ZEN和FUM的联合污染[1]。细胞因子是由免疫细胞和某些非免疫细胞分泌的一类活性物质,是免疫系统重要的信息分子,在免疫调节中充当十分重要的角色。作为细胞因子重要的组成部分,白介素(interleukin,IL)一直是研究的热点,其在细胞间相互作用、免疫调节以及炎症过程中均起到重要调节作用[2]。前人研究证实镰刀菌毒素能够在翻译和转录水平上影响相关细胞因子的稳定性[3],体外试验中发现镰刀菌毒素能够影响仔猪空肠上皮细胞的细胞因子mRNA的表达[4]。但是尚未见镰刀菌毒素对断奶仔猪肠道细胞因子IL-1β和IL-6分布和mRNA表达量的研究报道。本试验旨在从分子水平探讨镰刀菌毒素对断奶仔猪肠道IL-1β和IL-6的影响,为阐述镰刀菌毒素对仔猪肠道免疫的危害和指导养猪生产提供理论依据。
1 材料与方法
1.1试验动物
35日龄三元杂交(杜×长×大)雌性断奶仔猪40头,平均体重为8.45 kg±0.94 kg。
1.2试验设计
40头仔猪随机分为对照组和镰刀菌毒素组,每组20头,各组间仔猪初始体重差异不显著(P>0.05)。对照组饲喂基础饲粮,镰刀菌毒素组饲喂用自然霉变玉米和霉变玉米蛋白粉替代正常玉米和玉米蛋白粉配制的试验饲粮,预试期7 d,试验期35 d。
1.2.1饲养管理仔猪采用塑料漏缝地板的单体笼(0.48 m2)饲养。笼内安装乳头饮水器和料槽以便仔猪自由采食和饮水。试验开始前对猪舍进行全面清扫和消毒,试验期间每周进行一次消毒,舍内安装红外保温灯,第一周猪舍内温度维持在30 ℃左右,之后将温度调整在26~28 ℃,相对湿度保持在65%左右。试验在山东农业大学动物科技学院试验站进行。
1.2.2试验饲粮参考NRC(2012)仔猪饲养标准推荐量配制饲粮。本课题组于2013年6月至12月相继从山东省16个饲料厂和21个养殖场抽检饲料原料样品共计153个,检测其霉菌毒素含量,调查霉菌毒素污染状况。从中选择毒素水平低于检测限的原料配制对照饲粮,选择自然霉变玉米和霉变玉米蛋白粉配制镰刀菌毒素饲粮。检测发霉玉米和玉米蛋白粉中玉米赤霉烯酮(ZEN)、黄曲霉毒素(AFL)、T-2毒素、呕吐毒素(DON)和烟曲霉毒素(FUM)含量,根据毒素水平分别用50%自然发霉玉米和玉米蛋白粉代替基础饲粮中的玉米和玉米蛋白粉配制镰刀菌毒素饲粮。饲粮组成及营养水平见表1。
试验所需饲粮于正式试验开始前一周一次性配制完成,在试验开始和结束后分别取样,用以分析饲粮中的毒素和粗蛋白质水平[5]。ZEN、AFL、T-2毒素和FUM的测定采用酶联免疫吸附(ELISA)和荧光测定法,DON的测定采用高效液相色谱法(HPLC)。ZEN、DON、AFL、FUM和T-2毒素的最低检测限分别0.1 mg·kg-1、0.1 mg·kg-1、1.0 μg·kg-1、0.25 mg·kg-1和1.0 μg·kg-1。饲粮毒素水平见表1,AFL和T-2毒素低于检测限水平。
1.3测定指标及方法
1.3.1样本采集试验第35天每组随机选择10头仔猪电击致死后放血,剖开腹腔,在十二指肠、空肠、回肠和结肠的中段各取10 cm左右的样品,并用低温生理盐水轻轻冲洗肠内容物,用滤纸吸干水分后将样品均匀裁切成两段,一段置于Bouin’s液中固定,待做免疫组化切片,另一段放入5 mL无菌冻存管中,立即放入液氮中速冻,后转入-80 ℃低温冰箱待检测相关指标。
1.3.2免疫组化(SABC法)取Bouin’s液中固定好的组织块,用乙醇逐级脱水,二甲苯透明,采用BMJ23型包埋机包埋。具体步骤:①切片机(LEICA RM2135,德国)进行切片(5 μm),常规脱蜡至水。②柠檬酸缓冲液(0.01 mol·L-1,pH 6.0)进行抗原热修复,PBS(0.01 mol·L-1,pH 7.2)洗3次,5 min·次-1(下同)。③3%H2O2室温避光孵育30 min,用以阻断内源性过氧化物酶,PBS洗3次。④10%胎牛血清37 ℃封闭孵育1 h。⑤分别加一抗兔抗IL-6(1∶150)多克隆抗体(bs-4587R,北京博奥森生物技术有限公司)和兔抗IL-1β(1∶150)多克隆抗体(bs-0812R,北京博奥森生物技术有限公司),4 ℃孵育过夜,PBS洗3次。⑥加生物素化羊抗兔IgG(1∶150)二抗(SPN-9001,北京中杉金桥生物技术有限公司),37 ℃恒温箱中孵育1 h,PBS洗3次。⑦加辣根过氧化物酶-链霉素亲和素(1∶150),37 ℃孵育45 min,PBS洗3次。⑧DAB(ZLI-9018,北京中杉金桥生物技术有限公司,浓缩液∶缓冲液=1∶20)显色,显微镜下观察显色程度,控制显色时间。⑨苏木素复染、脱水、透明、封片,在显微镜下观察阳性细胞分布规律(阳性产物呈棕黄色)。
表1饲粮组成及营养水平(风干基础)
Table 1Composition and nutrient levels of diets (air-dry basis)
%
1)每千克日粮提供:VA 3300 IU;VD3330 IU;VE 24 IU;VK30.75 mg;VB11.50 mg;VB25.25 mg;VB62.25 mg;VB120.026 mg;泛酸 15.00 mg;尼克酸 22.5 mg;生物素 0.075 mg;叶酸 0.45 mg;锰 6.00 mg;铁 150 mg;锌 150 mg;铜 9.00 mg;碘 0.21 mg;硒 0.45 mg。2)粗蛋白质为实测值,其他营养水平为设计值。3)毒素水平为实测值
1)Supplied per kg of diet:Vitamin A 3300 IU;Vitamin D3330 IU;Vitamin E 24 IU;Vitamin K30.75 mg;Vitamin B11.50 mg;Vitamin B25.25 mg;Vitamin B62.25 mg;Vitamin B120.026 mg;Pantothenic acid 15.00 mg;Niacin 22.5 mg;Biotin 0.075 mg;Folic acid 0.45 mg;Mn 6.00 mg;Fe 150 mg;Zn 150 mg;Cu 9.00 mg;I 0.21 mg;Se 0.45 mg.2)Protein was analyzed value,and the other nutrient levels were calculated value.3)Zearalenone (ZEN),deoxynivalenol (DON) and fumonisins (FUM) were analyzed value
1.3.3肠道IL-6和IL-1β mRNA相对转录量根据GenBank已报道的猪的IL-1β、IL-6和GAPDH基因序列,用Primer 6.0设计相应特异性引物,引物由上海生物工程公司合成(表2)。
取出-80 ℃保存的十二指肠、空肠、回肠和结肠样品50~100 mg,按照Trizol试剂盒说明书(In-vitrogen公司,美国)提取总RNA,用紫外分光光度计检测RNA的质量和浓度,结果显示OD值均在1.8~2.0。检测后的总RNA立即进行反转录。反转录按照PrimeScript®RT Master Mix Perfect Real Time 试剂盒说明书进行操作(TaKaRa Coad:DDR036A,Lot:BK1302,反应体积为20 μL)。按照TaKaRa公司的荧光定量试剂盒说明书加入相应的反应试剂(TaKaRa公司,大连),反应体积为20 μL,组成为10 μL SYBR Primerx ExTaq,0.4 μL上游引物(10 μmol·L-1),0.4 μL下游引物(10 μmol·L-1),0.4 μL ROX Reference Dye,2 μL cDNA以及6.8 μL的dH2O。其扩增条件均为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸34 s,95 ℃ 15 s,60 ℃ 60 s,40个循环,60 ℃检测荧光信号。每个样品做3个重复。每个样品靶基因的相对mRNA表达水平用以下公式计算:相对mRNA表达=2-△△Ct[6]。
表2PCR反应的引物序列
Table 2Sequence of primers for real-time PCR

目的基因Targetgene引物序列(5'-3')Sequence产物大小/bpProductSize登录号AccessionNo.IL-1βF:CCTCTCCAGCCAGTCTTCATR:GCCATCAGCCTCAAATAACAG126NM_214055.1IL-6F:TGGCTACTGCCTTCCCTACCR:CACACATCTCCTTTCTCATTGC153NM_214399.1GAPDHF:ATGGTGAAGGTCGGAGTGAAR:CGTGGGTGGAATCATACTGG154NM_001206359.1
1.4统计与分析
数据采用SAS 9.2统计软件进行均值的双样本成对T检验分析(Two Sample Pairedt-test for the Means),通过SAS 9.2统计软件的CORR过程对小肠和结肠IL-1β和IL-6进行Pearson相关性分析。P<0.05为差异显著。
2 结 果
2.1小肠IL-1β和IL-6的分布
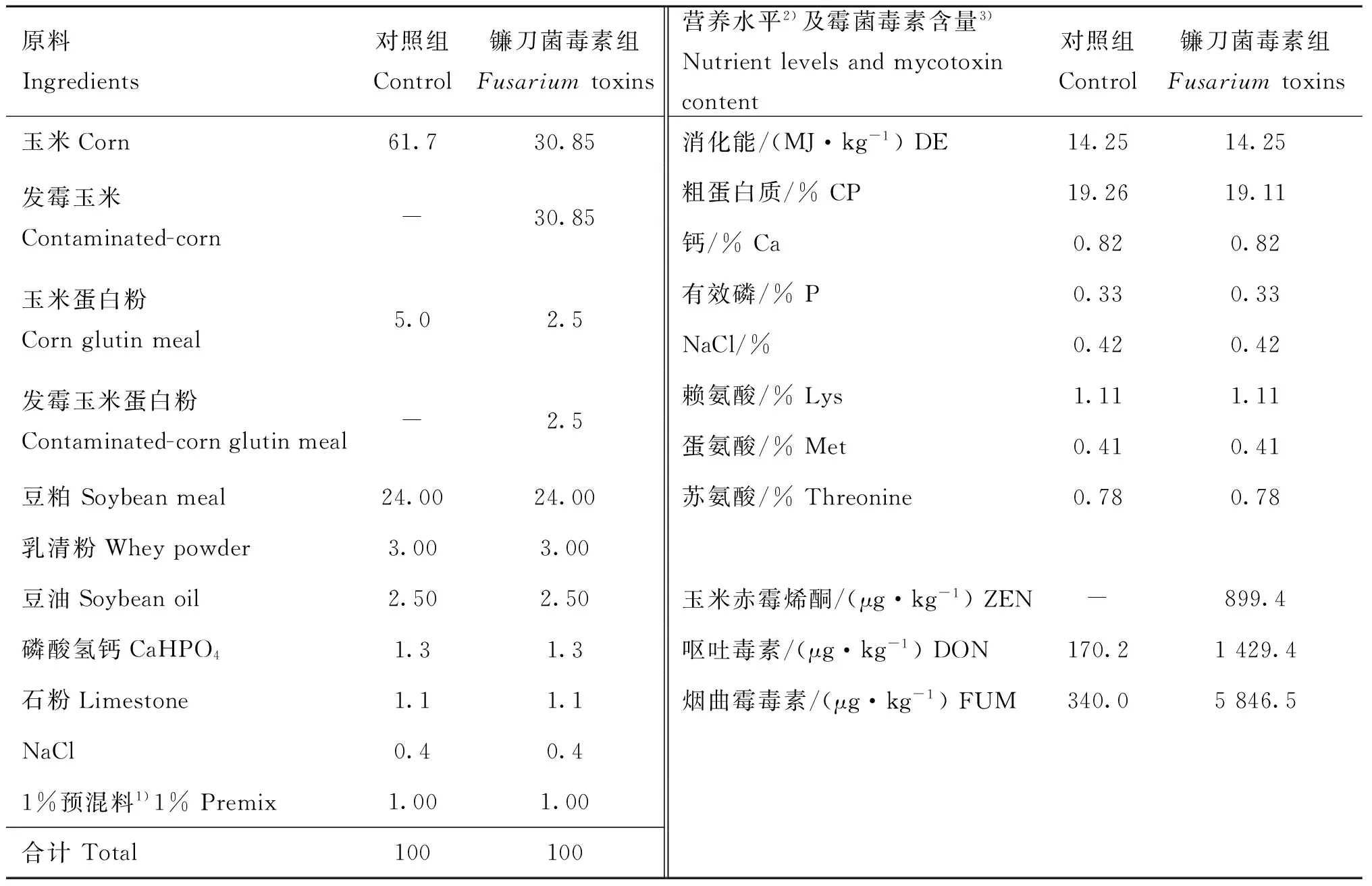
镰刀菌毒素对断奶仔猪小肠IL-1β分布的影响见图1。受镰刀菌毒素影响,小肠三段的绒毛形态由细长变得粗短,IL-1β的阳性反应物质在近肠腔面小肠绒毛上皮细胞着色强,而在小肠绒毛两侧的细胞免疫阳性反应弱;在肠腺周围的固有层细胞免疫阳性反应物质着色也较强。处理组的免疫阳性反应强于对照组,且处理组小肠绒毛两侧的细胞也呈强阳性反应。镰刀菌毒素对断奶仔猪小肠IL-6分布的影响见图2。受镰刀菌毒素影响,三段小肠(十二指肠、空肠和回肠)的绒毛形态由细长变得粗短,IL-6的分布同IL-1β相近,对照组较镰刀菌毒素组免疫阳性反应明显弱。
2.2小肠IL-6和IL-1β mRNA的转录量
与对照组相比,镰刀菌毒素显著提高了(P<0.05)十二指肠IL-1β的mRNA转录量(图3),回肠IL-1β的mRNA转录量有升高的趋势(P=0.087)。镰刀菌毒素显著提高了(P<0.05)十二指肠和空肠IL-6的mRNA转录量(图4)。
2.3结肠IL-1β和IL-6的分布和mRNA的转录量
镰刀菌毒素对断奶仔猪结肠IL-1β和IL-6的分布见图5。IL-1β阳性细胞分散在结肠黏膜固有层的大肠腺的柱状上皮细胞胞质内,镰刀菌毒素组IL-1β的阳性表达较对照组强。IL-6的分布同IL-1β相近,对照组较镰刀菌毒素组免疫阳性反应明显弱。
2.4结肠IL-6和IL-1β的分布和mRNA的转录量
与对照组相比,镰刀菌毒素组结肠IL-1β和IL-6的mRNA转录量显著升高(P<0.05,图6)。
2.5小肠和结肠IL-1β和IL-6的mRNA转录量的相关性
小肠和结肠炎性因子的相关性见表3。结肠IL-1β的mRNA转录量与十二指肠和回肠IL-1β的mRNA转录量存在显著正相关(P<0.05);结肠IL-6的mRNA转录量与十二指肠和空肠IL-6的mRNA转录量存在显著正相关(P<0.05)。
3 讨 论
本试验采用已知镰刀菌毒素含量的自然霉变玉米和霉变玉米蛋白粉配制试验饲粮,以便为动物生产提供科学依据,与此同时我们选择了优质原料配制对照饲粮,但是遗憾的是对照饲粮中也检测到不同程度的毒素含量,这进一步说明我国镰刀菌毒素污染的普遍性及本研究的迫切性。本试验对照组饲粮中ZEN和DON的水平远低于我国饲料卫生标准规定的小于0.5[7]、1 mg·kg-1[8],也低于欧盟关于仔猪饲粮中ZEN、DON和FUM小于0.1、0.9和5 mg·kg-1的最高限量规定[9],因此我们认为对照组中毒素含量不影响对镰刀菌毒素组结果的判断。

A、B.对照组十二指肠;C、D.镰刀菌毒素组十二指肠;E、F.对照组空肠;H、I.镰刀菌毒素组空肠;J、K:对照组回肠;L、M:镰刀菌毒素组回肠。LE.小肠绒毛上皮,G.肠腺,S.固有层;红色箭头示IL-1β免疫阳性细胞,蓝色箭头为阴性A and B were duodenum of the Control.C and D were duodenum of the Fusarium toxins.E and F were jejunum of the Control.H and I were jejunum of the Fusarium toxins.J and K were ileum of the Control.L and M were ileum of the Fusarium toxins.LE was epithelium of intestine,G was intestinal gland and S was lamina propria.Red arrows showed immunoreactive cells of IL-1β and blue arrows showed immune-negative cells of IL-1β图1 镰刀菌毒素对小肠IL-1β的影响(A、E、J、C、H、L.100×;B、F、K、D,I、M.400×)Fig.1 Effects of Fusarium toxins on IL-1β in small intestine(A,E,J,C,H,L.100×;B,F,K,D,I,M.400×)
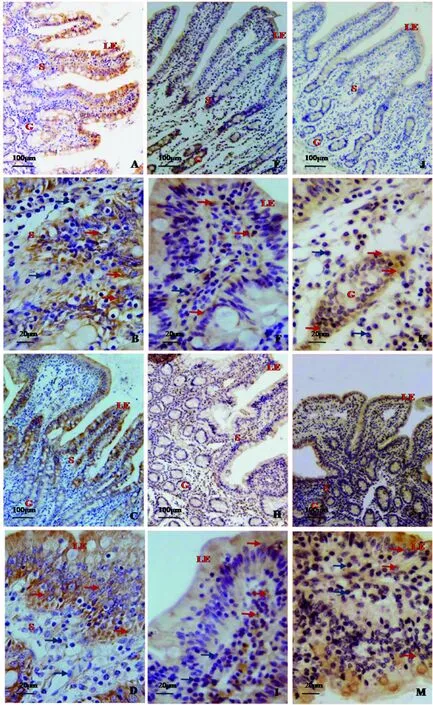
A、B.对照组十二指肠;C、D.镰刀菌毒素组十二指肠;E、F:对照组空肠;H、I:镰刀菌毒素组空肠;J、K.对照组回肠;L、M.镰刀菌毒素组回肠。LE.小肠绒毛上皮,G.肠腺,S.固有层。红色箭头示IL-6免疫阳性细胞,蓝色箭头为阴性A and B were duodenum of the Control.C and D were duodenum of the Fusarium toxins.E and F were jejunum of the Control.H and I were jejunum of the Fusarium toxins.J and K were ileum of the Control.L and M were ileum of the Fusarium toxins.LE was epithelium of intestine,G was intestinal gland and S was lamina propria.Red arrows showed immunoreactive cells of IL-6 and blue arrows showed immune-negative cells of IL-6图2 镰刀菌毒素对小肠IL-6的影响(A、E、J、C、H、L.100×;B、F、K、D、I、M.400×)Fig.2 Effects of Fusarium toxins on IL-6 in small intestine(A,E,J,C,H,L.100×;B,F,K,D,I,M.400×)
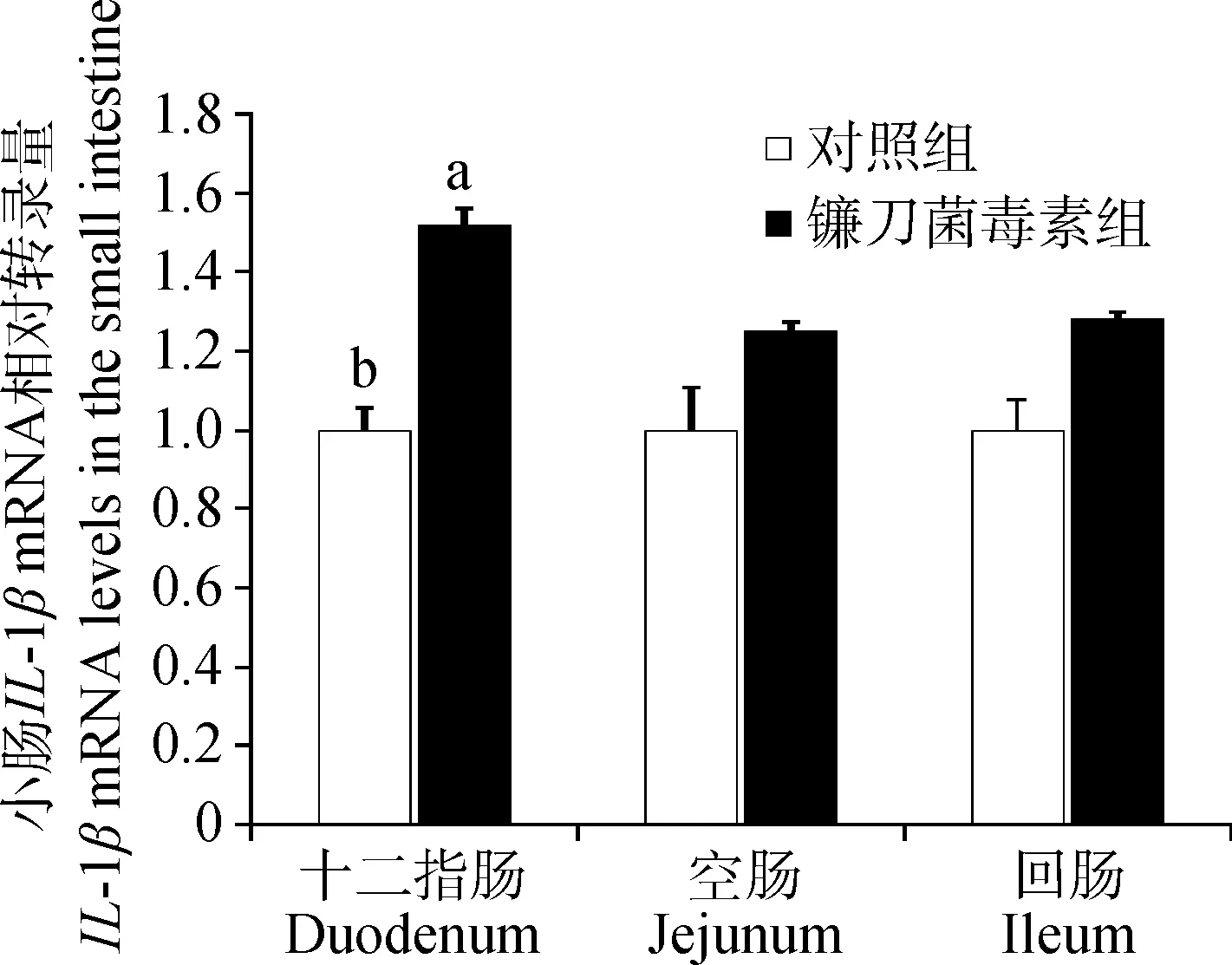
图3 镰刀菌毒素对小肠IL-1β的mRNA转录量的影响Fig.3 Effects of Fusarium toxins on IL-1β mRNA levels in the small intestine
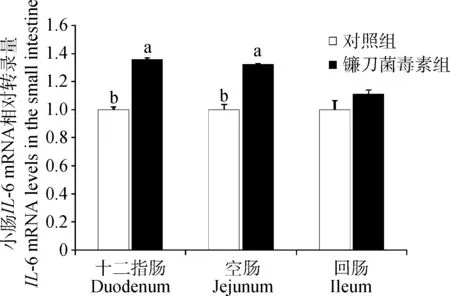
图4 镰刀菌毒素对小肠IL-6的mRNA转录量的影响Fig.4 Effects of Fusarium toxins on IL-6 mRNA levels in the small intestine
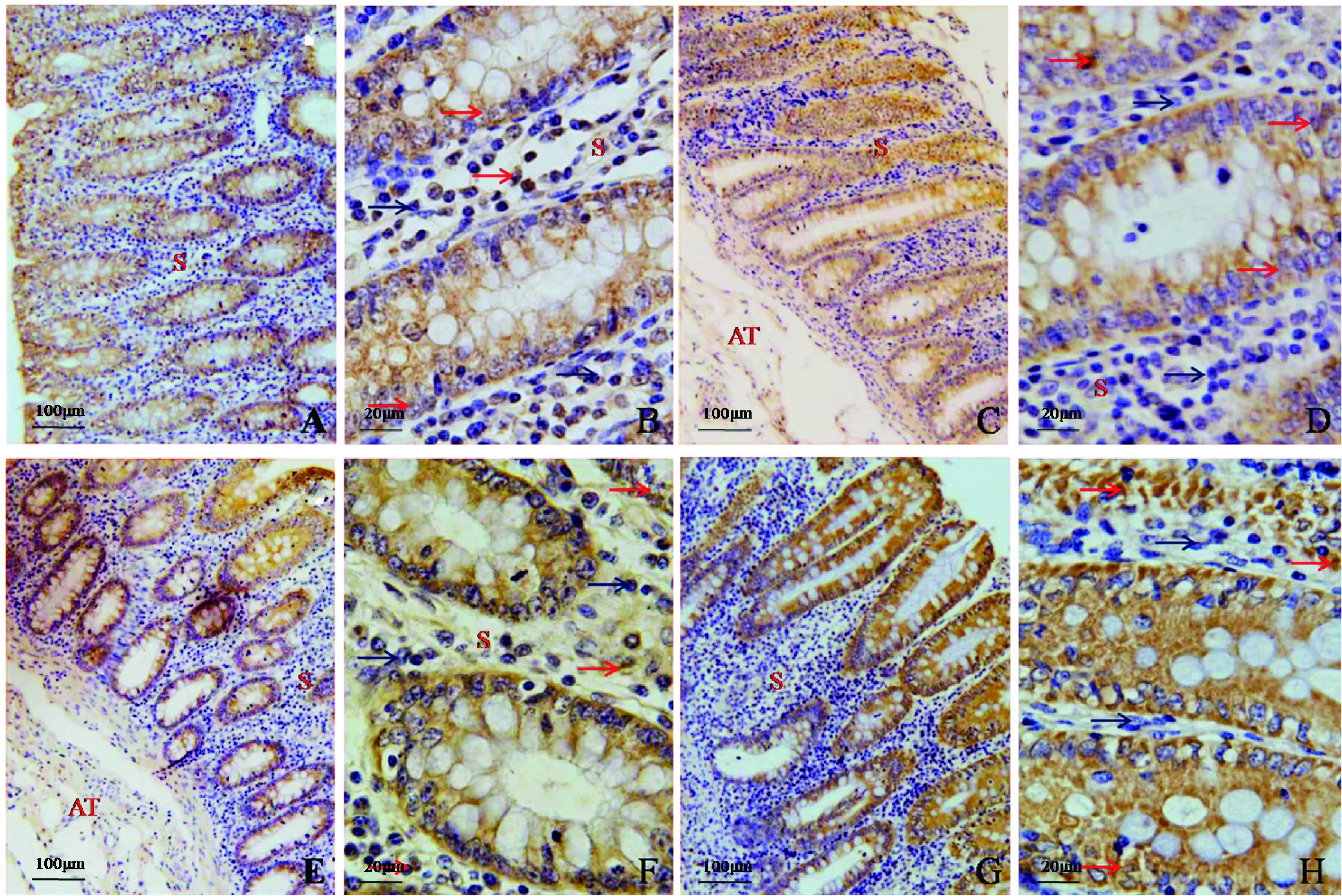
A、B:对照组IL-1β,C、D:镰刀菌毒素组IL-1β;E、F:对照组IL-6,G、H:镰刀菌毒素组IL-6。AT为脂肪组织,S为固有层。红色箭头示IL-1β免疫阳性细胞,蓝色箭头为阴性A and B were IL-1β of the Control.C and D were IL-1β of the Fusarium toxins.E and F were IL-6 of the Control.G and H were IL-6 of the Fusarium toxins.AT was adipose tissue and S was lamina propria.Red arrows showed immunoreactive cells and blue arrows showed immune-negative cells图5 镰刀菌毒素对结肠IL-1β和IL-6的影响(A、C、E、G.100×;B、D、F、H.400×)Fig.5 Effects of Fusarium toxins on IL-1β in the colon(A,C,E,G.100×;B,D,F,H.400×)
白介素在激活与调节免疫细胞中有重要作用。白介素IL-1β是在先天免疫过程中宿主炎症反应的主要介质,是一种对炎症反应和免疫功能有着显著调节作用的多功能细胞因子。IL-6是由多种细胞包括免疫细胞(例如单核细胞、巨噬细胞、淋巴细胞等)和非免疫细胞(例如成骨细胞、骨髓基质细胞、角化细胞、肠道上皮细胞等)产生的多效促炎性细胞因子[10],同样是炎症反应的重要介质。前人研究多种霉菌毒素单独和联合的免疫毒性发现,毒素能够提高小鼠、仔猪以及肉鸡脾的IL-1β和IL-6的mRNA转录量[11-13]。目前,镰刀菌毒素对免疫功能的研究多集中在对脾的研究上,且多为单一毒素作用,对肠道的免疫功能的影响研究较少。本试验小肠的IL-1β和IL-6阳性细胞分布集中在黏膜固有层和绒毛内淋巴细胞上,并有向绒毛段集中的趋势,这样的结果与肠道应急综合征的IL-1β和IL-6分布大体一致[2],说明毒素已经造成了肠道的损伤。本试验观察,镰刀菌毒素组仔猪小肠绒毛与对照组相比变粗变短,这与用储存4年的玉米饲喂肉鸡导致空肠绒毛高度降低的结果[14]相似。有报道指出IL-1β和IL-6的mRNA转录量的升高程度与肠道症状严重程度具有一定的相关性[15-16]。以大鼠为研究对象,对其结肠进行电灼伤,出现溃疡,测定小肠和结肠的IL-1β和IL-6的mRNA转录量,结果表明这两种细胞因子的转录量均大幅提高[17]。也有试验结果表明,机体在受到镰刀菌毒素影响后,IL-6和IL-1β的mRNA转录量通常会增加,这可能会激活小肠上皮细胞的炎性免疫应答[18]。本试验证实,镰刀菌毒素显著提高了十二指肠IL-1β和IL-6的mRNA转录量、空肠的IL-1β mRNA转录量以及结肠的IL-1β和IL-6的mRNA转录量,说明镰刀菌毒素可以刺激肠道免疫细胞和上皮细胞产生过量的IL-1β和IL-6,促进炎症反应的发生。
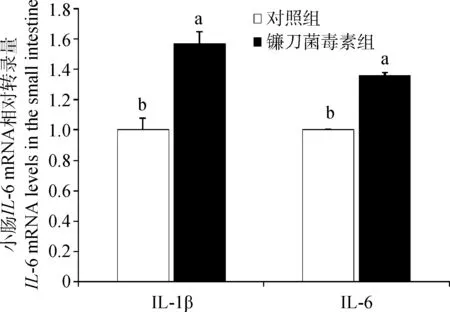
图6 镰刀菌毒素对结肠IL-1β和IL-6的mRNA转录量的影响Fig.6 Effects of Fusarium toxins on mRNA levels of IL-1β and IL-6 in the colon
表3小肠和结肠IL-1β和IL-6 mRNA转录量的相关性
Table 3Correlation analysis on mRNA levels of cytokine in between intestine and colon

细胞因子Cytokine小肠肠段Intestinalsegment结肠Colon相关系数CorrelationcoefficientP值P-value十二指肠Duodenum0.9090.012IL-1β空肠Jejunum0.7520.084回肠Ileum0.8930.017十二指肠Duodenum0.984<0.001IL-6空肠Jejunum0.967<0.001回肠Ileum0.6560.157
前人通过研究人和相关实验动物认为,结肠促炎性细胞因子的产生和增加与小肠相关症状是有联系的[19-21],同时以化学性结肠炎动物模型作为研究对象,发现结肠出现炎症会引起全身性炎症的产生,可能影响到小肠功能[17]。本试验系统性地研究了镰刀菌毒素对小肠和结肠的IL-1β和IL-6分布及其mRNA的转录量的影响,并进行了相关性分析,发现镰刀菌毒素对小肠和结肠细胞因子的影响存在一定的相关性,与前人的研究一致。这说明小肠产生炎性反应后会促进结肠促炎性因子的产生,同时结肠出现炎症可能会导致近端的非发炎区域肠神经元结构和功能的显著异常[22],进一步改变了小肠的蠕动,引起分泌功能障碍,最终可能影响肠道的吸收,其具体的反应机制尚需进一步探讨。
4 结 论
本试验条件下,镰刀菌毒素显著影响断奶仔猪小肠和结肠的IL-1β和IL-6阳性分布和mRNA转录量,说明镰刀菌毒素饲粮(0.90 mg·kg-1ZEN,1.43 mg·kg-1DON,5.85 mg·kg-1FUM)通过改变肠道IL-1β和IL-6的分布和表达,影响仔猪肠道的免疫机能。
[1]PLACINTA C M,D'MELLO J,MACDONALD A.A review of worldwide contamination of cereal grains and animal feed withFusariummycotoxins[J].AnimFeedSciTech,1999,78(1):21-37.
[2]李亚其.IL-1β,IL-6,IL-10在肠易激综合征患者中的表达及临床意义[D].长沙:中南大学,2012.
LI Y Q.The expression of cytokines IL-lβ,IL-6,IL-10 in patients with irritable bowel syndrome[D].Changsha:Central South University,2012.(in Chinese)
[3]CHUNG Y,JARVIS B,PESTKA J.Modulation of lipopolysaccharide-induced proinflammatory cytokine production by satratoxins and other macrocyclic trichothecenes in the murine macrophage[J].JToxicolEnvironHealthA,2003,66(4):379-391.
[4]WAN L Y M,TURNER P C,EL-NEZAMI H.Individual and combined cytotoxic effects ofFusariumtoxins (deoxynivalenol,nivalenol,zearalenone and fumonisins B1) on swine jejunal epithelial cells[J].FoodChemToxicol,2013,57:276-283.
[5]张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2003.
ZHANG L Y.Feed analysis and feed quality detection technology[M].Beijing:China Agricultural University Press,2003.(in Chinese)
[6]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[7]中华人民共和国国家质量监督检验检疫总局.GB13078.2-2006[S].中华人民共和国国家标准-饲料卫生标准.北京:中国标准出版社,2006:7-1.
General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China(AQSIQ).GB13078.2-2006[S].National standard of the people’s Republic of China-Hygienical standard for feeds.Beijing:Standards Press of China,2006:7-1.(in Chinese)
[8]中华人民共和国国家质量监督检验检疫总局.GB13078.3-2007[S].中华人民共和国国家标准-饲料卫生标准.北京:中国标准出版社,2007:3-1.
General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China(AQSIQ).GB13078.2-2007[S].National standard of the people's Republic of China-Hygienical standard for feeds.Beijing:Standards Press of China,2007:3-1.(in Chinese)
[9]European Commission.Commission recommendation of 17 August 2006 on the presence of deoxynivalenol,zearalenone,ochratoxin A,T-2 and HT-2 and fumonisins in products intended for animal feeding[J].OffiJEurUnn,2006,229:7-9.
[10]PAPANICOLAOU D A,WILDER R L,MANOLAGAS S C,et al.The pathophysiologic roles of interleukin-6 in human disease[J].AnnInternMed,1998,128(2):127-137.
[11]雷明彦.饲料中常见霉菌毒素对小鼠的联合毒性作用及机制的研究[D].武汉:华中农业大学,2013.
LEI M Y.Combined effects of predominant mycotoxins in feeds on mice[D].Wuhan:Huazhong Agricultural University,2013.(in Chinese)
[12]GRENIER B,LOUREIRO-BRACARENSE A P,LUCIOLI J,et al.Individual and combined effects of subclinical doses of deoxynivalenol and fumonisins in piglets[J].MolNutrFoodRes,2011,55(5):761-771.
[13]LI Z,YANG Z B,YANG W R,et al.Effects of feed-borneFusariummycotoxins with or without yeast cell wall adsorbent on organ weight,serum biochemistry,and immunological parameters of broiler chickens[J].PoultSci,2012,91(10):2487-2495.
[14]崔小燕.初探不同储存期玉米对雉科鸟类抗氧化及免疫功能的影响[D].哈尔滨:东北林业大学,2013.
CUI X Y.Effects of maize at different storage periods on antioxidant abilities and immune function of birds[D].Harbin:Northeast Forestry University,2013.(in Chinese)
[15]LIEBREGTS T,ADAM B,BREDACK C,et al.Immune activation in patients with irritable bowel syndrome[J].Gastroenterology,2007,132(3):913-920.
[16]OHMAN L,ISAKSSON S,LINDMARK A,et al.T-cell activation in patients with irritable bowel syndrome[J].AmJGastroenterol,2009,104(5):1205-1212.
[17]BARADA K,MOURAD F H,NOURSI B,et al.Electrocautery-induced localized colonic injury elicits increased levels of pro-inflammatory cytokines in small bowel and decreases jejunal alanine absorption[J].Cytokine,2015,71(1):109-118.
[18]ARSENEAU K O,TAMAGAWA H,Pizarro T T,et al.Innate and adaptive immune responses related to IBD pathogenesis[J].CurrGastroenterolRep,2007,9(6):508-512.
[19]BARADA K A,MOURAD F H,SAWAH S I,et al.Localized colonic inflammation increases cytokine levels in distant small intestinal segments in the rat[J].LifeSci,2006,79(21):2032-2042.
[20]BARADA K A,MOURAD F H,SAWAH S I,et al.Up-regulation of nerve growth factor and interleukin-10 in inflamed and non-inflamed intestinal segments in rats with experimental colitis[J].Cytokine,2007,37(3):236-245.
[21]YAMAMOTO T,MARUYAMA Y,UMEGAE S,et al.Mucosal inflammation in the terminal ileum of ulcerative colitis patients:endoscopic findings and cytokine profiles[J].DigestLiverDis,2008,40(4):253-259.
[22]BLANDIZZI C,FORNAI M,COLUCCI R,et al.Altered prejunctional modulation of intestinal cholinergic and noradrenergic pathways by α2-adrenoceptors in the presence of experimental colitis[J].BritJPharmacol,2003,139(2):309-320.
(编辑白永平)
Effects ofFusariumToxins on IL-1β and IL-6 in Post-weaning Piglets
CHEN Xiang-xing1,ZHANG Chong-yu2,HUANG Li-bo2,LIU Fa-xiao2,YANG Wei-ren2*,JIANG Shu-zhen2*
(1.CollegeofAnimalScienceandTechnology,NanjingAgriculturalUniversity,Nanjing210095,China;2.CollegeofAnimalScienceandVeterinaryMedicine,ShandongAgriculturalUniversity,Tai’an271000,China)
The aim of the present study was to investigate effects ofFusariumtoxins on distribution and mRNA expression levels of intestinal IL-1β and IL-6 in post-weaning piglets.A total of 40 healthy piglets (Duroc×Landrace×Large White) aged at 35 d with an average body weight (8.45±0.94) kg were randomly allocated into two treatments with 20 in the control group (Control) and 20 in the test group (FusariumToxins).Piglets in the control group were fed a basal diet only,and piglets in theFusariumtoxins group were fed a test diet (0.90 mg·kg-1ZEN,1.43 mg·kg-1DON,5.85 mg·kg-1FUM).The experimental period was 35 d after 7 d adaptation.Then 10 piglets of each treatment were chosen to slaughter and sample.Results showed because of theFusariumtoxins,the positive cells of the small intestinal IL-1β and IL-6 were from dispersed in the lamina propria to villous lymphocytes concentration.But the IL-1β and IL-6 positive cells of the colon were mainly distributed in the lamina propria cells.And theIL-1β mRNA levels of duodenum,theIL-6 mRNA levels of duodenum and jejunum and theIL-1β andIL-6 mRNA levels of colon of theFusariumtoxins group were significantly higher (P<0.05) than that of the control.The mRNA levels of IL-1β and IL-6 had a correlation between small intestine and colon.In the present study,it suggested thatFusariumtoxins exerted a deleterious effect on inflammatory response via distribution and mRNA expression levels of intestinal IL-1β and IL-6,which have a negative impact on immunity of piglets eventually.
Fusariumtoxins;intestine;IL-1β;IL-6;piglets
10.11843/j.issn.0366-6964.2016.10.022
2016-05-11
山东省现代农业产业技术体系生猪创新团队建设项目(SDAIT-08-05)
陈祥兴(1988-),男,山东淄博人,博士生,主要从事动物营养与饲料科学研究,Tel:0538-8241257,E-mail: cxxabcd@163.com
姜淑贞,副教授,硕士生导师,E-mail: shuzhen305@163.com;杨维仁,教授,博士生导师,E-mail: wryang@sdau.edu.cn
S859.87
A
0366-6964(2016)10-2126-10
