日粮营养水平对150~180日龄滩羊瘤胃相关微生物菌群数量、pH和VFA含量的影响
2016-11-08王尧悦赵钊艳王兴涛陈玉林杨雨鑫
王尧悦,赵钊艳,王兴涛,陈玉林,杨雨鑫
(西北农林科技大学动物科技学院,杨凌 712100)
日粮营养水平对150~180日龄滩羊瘤胃相关微生物菌群数量、pH和VFA含量的影响
王尧悦,赵钊艳,王兴涛,陈玉林*,杨雨鑫*
(西北农林科技大学动物科技学院,杨凌 712100)
本试验旨在研究不同营养水平日粮对150~180日龄期间宁夏滩羊瘤胃相关微生物菌群(溶糊精琥珀酸弧菌、栖瘤胃普雷沃氏菌、反刍兽月形单胞菌、溶纤维丁酸弧菌、黄色瘤胃球菌、小韦荣球菌和产甲烷菌)数量、pH和VFA含量的影响。选取112只(公母各半)、体重接近(29±1.25)kg、体况良好的105日龄宁夏滩羊,采用完全随机分组试验设计分为4个处理组(组Ⅰ,Ⅱ,Ⅲ和Ⅳ),每个处理组4个重复,每个重复7只羊。从处理组Ⅰ到Ⅳ,日粮能量分别为7.08、 8.09、9.10和10.11 MJ· kg-1;蛋白质水平分别为8.04%、9.19%、10.34%和11.49%。能量与蛋白质比值不变(约为0.88)。试验期共75 d,其中预试期15 d。分别在150和180日龄时,每个重复随机选取1只羊屠宰采集瘤胃内容物,测定其pH,并利用气相色谱法测定待测瘤胃内容物的VFA含量;提取瘤胃内容物基因组DNA,通过构建标准质粒对这些相关微生物进行绝对实时荧光定量-PCR分析。结果表明,不同日龄仅对反刍兽月形单胞菌的数量有显著影响(P<0.05);但随着日粮营养水平的提高,栖瘤胃普雷沃氏菌、黄色瘤胃球菌、溶糊精琥珀酸弧菌、溶纤维丁酸弧菌和产甲烷菌的数量均呈显著上升趋势(P<0.05);不同日龄和不同营养水平日粮对瘤胃液pH均无显著影响(P>0.05);瘤胃液中乙酸含量随日粮营养水平的提高呈显著下降趋势(P<0.05),丁酸、异丁酸、戊酸和异戊酸占总挥发性脂肪酸的比例随着日粮营养水平的提高呈显著上升趋势(P<0.05)。不同瘤胃微生物之间存在相互促进作用;丙酸含量与小韦荣球菌的数量呈显著正相关(r=0.42,P<0.05),而戊酸与小韦荣球菌的数量呈极显著负相关(r=-0.53,P<0.01)。与日龄相比,不同营养水平的日粮相关瘤胃微生物数量以及VFA的含量影响更大;瘤胃VFA、pH与相关瘤胃微生物之间存在相关关系。
滩羊;瘤胃微生物;qRT-PCR;pH;VFA
瘤胃是一个复杂的微生物生态系统,在反刍动物饲料消化以及维持反刍动物健康方面起着至关重要的作用[1]。瘤胃微生物通过厌氧发酵产生的挥发性脂肪酸(VFA,包括乙酸、丙酸、丁酸、戊酸等)和菌体蛋白,为反刍动物供应能量和蛋白质[2-4],影响反刍动物的生产性能。日粮营养水平是影响瘤胃微生物发酵的重要因素[5]。
VFA是反刍动物摄入碳水化合物后,经瘤胃厌氧发酵产生的,可为反刍动物提供65%~75%的能量需要[6]。瘤胃中产甲烷菌能够发酵碳水化合物,生成的甲烷通过嗳气形式排出体外,造成饲料能量浪费及大气污染。甲烷的产生量与VFA的生成量密切相关[7]。另外,瘤胃微生物在降解日粮蛋白质的过程中,会产生过多的氨气,造成饲料蛋白质的浪费并引起环境污染。
滩羊主要分布于宁夏回族自治区,其二毛裘皮被列为宁夏“五宝”之一;肉质鲜嫩,膻味较小,口感好。饲养滩羊是当地农民的主要经济来源方式[8]。但随着生态环境的压力,滩羊饲养方式由放牧、半放牧转变为舍饲养殖,随之日粮的类型也在逐渐发生改变。因此,探究滩羊瘤胃微生物与寄主之间的关系对提高滩羊的饲料消化率,改善其生产性能具有重要的生产实际意义。但是目前,有关滩羊瘤胃微生物菌群数量的研究较少,特别是日粮营养水平对滩羊瘤胃微生物菌群影响的研究更少。
因此,本试验应用实时荧光定量-PCR (qRT-PCR)分子技术探究了日粮营养水平对150~180日龄滩羊瘤胃微生物菌群数量的影响,并通过气相色谱法检测了瘤胃液VFA随日粮营养水平的变化趋势,为进一步了解滩羊瘤胃发酵机理以及瘤胃微生物与滩羊机体健康之间的关系奠定了理论基础。
1 材料与方法
1.1试验设计及试验动物
在宁夏红寺堡天源良种羊繁育养殖有限公司选取112只(公母各半)体况良好、105日龄、平均体重为(29±1.25)kg的宁夏滩羊,完全随机分为4个处理组(组Ⅰ,Ⅱ,Ⅲ和Ⅳ),每个处理组4个重复,每个重复7只羊。预饲15 d后正式开始试验。共分2个饲喂时期,每期30 d。预饲15 d,即到120日龄时正式开始试验。每天08:00和17:00等量饲喂2次,自由饮水。在试验羊150和180日龄时,每个处理组的每个重复中随机选取1只羊,共选取16只羊进行屠宰。收集并过滤瘤胃内容物,利用便携式pH计(testo-206-pH2)测定上清液pH后-80 ℃保存备用。
1.2试验动物日粮及饲养管理
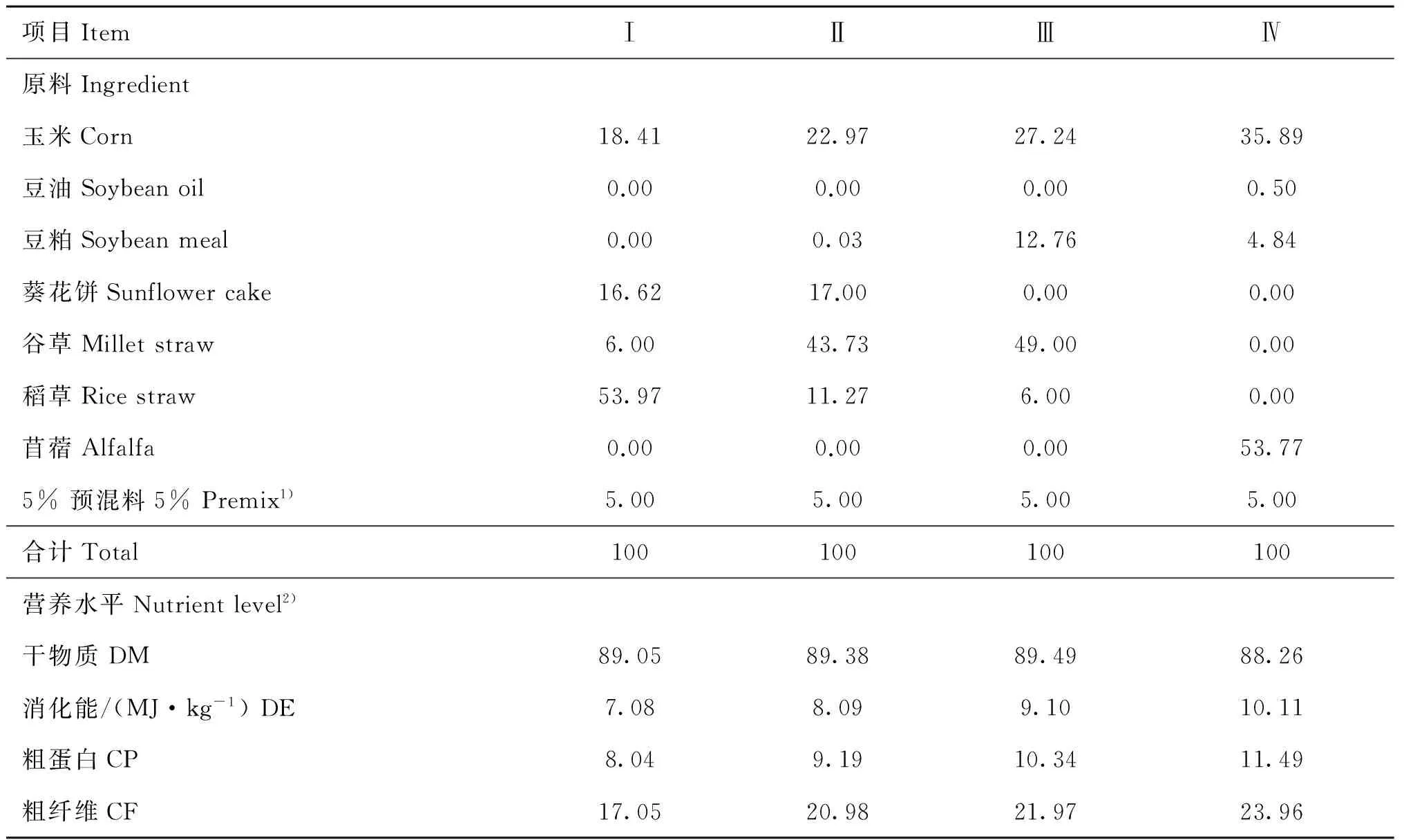
日粮参照肉羊饲养标准(NY/T 816-2004)配制,从处理组Ⅰ到Ⅳ饲喂的日粮能量分别为7.08、 8.09、9.10和10.11 MJ· kg-1;蛋白质水平分别为8.04%、9.19%、10.34%和11.49%。能量与蛋白质水平比值不变(约为0.88)。其他营养水平保持一致。从处理组Ⅰ到Ⅳ,粗纤维的含量分别为17.05%、20.98%、21.97%和23.96%,日粮精粗比保持不变。日粮混合后制作成颗粒饲料,每天定时等量饲喂,自由饮水,其他饲养管理按羊场正常程序进行。日粮组成及营养水平详见表1。
表1日粮的组成及营养水平
Table 1Dietary composition and nutrient levels
%
1).每千克预混料含有:VA 7 500 IU,VD31 050 IU,VE 10 IU,Fe 5 500 mg,Cu 500 mg,Mn 5 000 mg,Zn 4 000 mg,Se 32.5 mg,I 100 mg,Co 32.5 mg。2).DM和CP含量为实测值,DE和CF含量为计算值
1).Premix contained the following per kg of premix:VA 7 500 IU,VD31 050 IU,VE 10 IU,Fe 5 500 mg,Cu 500 mg,Mn 5 000 mg,Zn 4 000 mg,Se 32.5 mg,I 100 mg,Co 32.5 mg.2).The contents of DM and CP were measured values,the contents of DE and CF were calculated values
1.3细菌基因组DNA 的提取和PCR扩增
将瘤胃上清液于冰上解冻,并用涡旋混匀器HYQ-3111进行混匀。用stool DNA kit (OMEGA,USA) 试剂盒提取细菌基因组DNA,用超微量核酸蛋白测定仪(Thermo Fisher,上海)测定其浓度,并利用1.0%琼脂糖凝胶电泳检测所提取的细菌基因组DNA的质量。
利用16S rDNA通用引物V338F:5′-ACTCCTACGGGAGGCAGCAG-3′,和 V806R:5′-GGA-CTACHVGGGTWTCTAAT-3′扩增不同样品的基因组DNA。扩增条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27个循环;72 ℃ 10 min。总体系20 μL,每个体系中每个引物为0.8 μL,模板DNA 10 ng,5×FastPfu 反应缓冲液 4 μL,2.5 mmol·L-1寡核苷酸底物(dNTPs 混合液)2 μL,FastPfu聚合酶0.4 μL。
1.4qRT-PCR分析
1.4.1选取的微生物以及引物设计本试验由处理组Ⅰ到Ⅳ的日粮蛋白质水平是逐渐增加的(能量与蛋白质比值保持不变,约为0.88),且反刍动物对饲料粗纤维降解效果的研究也是近年研究的热点课题。因此,本研究选取了有关蛋白质降解菌和纤维素降解菌进行探究,其中包括:①栖瘤胃普雷沃氏菌(Prevotellaruminicola,即P.ruminicola):一种典型的蛋白质降解菌,能够选择性利用日粮中的蛋白质;②黄色瘤胃球菌(Ruminococcusflavefaciens,即R.flavefaciens)、溶纤维丁酸弧菌(Butyrivibriofibrisolvens,即B.fibrisolvens)及溶糊精琥珀酸弧菌(Succinivibriodextrinisolvens,即S.dextrinisolvens)均为纤维素降解菌,且溶纤维丁酸弧菌也是一种蛋白质降解菌。③反刍兽月形单胞菌(Selenomonasruminantium,即S.ruminantium)与小韦荣球菌(Veillonellaparvula,即V.parvula):均为丙酸生成菌,能维持瘤胃内环境酸碱度稳态且能为反刍动物提供能量。④产甲烷菌(Methanogens):一种甲烷生成菌,能够利用纤维降解过程中释放的氢和CO2。
参考已发表的文献,查找出7类菌种的特异性引物序列,同时使用NCBI BLAST(www.ncbi.nih.gov/BLAST)比对引物特异性(表2)。
表2qRT-PCR 试验所用引物
Table 2qRT-PCR primers used in this study

菌种Targetbacterium引物序列(5'-3')Primersequence扩增片段/bpProductsize退火温度/℃Annealingtemperature栖瘤胃普雷沃氏菌P.ruminicolaF:GAAAGTCGGATTAATGCTCTATGTTGR:CATCCTATAGCGGTAAACCTTTGG7459[9]黄色瘤胃球菌R.flavefaciensF:CGAACGGAGATAATTTGAGTTTACTTAGGR:CGGTCTCTGTATGTTATGAGGTATTACC13260[10]溶纤维丁酸弧菌B.fibrisolvensF:ACACACCGCCCGTCACAR:TCCTTACGGTTGGGTCACAGA6460[11]反刍兽月形单胞菌S.ruminantiumF:CAATAAGCATTCCGCCTGGGR:TTCACTCAATGTCAAGCCCTGG13861[9]溶糊精琥珀酸弧菌S.dextrinisolvensF:TAGGAGCTTGTGCGATAGTATGGR:CTCACTATGTCAAGGTCAGGTAAGG17459[12]小韦荣球菌V.parvulaF:TCCTCTTCTTCGGAAGCCAGAR:AGAGAGTGTTTCTCGGGTTTGC27860[13]产甲烷菌MethanogensF:GGTGGTGTMGGATTCACACARTAYGCWACAGCR:TTCATTGCRTAGTTWGGRTAGTT49155[14]
F和R分别代表上、下游引物
F and R indicates forward and reverse primers,respectively
1.4.2标准质粒的制备分别采用这7类菌种的特异性引物,同时以瘤胃内容物基因组DNA为模板,PCR扩增其特异性片段,利用胶回收试剂盒(AXYGEN,USA)回收产物并连接pGEM-T easy载体(Promega,USA),转化入感受态细胞。菌落PCR鉴定扩增的特异性片段正确后,挑选阳性克隆子测序鉴定,并在BLAST基因库进行在线比对。根据测序结果,利用质粒提取试剂盒(OMEGA,USA)提取含有目的片段的标准质粒,并准确测定质粒DNA溶液浓度。1.4.3标准曲线的制备将上述制备好的标准质粒分别进行10倍浓度梯度稀释(103~109),以其为DNA模板,利用对应的特异性引物,在iCycle iQ5 thermo cycler (Bio-Rad,USA)上进行qRT-PCR反应,反应结束后,以质粒拷贝数的对数为横坐标,以Ct值为纵坐标绘制标准曲线。质粒拷贝数的计算公式:Copies·μL-1=[ 6.02×1023(copy·mol-1)×(DNA amour (ng·μL-1)]/[DNA length (bp) ×660(μg·mol-1·bp-1)]。
1.4.4qRT-PCR反应分别采用这7类菌种的特异性引物,同时以瘤胃内容物基因组DNA为模板进行qRT-PCR反应。每个样品做4个重复。将Ct值带入相应的标准曲线,计算拷贝数。用Premix Ex Taq II (Tli RNaseH Plus) 试剂盒(TaKaRa,Japan)配制25 μL 的总反应体系,其中12.5 μL 2× SYBR Premix Ex Taq II (Tli RNaseH Plus),2.0 mmol·L-1正、反向引物,150.0 ng细菌基因组DNA。扩增反应条件:95 ℃预变性10 min;95 ℃ 变性15 s,退火温度(表2)退火30 s,72 ℃ 延伸45 s,40个循环;72 ℃ 10 min。
1.5瘤胃液VFA的测定
利用气相色谱法[15]采用Agilent 7820A气相色谱仪(安捷伦科技有限公司,USA)测定VFA含量。
1.6统计学分析
试验数据应用统计软件SPSS 20.0进行分析。其中,分析不同营养水平日粮对150~180日龄滩羊瘤胃微生物数量、瘤胃VFA和pH的影响时,采用GLM进行双因素方差分析。采用Duncan氏法进行多重比较,P<0.05表示差异显著。对滩羊瘤胃液pH、VFA和瘤胃微生物以及不同瘤胃微生物相互之间进行Pearson相关性分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1qRT-PCR标准曲线的建立
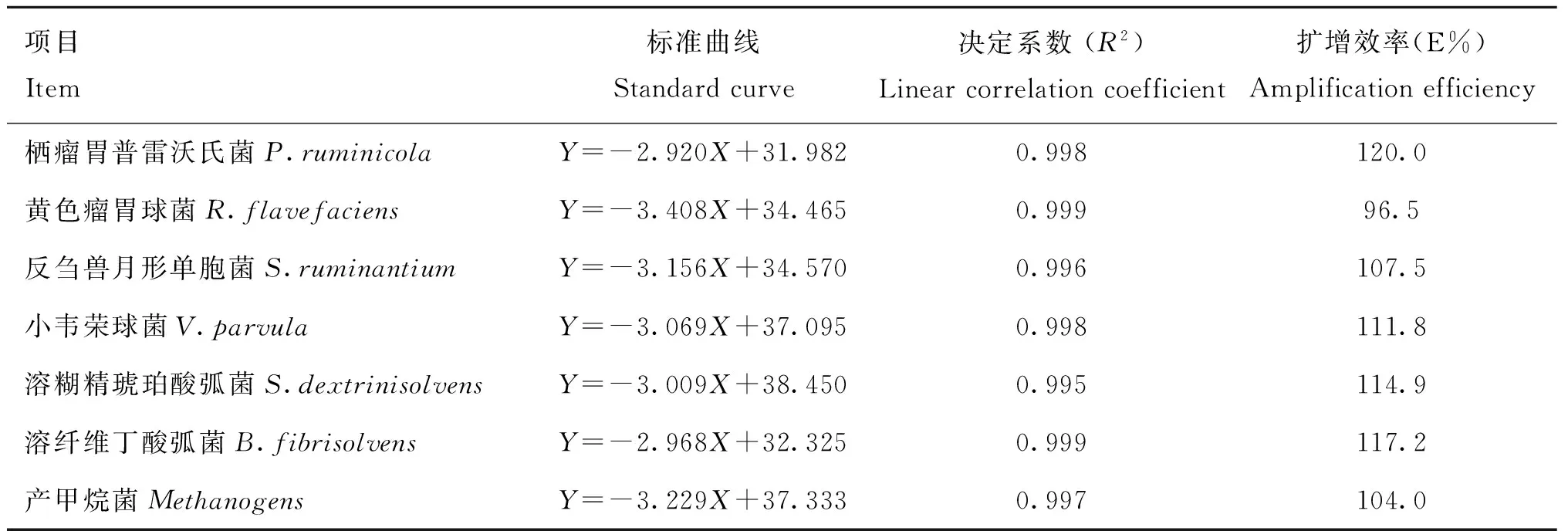
由iCycle iQ5 thermo cycler (Bio-Rad,USA)生成质粒标准品的扩增曲线。质粒拷贝数的对数与Ct值呈线性关系,各菌种的标准曲线方程见表3,标准曲线的决定系数均达到0.995以上,PCR扩增效率为96.5%~120%,符合qRT-PCR试验要求。
表3实时荧光定量PCR标准曲线及其扩增效率与决定系数
Table 3The standard curve,PCR efficiency and linear correlation coefficient (R2)
项目Item标准曲线Standardcurve决定系数(R2)Linearcorrelationcoefficient扩增效率(E%)Amplificationefficiency栖瘤胃普雷沃氏菌P.ruminicolaY=-2.920X+31.9820.998120.0黄色瘤胃球菌R.flavefaciensY=-3.408X+34.4650.99996.5反刍兽月形单胞菌S.ruminantiumY=-3.156X+34.5700.996107.5小韦荣球菌V.parvulaY=-3.069X+37.0950.998111.8溶糊精琥珀酸弧菌S.dextrinisolvensY=-3.009X+38.4500.995114.9溶纤维丁酸弧菌B.fibrisolvensY=-2.968X+32.3250.999117.2产甲烷菌MethanogensY=-3.229X+37.3330.997104.0
2.2日龄和日粮营养水平对瘤胃微生物数量的影响
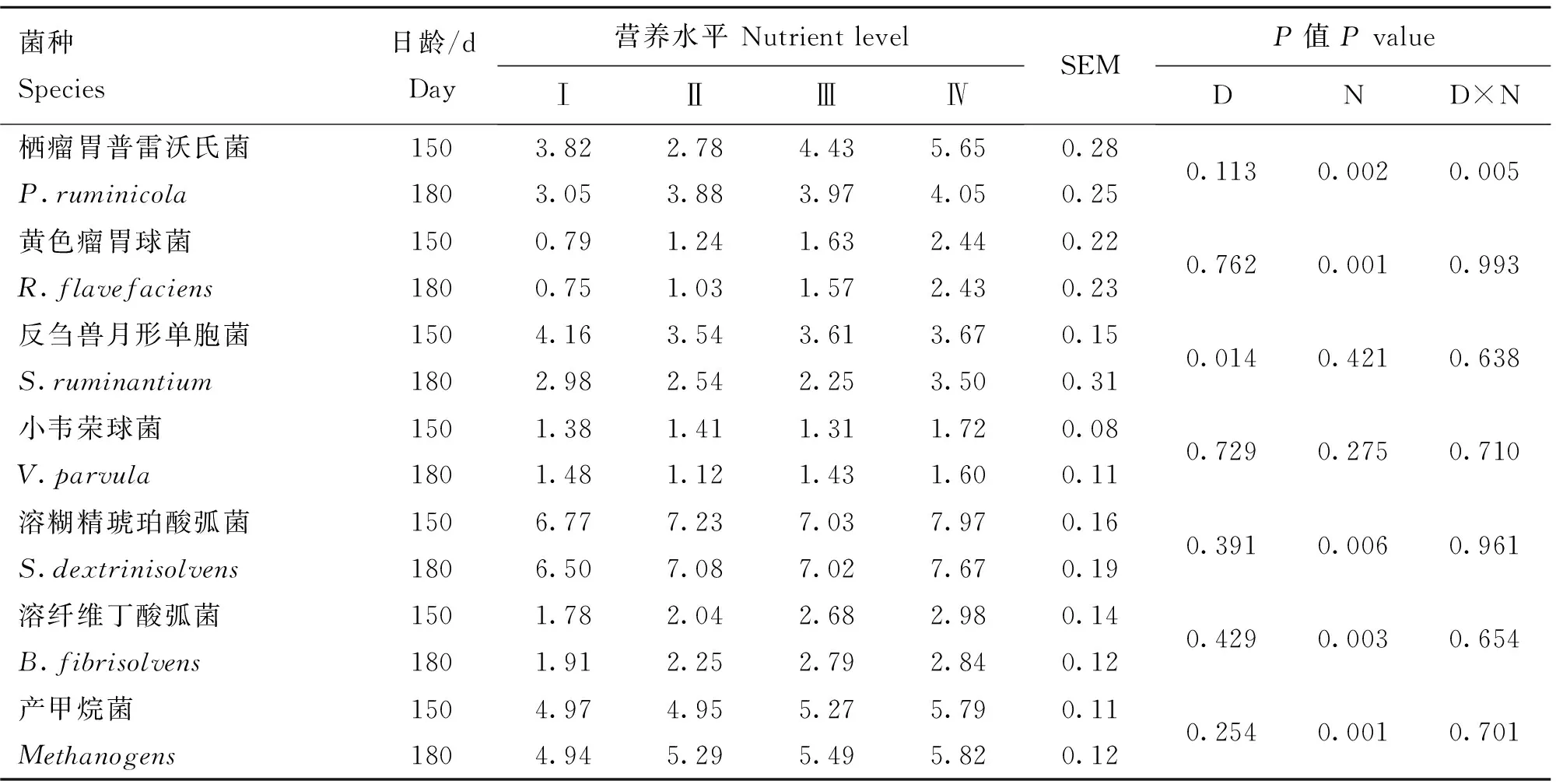
由表4可知,反刍兽月形单胞菌在150和180日龄时,数量有显著差异(P<0.05);其他菌株在不同日龄,数量差异均不显著(P>0.05);当日粮营养水平不同时,瘤胃中栖瘤胃普雷沃氏菌、黄色瘤胃球菌、溶糊精琥珀酸弧菌、溶纤维丁酸弧菌、产甲烷菌的数量差异显著(P<0.05),反刍兽月形单胞菌和小韦荣球菌的数量差异不显著;日龄与日粮营养水平的相互作用显著影响栖瘤胃普雷沃氏菌在瘤胃中的数量(P<0.05),而对其他6种菌株数量的影响不显著(P>0.05)。随着日粮营养水平的提高,瘤胃中栖瘤胃普雷沃氏菌、黄色瘤胃球菌、溶糊精琥珀酸弧菌、溶纤维丁酸弧菌、产甲烷菌的数量呈上升趋势,而反刍兽月形单胞菌、小韦荣球菌的数量变化趋势不明显。
2.3日龄和日粮营养水平对瘤胃液pH和VFA的影响
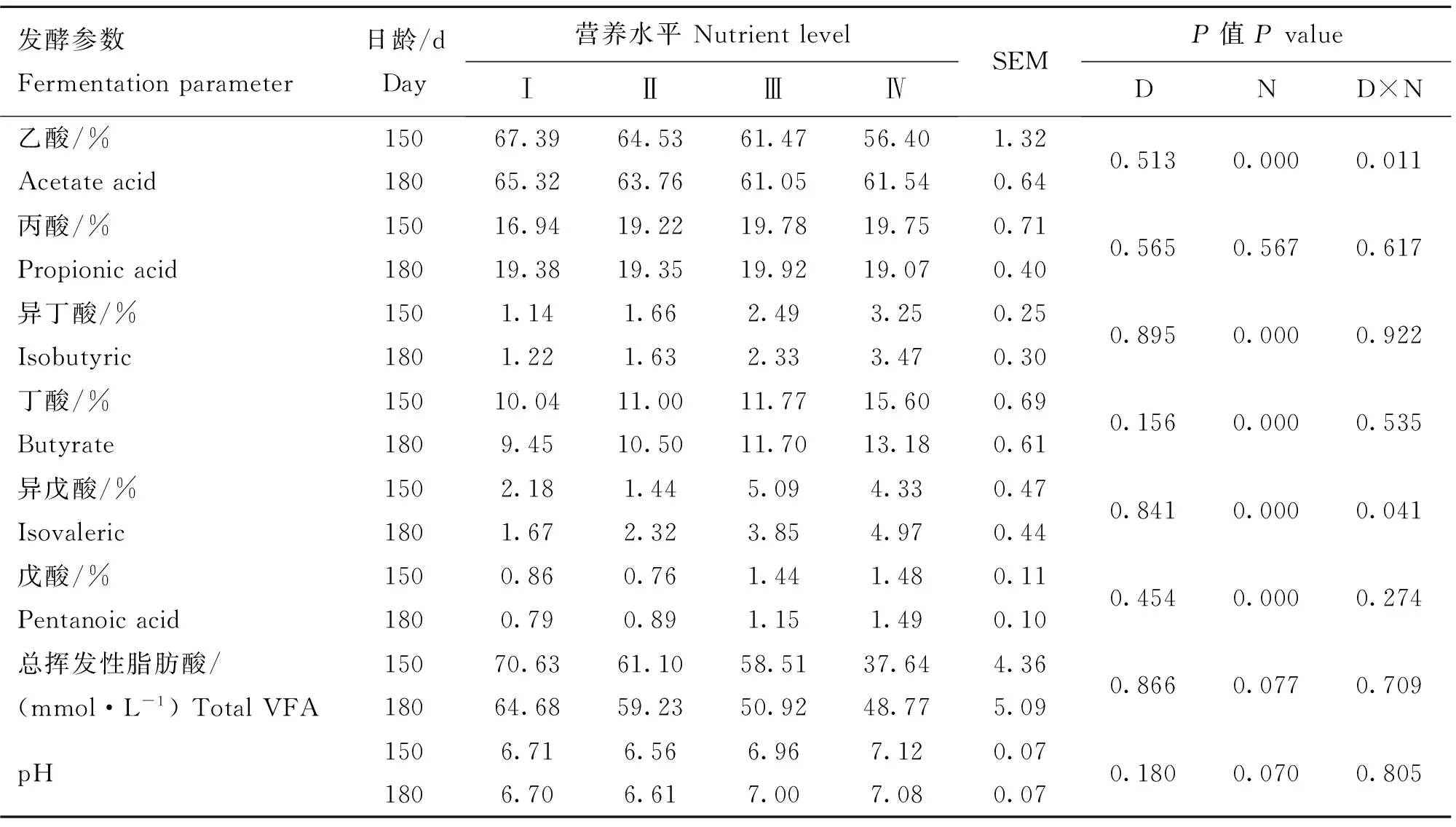
由表5可知,试验测定的瘤胃液pH均为6.56~7.12,且乙酸、丙酸、丁酸含量占总挥发性脂肪酸(TVFA)的比例较高。不同日龄变化对瘤胃液pH和VFA的影响均不显著(P>0.05)。不同营养水平日粮对瘤胃液pH无显著影响(P>0.05);而随着日粮营养水平的提高,乙酸占TVFA的比例呈显著下降趋势(P<0.05),丁酸、异丁酸、戊酸、异戊酸占TVFA的比例呈显著上升趋势(P<0.05),丙酸和TVFA的含量变化不明显(P>0.05)。日龄和日粮营养水平的相互作用显著影响乙酸和异戊酸的含量(P<0.05),而对丙酸、异丁酸等其他几种VFA的含量无显著影响(P>0.05)。
表 4不同日龄、不同营养水平对瘤胃微生物分布的影响
Table 4Effects of different days of age and nutrient levels on the distribution of rumen microbiome
菌种Species日龄/dDay营养水平NutrientlevelⅠⅡⅢⅣSEMP值PvalueDND×N栖瘤胃普雷沃氏菌P.ruminicola1501803.823.052.783.884.433.975.654.050.280.250.1130.0020.005黄色瘤胃球菌R.flavefaciens1501800.790.751.241.031.631.572.442.430.220.230.7620.0010.993反刍兽月形单胞菌S.ruminantium1501804.162.983.542.543.612.253.673.500.150.310.0140.4210.638小韦荣球菌V.parvula1501801.381.481.411.121.311.431.721.600.080.110.7290.2750.710溶糊精琥珀酸弧菌S.dextrinisolvens1501806.776.507.237.087.037.027.977.670.160.190.3910.0060.961溶纤维丁酸弧菌B.fibrisolvens1501801.781.912.042.252.682.792.982.840.140.120.4290.0030.654产甲烷菌Methanogens1501804.974.944.955.295.275.495.795.820.110.120.2540.0010.701
D.日龄;N.营养水平;D×N.日龄和营养水平的交互作用。微生物数量均用每10 ng基因拷贝数的对数值表示。下同
D. The effect of days of age;N. The effect of nutrient levels;D×N. Days of age × nutrient levels interactions.The number of microbes is showed by the logarithm of the values on gene copies per 10 ng.The same as below
表5不同日龄、不同营养水平日粮对滩羊瘤胃液pH和VFA的影响
Table 5Effects of different days of age and nutrient levels on pH and VFA in rumen of Tan sheep
发酵参数Fermentationparameter日龄/dDay营养水平NutrientlevelⅠⅡⅢⅣSEMP值PvalueDND×N乙酸/%Acetateacid15018067.3965.3264.5363.7661.4761.0556.4061.541.320.640.5130.0000.011丙酸/%Propionicacid15018016.9419.3819.2219.3519.7819.9219.7519.070.710.400.5650.5670.617异丁酸/%Isobutyric1501801.141.221.661.632.492.333.253.470.250.300.8950.0000.922丁酸/%Butyrate15018010.049.4511.0010.5011.7711.7015.6013.180.690.610.1560.0000.535异戊酸/%Isovaleric1501802.181.671.442.325.093.854.334.970.470.440.8410.0000.041戊酸/%Pentanoicacid1501800.860.790.760.891.441.151.481.490.110.100.4540.0000.274总挥发性脂肪酸/(mmol·L-1)TotalVFA15018070.6364.6861.1059.2358.5150.9237.6448.774.365.090.8660.0770.709pH1501806.716.706.566.616.967.007.127.080.070.070.1800.0700.805
2.4相关分析
2.4.1不同瘤胃微生物间的相关分析由表6可知,栖瘤胃普雷沃氏菌的数量与黄色瘤胃球菌、溶糊精琥珀酸弧菌的数量呈极显著正相关(r=0.57,P<0.01;r=0.57,P<0.01),与溶纤维丁酸弧菌的数量呈显著正相关(r=0.44,P<0.05);黄色瘤胃球菌与溶糊精琥珀酸弧菌的数量呈极显著正相关(r=0.73,P<0.01);产甲烷菌的数量与黄色瘤胃球菌、溶糊精琥珀酸弧菌及溶纤维丁酸弧菌的数量均呈极显著正相关(r=0.65,P<0.01;r=0.46,P<0.01;r=0.46,P<0.01)。
表6不同瘤胃微生物间的关联性分析
Table 6Correlation between different rumen microbes

项目ItemPrRuSeSuMeBuVePr1.000.57**0.260.57**0.39*0.44*0.24Ru1.000.310.73**0.65**0.44*0.40*Se1.000.44*0.040.170.31Su1.000.46**0.340.24Me1.000.46**0.17Bu1.000.19Ve1.00
Pr.栖瘤胃普雷沃氏菌;Ru.黄色瘤胃球菌;Se.反刍兽月形单胞菌;Ve.小韦荣球菌;Su.溶糊精琥珀酸弧菌;Bu.溶纤维丁酸弧菌;Me.产甲烷菌。*.显著相关(P<0.05);**.极显著相关(P<0.01)。下表同
Pr.P.ruminicola;Ru.R.flavefaciens;Se.S.ruminantium;Ve.V.parvula;Su.S.dextrinisolvens;Bu.B.fibrisolvens;Me.Methanogens.*. Significant correlation (P<0.05);**. Highly significant correlation (P<0.01).The same as below
2.4.2滩羊瘤胃液pH、VFA和瘤胃微生物之间的相关性分析由表7可知,滩羊瘤胃液的pH只与溶纤维丁酸弧菌的数量呈显著正相关(r=0.45,P<0.05)。丙酸含量与小韦荣球菌的数量呈显著正相关(r=0.42,P<0.05);丁酸含量与小韦荣球菌的数量呈显著负相关(r=-0.46,P<0.05),戊酸含量与小韦荣球菌的数量呈极显著负相关(r=-0.53,P<0.01),与反刍兽月形单胞菌的数量呈显著负相关(r=-0.41,P<0.05)。
表7滩羊瘤胃液pH、VFA和瘤胃微生物的相关分析
Table 7Correlation between pH,VFA and microbes in rumen of Tan sheep
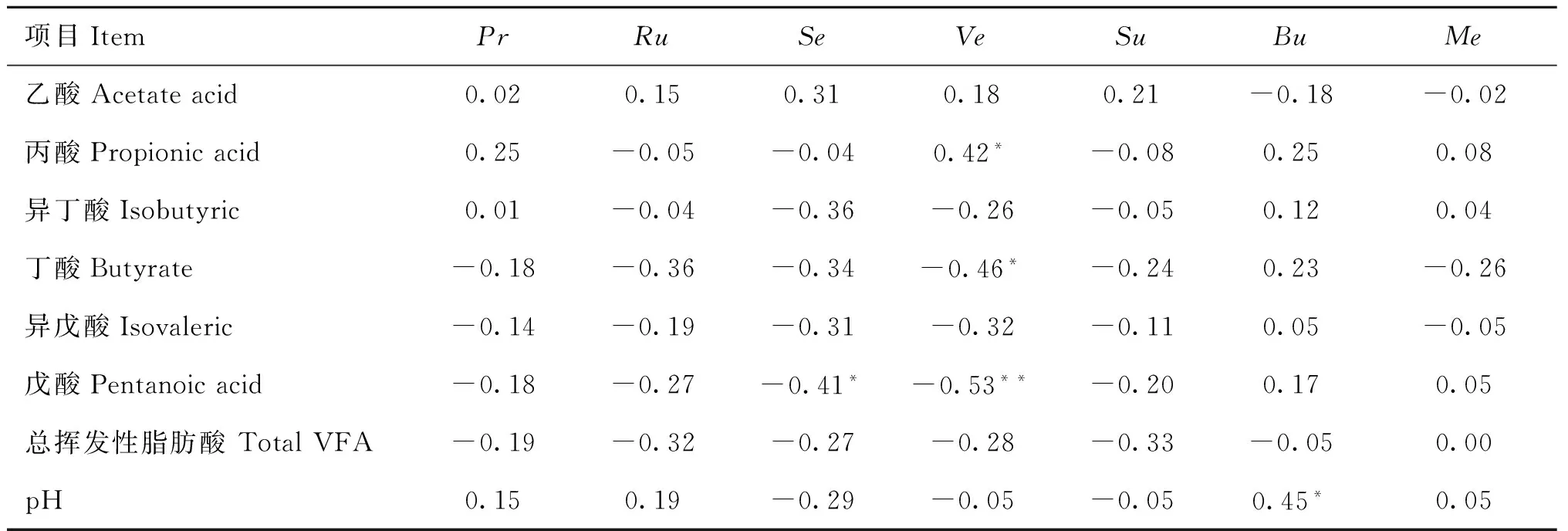
项目ItemPrRuSeVeSuBuMe乙酸Acetateacid0.020.150.310.180.21-0.18-0.02丙酸Propionicacid0.25-0.05-0.040.42*-0.080.250.08异丁酸Isobutyric0.01-0.04-0.36-0.26-0.050.120.04丁酸Butyrate-0.18-0.36-0.34-0.46*-0.240.23-0.26异戊酸Isovaleric-0.14-0.19-0.31-0.32-0.110.05-0.05戊酸Pentanoicacid-0.18-0.27-0.41*-0.53**-0.200.170.05总挥发性脂肪酸TotalVFA-0.19-0.32-0.27-0.28-0.33-0.050.00pH0.150.19-0.29-0.05-0.050.45*0.05
3 讨 论
3.1不同营养水平的日粮对150~180日龄滩羊瘤胃微生物数量的影响
瘤胃是反刍动物不可或缺且特有的器官。瘤胃微生物是瘤胃的重要组成部分,在维持反刍动物身体健康和提高反刍动物生产性能方面起着重要的作用[16]。由于传统的微生物培养方法不能准确估计瘤胃微生物的种类和数量[17],并且D.G.Welkie 等[18]研究发现瘤胃液相的微生物群落结构较固相微生物群落结构更加稳定,因此,本试验利用qRT-PCR技术研究了不同日龄及不同营养水平的日粮对滩羊瘤胃液相中有关微生物的影响。
关于不同饲料原料对瘤胃微生物影响的研究很多,但结果不尽一致。金迪[19]研究发现,保持日粮精粗比不变,不同粗饲料类型对瘤胃微生物的影响较显著,不同蛋白质来源的饲料对瘤胃微生物影响不显著。薛丰[20]的试验结果表明,不同粗饲料来源不能显著影响微生物的数量。而王梦芝等[21]发现不同来源的蛋白质饲料显著影响瘤胃微生物发酵及其群体结构。这说明影响瘤胃微生物数量的因素可能不只是饲料原料组成成分,也可能与饲养管理、品种等因素有关。而本试验是通过不同的饲料原料以保证所配制的日粮营养水平不断提高,因此主要考虑不同营养水平日粮对瘤胃微生物的影响。
其次,缺乏完善的成本管控体系。在现代建筑施工企业中,成本管控是一个十分复杂的体系,想要实现成本管控目标,必须构建与之相适应的管控体系。尤其是在成本核算方面,必须构建完善的制度,保障各方面工作的有效落后。但结合实际情况来看,我国部分建筑施工企业的成本管控体制都不够健全,以至于工作混乱、账目模糊、时效性差、资金管理不到位等情况普遍存在[2]。与此同时,成本管控工作人员的积极性也严重不足,工作态度敷衍,对工作质量造成了严重影响。总的来讲,很多建筑施工企业的成本管控都已经落后于时代。
本试验结果发现,除反刍兽月形单胞菌外,150日龄的各菌种数量和180日龄的各菌种数量无显著变化,且日龄和日粮营养水平的互作仅对栖瘤胃普雷沃氏菌的数量有影响。符运勤[22]研究指出,瘤胃微生物菌群数目会随年龄的增加而变化,但到达4~6月龄时基本保持稳定,从而形成一个稳定的瘤胃微生物生态环境,这与本试验结果一致。
瘤胃微生物的数量受到品种、地域、饲喂方式、日粮等诸多因素的影响[23],但日粮是最重要的因素[24],且日粮蛋白质水平的影响大于能量水平[25]。在本试验中,当日粮营养水平逐渐升高(即日粮能量水平和蛋白质水平同步增加,但能蛋比保持不变)时,除反刍兽月形单胞菌、小韦荣球菌无显著变化外,滩羊瘤胃中栖瘤胃普雷沃氏菌、黄色瘤胃球菌、溶糊精琥珀酸弧菌、溶纤维丁酸弧菌和产甲烷菌的数量均显著增加。有报道表明,栖瘤胃普雷沃氏菌能选择性利用日粮中的蛋白质[9],在本试验中组Ⅳ日粮蛋白质含量最高,因此栖瘤胃普雷沃氏菌数量最多。本试验所选日粮的粗纤维含量从组Ⅰ到Ⅳ是逐渐升高的,有利于黄色瘤胃球菌、溶糊精琥珀酸弧菌[26]和溶纤维丁酸弧菌这类纤维分解菌的生长,有助于其将纤维素类物质降解为VFA[27]。
3.2不同营养水平日粮对150~180日龄瘤胃液pH和VFA含量的影响
瘤胃液pH主要通过影响瘤胃微生物活性来反映瘤胃发酵状况,当瘤胃pH在6.2~7.0范围内时,瘤胃内微生物生态系统较为稳定,能够保证瘤胃的正常发酵[15,28]。在本试验中,不同日龄和日粮水平对瘤胃液pH影响均不显著,且pH一直保持在6.56~7.12之间。说明这两个时期内瘤胃内环境较为稳定,所测得的瘤胃微生物数量能够较为真实的反映出瘤胃微生物区系和数量,但pH不受营养水平的影响,这与王雅倩等[29]的研究结果一致。
瘤胃中VFA是瘤胃微生物发酵的重要产物之一,能为滩羊活动提供能量。在本试验中,不同日龄对瘤胃VFA影响不显著,但其含量受不同营养水平日粮的显著影响[30]。目前,关于不同日粮蛋白质水平对瘤胃液VFA含量影响的研究较多,但研究结果不尽相同。研究发现,随日粮蛋白质水平的提高,瘤胃液NH3-N浓度和VFA含量呈二次曲线增加[31]。但王雅倩等[29]研究发现,随日粮蛋白质水平的提高,瘤胃液NH3-N浓度和VFA含量呈线性变化趋势。目前,关于不同日粮能量水平对瘤胃液VFA含量的研究较少。崔祥等[25]研究发现,不同能量水平的日粮对瘤胃液中的乙酸、丙酸、异丁酸和戊酸的含量影响显著,其中乙酸含量随日粮能量水平的提高而减小,丙酸、戊酸含量随日粮能量水平的提高而增加。本试验中,随着日粮能量和蛋白质水平的同步提高,乙酸占TVFA的比例呈显著下降趋势,丁酸、异丁酸、戊酸、异戊酸占TVFA的比例显著上升,而丙酸的变化不显著,与前人研究结果基本一致[32]。杨宏波等[33]研究发现,溶纤维丁酸弧菌不仅能降解纤维素类物质产生VFA,而且能将吸收的乙酸转化成丁酸。在本试验中,处理组Ⅳ的纤维素含量最高且溶纤维丁酸弧菌的数量最多,因此处理组Ⅳ中丁酸占TVFA的比例显著高于其他3组,而乙酸的比例较低。结果表明,随着日粮营养水平的提高,乙酸占TVFA的比例呈下降趋势,丁酸、异丁酸、戊酸和异戊酸占TVFA的比例均呈上升趋势。
3.3相关分析
3.3.2滩羊瘤胃液pH、VFA和瘤胃微生物之间的相关性分析在本试验中,滩羊瘤胃液的pH与溶纤维丁酸弧菌的数量呈显著正相关,这与张双双等[37]的研究结果一致。小韦荣球菌能够发酵乳酸生成丙酸[38],因此随着该菌数量的增加,瘤胃中丙酸含量也会增加,这与本试验结果一致。丁酸、戊酸与小韦荣球菌相互之间的影响机理还有待进一步研究。毛胜勇等[39]通过体外发酵试验证明戊酸含量对反刍兽月形单胞菌数量无显著影响,这与本研究结果不一致,这可能与体外发酵模拟的瘤胃内环境与瘤胃内环境本身不完全相同有关。因此,瘤胃液pH和VFA含量与瘤胃微生物数量之间存在相关关系。
4 结 论
4.1不同营养水平的日粮对150~180日龄瘤胃微生物数量的影响
随着日粮营养水平的提高,栖瘤胃普雷沃氏菌、黄色瘤胃球菌、溶糊精琥珀酸弧菌、溶纤维丁酸弧菌、产甲烷菌的数量均显著增加,而日龄对这几株菌的影响不显著。
4.2不同营养水平的日粮对150~180日龄瘤胃液pH、VFA含量的影响
不同日龄和不同日粮营养水平对滩羊瘤胃液pH无显著影响。但随着日粮营养水平的提高,瘤胃液乙酸占TVFA的比例呈显著下降趋势,丁酸、异丁酸、戊酸和异戊酸含量均呈显著上升趋势,丙酸和TVFA的含量变化不明显,且日龄对VFA含量无显著影响。
4.3相关分析
不同瘤胃微生物之间存在相互促进作用;瘤胃液pH仅与溶纤维丁酸弧菌的数量呈显著正相关;丙酸含量与小韦荣球菌的数量呈显著正相关,而戊酸含量与小韦荣球菌的数量呈极显著负相关,与反刍兽月形单胞菌的数量呈显著负相关。
[1]ZENED A,COMBES S,CAUQUIL L,et al.Microbial ecology of the rumen evaluated by 454 GS FLX pyrosequencing is affected by starch and oil supplementation of diets[J].FEMSMicrobiolEcol,2013,83(2):504-514.
[2]JIANG S Z,YANG Z B,YANG W R,et al.Diets of differentially processed wheat alter ruminal fermentation parameters and microbial populations in beef cattle[J].JAnimSci,2015,93(11):5378-5385.
[3]崔祥.日粮能量水平对4~6月龄犊牛生长、消化代谢及瘤胃内环境的影响[D].北京:中国农业科学院,2014.
CUI X.Effect and mechanism of different energy level on growth,digestion and metabolism,ruminal environment in heifers aged 4 to 6 months[D].Beijing:Chinese Academy of Agricultural Sciences,2014.(in Chinese)
[4]CECONI I,RUIZ-MORENO M J,DILORENZO N,et al.Effect of urea inclusion in diets containing corn dried distillers grains on feedlot cattle performance,carcass characteristics,ruminal fermentation,total tract digestibility,and purine derivatives-to-creatinine index[J].JAnimSci,2015,93(1):357-369.
[5]张吉鹍,李龙瑞,吴文旋,等.稻草补饲苜蓿对山羊瘤胃发酵的组合效应[J].草业科学,2014,31(2):313-320.
ZHANG J K,LI L R,WU W X,et al.Associative effects of rice straw supplemented with different level of alfalfa hay on rumen fermentation of goats[J].PrataculturalScience,2014,31(2):313-320.(in Chinese)
[6]BERGMAN E N.Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J].PhysiolRev,1990,70(2):567-590.
[7]王满红,赵广永.日粮中氨化稻草水平对体外培养发酵甲烷和挥发性脂肪酸产量的影响[J].动物营养学报,2013,25(8):1775-1784.
WANG M H,ZHAO G Y.Effects of levels of ammoniated rice straw included in rations on rumen methane and volatile fatty acids production ininvitroincubation[J].ChineseJournalofAnimalNutrition,2013,25(8):1775-1784.(in Chinese)
[8]马琴琴,李铁军,何流琴,等.不同粗饲料组合对宁夏滩羊生长性能、屠宰性能及肉品质的影响[J].动物营养学报,2015,27(6):1936-1942.
MA Q Q,LI T J,HE L Q,et al.Effects of different combination of roughage on growth performance,slaughter performance and meat quality in Ningxia Tan sheep[J].ChineseJournalofAnimalNutrition,2015,27(6):1936-1942.(in Chinese)
[9]STEVENSON D M,WEIMER P J.Dominance ofPrevotellaand low abundance of classical ruminal bacterial species in the bovine rumen revealed by relative quantification real-time PCR[J].ApplMicrobiolBiotechnol,2007,75(1):165-174.
[10]MAO H L,MAO H L,WANG J K,et al.Effects of Saccharomyces cerevisiae fermentation product oninvitrofermentation and microbial communities of low-quality forages and mixed diets[J].JAnimSci,2013,91(7):3291-3298.
[11]ALZAHAL O,DIONISSOPOULOS L,LAARMAN A H,et al.Active dry Saccharomyces cerevisiae can alleviate the effect of subacute ruminal acidosis in lactating dairy cows[J].JDairySci,2014,97(12):7751-7763.
[12]KHAFIPOUR E,LI S,PLAIZIER J C,et al.Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J].ApplEnvironMicrobiol,2009,75(22):7115-7124.
[13]LIN M,GUO W,MENG Q,et al.Changes in rumen bacterial community composition in steers in response to dietary nitrate[J].ApplMicrobiolBiotechnol,2013,97(19):8719-8727.
[14]DAQUIADO A R,CHO K M,KIM T Y,et al.Methanogenicarchaeadiversity in Hanwoo (Bostauruscoreanae) rumen fluid,rectal dung,and barn floor manure using a culture﹣independent method based on mcrA gene sequences[J].Anaerobe,2014,27:77-81.
[15]翁秀秀.饲喂不同日粮奶牛瘤胃发酵和VFA吸收特性及其相关基因表达的研究[D].兰州:甘肃农业大学,2013.
WENG X X.The study on rumen fermentation,volatile fatty acid absorption characteristics and gene expression in dairy cows receiving different types of diets[D].Lanzhou:Gansu Agricultural University,2013.(in Chinese)
[16]马涛,刁其玉.瘤胃微生物多样性与定量[J].动物营养学报,2015,27(12):3649-3654.
MA T,DIAO Q Y.Rumen diversity and quantitative determination[J].ChineseJournalofAnimalNutrition,2015,27(12):3649-3654.(in Chinese)
[17]KIM G B,SEO Y M,KIM C H,et al.Effect of dietary prebiotic supplementation on the performance,intestinal microflora,and immune response of broilers[J].PoultSci,2011,90(1):75-82.
[18]WELKIE D G,STEVENSON D M,WEIMER P J.ARISA analysis of ruminal bacterial community dynamics in lactating dairy cows during the feeding cycle[J].Anaerobe,2010,16(2):94-100.
[19]金迪.不同粗饲料及蛋白质来源日粮条件下奶牛瘤胃细菌群落多样性变化[D].北京:中国农业科学院,2013.
JIN D.Bacterial community in the rumen of dairy cows fed diets differing in forage and protein sources[D].Beijing:Chinese Academy of Agricultural Sciences,2013.(in Chinese)
[20]薛丰.日粮中粗饲料品质对绵羊瘤胃微生物区系和纤维降解影响的研究[D].呼和浩特:内蒙古农业大学,2007.
XUE F.The effect of dietary forage quality on rumen microflora and fiber degradation in sheep[D].Hohhot:Inner Mongolia Agricultural University,2007.(in Chinese)
[21]王梦芝,喻礼怀,王洪荣,等.不同蛋白质饲料对瘤胃微生物体外发酵和群体结构的影响[J].动物营养学报,2009,21(5):673-679.
WANG M Z,YU L H,WANG H R,et al.The effect of different protein diets on fermentation of rumen microbesinvitro[J].ChineseJournalofAnimalNutrition,2009,21(5):673-679.(in Chinese)
[22]符运勤.地衣芽孢杆菌及其复合菌对后备牛生长性能和瘤胃内环境的影响[D].北京:中国农业科学院,2012.
FU Y Q.Effects ofBacilluslicheniformisand its combinations on growth performance and ruminal environment in replacement cattle[D].Beijing:Chinese Academy of Agricultural Sciences,2012.(in Chinese)
[23]刘开朗,王加启,卜登攀.2008-2009年反刍动物营养研究进展 I.瘤胃微生物多样性与功能[J].中国畜牧兽医,2010,37(2):5-14.
LIU K L,WANG J Q,BU D P.Research progress of ruminant nutrition from 2008 to 2009,I.The diversity and function of rumen microbes[J].ChinaAnimalHusbandry&VeterinaryMedicine,2010,37(2):5-14.(in Chinese)
[24]YANEZ-RUIZ D R,ABECIA L,NEWBOLD C J.Manipulating rumen microbiome and fermentation through interventions during early life:a review[J].FrontMicrobiol,2015,6:1133.
[25]崔祥,刁其玉,张乃锋,等.日粮能量水平对断奶犊牛生长性能及营养物质消化代谢的影响[J].畜牧兽医学报,2014,45(11):1815-1823.
CUI X,DIAO Q Y,ZHANG N F,et al.Effects of dietary energy levels on growth performance,digestion and metabolism of nutrients of weaned heifers[J].ActaVeterinariaetZootechnicaSinica,2014,45(11):1815-1823.(in Chinese)
[26]肖文萍.藏猪肠道微生物多样性的研究[D].杨凌:西北农林科技大学,2012.
XIAO W P.Diversity of gastrointestinal microflora of Tibetan pig[D].Yangling:Northwest A&F University,2012.(in Chinese)
[27]董瑞阳.粗饲料组合对泌乳牛与干奶牛甲烷产量、瘤胃发酵模式及微生物菌群的影响[D].郑州:河南农业大学,2014.
DONG R Y.Effect of roughage combinations on methane production,rumen fermentation pattern and microbial population of lactating cows and dry cows[D].Zhengzhou:Henan Agricultural University,2014.(in Chinese)
[28]张腾,庄苏,董文超,等.不同精粗比日粮对奶山羊瘤胃液pH值、VFA及血液VFA含量的影响[J].畜牧与兽医,2013,45(4):5-10.
ZHANG T,ZHUANG S,DONG W C,et al.Effects of different dietary concentrate to forage ratios on rumen fluid pH and VFA levels and blood VFA levels in dairy goats[J].AnimalHusbandryandVeterinaryMedicine,2013,45(4):5-10.(in Chinese)
[29]王雅倩,俞路,王春梅,等.日粮蛋白质水平对湖羊胃肠道pH、氨态氮及尿素氮的影响[J].畜牧与兽医,2008,40(3):34-39.
WANG Y Q,YU L,WANG C M,et al.Effects of different dietary protein level on pH,NH3-N and urea-N in gastrointestinal tract of hu sheep[J].AnimalHusbandryandVeterinaryMedicine,2008,40(3):34-39.(in Chinese)
[30]胡红莲,卢德勋,刘大程,等.不同NFC/NDF比日粮对奶山羊瘤胃pH值动态变化的影响[J].畜牧与饲料科学,2011,32(9-10):35-37.
HU H L,LU D X,LIU D C,et al.Effects of dietary non-fiber carbohydrate to neutral detergent ratios on ruminal pH dynamics in dairy goats[J].AnimalHusbandryandFeedScience,2011,32(9-10):35-37.(in Chinese)
[31]许曾曾.蛋白质饲料种类和添加水平对活体外瘤胃发酵和微生物氨基酸组成的影响[D].北京:中国农业大学,2004.
XU Z Z.Rumen fermentation and microbial amino acid profile influenced by sources and levels of feed proteininvitro[D].Beijing:China Agricultural University,2004.(in Chinese)
[32]周亚文,张玉杰,林波,等.瘤胃甲烷生成过程中微生物之间的相互关系[J].动物营养学报,2011,23(4):556-562.
ZHOU Y W,ZHANG Y J,LIN B,et al.Interactions between microbes in the process of methane generation[J].ChineseJournalofAnimalNutrition,2011,23(4):556-562.(in Chinese)
[33]杨宏波,刘红,占今舜,等.不同精粗比颗粒饲料对断奶公犊牛瘤胃发酵参数和微生物的影响[J].草业学报,2015,24(12):131-138.
YANG H B,LIU H,ZHAN J S,et al.Effect of diet pellets with different concentrate﹣roughage ratios on rumen fermentation parameters and microorganism abundance in weaned bull calves[J].ActaPratacultureSinica,2015,24(12):131-138.(in Chinese)
[34]FONDEVILA M,DEHORITY B A.Interactions betweenFibrobactersuccinogenes,Prevotellaruminicola,andRuminococcusflavefaciensin the digestion of cellulose from forages[J].JAnimSci,1996,74(3):678-684.
[35]王梦芝,徐爱秋,李世霞,等.瘤胃微生物对纤维素类物质降解的研究[J].饲料工业,2007,28(14):53-57.
WANG M Z,XU A Q,LI S X,et al.The research of degradation of cellulose by rumen microbes[J].FeedIndustry,2007,28(14):53-57.(in Chinese)
[36]MORVAN B,BONNEMOY F,FONTY G,et al.Quantitative determination of H2-utilizing acetogenic and sulfate-reducing bacteria and methanogenic archaea from digestive tract of different mammals[J].CurrMicrobiol,1996,32(3):129-133.
[37]张双双,杨承剑,梁明振,等.瘤胃溶纤维丁酸弧菌调控共轭亚油酸合成的研究进展[J].畜牧与兽医,2014,46(2):105-108.
ZHANG S S,YANG C J,LIANG M Z,et al.The research progress ofButyrivibriofibrisolvensregulation of the synthesis of conjugated linolenic acid[J].AnimalHusbandryandVeterinaryMedicine,2014,46(2):105-108.(in Chinese)
[38]邢欣.小韦荣球菌ACK基因缺失工程菌的构建及特性分析[D].长春:吉林大学,2009.
XING X.Construction ofACKgene deletion engineering bacteria ofVeillonellaParvulaand its characterization[D].Changchun:Jilin University,2009.(in Chinese)
[39]毛胜勇,龙黎明,朱伟云.体外研究反刍兽新月形单胞菌及与酵母联用对瘤胃微生物发酵的影响[J].草业学报,2010,19(4):176-186.
MAO S Y,LONG L M,ZHU W Y.The effect ofSelenomonasruminantiumand conjunction with yeast on rumen microbial fermentationinvitro[J].ActaPratacultureSinica,2010,19(4):176-186.(in Chinese)
(编辑郭云雁)
Effect of Dietary Nutrient Levels on the Number of Related Microbes,pH and VFA Levels in Rumen of Tan Sheep Aged from 150 to 180 Days
WANG Yao-yue,ZHAO Zhao-yan,WANG Xing-tao,CHEN Yu-lin*,YANG Yu-xin*
(CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling712100,China)
The aim of this experiment was to study the effect of dietary nutrient levels on the number of related microbes,includingSuccinivibriodextrinisolvens(S.dextrinisolvens),Prevotellaruminicola(P.ruminicola),Selenomonasruminantium(S.ruminantium),Butyrivibriofibrisolvens(B.fibrisolvens),Ruminococcusflavefaciens(R.flavefaciens),Veillonellaparvula(V.parvula) andMethanogens,pH and VFA levels in the rumen of Tan sheep aged from 150 to 180 days.One hundred and twelve 105-day-old Tan sheep(half males and half females) with the similar average body weight (BW) of (29±1.25) kg and better body condition were allotted randomly to 4 dietary treatments (group Ⅰ,Ⅱ,Ⅲ and Ⅳ).Each treatment had 4 replicated pens,with 7 sheep in each pen.From group Ⅰ to Ⅳ,energy of diets were 7.08,8.09,9.10 and 10.11 MJ· kg-1,respectively;dietary protein levels were 8.04%,9.19%,10.34% and 11.49%,respectively.The ratio of energy to protein was kept unchanged (about 0.88).The experiment lasted for 75 days,including 15 days for adaptation.On 150 and 180 days of age, one sheep was randomly selected in each replicate for slaughter and rumen contents were collected,pH was tested and VFA levels in the rumen were analyzed by gas chromatography measurement.Genomic DNA was extracted from rumen contents,qRT-PCR was used for the absolute quantification of these related microbes by the consruction of the standard plasmids.The result showed that the number ofS.ruminantiumon different days of age were significantly different (P<0.05).However,with the increasing of dietary nutrient levels,the number ofP.ruminicola,R.flavefaciens,S.dextrinisolvens,B.fibrisolvensandMethanogensincreased significantly (P<0.05).With the distinct days of age and dietary nutrient levels,pH was not significantly different (P>0.05).The content of acetate acid showed significantly downward trend from lower dietary nutrient levels to higher dietary nutrient levels(P<0.05).The ratio of butyrate,isobutyric,pentanoic acid and isovaleric to total volatile fatty acid (TVFA) showed significantly upward trends(P<0.05).There were mutually improved relationships between different rumen microbes.Propionic acid content was significantly and positively correlated with the number ofV.parvula(r=0.42,P<0.05),while the content of pentanoic acid was extremely significantly negatively related to the number ofV.parvula(r=-0.53,P<0.01).Compared with the effect of days of age,different nutrient levels have greater effects on rumen microbes and VFA levels.There are correlations between the levels of rumen VFA,pH and related ruminal microbes.
Tan sheep;rumen microbes;qRT-PCR;pH;VFA
10.11843/j.issn.0366-6964.2016.10.015
2016-04-19
国家绒毛用羊产业技术体系项目(CARS-40-13)
王尧悦(1992-),女,陕西临潼人,硕士生,主要从事动物营养与饲料科学研究,E-mail:18792629437@163.com
陈玉林,教授,博士生导师,E-mail:chenyulindk@163.com;杨雨鑫,副教授,硕士生导师,E-mail:yxyang@nwsuaf.edu.cn
S811.6
A
0366-6964(2016)10-2060-11
