高脂饲粮对生长育肥猪肉品质和骨骼肌蛋白质组的影响
2016-11-08刘静波张宏福
熊 火,蔡 欣,刘静波,*,陈 亮,张宏福
(1.西南科技大学生命科学与工程学院,绵阳 621010; 2.中国农业科学院北京畜牧兽医研究所,北京 100193)
高脂饲粮对生长育肥猪肉品质和骨骼肌蛋白质组的影响
熊火1,蔡欣1,刘静波1,2*,陈亮2,张宏福2
(1.西南科技大学生命科学与工程学院,绵阳 621010; 2.中国农业科学院北京畜牧兽医研究所,北京 100193)
本试验旨在研究高脂饲粮对生长育肥猪肉品质和骨骼肌蛋白质组的影响。选择20头平均体重为(73.28±0.57) kg的生长育肥猪,随机分为对照组(对照饲粮,含10.0%玉米淀粉)和试验组(高脂饲粮,含10.0%猪油),每个处理10个重复,每个重复1头猪,试验期42 d。研究饲粮脂肪含量对生长育肥猪生长性能、肉品质和骨骼肌蛋白质表达谱差异的影响。结果表明:高脂饲粮显著提高了生长育肥猪的平均日增重(P<0.05),并降低了料重比(P<0.01)。骨骼肌pH45 min、pH24 h、肌内脂肪含量、亮度、红度、黄度、蒸煮损失、滴水损失和剪切力不受饲粮脂肪含量的影响(P>0.05)。蛋白质组学分析表明,饲喂高脂饲粮上调了生长育肥猪骨骼肌中钙网蛋白、肌球蛋白重链、加帽蛋白、丙酮酸激酶、烯醇化酶、乳酸脱氢酶、磷酸丙糖异构酶、腺苷酸激酶、载脂蛋白A和B、脂肪酸结合蛋白、热休克蛋白27 ku和70 ku等蛋白质的表达量,但下调了肌球蛋白轻链和磷酸葡萄糖变位酶蛋白质的表达量。由此可见,采食高脂饲粮可显著改善生长育肥猪的生长性能,并上调骨骼肌中与脂质代谢、葡萄糖和能量代谢等生物学功能相关的蛋白质表达量。
高脂饲粮;肉品质;蛋白质组学;猪
能量摄入不足是限制生长育肥猪后期生长性能的主要因素,因此,养猪生产常通过增加饲粮脂肪含量的营养途径改善生长育肥猪的生长速度和饲料报酬[1]。与此同时,育肥猪脂质沉积和肉品质也在一定程度上受到饲粮脂肪含量和能量水平提高的影响[2],但也有研究表明肌内脂肪含量不受饲粮脂肪和能量水平的影响[3-4]。此外,前期研究还发现饲粮添加共轭亚油酸可增加肌内脂肪沉积[5],但也有研究发现共轭亚油酸对肌内脂肪沉积无显著影响或降低肌内脂肪含量[6-7]。由此可见,前期关于饲粮添加脂肪对生长育肥猪背膘沉积和肌内脂肪沉积的研究结果并不一致。
将双向电泳和质谱鉴定相结合的蛋白质组学技术可有效分析猪骨骼肌中数以千计的蛋白质表达量,该技术目前已被广泛应用于研究生长模式、饲粮能量来源和脂肪酸组成对肉品质相关蛋白质表达量的影响[8]。因此,为探究饲粮脂肪含量与生长育肥猪骨骼肌能量代谢和脂质代谢等过程中相关蛋白质表达量之间的关系,本试验通过蛋白质组学技术研究高脂饲粮对生长育肥猪肉品质和骨骼肌蛋白质组的影响,为探索营养途径调控育肥猪骨骼肌能量代谢和脂质代谢奠定基础。
1 材料与方法
1.1试验设计和饲养管理
试验采用单因子试验设计,选择20头体重(平均体重(73.28±0.57) kg)相似的杜长大三元杂交去势公猪,随机分到对照组(对照饲粮)和试验组(高脂饲粮),每个处理10个重复,每个重复1头猪。对照组饲粮为含有10.0%玉米淀粉的玉米豆粕型饲粮,试验组通过在对照组饲粮中添加10.0%的猪油替代玉米淀粉构成高脂饲粮,具体饲粮组成和营养水平见表1。试验期间动物饲养于代谢笼内,室内温度控制在18~22 ℃,自然光照,自由采食和饮水,试验期42 d。在试验开始和结束时记录每头猪的体重,用于计算平均日增重。记录试验期间每头猪的饲料消耗总量,用于计算平均日采食量和料重比(平均日采食量/平均日增重)。
1.2样本收集
试验结束时,动物空腹8 h后麻醉放血处死,在胸椎与腰椎结合处收集背最长肌样本用于测定肉品质,将蛋白质组学分析的样品置于液氮中保存。
1.3胴体品质和肉品质测定指标与方法
1.3.1屠宰率屠宰率由胴体重(去除头、蹄、尾和内脏组织后的重量)除以宰前活重计算得出。
1.3.2平均背膘厚分别测定左侧胴体肩部最厚处、胸腰结合处和腰荐结合处3点的背膘厚度,取平均值作为平均背膘厚。
1.3.3剪切力将新鲜肌肉组织切片后置于水浴锅中加热使其中心温度达到71 ℃,而后由剪切力测定仪(Texture Analyser,TA.XT.Plus.Stable Micro system)测定肌肉样本的剪切力。1.3.4肌内脂肪将5 g左右肌肉样本冷冻干燥后采用索氏抽提法提取油脂后用于计算肌内脂肪含量。1.3.5肉色采用CR-400(MINOLTA)色差计对肌肉样本进行肉色评分。
1.3.6pH试验动物屠宰45 min和24 h后使用pH-STAR(SFK-Techbology,Denmark)测定肌肉样本pH。
1.3.7滴水损失将新鲜肌肉组织剪成长5 cm、宽2 cm、厚3 cm的肉柱后称重,用铁丝挂住样本保持肌纤维垂直向下后置于气体充盈的塑料薄膜口袋,扎紧袋口悬挂于4 ℃冰箱内贮藏24 h后称重,计算滴水损失。
1.3.8蒸煮损失将肌肉样本剪成长4 cm、宽4 cm、厚2.5 cm肉块后置于蒸煮袋内排尽空气后密封,在75 ℃水浴锅中加热30 min后取出样本冷却至室温称重,计算蒸煮损失。
表1饲粮组成和营养水平(风干基础)
Table 1Composition and nutrient levels of experimental diets (air-dry basis)
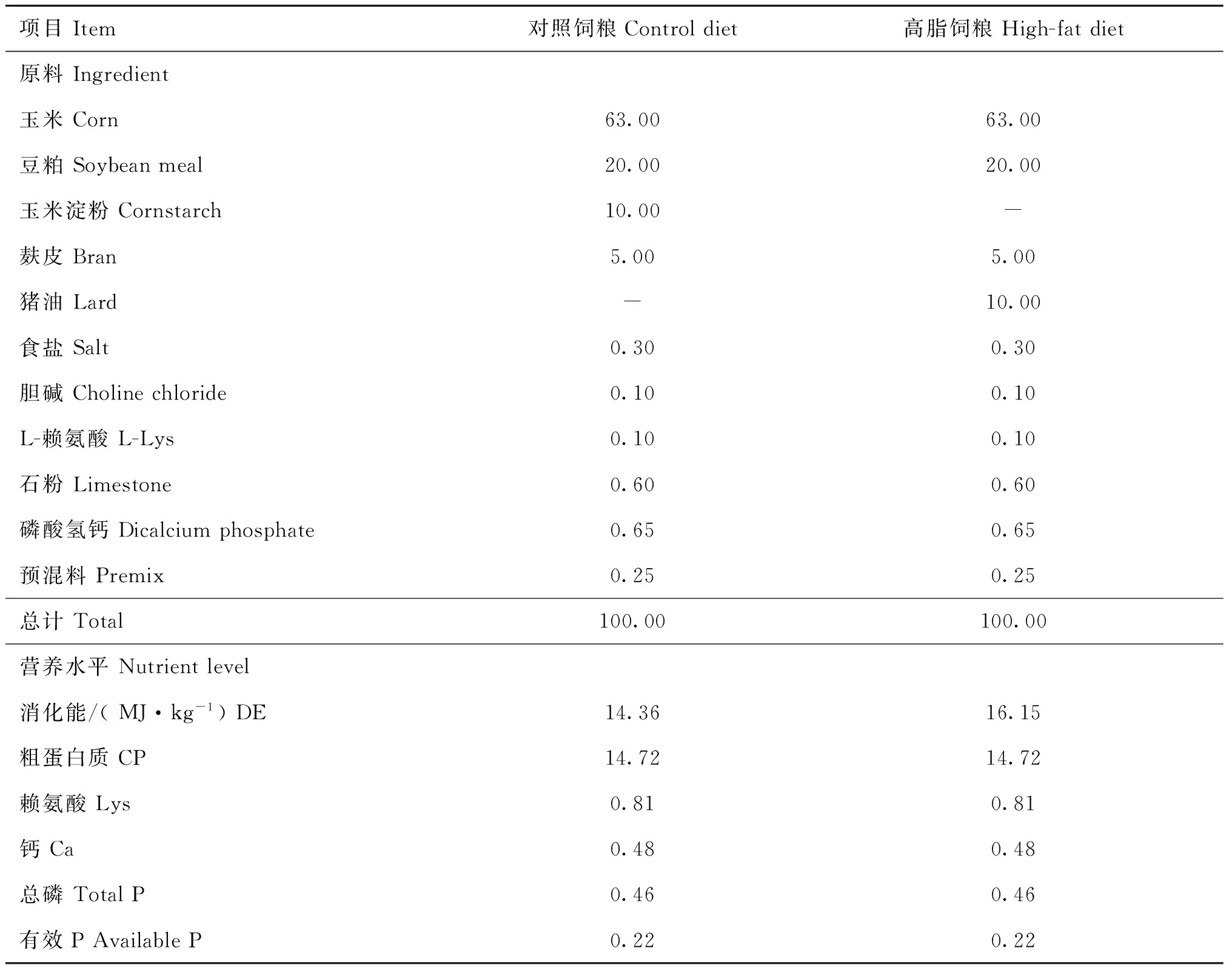
%
预混料为每千克日粮提供:Cu(CuSO4·5H2O) 10 mg,Fe(FeSO4·7H2O)80 mg,Mn(MnSO4·H2O)20 mg,Zn(ZnSO4·H2O)80 mg,Se(Na2SeO3)0.5 mg,I(KI)0.5 mg,VA 8 000 IU,VD32 000 IU,VE 12 IU,VK31.2 mg,VB11.5 mg,VB24 mg,VB62 mg,VB120.02 mg,生物素0.08 mg,泛酸12 mg,烟酸20 mg
Premix provided per kilogram of diet:Cu(CuSO4·5H2O) 10 mg,Fe(FeSO4·7H2O)80 mg,Mn(MnSO4·H2O)20 mg,Zn(ZnSO4·H2O)80 mg,Se(Na2SeO3)0.5 mg,I(KI)0.5 mg,VA 8 000 IU,VD32 000 IU,VE 12 IU,VK31.2 mg,VB11.5 mg,VB24 mg,VB62 mg,VB120.02 mg,biotin 0.08 mg,pantothenic acid 12 mg,niacin 20 mg
1.4骨骼肌蛋白质组学分析1.4.1蛋白质提取和荧光标记取少量骨骼肌(约0.2 g)样本于研钵中加入液氮以及含蛋白酶抑制剂的缓冲液(7 mol·L-1脲,2 mol·L-1硫脲,4% 3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸,50 mmol·L-1二硫苏糖醇,1%蛋白酶抑制剂),粉碎组织破碎细胞后离心取上清液于-80 ℃保存。Bradford法测定蛋白浓度后在各样本中取200 μg蛋白质在组内随机混合为5个样本(每两份样本混合成一份)用于蛋白质组学分析。按照DIGE试剂盒(GE Healthcare)说明进行荧光标记[9]。
1.4.2双向电泳及图象扫描分析第一向等电聚焦程序:1)线性升压至250 V,持续时间 30 min;2)快速升压至1 000 V,持续时间1 h;3)线性升压至10 000 V,持续时间5 h;4)快速升压至10 000 V,持续时间 60 000 Vh。二维电泳聚丙烯酰胺凝胶电泳在Ettan DALT(GE Healthcare)上进行,具体电泳过程如J.Liu等[9]所描述。电泳结束后使用Typhoon 9410TM荧光扫描仪(GE Healthcare)进行凝胶扫描,不同染料激发/发射波长分别为Cy2 (488/520 nm)、Cy3(532/580 nm)和Cy5(633/670 nm)。使用DeCyderTMv 6.5(GE Healthcare)软件对扫描图像进行比对分析,对扫描后凝胶上蛋白点进行胶内分析,然后再将不同胶上的同一蛋白点与内参匹配进行胶间分析,最终根据每个蛋白点匹配后的相对表达量确定差异表达蛋白。饲粮处理间蛋白质表达量差异比绝对值大于1.2,P<0.05的蛋白选定为目的蛋白,用于质谱分析。
1.4.3目的蛋白的定性使用制备胶分离目的蛋白,电泳过程如臧长江等[10]所描述,染色方法为考马斯亮蓝染色,蛋白质上样量为1 000 μg。冻干后的胶粒加入胰蛋白酶溶液,使用5%三氟乙酸溶解37 ℃条件下水解产生的肽混合物后,用0.5 μL肽溶液与1 μL基质(4-羟基-α-氰基肉桂酸,50%乙脲,0.1%三氟乙酸)相混合。使用基质辅助激光解吸电离飞行时间质谱或串联质谱技术检测分析肽混合液(4800 Proteomics Analyzer,Applied Biosystems),获取肽的指纹图谱。选择MASCOT 搜索软件与其他哺乳动物数据库(NCBI)蛋白质进行匹配,根据蛋白评分确定目的蛋白种类。分析过程使用GPS ExplorerTM软件(3.6版本,Applied Biosystems),软件评分>67代表P<0.05。
1.5统计分析
采用SAS统计软件中的One-way ANOVA程序分析试验数据,结果以“平均值±标准误”表示,P<0.05认为差异显著。
2 结 果
从表2结果可以看出,生长育肥猪采食高脂饲粮导致平均日增重(ADG)、试验结束时的活体重和胴体重显著增加(P<0.05),并极显著降低了料重比(P<0.01)。平均日采食量(ADFI)、屠宰率和平均背膘厚不受饲粮脂肪含量的影响(P>0.05)。从表3可知,生长育肥猪背最长肌的pH45 min、pH24 h、肌内脂肪含量、亮度、红度、黄度、蒸煮损失、滴水损失和剪切力等肉品质相关指标均不受饲粮脂肪含量因素的影响(P>0.05)。
通过使用双向差异凝胶电泳技术,本试验共分离出约2 000个蛋白点(图1),其中16个蛋白质的表达量受饲粮脂肪含量的影响,这些蛋白质的功能主要涉及到:(1)细胞凋亡;(2)细胞结构;(3)葡萄糖和能量代谢;(4)脂质代谢;(5)应激反应。由表4可以看出,采食高脂饲粮上调了生长育肥猪骨骼肌中钙网蛋白、肌球蛋白重链、加帽蛋白、丙酮酸激酶、烯醇化酶、乳酸脱氢酶、磷酸丙糖异构酶、腺苷酸激酶、载脂蛋白A和B、脂肪酸结合蛋白、热休克蛋白27 ku和70 ku等蛋白质的表达量,但下调了肌球蛋白轻链和磷酸葡萄糖变位酶的蛋白质表达量。
表2高脂饲粮对生长育肥猪生长性能和胴体品质的影响
Table 2Effect of high-fat diet on growth performance and carcass traits of growing-finishing pigs
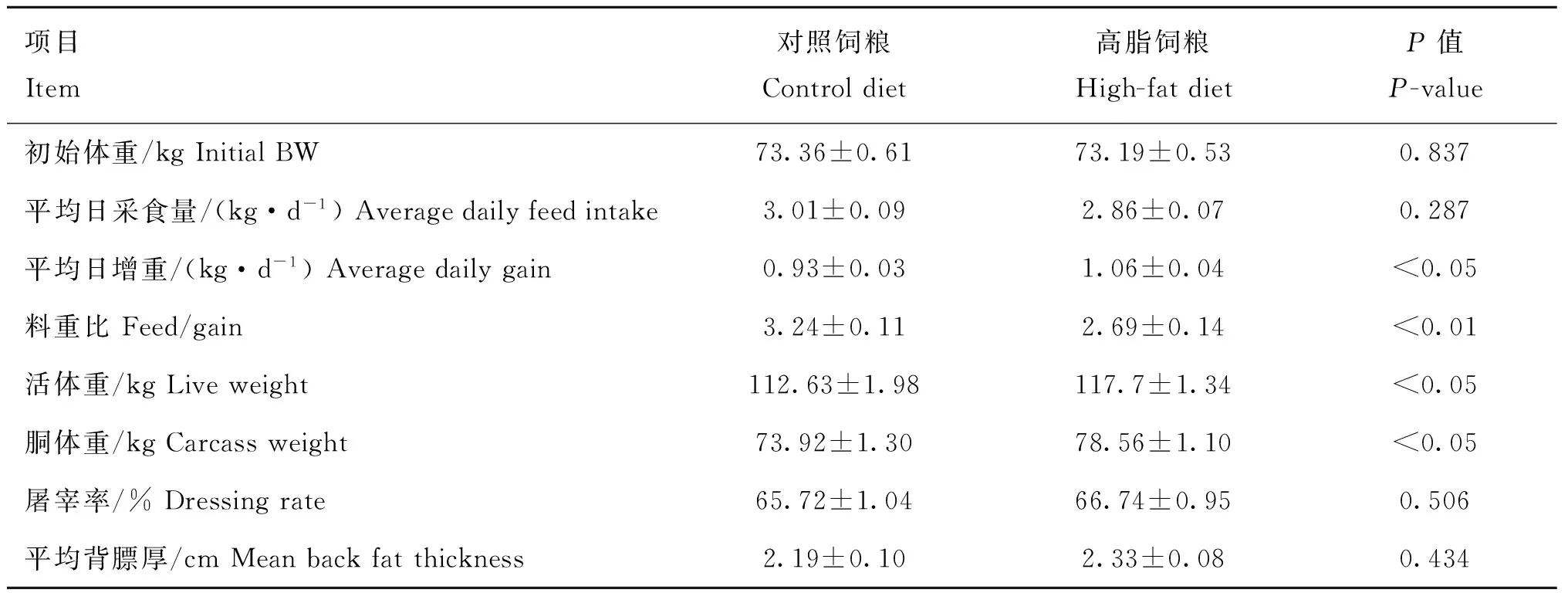
项目Item对照饲粮Controldiet高脂饲粮High-fatdietP值P-value初始体重/kgInitialBW73.36±0.6173.19±0.530.837平均日采食量/(kg·d-1)Averagedailyfeedintake3.01±0.092.86±0.070.287平均日增重/(kg·d-1)Averagedailygain0.93±0.031.06±0.04<0.05料重比Feed/gain3.24±0.112.69±0.14<0.01活体重/kgLiveweight112.63±1.98117.7±1.34<0.05胴体重/kgCarcassweight73.92±1.3078.56±1.10<0.05屠宰率/%Dressingrate65.72±1.0466.74±0.950.506平均背膘厚/cmMeanbackfatthickness2.19±0.102.33±0.080.434
3 讨 论
饲粮能量水平是影响育肥猪生长性能的重要因素,本试验结果表明,饲粮添加10.0%的猪油可显著提高生长育肥猪后期生长速度并改善饲料报酬,但对胴体品质和肉品质无显著影响,这与前期研究结果基本一致[1,4,11]。蛋白质组学分析结果表明,饲喂高脂饲粮显著影响育肥猪骨骼肌中涉及葡萄糖和能量代谢、脂质代谢以及应激反应的相关蛋白表达量。因此,本研究围绕高脂饲粮对具有不同生物学功能蛋白表达量的调控,从分子水平上检测其对生长育肥猪骨骼肌脂质代谢、葡萄糖和能量代谢的影响。
表3高脂饲粮对生长育肥猪肉品质的影响
Table 3Effect of high-fat diet on meat quality traits of growing-finishing pigs
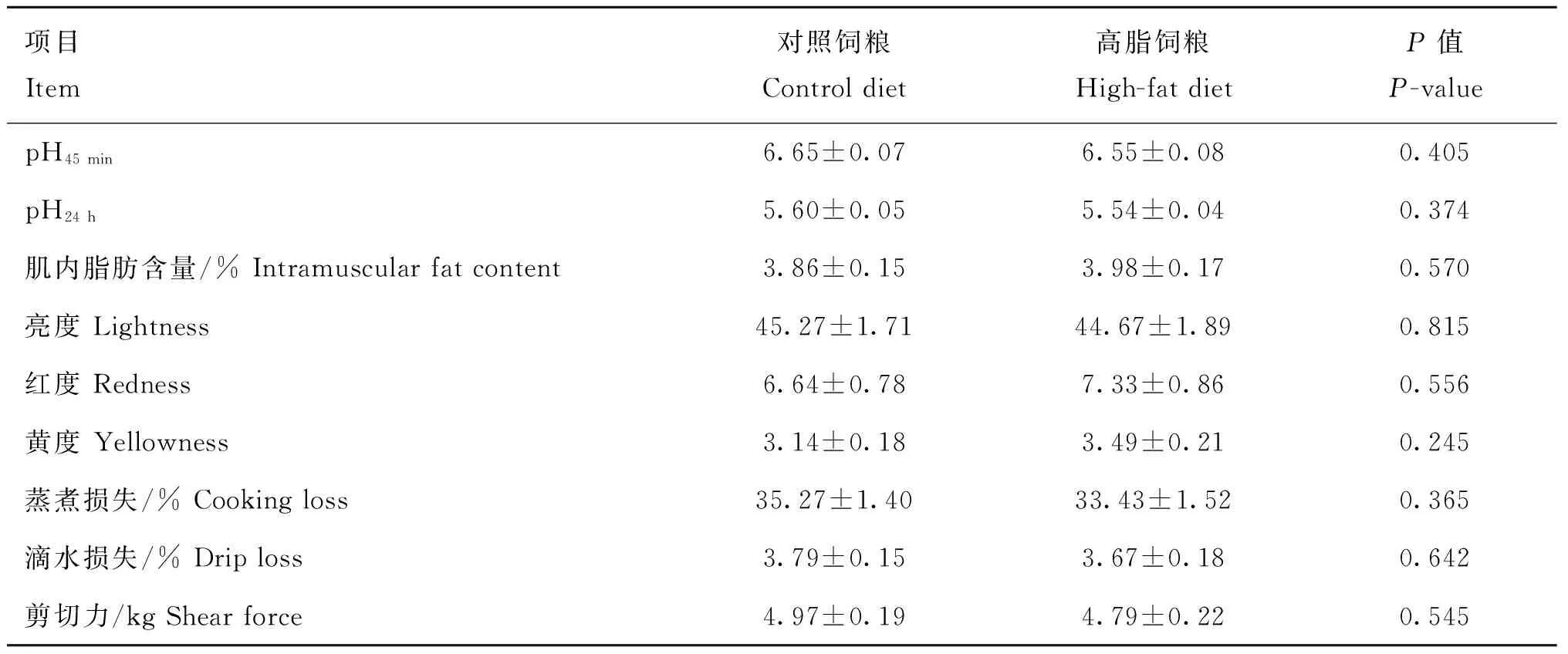
项目Item对照饲粮Controldiet高脂饲粮High-fatdietP值P-valuepH45min6.65±0.076.55±0.080.405pH24h5.60±0.055.54±0.040.374肌内脂肪含量/%Intramuscularfatcontent3.86±0.153.98±0.170.570亮度Lightness45.27±1.7144.67±1.890.815红度Redness6.64±0.787.33±0.860.556黄度Yellowness3.14±0.183.49±0.210.245蒸煮损失/%Cookingloss35.27±1.4033.43±1.520.365滴水损失/%Driploss3.79±0.153.67±0.180.642剪切力/kgShearforce4.97±0.194.79±0.220.545
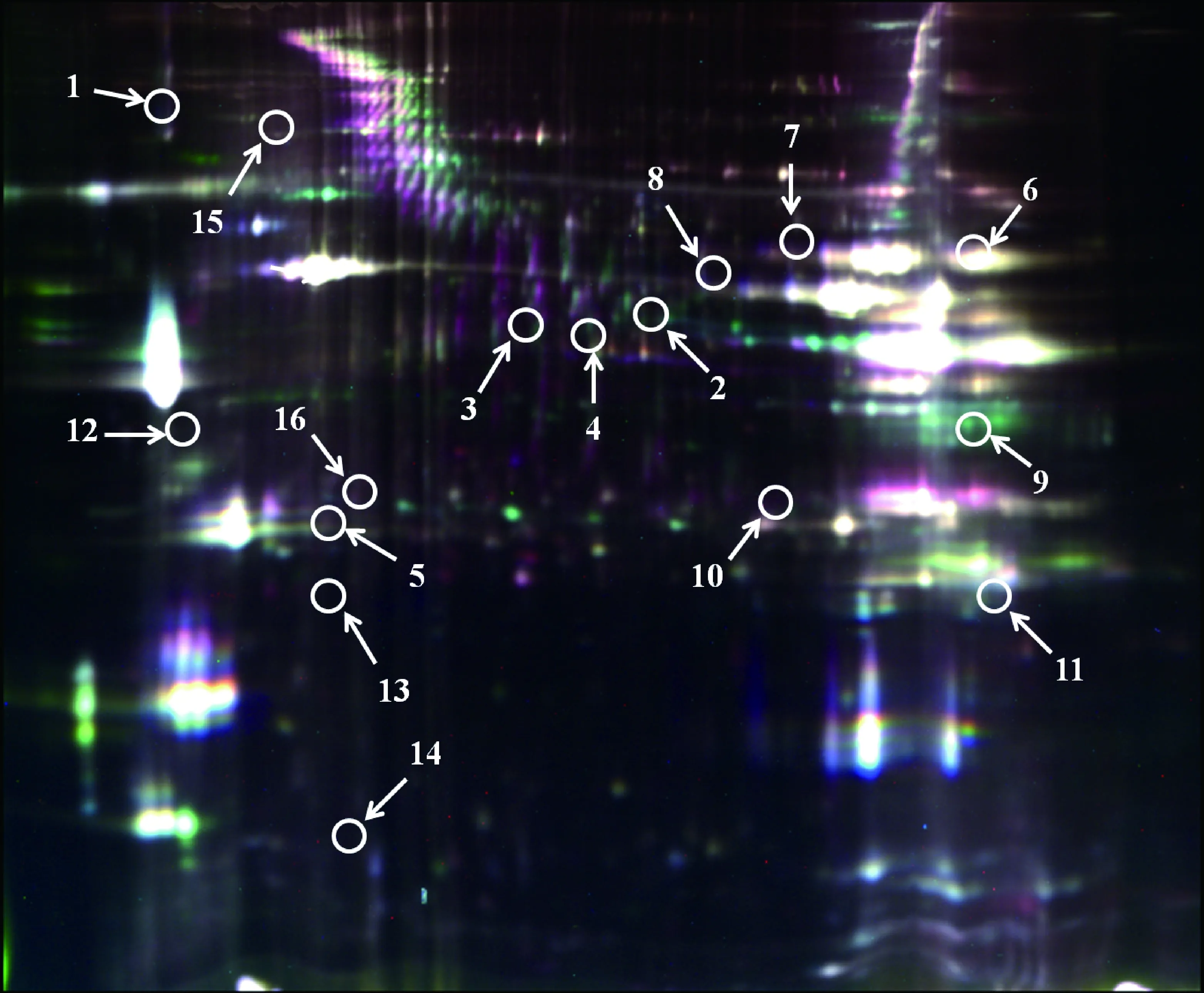
图1 生长育肥猪骨骼肌荧光差异双向电泳图谱Fig.1 Two-dimensional different in-gel electrophoresis image of the skeletal muscle proteome map of growing-finishing pigs
表4高脂饲粮对生长育肥猪骨骼肌蛋白质组的影响
Table 4Effect of high-fat diet on skeletal muscle proteome of growing-finishing pigs
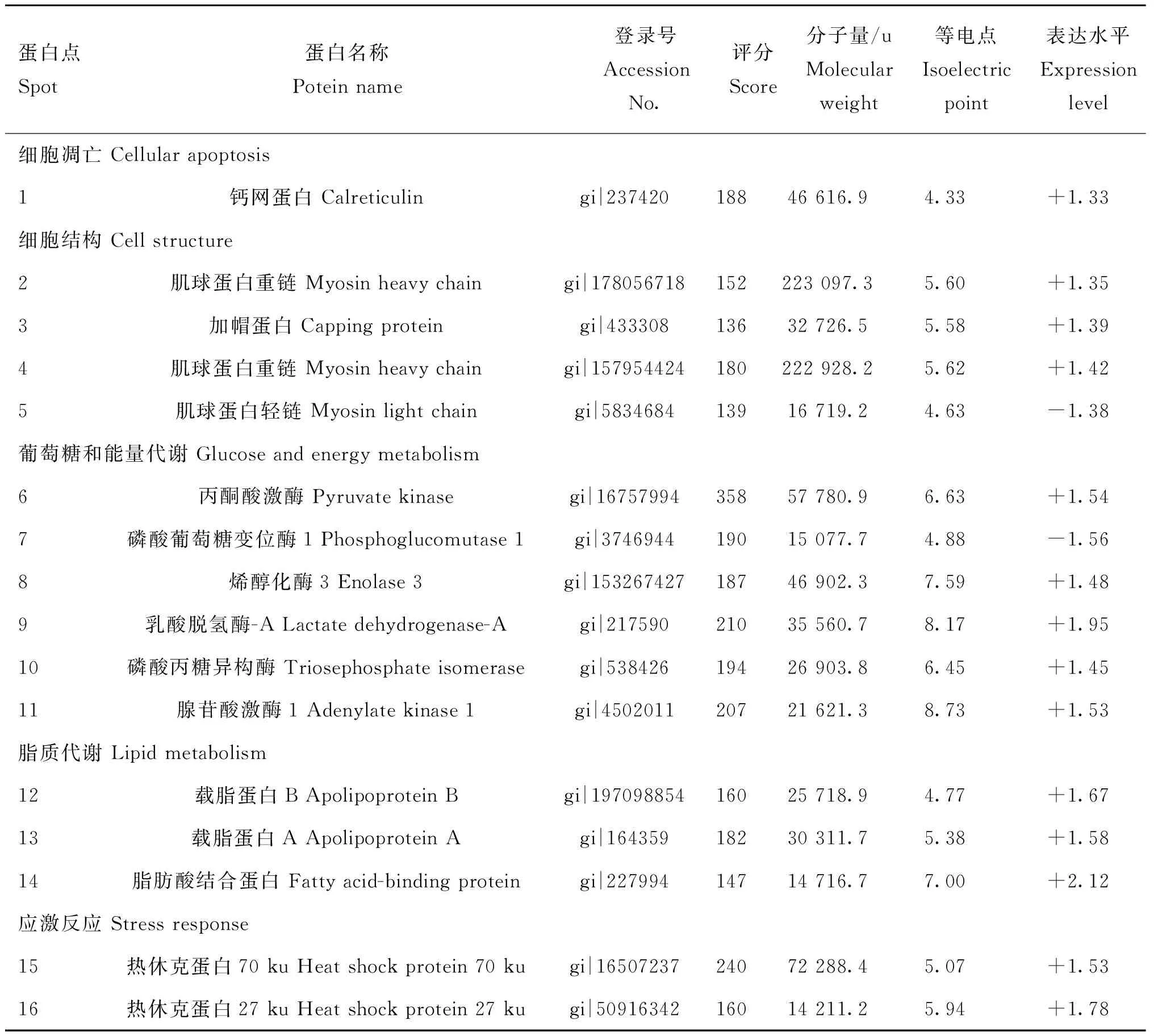
蛋白点Spot蛋白名称Poteinname登录号AccessionNo.评分Score分子量/uMolecularweight等电点Isoelectricpoint表达水平Expressionlevel细胞凋亡Cellularapoptosis1钙网蛋白Calreticulingi|23742018846616.94.33+1.33细胞结构Cellstructure2肌球蛋白重链Myosinheavychaingi|178056718152223097.35.60+1.353加帽蛋白Cappingproteingi|43330813632726.55.58+1.394肌球蛋白重链Myosinheavychaingi|157954424180222928.25.62+1.425肌球蛋白轻链Myosinlightchaingi|583468413916719.24.63-1.38葡萄糖和能量代谢Glucoseandenergymetabolism6丙酮酸激酶Pyruvatekinasegi|1675799435857780.96.63+1.547磷酸葡萄糖变位酶1Phosphoglucomutase1gi|374694419015077.74.88-1.568烯醇化酶3Enolase3gi|15326742718746902.37.59+1.489乳酸脱氢酶-ALactatedehydrogenase-Agi|21759021035560.78.17+1.9510磷酸丙糖异构酶Triosephosphateisomerasegi|53842619426903.86.45+1.4511腺苷酸激酶1Adenylatekinase1gi|450201120721621.38.73+1.53脂质代谢Lipidmetabolism12载脂蛋白BApolipoproteinBgi|19709885416025718.94.77+1.6713载脂蛋白AApolipoproteinAgi|16435918230311.75.38+1.5814脂肪酸结合蛋白Fattyacid-bindingproteingi|22799414714716.77.00+2.12应激反应Stressresponse15热休克蛋白70kuHeatshockprotein70kugi|1650723724072288.45.07+1.5316热休克蛋白27kuHeatshockprotein27kugi|5091634216014211.25.94+1.78
骨骼肌蛋白质总量的80%由肌球蛋白、肌动蛋白、肌联蛋白和伴肌动蛋白组成,其中肌球蛋白占肌纤维蛋白的45%。肌球蛋白重链和肌球蛋白轻链作为肌球蛋白的主要组成部分,对肌纤维结构和肉的嫩度具有显著影响。R.Lametsch等[12]研究表明,肌肉剪切力与动物屠宰后肌球蛋白降解片段肌球蛋白重链显著负相关,与肌球蛋白轻链的降解显著正相关。在本试验条件下,高脂饲粮在不影响育肥猪骨骼肌剪切力的情况下,分别上调和下调了肌球蛋白重链和肌球蛋白轻链的表达量,这与R.Lametsch等[12]的研究结果相比存在一定的差异,导致上述差异的原因可能在于不同试验的剪切力测定时间有所不同,从而影响了肌肉的嫩化。加帽蛋白表达量与肌肉剪切力之间的相关性在前期研究中已有所报道[13],虽然在本试验中高脂饲粮上调了加帽蛋白的表达量,但肌肉剪切力未受饲粮脂肪含量的影响,表明上述蛋白质的表达量对肌肉嫩度影响较小。钙网蛋白作为分子伴侣参与蛋白的折叠和转运,从而影响肌肉收缩等生物学功能[14],饲粮脂肪含量对其表达量的影响表明骨骼肌收缩等基本功能可能受高脂饲粮的影响。
脂肪酸结合蛋白作为脂肪酸的转运载体,其表达量与肌内脂肪细胞数量和脂肪含量显著正相关,肌内脂肪含量较高品种猪的脂肪酸结合蛋白表达量显著高于肌内脂肪含量较低的猪种[15-16]。运载脂质和稳定脂蛋白结构是载脂蛋白的主要生物学功能,肝是其主要合成部位。载脂蛋白作为高密度脂蛋白的重要组成部分,负责将脂类物质转运至靶器官[17]。与前期D.H.Kim等[18]的研究一致,本试验结果表明,高脂饲粮显著上调骨骼肌中与脂质代谢相关的脂肪酸结合蛋白和载脂蛋白表达量,但背膘沉积和肌内脂肪含量不受饲粮脂肪含量的影响。对照组饲粮能量水平可能已满足生长育肥猪最大肌内脂肪沉积的能量需要量,从而导致肌内脂肪含量不受高脂饲粮的影响,这与陈德志等[3]和蔡传江等[4]的研究结果基本一致。
流行病学研究已经证实,高脂饲粮诱导的能量代谢异常是导致发胖的主要原因。丙酮酸激酶作为糖酵解过程的三大限速酶之一,催化葡萄糖分解产生乙酰辅酶A用于氧化供能[19]。腺苷酸激酶催化ATP使AMP磷酸化形成两分子的ADP[20];烯醇化酶作为糖酵解的关键酶之一,催化2-磷酸甘油酸形成磷酸烯醇式丙酮酸[21];磷酸丙糖异构酶催化磷酸二羟丙酮转化为3-磷酸甘油醛从而进入糖酵解途径[22]。采食高脂饲粮显著上调上述4种蛋白质的表达量,表明动物机体需要提高能量消耗从而适应摄入的过多能量,这与D.H.Kim等[18]的研究结果一致。此外,参与能量代谢的磷酸葡萄糖变位酶在采食高脂饲粮的生长育肥猪骨骼肌中表达量却显著下降,与D.H.Kim等[18]的研究结果存在一定差异。乳酸脱氢酶活力是调控动物屠宰后乳酸生成的主要因素,乳酸脱氢酶活力较高意味着较高的乳酸生成率以及宰后pH下降加快[23]。虽然本试验条件下不同处理组之间骨骼肌的pH45 min和pH24 h无显著差异,但高脂饲粮对乳酸脱氢酶表达量的调控表明饲粮脂肪含量可能对动物屠宰后肌肉的pH变化有所影响。
热休克蛋白(HSP)具有维持细胞稳恒、损伤修复、稳定未折叠蛋白、避免蛋白聚集以及重塑变性蛋白等功能[24]。作为分子伴侣,HSP的表达量在应激条件下显著上调。在本试验中,高脂饲粮显著上调了育肥猪骨骼肌中HSP 27 ku和HSP 70 ku的蛋白表达量,表明饲粮脂肪摄入过多对动物造成一定程度的氧化应激,从而需要较高的HSP表达量以维持机体能量代谢和氧化还原反应的平衡,这与D.C.Henstridge等[25]的研究结果一致。
4 结 论
4.1饲喂高脂饲粮可改善生长育肥猪生长性能,但对肉品质无显著影响。
4.2饲喂高脂饲粮显著改变生长育肥猪骨骼肌中与脂质代谢、葡萄糖和能量代谢以及应激反应等生物学功能相关蛋白质的表达量。
[1]严鸿林,余冰,郑萍,等.不同初生重、饲粮能量水平和屠宰日龄对猪生产性能、胴体性状及肉品质的影响[J].中国畜牧杂志,2013,49(17):33-38.
YAN H L,YU B,ZHENG P,et al.Effect of birth weight,dietary DE level and slaughter age on growth performance,carcass traits and meat quality of pigs[J].ChineseJournalofAnimalScience,2013,49(17):33-38.(in Chinese)
[2]黄大鹏,郑本艳,李祥辉,等.营养水平对育肥后期三江白猪肌肉品质的影响[J].动物营养学报,2009,21(4):428-433.
HUANG D P,ZHENG B Y,LI X H,et al.Effects of nutrient levels on meat quality of Sanjiang white pigs in the latter finishing period[J].ChineseJournalofAnimalNutrition,2009,21(4):428-433.(in Chinese)
[3]陈德志,余冰,陈代文,等.日粮能量蛋白质水平对荣昌烤乳猪品系生长性能和肉质性状的影响[J].动物营养学报,2009,21(5):634-639.
CHEN D Z,YU B,CHEN D W,et al.Effects of dietary energy and protein levels on growth performance and meat quality trait in China Rongchang strain’s roast sucking pigs[J].ChineseJournalofAnimalNutrition,2009,21(5):634-639.(in Chinese)
[4]蔡传江,车向荣,赵克斌,等.亚麻油对育肥猪肉品质及脂肪组织脂肪酸组成的影响[J].畜牧兽医学报,2009,40(12):1755-1760.
CAI C J,CHE X R,ZHAO K B,et al.Effects of linseed oil on meat quality and fatty acid composition of adipose tissue in finishing pigs[J].ActaVeterinariaetZootechnicaSinica,2009,40(12):1755-1760.(in Chinese)
[5]JIANG Z Y,ZHONG W J,ZHENG C T,et al.Conjugated linoleic acid differentially regulates fat deposition in backfat and longissimus muscle of finishing pigs[J].JAnimSci,2010,88(5):1694-1705.
[6]THIEL-COOPER R L,PARRISH F C JR,SPARKS J C,et al.Conjugated linoleic acid changes swine performance and carcass composition[J].JAnimSci,2001,79(7):1821-1828.
[7]TISCHENDORF B F,SCHONE F,KIRCHHEIM,et al.Influence of a conjugated linoleic acid mixture on growth,organ weights,carcass traits and meat quality in growing pigs[J].JAnimPhysiolAnimNutr,2002,86(3):117-128.
[8]马原菲,吕梦园,钊守梅,等.蛋白质组学在动物科学研究中的应用与分析[J].动物营养学报,2014,26(11):3229-3235.
MA Y F,LV M Y,ZHAO S M,et al.Application of proteomics in animal science researches and its analysis[J].ChineseJournalofAnimalNutrition,2014,26(11):3229-3235.(in Chinese)
[9]LIU J,YAO Y,YU B,et al.Effect of maternal folic acid supplementation on hepatic proteome in newborn piglets[J].Nutrition,2013,29(1):230-234.
[10]臧长江,王加启,杨永新,等.热处理牛乳中乳蛋白变化的比较蛋白质组学的研究[J].畜牧兽医学报,2012,43(11):1754-1759.
ZANG C J,WANG J Q,YANG Y X,et al.Comparative proteomics analysis of changes of the milk protein during thermal treatment[J].ActaVeterinariaetZootechnicaSinica,2012,43(11):1754-1759.(in Chinese)
[11]LIU J,CHEN D,YAO Y,et al.Intrauterine growth retardation increases the susceptibility of pigs to high-fat diet-induced mitochondrial dysfunction in skeletal muscle[J].PLoSOne,2012,7(4):e34835.
[12]LAMETSCH R,KARLSSON A,ROSENVOLD K,et al.Postmortem proteome changes of porcine muscle related to tenderness[J].JAgricFoodChem,2003,51(24):6992-6997.
[13]HWANG I H,PARK B Y,KIM J H,et al.Assessment of postmortem proteolysis by gel-based proteome analysis and its relationship to meat quality traits in pig longissimus[J].MeatSci,2005,69(1):79-91.
[14]COPPOLINO M G,WOODSIDE M J,DEMAUREX N,et al.Calreticulin is essential for integrin-mediated calcium signalling and cell adhesion[J].Nature,1997,386(6627):843-847.
[15]DAMON M,LOUVEAU I,LEFAUCHEUR L,et al.Number of intramuscular adipocytes and fatty acid binding protein-4 content are significant indicators of intramuscular fat level in crossbred Large White × Duroc pigs[J].JAnimSci,2006,84(5):1083-1092.
[16]LAVILLE E,SAYD T,TERLOUW C,et al.Comparison of sarcoplasmic proteomes between two groups of pig muscles selected for shear force of cooked meat[J].JAgricFoodChem,2007,55(14):5834-5841.
[17]MEZDOUR H,LARIGAUDERIE G,CASTRO G,et al.Characterization of a new mouse model for human apolipoprotein A-I/C-III/A-IV deficiency[J].JLipidRes,2006,47(5):912-920.
[18]KIM D H,JOO J I,CHOI J W,et al.Differential expression of skeletal muscle proteins in high-fat diet-fed rats in response to capsaicin feeding[J].Proteomics,2010,10(15):2870-2881.
[19]REYNARD A M,HASS L F,JACOBSEN D D,et al.The correlation of reaction kinetics and substrate binding with the mechanism of pyruvate kinase[J].JBiolChem,1961,236(3):2277-2283.
[20]WALKER J E,SARASTE M,RUNSWICK M L,et al.Distantly related sequences in the alpha-and beta-subunits of ATP synthase,myosin,kinase and other ATP-requiring enzymes and a common nucleotide binding fold[J].EMBOJ,1982,1(8):945-951.
[21]COOPER J A,ESCH F S,TAYLOR S S,et al.Phosphorylation sites in enolase and lactate dehydrogenase utilized by tyrosine protein kinasesinvivoandinvitro[J].JBiolChem,1984,259(12):7835-7841.
[22]RIEDER S V,ROSE I A.The mechanism of the triosephosphate isomerase reaction[J].JBiolChem,1959,234(5):1007-1010.
[23]NISSEN P M,OKSBJERG N.Birth weight and postnatal dietary protein level affect performance,muscle metabolism and meat quality in pigs[J].Animal,2011,5(9):1382-1389.
[24]LANNEAU D,BRUNET M,FRISAN E,et al.Heat shock proteins:essential proteins for apoptosis regulation[J].JCellMolMed,2008,12(3):743-761.
[25]HENSTRIDGE D C,BRUCE C R,DREW B G,et al.Activating HSP72 in rodent skeletal muscle increases mitochondrial number and oxidative capacity and decreases insulin resistance[J].Diabetes,2014,63(6):1881-1894.
(编辑郭云雁)
Effects of High-fat Diet on Meat Quality Traits and Skeletal Muscle Proteome of Growing-finishing Pigs
XIONG Huo1,CAI Xin1,LIU Jing-bo1,2*,CHEN Liang2,ZHANG Hong-fu2
(1.SchoolofLifeScienceandEngineering,SouthwestUniversityofScienceandTechnology,Mianyang621010,China;2.InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
The present study was conducted to investigate the effect of high-fat (HF) diet on meat quality traits and skeletal muscle proteome of growing-finishing pigs.Twenty growing-finishing pigs with an average initial BW of (73.28±0.57) kg were randomly allocated to control group (control diet,supplemented with 10.0% cornstarch) and treatment group (high-fat diet,supplemented with 10.0% lard) to study the effect of dietary fat content on growth performance,meat quality traits and skeletal muscle proteome of growing-finishing pigs.There were 10 replicates in each treatment group with 1 pig per replicate.The experiment lasted 42 d.The results showed that pigs fed the HF diet had a greater average daily gain (P<0.05),but a lower ratio of feed to gain than pigs fed the control diet (P<0.01).The pH45 min,pH24 h,intramuscular fat content,lightness,redness,yellowness,cooking loss,drip loss and shear force in skeletal muscle of pigs were not affected by dietary fat content (P>0.05).Proteomic analysis revealed that pigs fed the HF diet had greater expression levels of calreticulin,myosin heavy chain,capping protein,pyruvate kinase,enolase,L-lactate dehydrogenase,triosephosphate isomerase,adenylate kinase,apolipoprotein A and B,fatty acid binding protein and heat shock protein 27 and 70 ku,but lower expression levels of myosin light chain and phosphoglucomutase than pigs fed the control diet.In conclusion,the HF feeding could improve the growth performance,and upregulate the expression levels of proteins related to lipid metabolism,glucose and energy metabolism in skeletal muscle of growing-finishing pigs.
high-fat diet;meat quality;proteome;pigs
10.11843/j.issn.0366-6964.2016.10.014
2015-10-08
动物营养学国家重点实验室开放课题(2004DA125184F1424);国家科技支撑计划项目(2012BDA39B01);中国农业科学院科技创新工程(ASTIP-IAS07)
熊火(1970-),男,四川绵阳人,讲师,主要从事单胃动物生理和营养研究,E-mail:xiongjiumu@163.com
刘静波,讲师,博士,主要从事抗病营养和单胃动物磷营养研究,E-mail:liuswust@163.com
S828;S816.71
A
0366-6964(2016)10-2052-08
