高强度超声处理对不同盐浓度下鲢鱼肌球蛋白理化特性的影响
2022-05-13谢亚如杜红英熊善柏
高 霞,谢亚如,胡 杨,尤 娟,杜红英,熊善柏,刘 茹
(华中农业大学食品科学技术学院,长江经济带大宗水生生物产业绿色发展教育部工程研究中心,国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
肌球蛋白是参与鱼糜热胶凝过程的骨架蛋白,其加热前良好的分散性是形成凝胶三维网络结构的基础[1]。肌球蛋白是一种盐溶性蛋白,通常在较高的盐浓度(c(NaCl)>0.3 mol/L)中才能充分溶解,低盐或过高盐浓度都不利于肌球蛋白分散[2-3]。近年来,为倡导健康饮食,降低由于过多摄入盐引发高血压和心血管疾病的几率,生产低盐鱼糜制品成为一种不可避免的趋势[4]。在降低盐含量的同时,保证肌球蛋白良好的溶解性对鱼糜制品的品质提升至关重要。有学者研究了L-组氨酸对低盐环境中肌球蛋白溶解性的影响,发现L-组氨酸的添加可提高蛋白质的亲水性,促进肌原纤维蛋白溶胀,从而利于肌球蛋白溶出[5-6]。此外,一些新兴技术如微波[7]、超高压[8-9]、超声波[10]等方法因能够促进蛋白质分子解聚集,提高其溶解性而被广泛研究。超声波作为一种绿色能源,具有操作简单、安全无毒等优点[11-14],特别是高强度超声波能够显著改善大豆蛋白[15]、乳清蛋白[16-17]等水溶性蛋白质的溶解性。高强度超声处理会产生空穴效应,并伴随剪切力、微射流等机械作用,以及诱发高活性自由基的化学作用,从而改变蛋白质的理化性质[18]。研究发现高强度超声处理提高了鸡肉肌原纤维蛋白(盐浓度为0.6 mol/L)的溶解性[19],且促进了肌球蛋白(盐浓度为0.5 mol/L)中疏水基团、巯基等功能性基团的暴露与氧化[20]。然而高强度超声处理对不同盐浓度环境中肌球蛋白溶解性及理化性质的影响鲜见报道。
本实验以鲢鱼为原料提取肌球蛋白,将其溶解于不同盐(NaCl,下同)浓度的缓冲液中,通过研究高强度超声处理后肌球蛋白溶解度和粒径的变化,探讨高强度超声处理对不同盐浓度下肌球蛋白聚集体的影响。进一步分析低(0.1 mol/L)、中(0.5 mol/L)、高(1.0 mol/L)盐浓度环境中肌球蛋白的流变学行为和活性巯基含量变化,并采用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察肌球蛋白的微观形貌,以期阐明高强度超声对不同盐环境下肌球蛋白理化性质的影响机制。
1 材料与方法
1.1 材料与试剂
鲢鱼(Hypophthalmichthys molitrix)质量约为1.5 kg/尾,购自华中农业大学菜市场。
5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithioobis-(2-nitrobenzoic acid),DTNB) 生工生物工程(上海)股份有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 阿拉丁试剂(上海)有限公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
JY92-IIN超声波细胞破碎仪 宁波新芝生物科技股份有限公司;ZEN 3600激光粒度仪 英国马尔文仪器有限公司;AR2000ex型动态流变仪 美国TA公司;F-4600型荧光光度计 日本日立公司。
1.3 方法
1.3.1 肌球蛋白的提取
参考高霞等[2]的方法提取肌球蛋白。肌球蛋白质量浓度测定采用Lowry法[21],用牛血清白蛋白作标准曲线。
1.3.2 样品制备与处理
用20 mmol/L Tris-HCl缓冲液(pH 7.5,含不同浓度NaCl)将肌球蛋白的盐浓度分别调整至0.1、0.2、0.3、0.5、1.0、2.0 mol/L。分别取25 mL肌球蛋白溶液于50 mL离心管中,用直径为0.6 cm的杆状探头没入溶液1 cm处理肌球蛋白样品。为避免蛋白质受热变性,始终将离心管置于冰水浴中。本实验中超声处理条件设置为频率20 kHz、功率150 W、时间9 min(为避免探头损坏,每超声处理2 s,间歇2 s,总超声处理时间包含间歇时间)。采用量热法[22]记录超声处理过程中的温度变化,通过公式(1)[13]计算超声强度。

式中:P表示超声强度/(W/cm2);m表示被超声溶液质量/kg;cp表示被超声溶液的比热容/(J/(kg·K));dT/dt表示温度随时间变化率/(K/s);S表示超声发射面的表面积/cm2。
经计算,本实验设置的超声处理条件对应的超声强度为32.47 W/cm2。超声处理结束后,测定相应的理化指标,暂时不用的肌球蛋白置于4 ℃冰箱存放。
1.3.3 溶解度测定
溶解度的测定参考Riebroy等[23]的方法,取5 mL肌球蛋白溶液于50 mL离心管中,然后4 ℃下8 000 r/min离心10 min,上清液中的蛋白质量浓度采用Lowry法[21]测定。溶解度以离心后上清液的蛋白质量浓度占离心前蛋白质量浓度的百分比表示。
1.3.4 粒径分布与平均粒径测定
用20 mmol/L Tris-HCl缓冲液(pH 7.5,NaCl浓度分别为0.1、0.2、0.3、0.5、1.0 mol/L和2.0 mol/L)将肌球蛋白质量浓度调整至1 mg/mL。参考Wei Li等[24]的方法并稍作修改,采用激光粒度仪测定肌球蛋白聚集体的平均粒径及粒径分布。
1.3.5 静态流变学性能测定
参考谢亚如等[13]的方法测定肌球蛋白静态流变学性能,肌球蛋白质量浓度为10 mg/mL,采用AR2000ex型动态流变仪在Steady state flow step模式下扫描,测试条件为温度4 ℃、椎板倾斜角2°、直径40 mm、载物台与椎板间距54 μm。
1.3.6 活性巯基与总巯基含量测定
用20 mmol/L Tris-HCl缓冲液(pH 7.5,NaCl浓度分别为0.1、0.5 mol/L和1.0 mol/L)将肌球蛋白质量浓度调整至1 mg/mL。活性巯基与总巯基含量的测定参考Ellman[25]的方法。测定活性巯基含量时,向5.5 mL的蛋白溶液中加入100 μL Ellman试剂(含质量分数0.1%DTNB、0.2 mol/L Tris-HCl,pH 6.8)混合均匀,于4 ℃下放置1 h后测定其在412 nm波长处的吸光度。测定总巯基含量时,向0.5 mL的蛋白溶液中加入5.0 mL 0.2 mol/L Tris-HCl缓冲液(含8.0 mol/L尿素、10 mmol/L乙二胺四乙酸、质量分数2%十二烷基硫酸钠,pH 8.0)混合均匀,再加100 μL Ellman试剂,于40 ℃水浴中保温25 min,同样测其在412 nm波长处的吸光度。巯基含量按式(2)计算。

式中:C0表示巯基含量/(10-4mol/g pro);A表示412 nm波长处的吸光度;D表示稀释倍数;ρ表示蛋白质量浓度/(mg/mL);ε表示摩尔消光系数/(13 600 L/(mol·cm));L表示比色皿光程/cm。
1.3.7 表面疏水性测定
参考Benjakul等[26]的方法测定肌球蛋白的表面疏水性。用20 mmol/L Tris-HCl缓冲液(pH 7.5,NaCl浓度分别为0.1、0.5 mol/L和1.0 mol/L)将肌球蛋白质量浓度分别调整至0.001、0.005、0.01、0.04 mg/mL和0.06 mg/mL,加入20 μL含有8 mmol/L ANS的磷酸盐缓冲液(0.1 mol/L、pH 7.0)。反应结束后,采用荧光光度计在激发波长364 nm和发射波长534 nm处测定荧光强度,表面疏水性(S0-ANS)以荧光强度-蛋白质量浓度曲线的斜率表示。
1.3.8 微观形貌观察
参考高霞等[2]的方法并稍作修改,采用CLSM观察肌球蛋白的微观形貌。将不同盐浓度下的肌球蛋白样品置于暗环境中染色15 min,结束后用蒸馏水冲洗剩余染料。使用10×目镜和60×物镜观测,选用荧光模式。
1.4 数据处理与分析
所有实验设置3次重复,每次至少3个平行,结果表示为平均值±标准差。采用Origin 8.0软件作图,通过SAS 8.0统计分析软件中方差分析法进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 高强度超声作用下不同盐浓度环境中肌球蛋白溶解度的变化
由图1可知,对照组肌球蛋白的溶解度随盐浓度的增大呈先上升后下降的趋势。肌球蛋白是一种盐溶性蛋白,低盐浓度(0.1~0.3 mol/L)下主要以粗丝的形式存在[1],溶解度较低。随着盐浓度增大(0.5~1.0 mol/L),电荷屏蔽效应使肌球蛋白溶解度增大。然而,盐浓度过高时(2.0 mol/L),分散均匀的蛋白质间静电斥力减小,易聚集发生盐析效应[2],从而使得溶解度降低。本研究中,盐浓度为1.0 mol/L时肌球蛋白的溶解性能最好,溶解度接近100%。
高强度超声处理显著提高了肌球蛋白的溶解度(盐浓度1.0 mol/L的除外),其中0.1 mol/L盐浓度下肌球蛋白的溶解度被提高到对照组的10 倍左右,接近于0.2 mol/L盐浓度时的对照组溶解度。高强度超声作用过程中会引发空穴效应,并伴随剧烈的剪切力、湍流等现象,推测这些机械作用能够打散蛋白质聚集体,使肌球蛋白溶出量增多,溶解度升高。盐浓度为1.0 mol/L时,超声组与对照组的肌球蛋白溶解度均接近100%,无显著差异(P>0.05),这说明肌球蛋白在此盐浓度下溶解效果较好,高强度超声处理对其溶解度无显著影响。
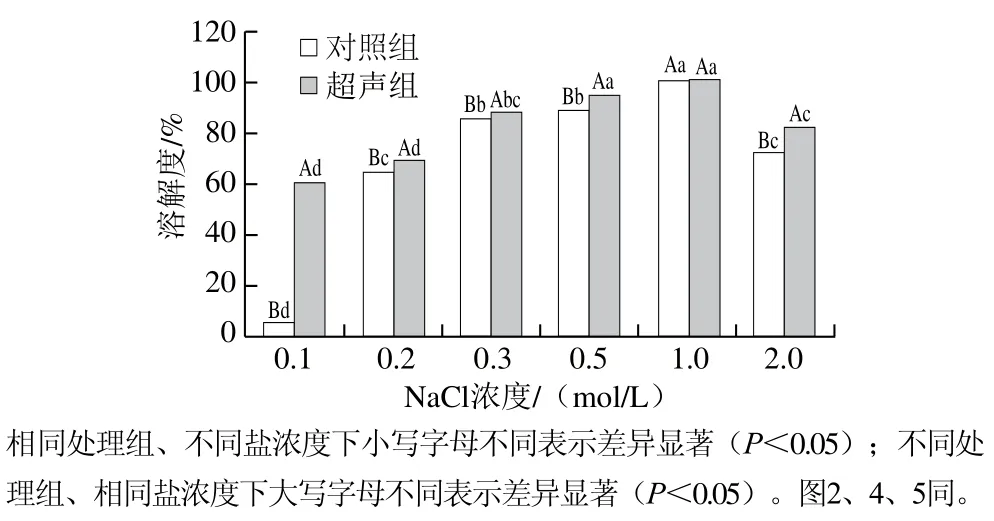
图1 高强度超声作用下不同盐浓度下肌球蛋白溶解度的变化Fig. 1 Effect of HIU on the solubility of myosin with different salt concentrations
2.2 高强度超声作用下不同盐浓度环境中肌球蛋白的粒径分布情况
为阐明高强度超声作用下肌球蛋白溶解度变化的原因,进一步研究了高强度超声对不同盐浓度下肌球蛋白聚集体尺寸与分布的影响。由图2A1可知,盐浓度为0.1 mol/L时,肌球蛋白聚集体在2 600~5 000 nm范围出现单一粒径分布峰,随着盐浓度的升高(0.2~0.5 mol/L),样品出现2~3个粒径分布峰,同时主峰位置向小粒径方向偏移,粒径逐渐分布在100~1 000 nm范围内。然而,继续增大盐浓度至1.0 mol/L以上时,粒径分布重新向大粒径方向移动,并且在5 000 nm附近观察到小峰的出现。有研究认为,提纯的肌球蛋白在最佳溶解环境中(0.5 mol/L)仍然以8~20个肌球蛋白单体组装的形式存在[27]。当盐浓度偏离0.5 mol/L时,肌球蛋白粒径较大,推测这是肌球蛋白中含有的单体数量增加所致,说明形成了更大的聚集体。由图2A2可知,高强度超声作用下低盐浓度(0.1~0.2 mol/L)环境中肌球蛋白的粒径分布峰由对照组的3 600、1 100 nm分别偏移至2 000、700 nm处,当盐浓度高于0.3 mol/L时,粒径分布在10~1 000 nm范围,且主峰的散射光强度较对照组有所提高。该结果说明高强度超声处理提高了肌球蛋白粒径分布的均匀性。Tang Ling等[10]曾报道了类似的现象,13.37 W/cm2超声处理后罗非鱼肌原纤维蛋白的粒径分布更为均一。由图2B可以看出,与对照组相比,高强度超声处理显著降低了肌球蛋白的平均粒径(P<0.05),尤其0.1 mol/L条件下样品降低程度最大,说明低盐环境中肌球蛋白聚集体的尺寸显著减小。聚集体尺寸减小有利于增大蛋白质与溶剂相接触的表面积,从而提高了溶解度(图1)。

图2 高强度超声处理对不同盐浓度下肌球蛋白粒径分布(A)与平均粒径(B)的影响Fig. 2 Effect of HIU on the particle size distribution (A) and average particle size (B) of myosin with different salt concentrations
2.3 高强度超声作用下不同盐浓度环境中肌球蛋白的静态流变学特性
为探究高强度超声对肌球蛋白理化特性影响的盐浓度依赖性,选取低(0.1 mol/L)、中(0.5 mol/L)、高(1.0 mol/L)盐浓度处理为代表,研究高强度超声处理前后肌球蛋白样品的静态流变学性能。在低剪切速率下,剪切应力随剪切速率的升高几乎呈直线上升的趋势(图3),表现出牛顿流体的性质,此阶段流体的黏性不受剪切速率的影响,表示为零剪切黏度(η0)[28]。采用Cross模型拟合所得η0见表1。未超声处理时,低盐浓度(0.1 mol/L)下肌球蛋白样品的η0最大,根据Wang Guan等[1]的报道,推测低盐环境中肌球蛋白分子间相互作用(氢键、离子键)较强,从而降低了其流动性。盐浓度增大至0.5、1.0 mol/L,对照组η0从20.33 Pa·s分别降至0.14、0.13 Pa·s,这是电荷屏蔽效应降低了分子间相互作用所致。由表1还可看出,高强度超声处理明显降低了肌球蛋白样品的η0,尤其在低盐浓度时降低程度更大,推测高强度超声产生的空穴效应及剪切力等机械作用破坏了肌球蛋白分子间氢键、离子键等非共价键,使其发生解缠绕,进而降低了其黏度。

图3 高强度超声作用下不同盐浓度环境中肌球蛋白静态流变学性能变化Fig. 3 Effect of HIU on the static rheological properties of myosin with different salt concentrations

表1 高强度超声作用下不同盐浓度环境中肌球蛋白的模型拟合参数Table 1 Model fitting parameters of myosin with different salt concentrations treated by HIU
由图3可知,随着剪切速率升高,曲线逐渐偏离直线向下弯曲,表现出剪切稀化现象,采用幂律模型进行拟合,结果见表1。所有样品的n均小于1,表现出假塑性流体行为。对照组中,肌球蛋白样品在中(0.5 mol/L)、高(1.0 mol/L)盐浓度下n较大,相较于低盐浓度,其K降低,说明较高盐浓度(0.5、1.0 mol/L)肌球蛋白样品的稠度下降、流动性增强。高强度超声处理明显降低了低盐浓度肌球蛋白溶液的K,而n高于对照组,说明高强度超声处理后肌球蛋白样品的流动性增强。同时中、高盐浓度肌球蛋白样品的稠度和流动性经高强度超声处理后变化不大。
2.4 高强度超声作用下不同盐浓度环境中肌球蛋白巯基含量的变化
由图4A可知,未超声处理时,随着盐浓度由0.1 mol/L升高至1.0 mol/L,肌球蛋白活性巯基含量显著增大(P<0.05),说明蛋白质构象发生了改变,使部分包埋在内部的巯基暴露在蛋白质表面。盐浓度为0.1、0.5 mol/L时,高强度超声处理显著提高了肌球蛋白的活性巯基含量(P<0.05),表明高强度超声处理促进了蛋白质结构的伸展。然而,高盐浓度(1.0 mol/L)下,肌球蛋白的活性巯基含量经高强度超声处理后显著降低(P<0.05),这可能与二硫键的形成有关。由图4B可知,高强度超声处理显著降低了肌球蛋白的总巯基含量(0.1 mol/L时差异不显著),表明高强度超声处理可促进二硫键的形成。高强度超声过程中水分子降解会产生高活性自由基(H2O→H·+·OH),促进—SH氧化为二硫键[29]。类似地,本课题组前期研究发现150 W超声处理12 min时可显著降低鲢鱼肌球蛋白(盐浓度为0.5 mol/L)的总巯基含量[20]。

图4 高强度超声处理对不同盐浓度下肌球蛋白活性巯基(A)与总巯基(B)含量的影响Fig. 4 Effect of HIU on the reactive (A) and total (B) sulfhydryl contents of myosin with different salt concentrations
2.5 高强度超声作用下不同盐浓度环境中肌球蛋白表面疏水性的变化
表面疏水性可用于反映蛋白质的构象变化情况。由图5可以看出,对照组肌球蛋白在1.0 mol/L盐浓度下表面疏水性最大,肌球蛋白分子的疏水性基团一般位于尾部的双螺旋结构中[30],表面疏水性升高意味着肌球蛋白的螺旋结构伸展,疏水性基团的暴露程度增大。高强度超声处理对低盐浓度环境中肌球蛋白的表面疏水性无显著影响(P>0.05),低盐浓度环境中肌球蛋白聚集体尺寸较大(图2),溶解度较低(图1),进一步证明高强度超声产生的能量主要用于打散蛋白质聚集体,而对蛋白质分子构象影响较小。盐浓度为0.5、1.0 mol/L时,高强度超声处理显著提高了肌球蛋白的表面疏水性(P<0.05),肌球蛋白在盐浓度高于0.5 mol/L时溶解性较好(图1),推测高强度超声诱导蛋白质结构发生较大程度伸展,使内部疏水基团暴露,从而引起表面疏水性提高。本课题组前期研究表明高强度超声可诱导肌球蛋白结构中的α-螺旋向较为松散的β-折叠和无规卷曲结构转变,可促使包埋在内部的活性基团暴露出来[13]。
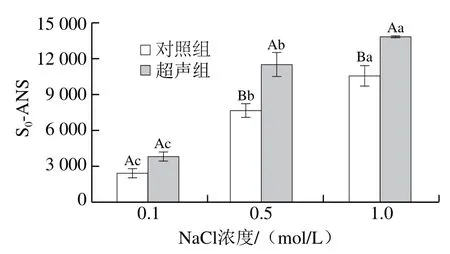
图5 高强度超声处理对不同盐浓度下肌球蛋白表面疏水性的影响Fig. 5 Effect of HIU on the surface hydrophobicity of myosin with different salt concentrations
2.6 高强度超声作用下不同盐浓度环境中肌球蛋白的微观形貌观察
图6是高强度超声处理前后不同盐浓度环境中肌球蛋白的CLSM图,低盐环境(0.1 mol/L)下,肌球蛋白以粗丝形式存在(图6A1),这解释了其粒径较大(图2)、溶解度低(图1)的现象。增大盐浓度时,肌球蛋白粗丝出现溶胀现象(图6B1),盐离子的电荷屏蔽效应增大了蛋白质间的空隙,粗丝结构变得均匀。当盐浓度为1.0 mol/L时,肌球蛋白重新发生聚集(图6C1),形成的聚集体较低盐浓度时变得均匀,这可能与蛋白质之间的相互作用增强有关。该结果与平均粒径的变化呈现一致性(图2)。
相较于中、高盐浓度,高强度超声作用下低盐环境中肌球蛋白的粗丝结构发生明显断裂,分散得更加均匀(图6A2),这与其溶解度升高现象密切相关。类似地,Tang Ling等[10]研究发现高强度超声作用使低盐浓度(0.2 mol/L)下肌原纤维蛋白的粗丝结构尺寸减小。此外,1.0 mol/L盐浓度下高强度超声处理对肌球蛋白的微观形貌无明显影响,这与溶解度无显著变化相印证(图1)。

图6 高强度超声作用下不同盐浓度环境中肌球蛋白的CLSM图像(×600)Fig. 6 CLSM images of myosin with different salt concentrations treated by HIU (× 600)
3 讨 论
结合高强度超声作用下不同盐浓度环境中肌球蛋白理化指标的变化,推测其作用机理如图7所示。低盐浓度环境中,由于氨基酸侧链带电基团的存在,多个肌球蛋白分子通过弱离子键发生聚集[1],通过CLSM可观察到的粗丝结构存在,此时肌球蛋白聚集体的粒径较大,溶解性差。高强度超声作用时,粗丝结构在空穴效应产生的机械力及剪切力等作用下被打散,粒径显著降低,增强了与水的相互作用,有利于肌球蛋白溶解度的升高。本研究中肌球蛋白体系的pH值为7.5,高于其等电点(pI 5.5),体系带有一定量的静负电荷[31]。增加盐浓度时,Cl-与—NH+3结合,正电荷被屏蔽,蛋白质所带负电荷数量进一步增加,静电斥力增强,粗丝中蛋白质间形成较大的空隙,并且暴露出部分活性基团。经过高强度超声后蛋白质分子更易从粗丝中游离出来,提高分散程度,此外,高强度超声产生的能量还可诱导蛋白质构象进一步伸展,使原本包埋在螺旋结构内部的活性基团暴露在蛋白质表面,这有利于肌球蛋白溶解度的升高。
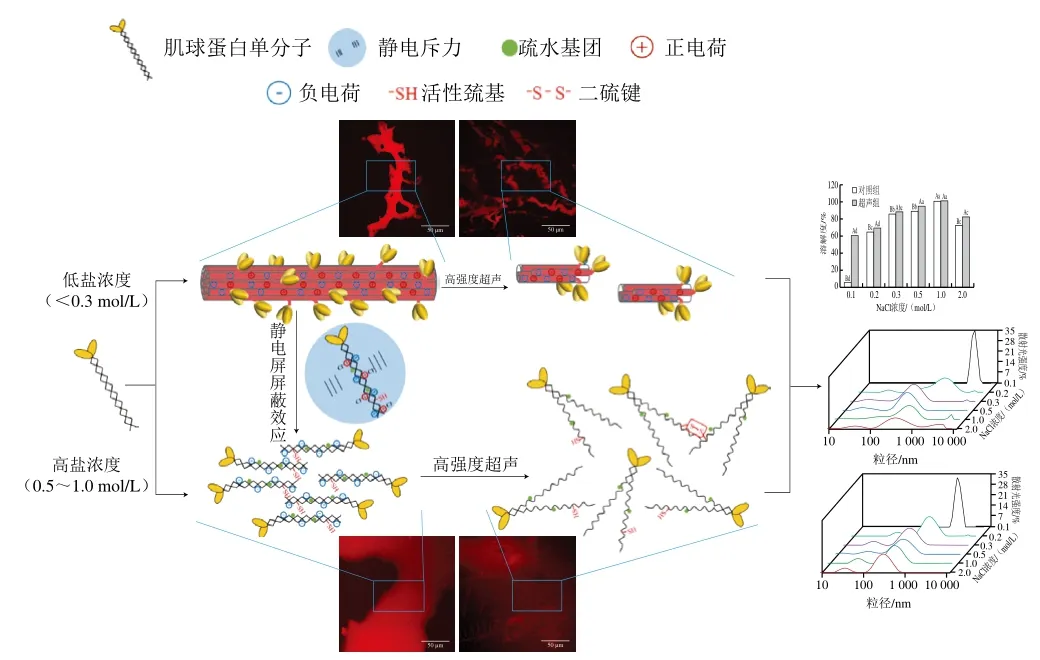
图7 高强度超声对肌球蛋白理化特性影响的作用机理Fig. 7 Proposed mechanism of HIU on the physicochemical properties of myosin
4 结 论
高强度超声诱导的肌球蛋白理化性质变化受盐浓度的影响。低盐浓度(0.1 mol/L)下,高强度超声处理通过打散肌球蛋白的粗丝结构,提高了蛋白质分散程度,使聚集体的平均粒径显著下降,肌球蛋白的溶解度增大。高强度超声处理大幅降低了低盐浓度环境中肌球蛋白样品的η0和K,流动性增强。中、高盐浓度下,肌球蛋白分散均匀,溶解性较好,高强度超声处理诱导其构象发生改变,促进了部分活性基团的暴露,肌球蛋白的溶解性也有一定程度的提高。相比而言,高强度超声处理对中、高盐浓度肌球蛋白的促溶效果弱于低盐浓度的。综上,低盐浓度下超声能量主要用于打散肌球蛋白聚集体,而中、高盐浓度下,超声能量还会进一步诱导蛋白质构象发生改变。
