茚[1,2-b]喹喔啉-11-酮肟醚的合成与细胞毒性
2016-11-07冯卫培王应杏刘思远王书香李胜辉
冯卫培,王应杏,刘思远,王书香,李胜辉
(河北大学 化学与环境科学学院 药物化学与分子诊断教育部重点实验室,河北 保定 071002)
茚[1,2-b]喹喔啉-11-酮肟醚的合成与细胞毒性
冯卫培,王应杏,刘思远,王书香,李胜辉
(河北大学 化学与环境科学学院 药物化学与分子诊断教育部重点实验室,河北 保定071002)
以茚[1,2-b]喹喔啉-11-酮肟、二卤代烷和哌啶或吡咯、吗啉、二丁胺为原料,合成了10种新型茚[1,2-b]喹喔啉-11-酮肟醚(4A-4J),并以HeLa、A549和MCF-7细胞株为模型,采用MTT法评价了其体外细胞毒性. 结果表明:4A、4B、4E、4F和4J对3种细胞株的毒性均高于顺铂;其中,4A、4B和4F的细胞毒性比顺铂高2~6倍.肟醚链长度和末端基团对其细胞毒性有较大的影响. 随肟醚链长度的增大,细胞毒性降低;末端基团为吡咯时细胞毒性较高. 细胞周期、凋亡实验表明4A引起G0/G1和G2/M期阻滞,导致肿瘤细胞凋亡. 说明吡咯修饰的茚[1,2-b]喹喔啉-11-酮肟醚是有潜力的抗肿瘤先导化合物.
茚(1,2-b)喹喔啉-11-酮肟衍生物;肟醚; 细胞毒性
肿瘤已成为威胁人类生命的第一杀手[1],抗肿瘤药物一直是药物研究的热点[2]. 喹喔啉衍生物(如玫瑰树碱[3]、依利醋铵[4]、11-取代茚喹喔啉衍生物[5]等)因其良好的抗肿瘤活性引起了人们的重视[6],但他们的毒性限制了其应用. 肟醚能够改善药物分子的溶解性和生物利用度,已被用于抗肿瘤药物研究. 例如,喜树碱[7]、吲哚[2,1-b]喹喔啉[8]及吲哚[1,2-c]喹喔啉[9]等的肟醚衍生物均表现出良好的抗肿瘤活性. 为发现新型抗肿瘤药物, 设计合成了系列茚[1,2-b]喹喔啉-11-酮肟醚,对其细胞毒性进行评价, 探讨肟醚链的长度和末端基因的结构对其细胞毒性的影响,并采用细胞周期和凋亡实验探讨其毒性机制.
1 实验部分
1.1试剂与仪器
牛血清购于杭州市四季青生物工程材料有限公司,低糖DMEM培养基 Gibco和胰蛋白酶购于美国Amresco公司,琼脂糖购于美国Sigma公司. 其他试剂均为分析纯.
Perkin-Elmer Model-683型红外光谱仪,Bruker AVANCE 600核磁共振波谱仪,apex ultra 7.0T US+型高分辨质谱仪, Moleular Devices VersaMax全波长酶标仪, SANYO MCO-20AIC型CO2恒温培养箱.
1.2化合物的合成与表征
将茚[1,2-b]喹喔啉-11-酮肟(2.47 g,10 mmol)和氢氧化钠(0.40 g,10 mmol)置于装有回流冷凝管的反应瓶中,加入60 mL四氢呋喃,搅拌溶解. 再加入二卤代烷(30 mmol),回流反应12 h. 冷却、浓缩、蒸除溶剂,硅胶柱分离(V(石油醚)∶V(乙酸乙酯)=4∶1为淋洗剂),真空干燥后得黄色固体3a-3c. 将1 mmol的3a-3c、10 mmol哌啶(或吡咯、吗啉、二丁胺)和10 mL四氢呋喃搅拌溶解,回流反应8 h. 冷却后浓缩,硅胶柱分离(V(二氯甲烷)∶V(甲醇)=25∶1为淋洗剂),真空干燥得黄色固体4A-4J. 合成路线见式1.

式1 茚[1,2-b]喹喔啉-11-酮肟醚4A-4J的合成Scheme 1 Synthetic route for 11-substituted indeno[1,2-b]quinoxalin-11-one oxime ethers 4A-4J
1.3体外细胞毒性评价
1.3.1细胞培养及溶液配制
将3种肿瘤细胞HeLa、 A549和MCF-7在含有体积分数10%的牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640培养基中孵育(体积分数5% CO2,37 ℃).
将化合物溶解在DMSO中,配制成5 mmol/L储存液待用.取一定量的母液,并用培养基稀释成不同浓度的溶液(1.0, 10, 100和500 μmol/L),使DMSO的体积分数低于0.1%.
1.3.2体外细胞毒性的测定
取处于对数生长期的HeLa、A549和MCF-7细胞悬浮液(2×104/mL)加入到96孔培养板中(90 μL /孔),于37 ℃,体积分数5% CO2的培养箱中培养24 h. 待细胞贴壁后,加入浓度为0.1、1和10 μmol/L的4A-4J(10 μL/孔,每种化合物设5个复孔),不含药物组作空白. 孵育48 h后,每孔加入10 μL质量浓度为5 mg/mL的MTT溶液,继续培养4 h,每孔加入100 μL的DMSO,室温下震荡10 min,用酶标仪在490 nm波长下测定OD值. 进一步采用Logit法计算50%生长抑制浓度IC50值.
1.3.3细胞周期实验
将生长状态良好的HeLa细胞(2×104/mL)接种于96孔培养板中(100 μL/孔). 待细胞贴壁后, 向各孔中加入4A(终浓度:0.1、1.0、5.0和10.0 μmol/L),不含4A组作空白,孵育48 h. 用质量分数为0.25%的胰蛋白酶消化,收集细胞于离心管中,1 000 r/min离心5 min,弃上清液. 加入体积分数70%预冷乙醇1 mL,于4 ℃过夜。通过离心的方式用PBS洗涤3遍,除上清液. 每管加入PI染液500 μL使其终质量浓度为4 μg/mL, 室温染色30 min,利用流式细胞仪进行检测, 结果采用Modfit 3.2软件进行分析.
1.3.4细胞凋亡实验
将HeLa细胞按1.3.3操作方法处理,加入不含EDTA的质量分数为0.25%的胰蛋白酶,收集细胞于离心管中,1 000 r/min离心5 min,弃去上清液,PBS洗涤,将细胞悬浮于500 μL缓冲液中,加入Annexic V-FITC染液使其终质量浓度为100 ng/mL,置于暗处反应10 min,再加入5 μL PI染液,轻轻振摇,利用流式细胞仪进行检测.
2 结果与讨论
2.1化合物的合成
以茚[1,2-b]喹喔啉-11-酮(1)为原料,经肟化、醚化和胺化反应得到4A-4J. 将1与盐酸羟胺在苯和乙醇的混合溶液中加热回流,得61%收率的2. 将2 与过量的二卤代烷和氢氧化钠在THF中回流得到81%~86%收率的3a-3c. 将3a-3c与哌啶或吡咯、吗啉、二丁胺在THF中发生取代反应得到53%~82%收率的4A-4J.










2.2体外细胞毒性
以HeLa、A549和MCF-7为模型, 采用MTT法测定了化合物2、4A-4J和顺铂的IC50值(表1). 结果表明: 4A-4J对3种细胞系均表现出较高的细胞毒性(IC50< 20 μmol/L); 4F对A549和MCF-7的细胞毒性为顺铂的5倍; 4A和4B对HeLa的毒性为顺铂的2倍;4A、4B、4F和4J对A549的细胞毒性为顺铂的2、5、5和2倍;4A、4B、4F和4J对MCF-7的细胞毒性为顺铂的3、6、5和3倍. 端基胺修饰的肟醚链的引入增强了其细胞毒性. 4A-4J对HeLa和MCF-7的细胞毒性高于2. 端基结构对其毒性有影响. 具有相同侧链长度和不同端基的4A-4D(碳链长度为2)对HeLa的细胞毒性顺序为4A ≈ 4B > 4C > 4D,对A549的细胞毒性顺序为4B > 4A > 4C > 4D,对MCF-7的细胞毒性顺序为4B > 4A > 4C ≈ 4D. 具有相同侧链长度和不同端基的4E-4H(碳链长度为4),对HeLa和A549的细胞毒性顺序为4F > 4E > 4G > 4H. 端基为吡咯的化合物表现出较高的细胞毒性. 侧链长度对毒性有影响. 具有不同侧链长度和相同端基的4A、4E、4I对He La、A549和MCF-7的细胞毒性顺序为4A > 4E > 4I.

表1 化合物4A-4J的细胞毒性
2.3化合物4A对于HeLa细胞周期的影响
为探讨化合物对肿瘤细胞的损伤机制,采用PI染色法检测4A对HeLa细胞周期的影响, 结果见图1. 分别用0.1、1.0、5.0 和 10.0 μmol/L浓度的4A处理,G0/G1期在细胞周期中所占比例分别为56.46%、58.94%、59.50%、57.33%、68.83%;G2/M期在细胞周期中所占比例分别为7.35%、8.01%、13.13%、23.33%、29.42%;亚G0/G1期在细胞周期中所占比例分别为36.19%、33.05%、27.37%、19.34%、1.75%. 随4A浓度的增大,G0/G1和G2/M期在细胞周期中所占比例呈增加趋势, 而亚G0/G1期(S期)在细胞周期中所占比例逐渐降低. 结果表明,4A使肿瘤细胞主要阻滞在G0/G1和G2/M期.

a.空白组;b、c、d、e.分别用0.1、1.0、5.0 和 10.0 μmol/L的4A处理.图1 PI单染检测细胞周期Fig.1 Detection of the cell cycle by PI single staining method
2.4化合物4A对于HeLa细胞凋亡的影响
为进一步探讨4A的毒性机制,利用Annexin V/PI双染法检测细胞凋亡情况,结果如表2所示. 当4A的浓度分别为0、5.0和10.0 μmol/L时, 早期凋亡比例分别为2.58%、31.25%和55.62%. 随4A浓度的增大,早期凋亡比例显著增加.结果表明, 4A可能是通过引起肿瘤细胞早期凋亡产生细胞毒性的.
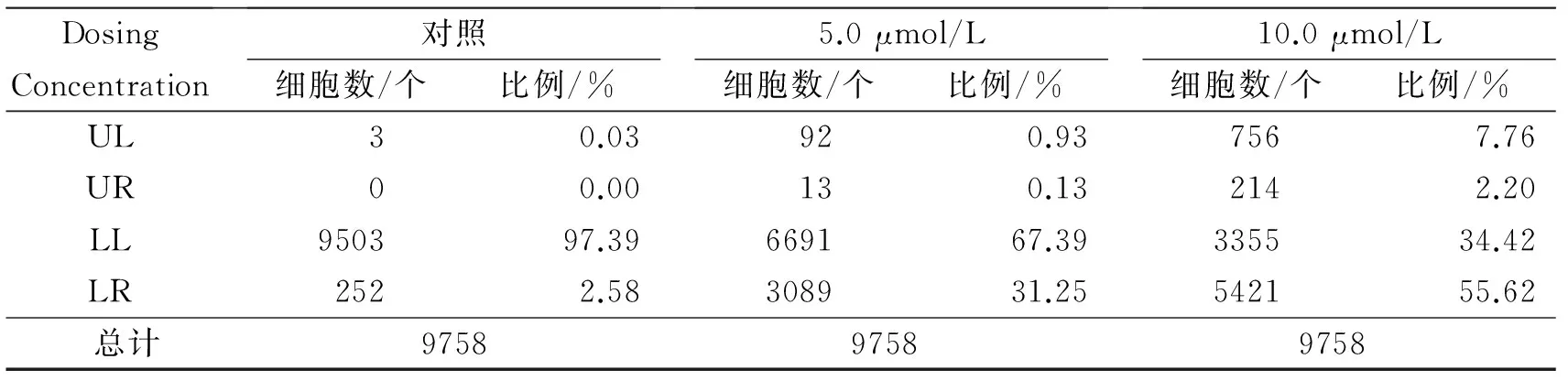
表2 Annexin V/PI双染检测细胞凋亡
3 结论
合成了系列茚[1,2-b]喹喔啉-11-酮肟衍生物,采用MTT法对其体外细胞毒性进行了评价. 4A-4J对HeLa、A549和MCF-7具有较高的细胞毒性;4B对3种细胞系的细胞毒性分别为顺铂的2、5和6倍. 胺基化肟醚链的引入增强了其体外细胞毒性,细胞毒性随侧链长度的增长而降低;端基为吡咯时,化合物的毒性高于端基为哌啶、吗啉、二丁胺的化合物. 细胞周期和凋亡实验表明4A引起G0/G1和G2/M期阻滞,进而诱导细胞凋亡. 因此, 吡咯修饰的茚[1,2-b]喹喔啉-11-酮肟醚可作为潜在的抗肿瘤先导化合物.
[1]NOOLVI M N, PATEL H M, BHARDWAJ V, et al. Synthesis and in vitro antitumor activity of substituted quinazoline and quinoxaline derivatives: search for anticancer agent[J]. Eur J Med Chem, 2011, 46: 2327-2346. DOI:10.1016/j.ejmech.2011.03.015.
[2]AL-RASHOOD S T, ABOLDAHAB I A, NAGI M N, et al. Synthesis, dihydrofolate reductase inhibition, antitumor testing, and molecular modeling study of some new 4(3H)-quinazolinone analogs[J]. Bioorg Med Chem, 2006, 14: 8608-8621. DOI:10.1016/j.bmc.2006.08.030.
[3]GOODWIN S, SMITH A F, HORNING E C. Alkaloids of Ochrosia elliptica labill[J]. J Am Chem Soc, 1959, 81: 1903-1908. DOI: 10.1021/ja01517a031.
[4]JURET P, TANGUY A, GIRARD A, et al. Preliminary trial of 9-hydroxy-2-methyl ellipticinium (NSC 264-137) in advanced human cancers[J]. Eur J Cancer, 1978, 14: 205-206. DOI:10.1016/0014-2964(78)90180-9.
[5]SELVAM P, CLERCP E D, PANNECOUQUE C. Design, synthesis, anti-HIV activity and cytotoxicity of novel schiff’s base of indeo[1,2-b]quinoxalin-11-one derivatives[J]. Int J Drug Des Discov, 2013, 4: 1017-1019.
[6]ZARRANZ B, JASO A, ALDANA I, et al. Synthesis and anticancer activity evaluation of new 2-alkylcarbonyl and 2-benzoyl-3-trifluoromethyl-quinoxaline 1,4-di-N-oxide derivatives[J]. Bioorg Med Chem, 2004, 12: 3711-3721. DOI:10.1016/j.bmc.2004.04.013.
[7]DALLAVALLE S, FERRARI A, BIASOTTI B, et al. Novel 7-oxyiminomethyl derivatives of camptothecin with potent in vitro and in vivo antitumor activity[J]. J Med Chem, 2001, 44: 3264-3674. DOI: 10.1021/jm0108092.
[8]SHARMA V M, PRASANNA P, SESHU K V A, et al. Novel indolo[2,1-b]quinazoline analogus as cytostatic agent: synthesis, biological evaluation and structure-activity relationship[J]. Bioorg Med Chem Lett, 2002, 12: 2303-2307. DOI:10.1016/S0960-894X(02)00431-6.
[9]TSENG C H, TZENG C C,YANG C L, et al. Synthesis and antiproliferative evaluation of certain indeno[1,2-c]quinoline derivatives. part 2[J]. J Med Chem, 2010, 53: 6164-6179. DOI: 10.1021/jm1005447.
(责任编辑:梁俊红)
Synthesis and cytotoxicity of indeno[1,2-b]quinoxalin-11-one oxime ethers
FENG Weipei, WANG Yingxing, LIU Siyuan, WANG Shuxiang, LI Shenghui
(Key Laboratory of Medicinal Chemistry and Molecular Diagnosis of Ministry of Education, College of Chemistry and Environmental Science, Hebei University, Baoding 071002, China)
Ten novel indeno[1,2-b]quinoxalin-11-one oxime ethers (4A-4J) were synthesized by indeno[1,2-b]quinoxalin-11-one oxime, saturated dihalide, and piperidine or pyrrole, morpholine, and dibutylamine. Their cytotoxicity against HeLa, A549 and MCF-7 cell lines was evaluated by MTT assay. The results indicated that compounds 4A,4B,4E,4F, and 4J showed higher cytotoxicty than cisplatin against HeLa, A549, and MCF-7 cell lines. Among them, 4A, 4B and 4F exhibited 2 to 6 folds higher cytotoxicty than cisplatin. Both the length of oxime ether chain and the nature of the terminal group have important effects on the cytotoxicity. The cell cycle and apoptosis assays indicated that 4A could change the cells cycle ratio, and induce apoptosis. Our results suggest that indeno[1,2-b]quinoxalin-11-one oxime ether modified by pyrrole is a potential anti tumor precursor compound.
indeno[1,2-b]quinoxalin-11-one oxime derivatives; oxime ether; cytotoxicity
10.3969/j.issn.1000-1565.2016.02.007
2015-10-25
河北省应用基础研究计划重点基础研究项目(12966418D);河北省自然科学基金资助项目(B2015201213)
冯卫培(1987—),男,河北南和人,河北大学在读硕士研究生. E-mail:yukancaihong@163.com
王书香(1965—),男,河北大城人,河北大学教授,主要从事抗肿瘤药物研究. E-mail:wsx@hbu.edu.cn
李胜辉(1973—),男,河北元氏人,河北大学教授,主要从事抗肿瘤药物研究.E-mail:lish@hbu.edu.cn
O62
A
1000-1565(2016)02-0148-07
