不同浓度尿酸对体外红细胞流变学指标的影响
2016-11-07李葵花李璐严鹏佟晓波谢利德
李葵花,李璐,严鹏,佟晓波,谢利德
(1.承德医学院生物医学工程系,河北承德 067000;2.河北大学附属医院麻醉科,河北保定 071000)
不同浓度尿酸对体外红细胞流变学指标的影响
李葵花,李璐,严鹏,佟晓波,谢利德
(1.承德医学院生物医学工程系,河北承德067000;2.河北大学附属医院麻醉科,河北保定071000)
探讨了不同浓度尿酸水平对体外红细胞流变学指标的影响.300、600、1 200 μmol/L的尿酸对体外红细胞作用2 h后,测量红细胞的流变学指标,并应用SDS-PAGE对红细胞膜蛋白成分进行分析.随尿酸浓度的增加,体外红细胞的积分变形指数、松弛指数降低,红细胞的破碎率升高.与对照组相比,红细胞锚蛋白及带3蛋白含量减少,1 200 μmol/L尿酸组的相关指标具有明显差别.提示高浓度尿酸可对红细胞膜蛋白产生明显的破坏作用,是引起红细胞流变学特性改变的独立因素.
尿酸;红细胞;血液流变学;膜蛋白
随着人民生活水平的提高和饮食结构的改善,特别是富含蛋白质和嘌呤食物摄入的增加,高尿酸血症(Hyperuricemia,HUA)的发病率逐年上升,日益受到研究者的关注[1].大多数研究者认为高尿酸血症是很多疾病的危险因素,尿酸盐沉积于肾脏、关节等部位容易引起尿酸肾结石和痛风,同时血尿酸水平升高使红细胞聚集性增强、变形能力降低,需及时纠正高尿酸血症[2],但也有文献报道血尿酸水平对红细胞参数不存在影响,不需治疗[3],由于HUA患者红细胞流变参数的改变迥异,与其常伴发高血压、高血脂、糖尿病、心脑血管等疾病有关[4].当排除其他疾病因素后,高尿酸血症患者红细胞流变学特性是否发生变化对临床高尿酸血症的处理存在一定的指导作用.因此本文通过不同浓度尿酸作用于体外红细胞,研究尿酸对红细胞流变特性及膜蛋白的影响,为临床高尿酸血症的处理提供参考依据.
1 材料和方法
1.1主要仪器和试剂
LBY-BX红细胞变形仪(北京普利生仪器有限公司);UNICO UV-2000型分光光度计(上海尤尼柯仪器有限公司);全自动生化分析仪(日立7180);SDS-PAGE电泳仪Protein ⅡXi Cell(美国BioRAD公司);尿酸(西亚试剂研究中心);聚丙烯吡咯烷酮(北京化学试剂公司);尿酸试剂盒(北京北化康泰临床试剂有限公司);蛋白定量试剂盒(北京索莱宝试剂公司).
1.2尿酸体外刺激红细胞
取适量尿酸(uric acid,UA)粉剂置于等渗透压的PBS溶液中,37 ℃水浴助溶至溶液清澈透明.滤器除去可能存在的尿酸盐晶粒,偏振显微镜下观察无尿酸晶体.酶法测定尿酸浓度,用等渗PBS调节尿酸溶液浓度.
健康雄性SD大鼠10只,购于北京大学医学部实验动物中心.取大鼠肝素抗凝血,离心去除血浆和白细胞,PBS多次洗涤后获得洗涤红细胞.临床上把男性高于420 μmol/L、女性高于360 μmol/L尿酸水平称为高尿酸血症,在急性情况下尿酸可达1 200 μmol/L以上[5].尿酸溶液的浓度调节为300、600、1 200 μmol/L分别模拟正常、高尿酸、极高尿酸水平.将洗涤红细胞与不同浓度的尿酸溶液等体积混匀,37 ℃孵育2 h后测量红细胞流变学相应指标.对照组采用红细胞与等渗透压的PBS溶液混合,处理方法同尿酸组.
1.3红细胞流变学参数的测定
玻片法观察红细胞形态,随机取100个红细胞,Photoshop图像处理软件测量红细胞直径.取红细胞悬液,用LBY-BX红细胞变形仪检测反映红细胞各切变率变形能力总体效应的积分变形指数(integrated deformation index,IDI)、体现红细胞松弛特性的松弛指数(relaxation index,RI)、反映红细胞膜流动性的小变形指数DI(d)和表述红细胞在血液流动中取向能力的取向指数DI(or),具体操作遵照仪器使用说明书.取30 μL红细胞悬液分别加入到3 mL不同渗透压的PBS溶液中混匀,静置1 h后离心取上清液以540 nm的波长比色,根据各管上清液的透光率,计算细胞破碎率(haemolysis rate,Hr),Hr代表红细胞对不同渗透压溶液的抵抗能力[6].
1.4红细胞膜蛋白电泳
低渗破膜法提取红细胞膜[7],应用蛋白定量试剂盒测定蛋白浓度.配置聚丙烯酰胺体积分数为7.5%的分离胶,SDS-PAGE分离红细胞膜蛋白.电泳完毕,将凝胶置于考马斯亮蓝R250染色液中染色,着色后取出.室温下置于摇床上脱色,期间更换脱色液,直至本底洗脱干净.扫描凝胶,分析膜蛋白成分,以各带面积灰度值占总条带灰度值的相对百分比表示.
1.5统计学方法
2 结果
2.1尿酸对红细胞形态的影响
图1所示,正常对照组红细胞的平均直径为(7.11±0.42) μm,1 200 μmol/L尿酸作用后红细胞直径为(7.03±0.56) μm,与正常对照组相比差异无统计学意义,尿酸作用前后细胞形态无显著变化.

a.对照组;b.1 200 μmol/L尿酸组.图1 红细胞形态图像Fig.1 Pictures of erythrocyte morphology
2.2尿酸对红细胞流变参数的影响
本实验发现随着尿酸浓度的升高,红细胞的积分变形指数IDI、松弛指数RI、小变形指数DI(d)、取向指数DI(or)均有降低趋势.在体外的尿酸浓度为600 μmol/L以上时,红细胞的IDI和RI的降低有统计学差异(P<0.05).红细胞处于等渗透压的环境中时,破碎率Hr为0,保持了良好的完整性.随着外环境渗透压的降低,细胞的Hr逐渐升高,但存在一个升势较为平缓的“平台期”.随后,细胞的Hr迅速升高,最后细胞全部破碎.本实验发现在145 mmol/L渗透压下各组细胞的Hr差异较大,统计发现1 200 μmol/L浓度的尿酸使红细胞的Hr与对照组相比显著升高(P<0.05).但尿酸对红细胞的DI(d)和DI(or)的影响无统计学差异(表1).

表1 尿酸对红细胞流变参数的影响
与对照组相比*P<0.05.
2.3尿酸作用前后红细胞膜蛋白变化
根据Marker分子质量与大鼠红细胞蛋白分子质量对比分析SDS-PAGE电泳图谱中的条带,证实本实验主要分离获得血影蛋白(Spectrin)、锚蛋白(Ankyrin)、带3蛋白(Band 3)、带4.2蛋白(Band 4.2)、肌动蛋白(Actin),共5种蛋白,如图2所示.其中各组大鼠红细胞膜蛋白中血影蛋白和带3 蛋白含量较多,是红细胞膜蛋白的主要组分.与正常对照组相比,各尿酸组血影蛋白含量有一定程度的增加,锚蛋白和带3蛋白含量均有一定程度减少,而600 μmol/L以上的尿酸浓度组的变化有统计学差异(P<0.05).各组大鼠红细胞膜带4.2蛋白和肌动蛋白含量均无统计学差异(表2).
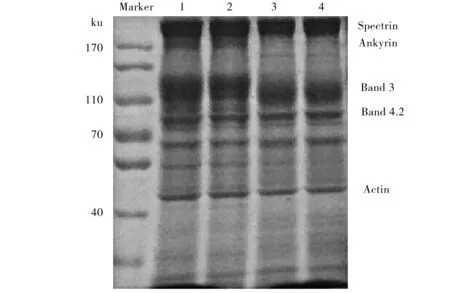
1-4.尿酸浓度分别为0、300、600、1 200 μmol/L.图2 大鼠红细胞SDS-PAGE电泳图谱Fig.2 SDS-PAGE electrophoresis of rat erythrocytes

组 别w(Spectrin)/%w(Ankyrin)/%w(Band3)/%w(Band4.2)/%w(Actin)/%对照组35.06±3.268.10±1.3734.83±2.1615.77±0.635.89±1.06300μmol/L尿酸组36.34±3.326.79±1.3433.55±3.0515.16±0.426.15±0.47600μmol/L尿酸组41.10±2.58*2.67±0.89#31.68±3.5116.96±0.815.89±0.581200μmol/L尿酸组44.49±2.72#2.40±0.42#28.98±3.87*16.77±0.666.67±0.39
与对照组相比*P<0.05,#P<0.01.
3 讨论
本实验发现随着尿酸浓度的升高,红细胞的流变参数逐渐发生变化.在体外的尿酸浓度为600 μmol/L以上时,红细胞流变学的IDI、RI及Hr发生显著变化,说明尿酸作用后红细胞的变形能力和松弛能力降低,在低渗透压环境中Hr增加,容易发生溶血事件.红细胞不含内膜和胞核,其流变学参数变化的原因源自本身的膜结构和细胞骨架支撑.
本实验结果表明体外尿酸作用引起红细胞膜锚蛋白含量的下降.锚蛋白是膜骨架蛋白的一种,主要起锚定作用,它含有β-血影蛋白、带4.2 蛋白和带3 蛋白的结合位点,可将膜整合蛋白稳定连接到细胞膜内表面的骨架蛋白网络,是膜骨架与脂质双分子层连接的重要纽带.锚蛋白缺陷的转基因小鼠的红细胞,由于锚蛋白的缺乏可造成红细胞膜脂以脂质小泡的形式脱落,使红细胞的变形性下降,与本实验的结果基本一致[8].尿酸引起红细胞锚蛋白水平的下调将影响锚蛋白与收缩蛋白的作用,从而破坏以锚蛋白为中介的细胞骨架网络的形成,致使红细胞变形性和松弛性下降并且容易发生破裂溶血.
有研究发现当患者体内的氧化应激增强,超出自身的抗氧化能力,体内红细胞膜受自由基攻击更容易发生氧化损伤,而红细胞带3蛋白是主要的靶点,可造成带3蛋白构象的改变[9-10].同时脂质的过氧化也将影响红细胞膜的通透性.本研究亦发现尿酸作用红细胞后其带3蛋白的相对水平和条带位置下降,这是由于尿酸具有较强的氧化作用[11],并且体外尿酸作用于红细胞时缺乏抗氧化酶的调和作用,带3蛋白受到尿酸的氧化应激损伤,蛋白易发生交联、降解.带3蛋白胞浆段具有膜骨架蛋白、血红蛋白、糖酵解酶、过氧化氢酶、酪氨酸磷酸化酶等的结合位点,起着将膜与膜骨架、细胞内环境相联系的重要作用,从而调节红细胞的变形能力、糖酵解速率、携氧和免疫清除功能[12].力竭运动引起大鼠红细胞膜带3蛋白含量的减少,大鼠红细胞变形能力降低,与本实验的结论一致[13-14].
综上所述:体外尿酸作用于红细胞后,由于红细胞膜蛋白中锚蛋白和带3蛋白含量的下调,可使红细胞膜的变形性、松弛性和渗透脆性明显降低,提示高尿酸血症患者可能产生红细胞流变特性的改变,从而影响正常的血液循环,需要及时纠正.但尿酸作用是否引起锚蛋白和带3蛋白在红细胞中分布的变化有待于进一步研究.
[1]BERGAMINI C,CICOIRA M,ROSSI A,et al.Oxidative stress and hyperuricaemia:pathophysiology,clinical relevance,and therapeutic implications in chronic heart failure[J].Eur J Heart Fail,2009,11(5):444-452.DOI:10.1093/eurjhf/hfp042.
[2]于丽华.血液流变学指标变化与高尿酸血症的相关性分析[J].实用医药杂志,2008,25(10):1202.DOI:10.3969/j.issn.1671-4008.2008.10.030.
[3]虞丹丹,王明山,吕美艳,等.高尿酸血症患者血小板及红细胞相关参数的变化分析[J].实用医学杂志,2010,26(10):1170-1172.DOI:10.3969/j.issn.1006-5725.2010.10.040.
[4]SOLTANI Z,RASHEED K,KAPUSTA DR,et al.Potential role of uric acid in metabolic syndrome,hypertension,kidney injury,and cardiovascular diseases:is it time for reappraisal [J].Curr Hypertens Rep,2013,15(3):175-181.DOI:10.1007/s11906-013-0344-5.
[5]贺振新,陈立.多发性骨髓瘤致急性尿酸盐肾病肾功能衰竭抢救1例[J].临床血液学杂志,1994,7(1):40.DOI:10.13201/j.issn.1004-2806.1994.01.021.
[6]SONG J,WANG X,XU X,et al.The effects of non-ionic contrast medium on the hemorheology in vitro and in vivo [J].Clin Hemorheol Microcirc,2014,58(3):385-393.DOI:10.3233/CH-121669.
[7]XIONG Y,LI Y,XIONG Y,et al.Exhaustive running exercise induce tyrosine phosphorylation of band 3 in rat erythrocytes [J].Cell Physiol Biochem,2013,32(4):1060-71.DOI:10.1159/000354506.
[8]任绪义,张建鹏,冯伟华.红细胞膜锚蛋白研究进展[J].国外医学:输血及血液学分册,2002,25(3):198-200.
DOI:10.3760/cma.j.issn.1673-419X.2002.03.003.
[9]张晶,马智峰,李云云,等.低浓度砷染毒大鼠红细胞膜蛋白的变化 [J].毒理学杂志,2011,25(4):261-265.
ZHANG Jing,MA Zhifeng,LI Yunyun,et al.The effects of low-level arsenic exposure on erythrocyte membrane proteins in rats [J].Journal of Toxicology,2011,25(4):261-265.
[10]常文露,孙永叶,汪求真,等.红细胞膜带3 蛋白水平与中老年人生理状况相关分析[J].卫生研究,2011,40(3):323-326.
CHANG Wenlu,SUN Yongye,WANG Qiuzhen,et al.Correlation of band 3 protein in erythrocytes with physiological status of middle-aged and elderly people[J].Journal of Hygiene Research,2011,40(3):323-326.
[11]OSHIMA N,ONIMARU H,MATSUBARA H,et al.Uric acid,indoxyl sulfate,and methylguanidine activate bulbospinal neurons in the RVLM via their specific transporters and by producing oxidative stress[J].Neuroscience,2015,304:133-45.DOI:10.1016/j.neuroscience.2015.07.055.
[12]FRANKE R P,SCHARNWEBER T,FUHRMANN R,et al.Effect of radiographic contrast media on the spectrin/band3-network of the membrane skeleton of erythrocytes[J].PloS One,2014,9(2):e89512.DOI:10.1371/journal.pone.0089512.
[13]XIONG Y,LI Y,XIONG Y,et al.Cluster of erythrocyte band 3:a potential molecular target of exhaustive exercise-induced dysfunction of erythrocyte deformability[J].Can J Physiol Pharmacol,2013,91(12):1127-1134.DOI:10.1139/cjpp-2013-0145.
[14]洪平,李开刚,冯连世.大强度训练及恢复后大鼠红细胞变形能力和红细胞膜蛋白的变化[J].中国应用生理学杂志,2002,18(3):269-273.
HONG Ping,LI Kaigang,FENG Lianshi.Alterrations of erythrocyte deformability and memberane protein after high intensity training and recovevery in rats [J].Chinese Jounal of Applied Physiology,2002,18(3):269-273.DOI:10.3969/j.issn.1000-6834.2002.03.015.
(责任编辑:赵藏赏)
Effects of different concentrations of uric acid on erythrocyte hemorheology in vitro
LI Kuihua1,LI Lu2,YAN Peng1,TONG Xiaobo1,XIE Lide1
(1.Department of Biomedical Engineering,Chengde Medical College,Chengde 067000,China;2.Department of Anesthesiology,Affiliated Hospital of Hebei University,Baoding 071000,China)
The effects of different concentrations of uric acid on hemorheology were investigated in vitro.The erythrocytes were suspended in 300,600,1 200 μmol/L uric acid for 2 h and the hemorheological parameters were measured.The membrane protein composition was also analyzed by SDS-PAGE.We found that the integrated deformation index and relax index were reduced in a dose-dependent manner.The hemolysis rate increased.As compared with the control group,the content of ankyrin and band 3 proteins showed a decrease trend.These results were statistically significant in the 1 200 μmol/L group.The results suggest that high concentrations of uric acid can have significant damaging effects on erythrocyte membrane proteins,which is an independent factor affecting the hemorheological properties of erythrocytes.
uric acid;erythrocyte;hemorheology;membrane proteins
10.3969/j.issn.1000-1565.2016.02.013
2015-04-18
河北省高等学校科学技术研究项目(QN20131033);承德医学院自然科学一般项目(201313);承德医学院大学生科研立项(201439)
李葵花(1978—),女,河北保定人,承德医学院副教授,主要从事血液流变学研究. E-mail:148117940@qq.com
R35;Q51
A
1000-1565(2016)02-0184-05
