普萘洛尔与阿替洛尔治疗婴儿血管瘤的比较研究
2016-11-06王琦向波吉毅李福玉徐志诚钟麟
王琦 向波 吉毅 李福玉 徐志诚 钟麟
610041成都,四川大学华西医院小儿外科
普萘洛尔与阿替洛尔治疗婴儿血管瘤的比较研究
王琦 向波 吉毅 李福玉 徐志诚 钟麟
610041成都,四川大学华西医院小儿外科
目的评价普萘洛尔与阿替洛尔治疗婴儿血管瘤的疗效与安全性。方法年龄5~24周的婴儿血管瘤患儿75例,分为普萘洛尔组(30例)与阿替洛尔组(45例)。普萘洛尔组给予普萘洛尔2 mg/kg,每天分3次口服;阿替洛尔组给予阿替洛尔1 mg/kg,每天1次口服。两组均连续服药24周,并于治疗后第1、4、12、24周进行随访,记录不良反应,并对治疗24周前后的瘤体情况进行血管瘤活跃度评分以评价疗效。结果在普萘洛尔组中,达到瘤体消退满意的患儿为70%(21/30),阿替洛尔组中达到瘤体消退满意的患儿为75.6%(34/45),两组比较,差异无统计学意义(P>0.05)。普萘洛尔组中1例患儿因严重气道高反应性而停药导致治疗失败。阿替洛尔组中1例患儿因出现药物抵抗而治疗失败。两组相比,普萘洛尔组患儿出现胃肠道反应、中枢神经系统不良反应及肢端发凉、细支气管炎合并气道高反应性的比例更高(P<0.05)。两组中均未出现低血压、低血糖及心动过缓。结论阿替洛尔治疗婴儿血管瘤的疗效与普萘洛尔相仿,但阿替洛尔的不良反应更少。
血管瘤;儿童;普萘洛尔;阿替洛尔;疗效比较研究
婴儿血管瘤(infantile hemangioma,IH)是一种好发于头面颈部的良性肿瘤,在新生儿的发病率4% ~ 10%[1⁃3]。约80%的IH会自行消退,但部分瘤体在消退前所致的外貌缺陷,以及消退后导致的皮肤松弛、色素沉着、瘢痕形成及纤维脂肪组织沉积等情况,常给患儿家庭带来沉重的精神负担。而另外20%IH被称为难治性IH,常生长在要害部位,或因出血、溃疡,或因生长迅速、面积较大而影响器官的功能,甚至危及患儿生命[4⁃6]。2008 年,Léauté⁃Labrèze等[7]首次报道普萘洛尔治疗IH疗效显著,但作为一种脂溶性的非选择性β受体阻滞剂,普萘洛尔所带来的不良反应如:睡眠障碍、气道高反应性以及腹泻等也逐渐引起重视[8⁃10]。因此我们设想:水溶性的选择性β1受体阻滞剂阿替洛尔,是否有普萘洛尔相似的疗效而不良反应更少?本研究对普萘洛尔与阿替洛尔治疗IH的疗效及安全性进行对比观察。
资料与方法
一、临床资料
2014年6月至2015年11月在四川大学华西医院小儿外科门诊就诊的IH患儿75例,根据患儿首诊日期的不同,并遵照患儿家属的意愿分别使用普萘洛尔或阿替洛尔进行治疗,定期门诊随访,随访时间为开始治疗时以及规律治疗后的1、4、12、24周。本研究通过本院医学伦理委员会批准,患儿家属均签署知情同意书。
二、纳入及排除标准
纳入标准:IH患儿首诊年龄5~24周,并确诊为增殖期,未经治疗过的浅表性或混合性IH[6];头面部IH瘤体直径≥1.5 cm,躯体及四肢瘤体直径≥3.0 cm,或瘤体≥1.5 cm但有溃疡形成。排除标准:患儿合并其他需使用糖皮质激素治疗的疾病;患儿合并严重心脏畸形、房室传导阻滞、心动过缓、哮喘、PHACE综合征或LUMBAR综合征[11⁃12];患儿合并有肝脏血管瘤或全身多发性血管瘤(≥3处)等。
三、方法
治疗前行心电图和(或)超声心动图及随机血糖等检查以排除禁忌证。普萘洛尔组治疗方案:第1周,1 mg·kg⁃1·d⁃1;第2 ~ 24周,2 mg·kg⁃1·d⁃1,每日间隔6~8 h分3次口服。阿替洛尔组治疗方案:第1周,0.5 mg·kg⁃1·d⁃1;第2 ~ 24周1 mg·kg⁃1·d⁃1,每日1次口服[8]。每次随访时均对患儿的随机血糖、心电图及血压等指标进行监测,记录药物相关不良反应的发生情况,对患儿IH瘤体情况进行评分,并拍摄瘤体的照片。同时根据患儿体重变化调整药物剂量。从规律用药的第4周开始,根据瘤体评分初步评估疗效,并以最终治疗24周前后的评分之差作为最终的疗效判定值。
四、疗效及不良反应的评价
使用2011年由Janmohamed及其团队提出的血管瘤活跃度评分(The hemangioma activity score,HAS)[13⁃14],对患儿治疗24周前后的瘤体情况进行评分。具体评分内容如下。
1.瘤体膨胀程度及体积变化评分(h1):①瘤体肿大膨起且表面张力较高(6分);②瘤体肿大膨起但表面张力较小,或与初诊时相比瘤体有所缩小但程度<50%(4分);③与初诊时相比瘤体体积缩小程度≥50%(2分);④与初诊时相比,病变处皮肤平坦无包块或瘤体完全消失(0分)。初诊时即为平坦无明显包块的IH,可省略此项评分。
2.瘤体颜色及其变化评分(h2):①瘤体全部呈鲜红色/亮红色(5分);②仅瘤体边缘呈鲜红色/亮红色而其余部分瘤体呈其他颜色(4分);③瘤体整体/局部呈暗红色/紫红色,或仅瘤体边缘呈暗红色(3分);④瘤体整体/局部呈蓝色,或深部血管瘤的表面皮肤局部/整体呈蓝色(2分);⑤瘤体整体/局部呈灰白色或苍白色(1分);⑥瘤体局部/整体恢复正常皮肤的颜色(0分)。当瘤体不同部分呈现不同颜色时,可按以上标准进行多次计分。
3.瘤体溃疡程度评分(h3):①瘤体表面完整无溃疡(0分);②瘤体有溃疡且面积≤1 cm2(0.5分);③溃疡面积1~25 cm2(1分);④溃疡面积≥25 cm2(2分);根据1、2项总分及计分次数得出平均值h′,h′=(h1+h2)/计分次数。再将h′与第3项溃疡评分(h3)相加即 得 出最终 HAS评 分(HAS=h′+h3)[13⁃14]。图1中阿替洛尔组患儿初诊时:瘤体高于体表且张力较高(6分),瘤体整体呈鲜红色(5分),1、2项共计分2次,瘤体无溃疡(0分),则HAS=(5+6)/2+0=5.5。普萘洛尔组患儿于治疗后第24周随访时:瘤体不再突出体表(0分),瘤体边缘呈暗红色(3分),瘤体中央部分稍显苍白(1分),1、2项共计分3次,瘤体无溃疡(0分)。则HAS=(0+3+1)/3+0=1.3。
随访时,分别由两位评分者对每例患儿每次随访时的IH瘤体情况进行评分。当两位评分者的结果不同时,则互相沟通给出一个最终评分。我们定义患儿初诊时、1、4、12、24周随访时的瘤体HAS评分分别为H0、H1、H4、H12、H24,然后再算出每例患儿初诊时的HAS评分(H0)与24周随访时的HAS评分(H24)之间的差值ΔH,作为评价药物疗效的标准,ΔH数值越大,说明与治疗前相比,规律治疗24周后瘤体的消退程度越大,疗效越显著[8]。
本次研究主要监测与β受体阻滞剂相关的药物不良反应,以及在服药后开始出现,停药后即消失或迅速缓解的症状,如低血压、低血糖、心动过缓、细支气管炎合并气道高反应性、睡眠障碍及腹泻、便秘等症状[8⁃10]。并进行分类统计。
五、统计方法
使用SPSS19.0软件进行数据分析。按照治疗后24周复查的B超或磁共振检查结果判断,当瘤体消退程度 ≥90%即认定为瘤体消退满意[15],用Fisher确切概率法比较两组中达到消退满意标准的患者比例以及各种不良反应的发生情况。使用t检验法比较两组中疗效判定值ΔH的差异。
结 果
一、一般资料
本研究共纳入75例患儿,普萘洛尔组30例,男10例,女20例;年龄(10.03±3.69)周;瘤体位于头面部17例,躯干部4例,四肢7例,会阴部2例;其中草莓状血管瘤27例,混合性血管瘤3例;瘤体平均面积为4.2 cm×3.5 cm,平均厚度/深度为0.41 cm;治疗前HAS评分(4.40±0.97)。治疗过程中有1例患儿因严重气道高反应性而停药,导致治疗失败。阿替洛尔组45例,男14例,女31例;年龄(10.62±4.48)周;瘤体位于头面部23例,躯干部11例,四肢6例,会阴部5例;其中草莓状血管瘤43例,混合性血管瘤2例;瘤体平均面积为3.5 cm ×3.1 cm,平均厚度/深度为0.36 cm;治疗前HAS评分(4.38±0.84)。其中1例患儿在早期使用阿替洛尔时,瘤体颜色及体积均有所消退,随后持续用药直至随访结束,其瘤体色泽及体积又逐渐增长至首诊时状态,进入增殖期。因出现药物抵抗,而导致治疗失败。经统计学分析,治疗前两组间性别、年龄、瘤体类型、部位、面积及HAS评分等之间的差异无统计学意义(P>0.05),具有可比性。
二、疗效评价
在治疗24周后,两组中患儿达到消退满意标准的比例分别为:普萘洛尔组70%(21/30),阿替洛尔组75.6%(34/45),见图1,两组间差异无统计学意义(χ2=0.284,P=0.605)。使用t检验比较两组间疗效判定值ΔH,结果显示差异无统计学意义(t=0.174,P=0.862)。见表1。
三、不良反应评价
两组均未出现低血压、心动过缓及低血糖。普萘洛尔组共出现41例不良反应,阿替洛尔组共出现27例不良反应,两组各类不良反应之间的差异均有统计学意义。中枢神经系统不良反应(烦躁及睡眠障碍):普萘洛尔组(11/30)比阿替洛尔组(6/45),χ2=5.591,P=0.025。β2受体相关不良反应(细支气管炎合并气道高反应性及四肢肢端发凉):普萘洛尔组(11/30)比阿替洛尔组(6/45),χ2=5.591,P=0.025。消化道不良反应(呕吐、腹泻便秘及食欲减退):普萘洛尔组(19/30)比阿替洛尔组(15/45),χ2=6.537,P=0.017。见表2。

表1 普萘洛尔与阿替洛尔治疗24周前后的血管瘤活跃度评分
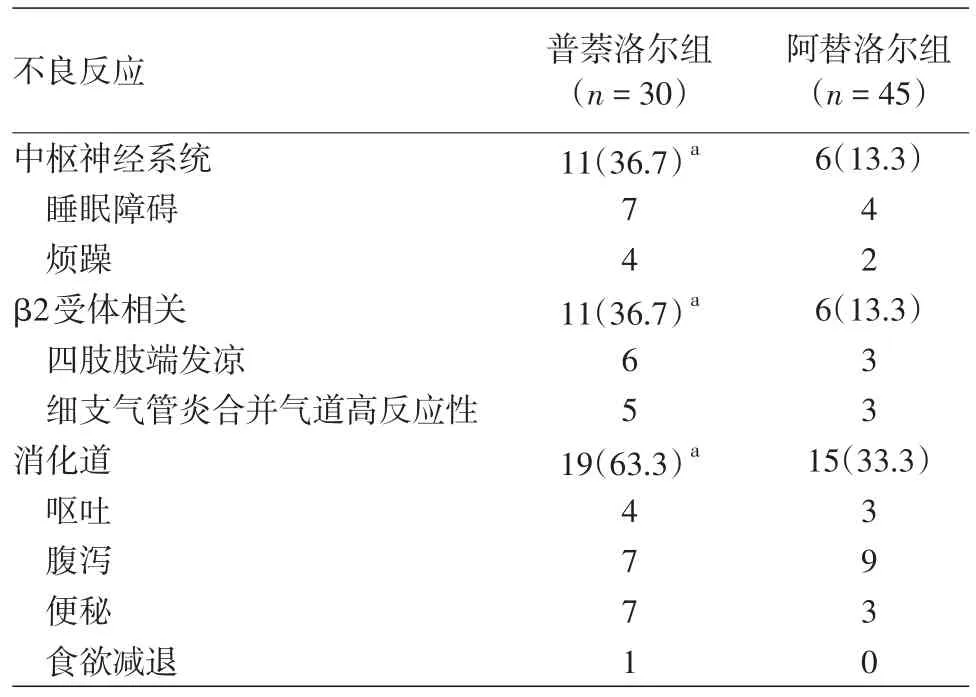
表2 普萘洛尔组和阿替洛尔组不良反应的发生情况[例(%)]
讨 论
目前认为,普萘洛尔治疗血管瘤可能有以下机制:普萘洛尔可以诱导由血管瘤周细胞介导的毛细血管收缩;抑制血管生长尤其是儿茶酚胺类物质诱导的血管生成;破坏瘤体内血流动力平衡而诱导血管内皮细胞凋亡;以及导致肾素⁃血管紧张素系统的失活等[15]。
在本研究中,我们采用标准的HAS对药物治疗IH的疗效进行判定,同以往的评分方法相比,HAS能更有效的反映瘤体的变化以及药物的疗效。结果显示,两种药物在疗效方面无明显的差异。同时,本研究发现中枢神经系统不良反应、β2受体相关不良反应和消化道相关不良反应在普萘洛尔组中出现的频次分别为11(36.7%)、11(36.7%)和19(63.3%),均明显高于阿替洛尔组中相应不良反应的发生频次:6(13.3%)、6(13.3%)和15(33.3%)。对此我们认为可能有以下原因:与选择性β1受体阻滞剂阿替洛尔不同,普萘洛尔可同时作用于β1、β2受体,这会增加阻断β2受体所带来的支气管平滑肌收缩的不良反应,从而增加气道高反应性与哮喘发生的风险[10]。普萘洛尔作为一种脂溶性药物,与水溶性的阿替洛尔相比,它更易于通过血脑屏障而导致如睡眠障碍、烦躁等中枢神经系统相关的不良反应[10]。此外,我们还观察到,两种药物均会引起不同程度的胃肠道相关不良反应,如呕吐、腹泻、便秘、食欲减退等。这些胃肠道反应在停药后均可自行消失,但这类不良反应发生的机制尚缺乏定论。
本研究还有不足之处:所选对象仅为来我院小儿外科就诊的患儿,无论是样本量还是患儿来源地都具有局限性。我们考虑到人种的差异,用量比较低,并未按照国外研究中所提到的,当疗效不明显时增加普萘洛尔用量至4 mg·kg⁃1·d⁃1[10],阿替洛尔用量至3 mg·kg⁃1·d⁃1[8]。而药物的疗效、不良反应与药物用量的关系,仍需进一步研究证实。本研究仅观察了β受体阻滞剂的短期疗效与不良反应,缺乏较长期的随访资料。婴儿正处于体格发育与神经系统发育的关键阶段,因此,长期使用β受体阻滞剂是否会对婴儿的生长发育、尤其是神经系统的发育产生影响,值得研究。
[1]George A,Mani V,Noufal A.Update on the classification of hemangioma[J].J Oral Maxillofac Pathol,2014,18(Suppl 1):S117⁃120.DOI:10.4103/0973⁃029X.141321.
[2]Kilcline C,Frieden IJ.Infantile hemangiomas:how common are they?A systematic review of the medical literature[J].Pediatr Dermatol,2008,25(2):168 ⁃173.DOI:10.1111/j.1525 ⁃1470.2008.00626.x.
[3]Hoornweg MJ,Smeulders MJ,Ubbink DT,et al.The prevalence and risk factors of infantile haemangiomas:a case⁃control study in the Dutch population[J].Paediatr Perinat Epidemiol,2012,26(2):156⁃162.DOI:10.1111/j.1365⁃3016.2011.01214.x.
[4]Chen TS,Eichenfield LF,Friedlander SF.Infantile hemangiomas:an update on pathogenesis and therapy[J].Pediatrics,2013,131(1):99⁃108.DOI:10.1542/peds.2012⁃1128.
[5]Luu M,Frieden IJ.Haemangioma:clinical course,complications and management[J].Br J Dermatol,2013,169(1):20⁃30.DOI:10.1111/bjd.12436.
[6]Chang LC,Haggstrom AN,Drolet BA,et al.Growth characteristics of infantile hemangiomas:implications for management[J].Pediatrics,2008,122(2):360 ⁃367.DOI:10.1542/peds.2007⁃2767.
[7]Léauté⁃Labrèze C,de la Roque ED,Hubiche T,et al.Propranolol for severe hemangiomas of infancy[J].N Engl J Med,2008,358(24):2649⁃2651.DOI:10.1056/NEJMc0708819.
[8]de Graaf M,Raphael MF,Breugem CC,et al.Treatment of infantile haemangiomas with atenolol:comparison with a historical propranolol group[J].J Plast Reconstr Aesthet Surg,2013,66(12):1732⁃1740.DOI:10.1016/j.bjps.2013.07.035.
[9]Léauté⁃Labrèze C,Hoeger P,Mazereeuw ⁃Hautier J,et al.A randomized,controlled trial of oral propranolol in infantile hemangioma[J].N Engl J Med,2015,372(8):735⁃746.DOI:10.1056/NEJMoa1404710.
[10]de Graaf M,Breur JM,Raphaël MF,et al.Adverse effects of propranolol when used in the treatment of hemangiomas:a case series of 28 infants[J].J Am Acad Dermatol,2011,65(2):320⁃327.DOI:10.1016/j.jaad.2010.06.048.
[11]Metry D,Heyer G,Hess C,et al.Consensus statement on diagnostic criteria for PHACE syndrome[J].Pediatrics,2009,124(5):1447⁃1456.DOI:10.1542/peds.2009⁃0082.
[12]Iacobas I,Burrows PE,Frieden IJ,et al.LUMBAR:association between cutaneous infantile hemangiomas of the lower body and regional congenital anomalies[J].J Pediatr,2010,157(5):795⁃801.e1⁃7.DOI:10.1016/j.jpeds.2010.05.027.
[13]Janmohamed SR,de Waard⁃van der Spek FB,Madern GC,et al.Scoring the proliferative activity of haemangioma of infancy:the Haemangioma Activity Score (HAS)[J].Clin Exp Dermatol,2011,36(7):715⁃723.DOI:10.1111/j.1365⁃2230.2011.04080.x.
[14]Janmohamed SR,van Oosterhout M,de Laat PC,et al.Scoring the therapeutic effects of oral propranolol for infantile hemangioma:a prospective study comparing the Hemangioma Activity Score(HAS)with the Hemangioma Severity Scale(HSS)[J].J Am Acad Dermatol,2015,73(2):258⁃263.DOI:10.1016/j.jaad.2015.05.012.
[15]Ji Y,Chen S,Xu C,et al.The use of propranolol in the treatment of infantile haemangiomas:an update on potential mechanisms of action[J].Br J Dermatol,2015,172(1):24⁃32.DOI:10.1111/bjd.13388.
Propranolol versus atenolol in the treatment of infantile hemangioma:a comparative study
Wang Qi,Xiang Bo,Ji Yi,Li Fuyu,Xu Zhicheng,Zhong Lin
Department of Pediatric Surgery,West China Hospital,Sichuan University,Chengdu 610041,China
ObjectiveTo evaluate the efficacy and safety of oral propranolol versus atenolol in the treatment of infantile hemangioma(IH).MethodsA total of 75 infants with IH aged 5-24 weeks were randomly divided into two groups:propranolol group(n=30)orally administrating propranolol 2 mg·kg⁃1·d⁃1in 3 divided doses daily for 24 consecutive weeks,atenolol group(n=45)orally administrating atenolol 1 mg·kg⁃1·d⁃1once a day for 24 consecutive weeks.After 1⁃,4⁃,12⁃,24⁃week treatment,the infants with IH were followed and adverse reactions were recorded.In addition,the activity of IH was assessed by hemangioma activity score(HAS)before and after 24⁃week treatment,and changes of HAS were compared between the propranolol group and atenolol group.ResultsThere was no significant difference in the proportion of patients experiencing satisfactory regression of hemangioma between the propranolol group and atenolol group(70%[21/30]vs.75.6%[34/45],P > 0.05).Treatment failure occurred in one patient in the propranolol group because of severe airway hyperreactivity,and in another patient in the atenolol group because of drug resistance.The incidence rates of gastrointestinal reactions,central nervous system adverse effects,chills on the extremities and bronchiolitis complicated by airway hyperreactivity were all significantly higher in the propranolol group than in the atenolol group(all P < 0.05).None of hypotension,hypoglycemia and bradycardia occurred in the two groups.ConclusionCompared with propranolol,atenolol shows similar efficacy but less adverse effects in the treatment of IH.
Hemangioma;Child;Propranolol;Atenolol;Comparative effectiveness research
Ji Yi,Email:jijiyuanyuan@163.com
2016⁃02⁃22)
(本文编辑:吴晓初)
吉毅,Email:jijiyuanyuan@163.com
10.3760/cma.j.issn.0412⁃4030.2016.10.001
国家自然科学基金(81401606、81400862);四川大学优秀青年学者基金(2015SU04A15)
Fund programs:National Natural Science Foundation of China(81401606,81400862);Science Foundation for Excellent Youth Scholars of Sichuan University(2015SU04A15)
