水溶液中氨基酸侧链对G∶C碱基对间氢键影响的理论研究
2016-11-03杨忠志赵东霞
赵 健, 都 京, 刘 硕, 杨忠志, 赵东霞, 刘 翠
(辽宁师范大学化学化工学院, 大连 116029)
水溶液中氨基酸侧链对G∶C碱基对间氢键影响的理论研究
赵健, 都京, 刘硕, 杨忠志, 赵东霞, 刘翠
(辽宁师范大学化学化工学院, 大连 116029)
利用量子化学方法研究了气相和水溶液下, 氨基酸侧链与鸟嘌呤和胞嘧啶间的氢键作用. 应用B3LYP/6-31+G(d,p)方法优化复合物几何结构, 使用MP2/aug-cc-pVDZ方法进行复合物能量、 自然键轨道(NBO)电荷和二阶稳定化能的计算. 结果表明, 水溶液可使氨基酸侧链与碱基或碱基对之间氢键键能显著减小; 带电复合物气相和水溶液氢键键能之差范围为50.63~146.48 kJ/mol, 中性为0.17~24.94 kJ/mol; 电荷的转移量与氢键键能成正比, 电荷转移量越多, 复合物越稳定; 二阶稳定化能与氢键键长成反比, 与电荷转移量成正比, 且气相与水溶液氢键二阶稳定化能之比约为两相的电荷转移量之比. 水溶液对该类体系中氢键作用具有明显影响.
氨基酸侧链; 鸟嘌呤; 胞嘧啶; 氢键; 自然键轨道电荷
蛋白质和DNA作为生命体中两种重要的物质, 前者参与了生命活动的所有进程, 如催化细胞中各类化学反应的酶, 多数具有催化功能的酶常作为改变DNA结构的工具[1,2], 后者具有携带和传递遗传信息的功能. 蛋白质-核酸的相互作用极大地影响着许多细胞过程, 如在细胞的生长和分裂过程中为了复制核酸序列, 蛋白质需与核酸相结合[3]. 可见, DNA分子功能的实现需要大量蛋白质分子参与反应[1], 而基因表达也需要特定的蛋白质与DNA结合[4].
氢键的概念已经提出将近一个世纪[5], 但由于实验的新发现和高水平理论计算的结果, 使氢键的概念不断发展[6]. 在许多科学领域, 氢键都扮演着重要的角色, 其对蛋白质-DNA复合物的性质有非常大的影响, 能决定它们的结构、 稳定性、 变异性和功能性等[7,8]. Jones等[9]和Shelkovsky[10]研究发现, 核酸碱基与蛋白质间的氢键作用在蛋白质-DNA的识别过程中起着重要作用. 由于生物分子体系的复杂性, 现阶段单纯使用实验手段难以确定单个核酸碱基与其它分子间的氢键相互作用. 而理论计算可精确求解相互作用信息、 分子间相互作用的强度、 单个分子的几何结构和能量等. Kumar和Govil[11]运用二阶微扰理论研究了核酸碱基及碱基对与氨基酸侧链的氢键作用, 发现与中性氨基酸侧链相比, 带电氨基酸侧链与碱基或碱基对形成的复合物更稳定. Mandel-Gutfreund等[12]分析了蛋白质-DNA复合物形成氢键的方案, 获得了不同类型蛋白质与DNA氢键的数量. Deepa等[7]应用从头算和密度泛函理论研究了AT和GC碱基对与氨基酸侧链的相互作用, 发现氨基酸侧链与碱基对间的氢键作用很强, 可使碱基对的结构发生改变. Wang等[13]应用密度泛函理论研究了槲皮素与尿嘧啶和胸腺嘧啶的氢键结合位点, 通过结合能确定了槲皮素不同位点与尿嘧啶和胸腺嘧啶不同位点结合能力的大小, 并用分子中原子(AIM)和自然键轨道(NBO)分析复合物, 发现轨道作用在氢键中起到十分重要的作用. Rachael等[14]应用M06-2X/6-31+G(d,p)研究了带电和中性氨基酸侧链与胞嘧啶之间π-π相互作用, 发现优势单体的相对取向与单体的组成与电荷具有紧密关系. Huo等[15]应用从头算和ABEEMσπ研究了N-甲基乙酰胺(NMA)与碱基相互作用, 发现NMA与DNA碱基相互作用的强度大小依次为鸟嘌呤>胸腺嘧啶>胞嘧啶>腺嘌呤.
以上计算均在气相下进行. 生物体内水的组分约占其重量的70%, 是生物体内化学反应的介质, 为必需的生化反应提供一个物理环境, 故水溶液会对生物体中氨基酸侧链与鸟嘌呤和胞嘧啶间氢键作用有一定的影响. 近30年来, 理论计算中对溶液体系的研究与日俱增, 随着计算机技术的不断发展, 应用溶液研究相关体系已成为可能[16]. 极化连续介质模型(PCM)将溶剂描述为极化的连续介质, 并将溶质放入溶剂间的空穴中, 能够用于模拟溶液体系. Takano和Houk[17]利用PCM计算了70种有机分子在水溶液中的溶剂化自由能, 并将计算值与实验值进行对比, 发现理论计算所得的自由能数值与实验值的平均绝对偏差为10.87 kJ/mol. Si和Li[18]用二阶Mφller-Plesset微扰理论和导体极化连续模型研究了碱基对在气相和水溶液下, 基态和最低三重激发态下氢键的情况, 结果表明, 基态时氢键的能量比最低三重激发态的能量高约4.18 kJ/mol. Paukku和Hill[19]在PCM模型下, 应用M06-2X/6-311++G(d,p)得到了DNA碱基和碱基对的氧化还原电势, 这种方法不仅避免了自洽反应场的迭代过程, 而且结果也与实验值相吻合[20]. Liu等[21]应用PCM模型研究了氧化鸟嘌呤与碱基的氢键作用, 结果表明, 氧化鸟嘌呤可以发生碱基错配.
为了模拟真实情况下复合物的情况, 本文采用连续介质模型模拟水溶液中氨基酸侧链与鸟嘌呤和胞嘧啶间的氢键作用. 研究了氨基酸侧链与G, C碱基和G∶C碱基对之间的氢键作用, 对所得复合物进行结构优化及频率、 结合能、 NBO电荷和二阶稳定化能计算. 研究结果为水溶液中多肽与碱基体系的极化力场构建和分子动力学模拟提供了参考, 同时也为蛋白质-DNA相互作用的研究奠定了理论基础.
1 研究方法与模型分子
为了研究氨基酸侧链(AASC)与碱基及碱基对间的氢键作用, 本文以DNA中常见的鸟嘌呤(G)和胞嘧啶(C)为例, 选取所有能与其作用的AASC作为模型分子. 图1给出了碱基G, C和碱基对(G∶C)与AASC类似物(AASC)可能形成氢键的位点. G, C和G∶C分别具有4个、 3个和6个位点可与AASC形成氢键复合物.
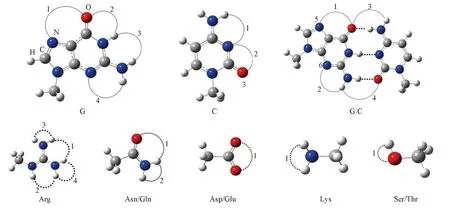
Fig.1 Sites of hydrogen bonds of guanine(G), cytosine(C), G∶C and amino acid side chain The sites of hydrogen bonds are labeled by number.
Czyznikowska等[22]对PDB数据库进行统计后指出, DNA与蛋白质识别体系中, 至少需形成两个氢键. 结果显示只有Arg, Asn, Asp, Gln, Glu, Lys, Ser和Thr 8种AASC可与G和C作用. 根据这些单体中氢键供体和受体的数目可知, 它们与G和C最多只能形成两个氢键. 图S1(见本文支持信息)给出了应用B3LYP/6-31+G(d,p)优化得到的29种复合物(其中AASC与G, C及G∶C形成的复合物分别有9种, 6种和14种)稳定构型, 复合物的命名方式按照碱基或碱基对与AASC形成氢键的位点进行, 如当G的1位点与Arg的1位点形成复合物时, 命名为G1∶Arg1, 其它复合物也按照此方法来命名. 本文中将G或C与AASC形成的复合物叫二体复合物, G∶C与AASC形成的复合物叫三体复合物.
AASC与G和C及G∶C碱基对复合物的结构优化和性质计算均在Gaussian 09软件包[23]下进行. 采用B3LYP/6-31+G(d,p)对所有的模型分子进行结构优化和频率计算, 得到稳定的构型; 应用MP2/aug-cc-pVDZ方法在基组重叠误差(BSSE)校正条件下计算体系能量, 进行自然键轨道(NBO)计算[24], 获得体系中各原子的电荷, 统计了碱基或碱基对与AASC间电荷转移数量. 通过二阶稳定化能可得到复合物中每一个氢键的能量, 从而可定性了解复合物的稳定性. 二阶稳定化能的计算如下:
(1)
式中:Ej-Ei为电子供体轨道(i)与电子受体轨道(j)之间能量差, Fij为Fock矩阵的矩阵元, qi为电子供体轨道上的电子占据数.
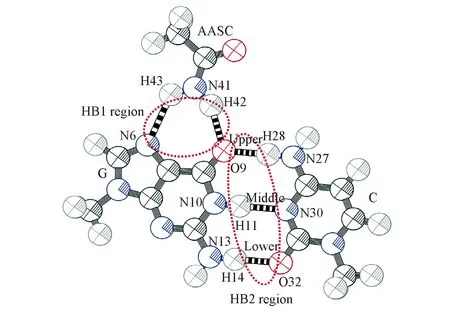
Fig.2 Snapshot of the first and second regions of hydrogen bond
目前还没有明确公式计算氢键能[25],AASC与G,C或G∶C之间主要靠氢键作用结合[26], 本文将结合能近似认为是氢键能(为方便讨论, 氢键能取绝对值). 将AASC与G,C或G∶C之间的区域定义为1区, G与C之间的区域定义为2区, 这2个区域的位置见图2, 它们的氢键键能分别用EHB1和EHB2表示:
(2)
(3)
式中,EHB1为AASC与G, C或G∶C之间的氢键键能, 可用来表征AASC与G, C或G∶C间氢键的强度; A代表G, C或G∶C, B代表AASC;EAB为二体或三体复合物的总能量;EHB2为将三体中AASC去除后G∶C的结合能, 它可用来表征AASC对G∶C之间相互作用影响的程度, 其中,EGC为G∶C的总能量,EG和EC分别为G和C的能量.
2 结果与讨论
2.1几何结构
通过计算获得了29种复合物的稳定结构. 图S1(见本文支持信息)给出了水溶液下氨基酸侧链与胞嘧啶和鸟嘌呤复合物的结构和受体原子与H之间的距离. 从图1可见, 氢键有N—H…N, N—H…O, O—H…N和O—H…O共4种类型. 表1给出了气相和水溶液中复合物的4类氢键氢长与键角. 由表1可知, 无论在气相还是水溶液中, O—H…O的键长比O—H…N的短, 而N—H…N的键长比N—H…O的长, 因此, G, C和G∶C与AASC之间的氢键存在如下规律:当O为供体原子时, O—H…O的键长小于O—H…N的; N为供体原子, N—H…N的键长大于N—H…O的. 图S2(A)(见本文支持信息)给出了气相与水溶液1区复合物的氢键键长, 水溶液中复合物的氢键键长要比气相的长, 表明水的存在使复合物与AASC之间的氢键作用减弱. 而G1∶Asn/Gln2的N6…H27N25, C2∶Ser/Thr1的N12…H22O20, GC2∶Asn/Gln1的N13H15…O40以及GC1∶Asn/Gln2和GC4∶Asn/Gln4的两个氢键中, 水溶液中的氢键键长均比气相的短, 可能由于它们在气相中趋向于形成单个氢键, 而由于水的存在, 它们更倾向于形成2个氢键.
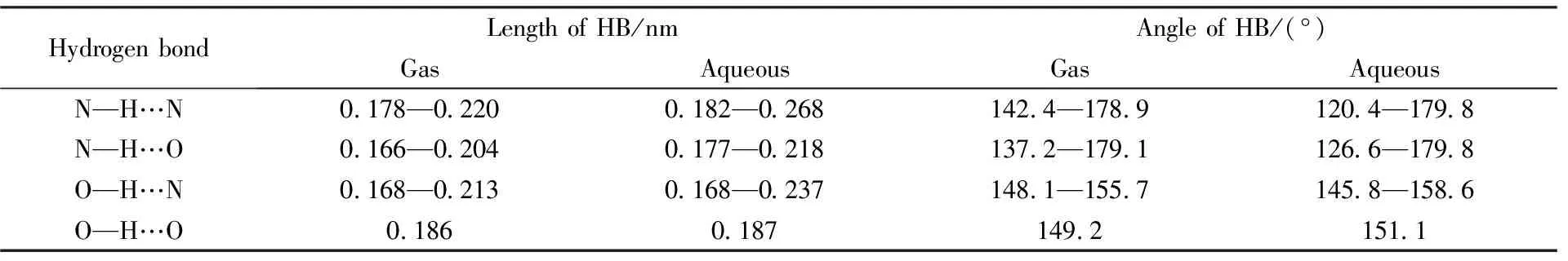
Table 1 Geometry structure of complexes in gas and aqueous solution within region 1
通过观察所有复合物的结构, 发现在正常情况下, G, C和G∶C所有原子皆在同一平面, 而对AASC与G, C或G∶C所形成的复合物在一定程度上偏离了平面, 尤其是形成氢键的部分, 偏离程度相对较大, 其中气相使结构的偏离程度比水溶液的大, 带电AASC使结构的偏离程度比中性的大.
为了考察AASC对G∶C间氢键的影响, 还计算了三体中G∶C间的氢键键长, 列于表2. N作为供体原子, N—H…N的氢键键长比N—H…O的要长. 2区含有的N—H…O(upper), N—H…N(middle)和N—H…O(lower) 3个氢键, 带电的Arg与G∶C的5,6位点作用的复合物, 气相和水溶液upper的氢键键长均比孤立的G∶C大, 两相的middle和lower比孤立的的氢键键长都短. 带电的Lys与G∶C的1位点作用的复合物, 氢键键长的变化规律与Arg相同. Ser/Thr1与G∶C形成的复合物与孤立的G∶C相比, upper氢键键长增大, middle缩小, lower增大. Asn/Gln形成的复合物与孤立的G∶C相比则没有明显的规律.
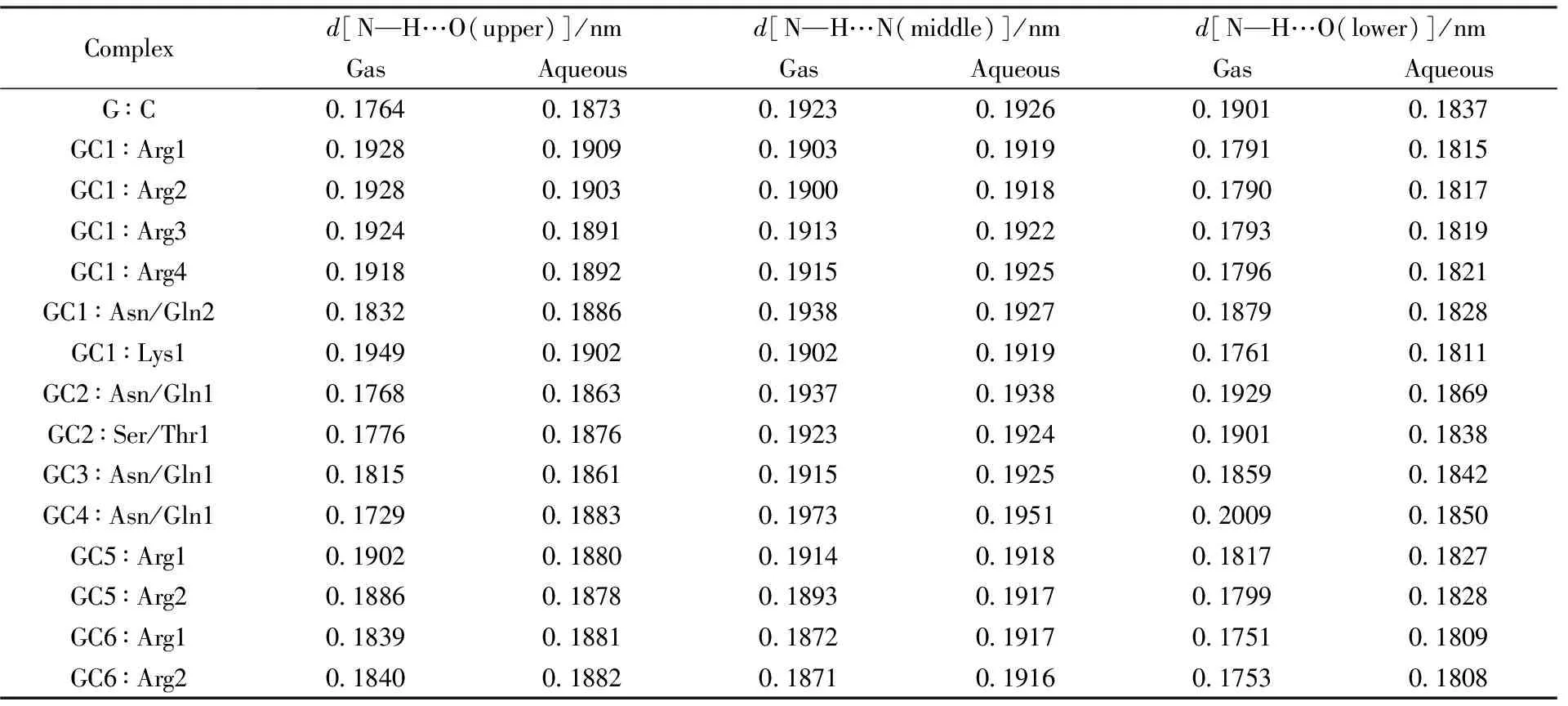
Table 2 Bond length of hydrogen bond of G∶C in gas and aqueous solution within region 2
2.2能量分析
通过氢键键能可知复合物的稳定性, 因此本文计算了二体和三体及G∶C之间的氢键键能. 图3给出了气相与水溶液中复合物的氢键键能. 由图3可知, 气相的氢键键能高于水溶液的氢键键能, 这是因为水溶液中的复合物受到水溶液的影响使氢键作用减弱, 键能降低. 虽然GC4∶Asn/Gln1气相下的氢键键能低于水溶液的, 但由于两者仅相差2.26 kJ/mol, 故可以忽略. 带电复合物在气相与水溶液中氢键键能的差值较大, 其中, 含Lys复合物气相和水溶液的EHB1差值为132.55~148.95 kJ/mol, 这是由于带1个正电荷的AASC将电荷仅仅分布在4个原子上, 电荷相对较集中, 故EHB1相应较大; 带有1个正电荷的Arg与G, C和G∶C形成的复合物两相EHB1的差值为55.31~103.26 kJ/mol, 这是由于Arg的9个原子形成大π键, 电荷分布比较均匀, 故与Lys的相比,EHB1相对较小; 在Arg与G, C和G∶C的复合物中, 在两相中EHB1顺序为GC1>GC5>G1>C3>C1>GC6. 当G∶C的6位点与Arg结合时, 两相EHB1差值为55.31~56.44 kJ/mol, 如图S1(C)(见本文支持信息)所示, 由于G∶C的6位点与Arg的1和2位点间的氢键作用时, 所形成的氢键平面与G∶C所在平面有很大偏离, 使G∶C的6位点与Arg的1和2位点结合较弱. 中性复合物在气相和水溶液中EHB1差值较小, 为0.17~24.94 kJ/mol, 与带电的相比, GC4∶Asn/Gln1两相间差值很小, 为-2.26 kJ/mol, 这说明水溶液对带电复合物的EHB1影响较大, 而对中性复合物的影响较小, 水溶液可以减弱碱基或碱基对与氨基酸侧链之间的相互作用.

Fig.3 Hydrogen bond energies of complexes(A) EHB1 of the complexes in gas and aqueous solution. (B) EHB2 of G∶C of complexes in gas and aqueous solution. a. G1∶Arg1; b. G1∶Arg2; c. G1∶Lys1; d. G3∶Asn/Glu1; e. C1∶Arg1; f. C1∶Arg2; g. C3∶Arg1; h. C3∶Arg2; i. GC1∶Arg1; j. GC1∶Arg2; k. GC1∶Arg3; l. GC1∶Arg4; m. GC1∶Lys1; n. GC5∶Arg1; o. GC5∶Arg2; p. GC6∶Arg1; q. GC6∶Arg2; r. G1∶Asn/Gln2; s. G2∶Asn/Gln1; t. G2∶Ser/Thr1; u. G4∶Asn/Gln1; v. G4∶Asn/thr1; w. C2∶Ser/Thr1; x. C2∶Asn/Gln1; y. GC1∶Asn/Gln2; z. GC2∶Asn/Gln1; a1. GC2∶Ser/Thr1; a2. GC3∶Asn/Gln1; a3. GC4∶Asn/Gln1. (B) a. G∶C; b. GC1∶Arg1; c. GC1∶Arg2; d. GC1∶Arg3; e. GC1∶Arg4; f. GC1∶Lys1; g. GC5∶Arg1; h. GC5∶Arg2; i. GC6∶Arg1; j. GC6∶Arg2; k. GC1∶Asn/Gln2; l. GC2∶Asn/Gln1; m. GC2∶Ser/Thr1; n. GC3∶Asn/Gln1; o. GC4∶Asn/Gln1.
表S1(见本文支持信息)列出了电荷转移量与EHB1. 对于带电复合物, 气相的电荷转移量大于水溶液的, 而对于中性复合物, 气相的电荷转移量小于水溶液的. 对于气相复合物, 电荷转移量越大,EHB1越大, AASC与G, C及G∶C相互作用越强. 对于水溶液的复合物, 电荷转移量越大,EHB1也越大. 通过对AASC相同位点与碱基和碱基对相同位点形成复合物的对比, 发现带电三体的EHB1比二体的大, 而中性则相反, G∶C与带电AASC作用, 由于共轭π键的作用, G∶C总体电荷向AASC转移, 而中性AASC与G或C之间本身作用较弱, 当另一个碱基与G或C作用时, 使碱基向中性AASC转移的电荷量更少了.
对于Arg和Asn/Gln两种AASC, 其氢键复合物可以形成多种环数, 如果将所形成的氢键连接起来, 将包含氢键的原子形成一个闭合环, 其中对于带电的Arg, 无论是气相还是水溶液, 其八元环和九元环的EHB1均较大, 气相中为144.72~170.08 kJ/mol, 水溶液中为44.85~46.53 kJ/mol. 六元环和七元环次之, 气相中为101.29~152.46 kJ/mol, 水溶液中为44.85~52.09 kJ/mol. 而对于中性的Asn/Gln, 无论气相还是水溶液, 八元环的氢键键能大于七元环, 其中八元环氢键键能在气相中为32.05~78.32 kJ/mol, 水溶液中为34.10~53.39 kJ/mol, 而七元环氢键键能在气相中为38.16~41.97 kJ/mol, 水溶液中为24.60~33.68 kJ/mol, 这可能是由于环数大, 形成的氢键张力小一些, 结合能力更强一些.
为了研究AASC对G∶C之间氢键作用的影响, 图3(B)给出了三体复合物中G∶C之间的EHB2. 从图3(B)可以看出, 气相复合物的EHB2大于水溶液的, 两者相差15.02~24.09 kJ/mol. 孤立G∶C在气相和水溶液中的EHB2分别为108.32和81.21 kJ/mol. 与孤立G∶C相比, 无论是气相还是水溶液及AASC带电与否对G∶C之间EHB2的影响均不大, 气相中减小0.96~9.04 kJ/mol, 水溶液中减小0~5.19 kJ/mol. 当AASC与G∶C相互作用时, G∶C间的氢键键长稍有拉长, 使EHB2稍微减小. 在水溶液中, 对于AASC和G∶C, 除了它们之间的相互作用, 还有与水溶液中水分子的相互作用, 从而使GC∶AASC之间及G∶C之间的相互作用减弱.
2.3自然键轨道分析
为了探究氢键的相关性质, 本文还对复合物做了NBO电荷分析. 图4给出了水溶液中带电GC∶Arg1与中性GC2∶Ser/Thr1复合物的氢键原子所带的NBO电荷. 在气相和水溶液中, 在碱基或碱基对与带电氨基酸侧链形成的复合物中, 由G, C或G∶C转移到AASC的电荷要多于G, C或G∶C与中性AASC形成的复合物, 其中带电AASC与G, C或G∶C相互作用后, 电荷转移量为0.06~0.10 e. 大部分电荷转移量接近0.08 e, 说明带电AASC与G, C或G∶C之间发生了电荷的转移, 它们之间氢键作用较强, 但Arg的某些位点与G, C或G∶C某些位点结合时, 电荷小于0.06 e, 这也说明G, C或G∶C对AASC具有选择性; 而中性AASC与G, C或G∶C相互作用后, 电荷转移量的范围为0~0.03 e, 因此, 中性AASC与G, C或G∶C结合时, 电荷转移可以忽略. 未形成氢键的原子在气相和水溶液中, 电荷变化都不大; G∶C复合物中G∶C之间形成氢键的原子的电荷变化不大; 除Asn/Gln的1位点外, 其余碱基或碱基对与AASC形成复合物时, 电荷转移的方向是由G, C或G∶C向AASC.
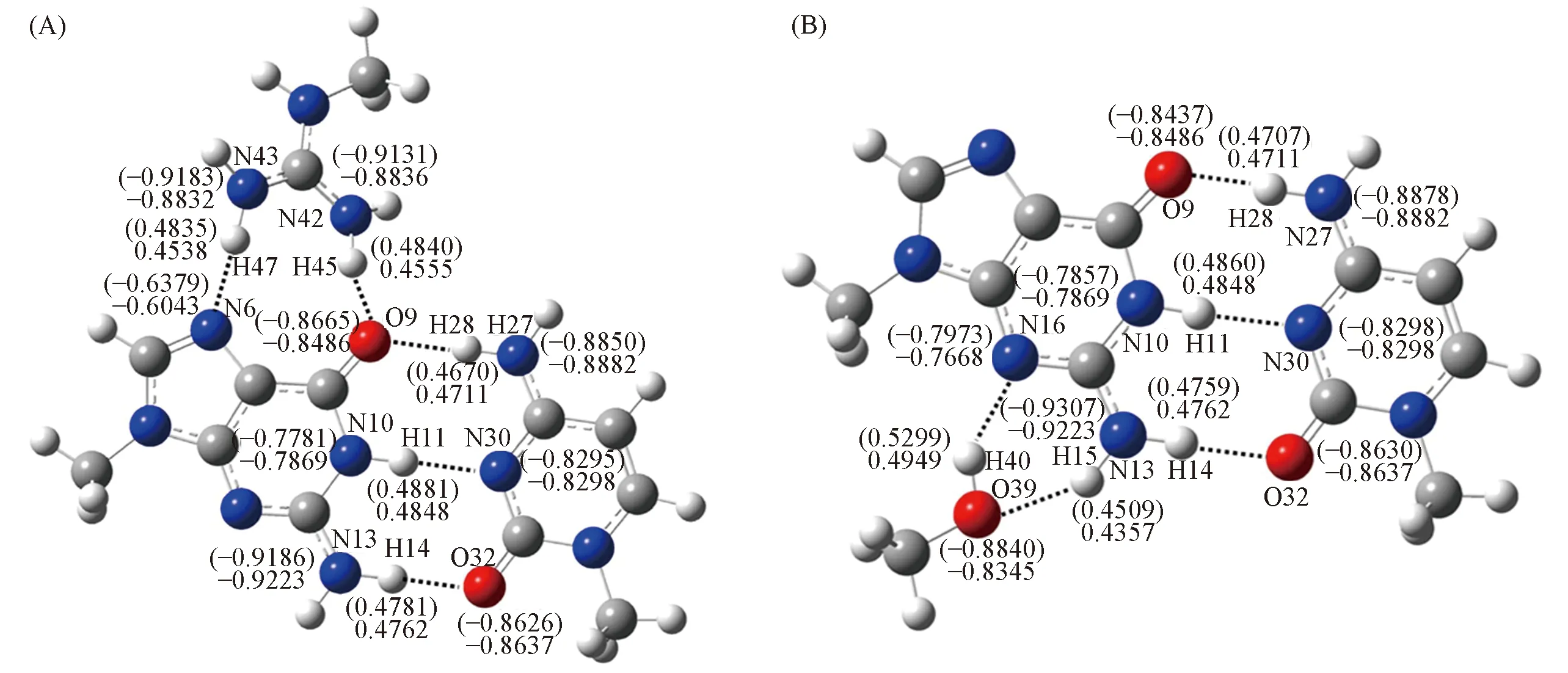
Fig.4 Atomic charges of hydrogen bonds of GC1∶Arg1(A) and GC2∶Ser/Thr1(B) complexes in aqueous solutionValue in parenthesis denotes the atomic charges(e) of forming the triple-body complexes; values without parenthesis are those of G, C and AASC.
此外, 为了研究AASC与G, C或G∶C之间每一个氢键的强度, 还统计了所有复合物在气相和水溶液下的二阶稳定化能. 图S3(A)(见本文支持信息)给出了所有复合物1区的二阶稳定化能. 从图S3(A)可以看出, 带电AASC与碱基或碱基对间复合物氢键的二阶稳定化能比中性的大; C3∶Arg2, GC5∶Arg1, GC5∶Arg2, GC6∶Arg1和GC6∶Arg2二阶稳定化能小于G, C或G∶C与中性AASC的, 这是由于AASC的两个供体H同时与一个受体原子形成氢键导致的. 复合物的1区中, 气相的二阶稳定化能大于水溶液的, 但Asn/Gln与碱基或碱基对形成的复合物, 气相的二阶稳定化能小于水溶液的, 虽然Asn/Gln不符合此规律, 但其结果却与EHB1的结论一致, 这也说明Asn/Gln与其它AASC相比, 其具有特殊性. 在气相和水溶液中, 带电的二体复合物, N—H…N或O—H…O氢键的二阶稳定化能小于N—H…O或O—H…N的, 而中性的二体则相反; 带电三体复合物的结果正好与二体复合物中的相反, N—H…N或O—H…O氢键的二阶稳定化能大于N—H…O或O—H…N的. 中性三体复合物中, N—H…O或O—H…N氢键的二阶稳定化能大于N—H…N或O—H…O的. 从表S1可知, 随着氢键键长变大, 二阶稳定化能却变小, 可见二阶稳定化能与氢键键长成反比, 与电荷转移量成正比, 且气相与水溶液的电荷量的比约等于两相二阶稳定化能的比, 而Asn/Gln1和Ser/Thr1与G, C和G∶C的复合物, 不符合这一结论.
图S3(B)和表S2(见本文支持信息)给出了气相与水溶液中复合物2区的二阶稳定化能. 通过分析可知, 对于带电和中性的复合物, 水溶液中2区二阶稳定化能大于气相的, 这是因为在水溶液中, G∶C与AASC之间的相互作用减弱, 在PCM模型中, 复合物与水分子之间没有电荷转移, 故G与C之间的电荷转移增加了, 因此, G∶C之间的相互作用增强了. 与孤立G∶C相比, 气相和水溶液中, 除了6位点, 2区的二阶稳定化能都变小, 即AASC使G∶C之间结合能力减小, 这是由于与孤立G∶C相比, 在水溶液中, AASC影响了G∶C间的相互作用, 因此, 复合物中G∶C间相互作用小于孤立G∶C的. 在气相中, 复合物中G∶C与孤立G∶C相比, 二阶稳定化能减小约14.10 kJ/mol, 而对于G∶C的6位点, 其与Arg作用后, G与C之间结合能力反而增加了约43.72 kJ/mol, 这也充分说明了AASC对不同G∶C位点影响不同. 水溶液中, 二阶稳定化能减小约6.49 kJ/mol, 但水溶液中AASC使G∶C之间结合能力增加的复合物也增多, 但仅数值增加约5.44 kJ/mol. 分析2区中二阶稳定化能可知, 带电三体G∶C中, 气相与水溶液中的lower型氢键键能比孤立G∶C中的平均增加约38.24和6.95 kJ/mol, middle的氢键键能平均增加约14.02和3.26 kJ/mol, 而upper的氢键键能平均减小约55.02和9.20 kJ/mol. 中性三体G∶C中, 无论气相还是水溶液, 变化趋势是一样的, 但3个氢键变化则无规律.
3 结 论
应用B3LYP/6-31+G(d,p)方法进行优化, 获得了气相与水溶液下的29种氨基酸侧链(AASC)与G, C以及G∶C间氢键复合物的稳定结构. 使用MP2/aug-cc-pVDZ计算这些复合物的结合能, NBO电荷和二阶稳定化能. 结果表明, 带电AASC与G, C以及G∶C形成的复合物, 气相和水溶液中氢键键能差为50.63~146.48 kJ/mol, 中性的为0.17~24.94 kJ/mol. 带电和中性AASC与G, C或G∶C的复合物, 电荷转移量的范围分别为0.06~0.10 e和0~0.03 e, 带电AASC与G, C或G∶C间电荷转移量大于中性的. 电荷的转移量与氢键键能成正比, 电荷转移量越多, 氢键键能越大. 二阶稳定化能与氢键键长成反比, 与电荷转移量成正比, 且气相与水溶液二阶稳定化能之比约为两相下电荷转移量之比. 水溶液对碱基或碱基对与AASC之间的氢键影响较大.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20160270.
[1]Malone T., Blumenthal R. M., Cheng X.,J.Mol.Biol., 1995, 253(4), 618—632
[2]Xin L., Zhou C., Yang Z. Q., Liu D. S.,Small, 2013, 9(18), 3088—3091
[3]Katie A. W., Jennifer L. K.,NucleicAcidsRes., 2014, 42(10), 6726—6741
[4]Wells R. A., Kellie J. L., Wetmore S. D.,J.Phys.Chem.B, 2013, 117(36), 10462—10474
[5]Latimer W. M., Rodebush W. H.,J.Am.Chem.Soc., 1920, 42(7), 1419—1433
[6]Buckingham A. D., Del Bene J. E., McDowell S. A. C.,Chem.Phys.Lett., 2008, 463(1), 1—10
[7]Deepa P., Kolandaivel P., Senthilkumar K.,Mol.Phys., 2011, 109(16), 1995—2008
[8]Qiu Z. M., Xia Y. M., Wang H. J., Diao K. S.,Struct.Chem., 2010, 1(21), 99—105
[9]Jones S., Heyningen P., Berman H. M., Thornton J. M.,J.Mol.Biol., 1999, 5(287), 877—896
[10]Shelkovsky V. S.,Eur.Phys.J.D, 2002, 20(3), 421—430
[11]Kumar N. V., Govil G.,Biopolymers, 1984, 23(10), 1995—2008
[12]Mandel-Gutfreund Y., Ora S., Hanah M.,J.Mol.Bio., 1995, 253(2), 370—382
[13]Wang C. S., Liu P., Yu N.,ActaPhys.Chim.Sin., 2013, 29(6), 1173—1182(王长生, 刘朋, 于楠. 物理化学学报, 2013, 29(6), 1173—1182)
[14]Rachael A. W., Kellie J. L., Wetmore S. D.,J.Phys.Chem.B, 2013, 117(36), 10462—10474
[15]Huo H. J., Zhao D. X., Yang Z. Z.,Chem.J.ChineseUniversities, 2011, 32(12), 2877—2884(霍红洁, 赵东霞, 杨忠志. 高等学校化学学报, 2011, 32(12), 2877—2884)
[16]Jacopo T., Benedetta M., Roberto C.,Chem.Rev., 2005, 105(8), 2999—3093
[17]Takano Y., Houk K. N.,J.Chem.Theory.Comput., 2005, 1(1), 70—77
[18]Si D., Li H.,J.Chem.Phys., 2011, 135(14), 144107
[19]Paukku Y., Hill G.,J.Phys.Chem.A, 2011, 115(18), 4804—4810
[20]Ryoichi F., Masahiro E., Roberto C.,J.Chem.Phys., 2014, 140(6), 064114
[21]Liu C., Zhang Q. H., Gong L. D., Lu L. N., Yang Z. Z.,Chem.J.ChineseUniversities, 2014, 35(12), 2645—2653(刘翠, 张千慧, 宫利东, 卢丽男, 杨忠志. 高等学校化学学报, 2014, 35(12), 2645—2653)
[22]Czyznikowska Z., Lipkowski P., Góra R. W., Zalesny R., Cheng A. C.,J.Phys.Chem.B, 2009, 113(33), 11511—11520
[23]Frisch M. J., Trucks G. W., Schlegel H. B., Scuseria G. E., Robb M. A., Cheeseman J. R., Scalmani G., Barone V., Mennucci B., Petersson G. A., Nakatsuji H., Caricato M., Li X., Hratchian H. P., Izmaylov A. F., Bloino J., Zheng G., Sonnenberg J. L., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Montgomery J. A. Jr., Peralta J. E., Ogliaro F., Bearpark M., Heyd J. J., Brothers E., Kudin K. N., Staroverov V. N., Kobayashi R., Normand J., Raghavachari K., Rendell A., Burant J. C., Iyengar S. S., Tomasi J., Cossi M., Rega N., Millam J. M., Klene M., Knox J. E., Cross J. B., Bakken V., Adamo C., Jaramillo J., Gomperts R., Stratmann R. E., Yazyev O., Austin A. J., Cammi R., Pomelli C., Ochterski J. W., Martin R. L., Morokuma K., Zakrzewski V. G., Voth G. A., Salvador P., Dannenberg J. J., Dapprich S., Daniels A. D., Farkas Ö., Foresman J. B., Ortiz J. V., Cioslowski J., Fox D. J.,Gaussian09,RevisionD.01, Gaussian Inc., Wallingford CT, 2009
[24]Glendening E. D., Reed A. E., Carpenter J. E., Weinhold F.,NBOVersion3.1Gaussian09,RevisionD.01, Gaussian Inc., Wallingford CT, 2009
[25]Liu C., Zhao D. X., Yang Z. Z.,J.Comput.Chem., 2012, 33(4), 379—390
[26]Seeman N. C., Rosenberg J. M., Rich A.,P.Natl.Acad.Sci., 1976, 73(3), 804—808
(Ed.:Y, Z, S)
† Supported by the Key Project of National Natural Science Foundation of China(Nos.21133005, 21473083), the General Project of Education Department of Liaoning Province, China(No.L2014426) and the Laboratory Opening Program of Liaoning Normal University, China(No.cx20160111).
Theoretical Studies on the Effect of Amino Acid Side Chains on Hydrogen Bonding for G∶C in Aqueous Solution†
ZHAO Jian, DU Jing, LIU Shuo, YANG Zhongzhi, ZHAO Dongxia*, LIU Cui*
(School of Chemistry and Chemical Engineering, Liaoning Normal University, Dalian 116029, China)
Quantum chemical method was employed to study the hydrogen bond interaction between the amino acid side chain(AASC) analogues and G, C bases, as well as GC base pair in gas and aqueous solution. B3LYP/6-31+G(d,p) was carried out to optimize the complex structures. Moreover, MP2/aug-cc-pVDZ was performed to calculate the energies, natural bond orbital(NBO) charges and second order stabilization energies of these complexes. It demonstrates that hydrogen bond interaction between AASC analogues and bases or base pair can be dramatically weakened in aqueous solution, compared with in gas. For the complexes of AASC analogues with positive charge along with the base or base pair, the difference of their hydrogen bond energies between in gas and aqueous solution is 50.63—146.48 kJ/mol, whereas 0.17—24.94 kJ/mol for neutral AASC analogues. The value of charge transfer is proportional to the hydrogen bonding energy, the more the charge transfer, the more stable the complex. The second-order stabilization energies are inverse proportional to the hydrogen bonds, and the second-order stabilization energies of gas divide ones of aqueous solution is approximately to the value of charge transfer in two phases. It is explicitly shown that aqueous solution has an extremely large impact on hydrogen bonding in these systems.
Amino acid side chain; Guanine; Cytosine; Hydrogen bond; Natural bond orbital(NBO) charge
10.7503/cjcu20160270
2016-04-22. 网络出版日期:2016-08-23.
国家自然科学基金重点项目(批准号:21133005, 21473083)、 辽宁省教育厅一般项目(批准号:L2014426)和辽宁师范大学实验室开放项目(批准号:cx20160111)资助.
O641
A
联系人简介:赵东霞, 女, 博士, 教授, 博士生导师, 主要从事理论与计算化学研究. E-mail:zhaodxchem@lnnu.edu.cn
刘翠, 女, 博士, 讲师, 主要从事理论与计算化学研究. E-mail:liuc@lnnu.edu.cn
