溶剂对镍(Ⅱ)金属有机骨架结构的影响
2016-11-03高丽娟王圣燕井淑波
高丽娟, 王 莉, 王圣燕, 井淑波
(吉林大学化学学院, 长春 130012)
溶剂对镍(Ⅱ)金属有机骨架结构的影响
高丽娟, 王莉, 王圣燕, 井淑波
(吉林大学化学学院, 长春 130012)
通过乙酸镍和4-咪唑-1-基-苯甲酸(HL)在不同溶剂热条件下合成了3个新型金属有机骨架化合物[Ni(L)2]n·DMF(1), Ni(H2O)2(L)2(2)和Ni(L)2(CH3OH)2(3). 化合物1是用N,N-二甲基甲酰胺(DMF)作为溶剂合成的具有菱形孔道的三维骨架化合物; 化合物2是在DMF/H2O(体积比4∶1)中合成的水作为终端配体参与配位的二维层状化合物, 并通过层与层之间的氢键作用构筑形成了三维超分子结构; 当溶剂为甲醇时, 得到了二维层状化合物3, 且甲醇作为终端配体参与配位. 磁学和电化学性质研究结果表明, 化合物1~3中相邻镍离子之间存在反铁磁相互作用; 在一定的电势范围内出现一对明显的Ni(Ⅱ)/Ni(Ⅲ)氧化还原峰, 表明化合物1~3是潜在的磁性材料或电催化剂材料.
金属有机骨架; 磁性; 循环伏安法; 溶剂效应
近几年, 过渡金属与有机配体构筑的金属有机骨架的研究已经得到了广泛的发展[1~3], 配体的结构和配位模式的多样性及金属种类和配位环境的不同, 使金属有机骨架的结构多种多样[4~6]. 在合成结构新颖和性能优异的金属有机骨架化合物时有机配体的选择很关键, 常见的有机配体有羧酸类配体及含氮杂环类配体[7,8]. 其中, 氮杂环配体因含有易与金属配位的N和O原子, 展现出多样的配位模式, 从而可以构筑许多结构新颖的金属有机骨架化合物[9,10]. 溶剂在大部分金属有机骨架的合成中也具有重要作用[11,12], 不同的溶剂可以诱导合成结构甚至性质多样的金属有机骨架[13,14]. 溶剂在金属有机骨架的合成中可以作为配体参与配位, 也可以作为客体分子存在于骨架的孔道中, 还可以同时扮演配体与客体的角色[15,16]. 此外, 溶剂还可以作为结构导向剂, 诱导形成不同结构的金属有机骨架[17~19].
金属有机骨架在磁学、 荧光、 电化学和催化等领域展现了巨大的潜在应用价值[20~24], 尤其在磁学性质方面的研究倍受人们的关注[25,26]. 在金属有机骨架结构中, 磁性中心之间通过有机配体连接在一起, 并且通过有机配体来传递作用, 从而使分子磁体表现出磁性. 此外, 当磁性中心和桥连配体相同, 但配体的配位模式不同时, 它们表现出来的磁学性质也会不同[27]. 人们在金属有机骨架的电化学性质方面也开展了很多研究[28]. 具有明显的氧化还原峰的物质会成为潜在的氧化还原反应的电催化剂材料[29].
本文选择4-咪唑-1-基-苯甲酸(HL)作为有机配体, 乙酸镍作为金属源,N,N-二甲基甲酰胺(DMF)、 DMF/H2O和甲醇作为溶剂, 合成了3种具有不同结构的镍金属有机骨架化合物[Ni(L)2]n·DMF(1), Ni(H2O)2(L)2(2)和Ni(L)2(CH3OH)2(3). 在化合物1~3中, 相邻的镍离子之间存在反铁磁相互作用, 循环伏安测得晶体在特定的电势范围内具有一对明显的氧化还原峰.
1 实验部分
1.1试剂与仪器
四水合乙酸镍、 氟化铵、N,N-二甲基甲酰胺和甲醇均为分析纯, 购于国药集团化学试剂有限公司; 4-咪唑-1-基-苯甲酸(分析纯)购于济南恒化科技有限公司.
Bruker Smart CCD 1000 X射线单晶衍射仪(德国Bruker公司); Shimadzu XRD-6000 X射线粉末衍射仪(XRD, 日本Shimadzu公司); Nicolet Impact 410傅里叶变换红外光谱仪(FTIR, 美国Nicolet公司); Perkin-Elmer TG-7热重分析仪(TG, 美国TA公司); Perkin-Elmer 2400元素分析仪(美国Perkin Elmer有限责任公司); MPMS-XLT磁性测量系统(美国Quantum Design公司); CHI 660B电化学工作站(北京华科普天科技有限责任公司).
1.2实验过程
1.2.1化合物1~3的合成[Ni(L)2]n·DMF(1):将Ni(OAc)2·4H2O(0.05 g, 0.02 mmol)、 HL(0.019 g, 0.01 mmol)、 NH4F(0.013 g, 0.35 mmol)和DMF(5 mL)放入23 mL带有聚四氟乙烯釜衬的不锈钢反应釜中, 在120 ℃ 烘箱中反应3 d. 取出, 冷却至室温, 有绿色块状晶体析出, 用DMF洗涤, 干燥后称重, 产率为80%[以Ni(Ⅱ)为基准]. 元素分析实测值(%, NiC23N5O5H21计算值):C 54.20(54.58), H 4.18(4.15), N 13.64(13.84).
Ni(H2O)2(L)2(2):将Ni(OAc)2·4H2O(0.05 g, 0.02 mmol)、 HL(0.019 g, 0.01 mmol)、 NH4F(0.013 g, 0.35 mmol), DMF(4 mL)和H2O(1 mL)放入23 mL带有聚四氟乙烯釜衬的不锈钢反应釜中, 在120 ℃烘箱中反应3 d. 取出, 冷却至室温, 有蓝色块状晶体析出, 用水洗涤, 干燥后称重, 产率为65%[以Ni(Ⅱ)为基准]. 元素分析实测值(%, NiC20N4O6H18计算值):C 50.32(51.17), H 3.90(3.84), N 11.60(11.94).
Ni(L)2(CH3OH)2(3):将Ni(OAc)2·4H2O(0.05 g, 0.02 mmol), HL(0.019 g, 0.01 mmol)和CH3OH(5 mL)放入23 mL带有聚四氟乙烯釜衬的不锈钢反应釜中, 在120 ℃烘箱中反应2 d. 取出, 冷却至室温, 有浅绿色块状晶体析出, 用甲醇洗涤, 干燥后称重, 产率为75%[以Ni(Ⅱ)为基准]. 元素分析实测值(%, NiC22N4O6H22计算值):C 53.20(53.10), H 4.55(4.43), N 11.12(11.26).
1.2.2晶体结构测定化合物1~3的晶体数据于室温下在Bruker Smart CCD 1000 X射线单晶衍射仪上收集, 以MoKα(λ=0.071073 nm)射线作为入射光源. 晶体数据采用SHELXTL-97软件处理, 由原子各向异性确定非氢原子, 几何加氢确定配体中的氢原子. 化合物1~3的结构精修参数和晶体学数据见表 1.
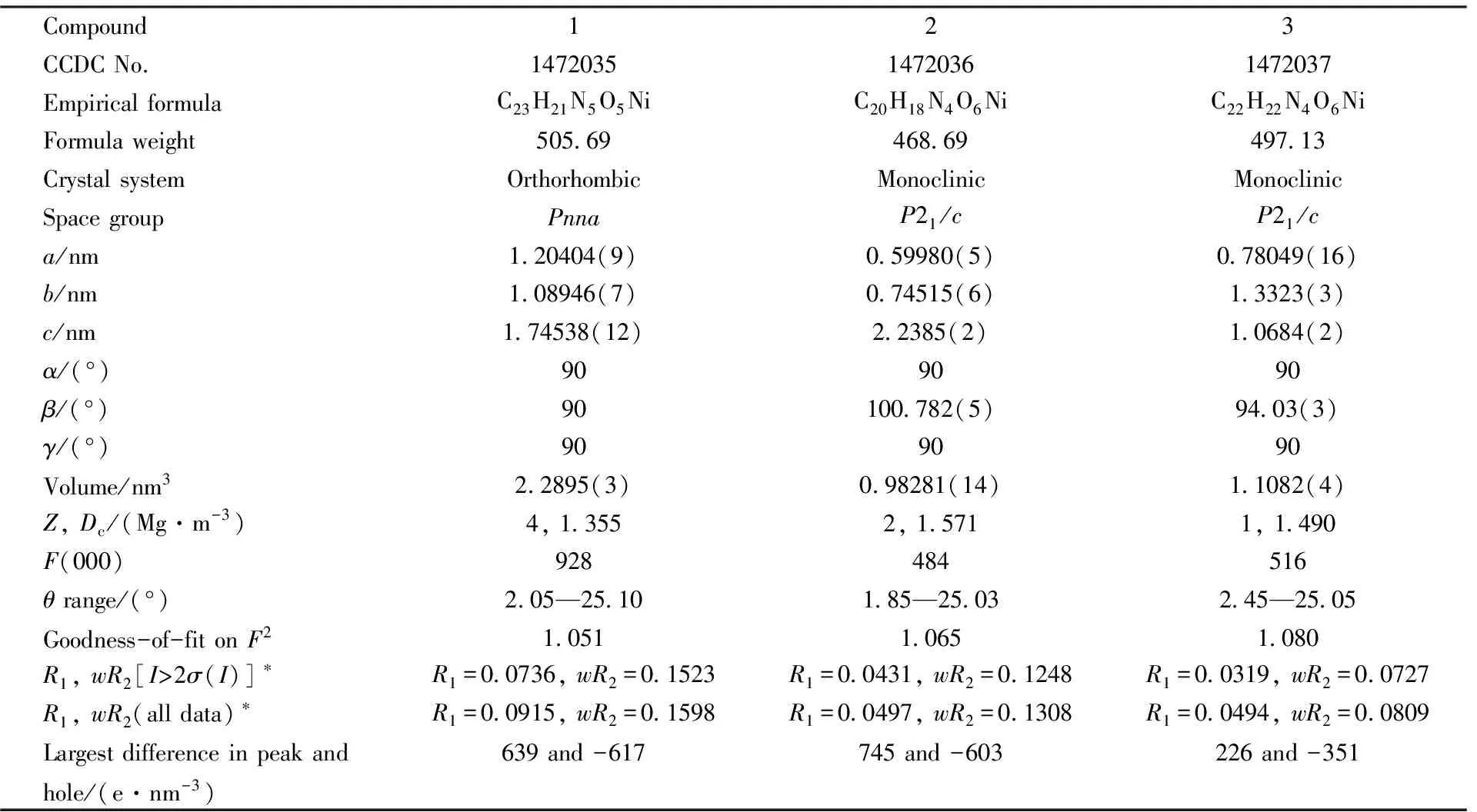
Table 1 Crystal data and structure refinement for compounds 1—3
*R1= ∑||Fo| - |Fc||/∑|Fo|;wR2= {∑[w(Fo2-Fc2)2]/∑[w(Fo2)2]}1/2.
1.2.3电化学分析将0.004 g化合物1, 2或3样品与0.008 g石墨粉混合后在玛瑙研钵中研磨均匀. 向混合物中加入石蜡搅拌均匀成糊状, 装入工作电极, 压实. 以1 mol/L硫酸为电解质, 在100 mV/s的扫描速度下测试化合物1~3的循环伏安(CV)曲线.
2 结果与讨论
2.1溶剂的影响
在合成过程中发现, 溶剂对化合物1~3的合成影响较大. 以DMF为溶剂时, 得到绿色晶体1, DMF作为客体分子存在于一维菱形孔道中; 当溶剂为DMF/H2O(体积比4∶1)时, 得到蓝色晶体2, 其中, H2O作为端基配体占据了六配位的Ni(Ⅱ)中心的2个配位点; 而以甲醇为溶剂时, 得到浅绿色晶体3, 甲醇分子作为端基配体与Ni(Ⅱ)中心配位.
2.2化合物的晶体结构
2.2.1化合物1的晶体结构化合物1属于正交晶系,Pnna空间群. 如图1(A)所示, 其不对称结构单元中包含1个Ni(Ⅱ)离子、 2个L-配体和1个客体DMF分子. Ni(Ⅱ)中心采取六配位的变形八面体构型, 其中4个O来自于2个配体中以螯合形式配位的羧基, 2个N来自于2个配体中的咪唑环[配体的配位模式见图1(B)]. Ni—N和Ni—O键长分别为0.2033(4)和0. 2087(3)~0.2161(3) nm, N—Ni—N键角为93.4(3)°, N—Ni—O键角为90.33(16)°~167.63(15)°, O—Ni—O键角为62.21(13)°~147.05(17)°, 与已报道的Ni化合物的键长和键角相似[30]. 化合物1是一个3D的结构, 如图1(C)所示, 沿着y轴方向看, 化合物1呈现出1D的菱形开放孔道. 将桥连的4-咪唑-1-基-苯甲酸配体看作是两节点的棒状配体, 金属中心看作为四节点, 做出了化合物1的简化图, 通过TOPOs 4.0[31]计算, 化合物1为四重穿插的Diamond网络, 如图1(D)所示.

Fig.1 Coordination environment of Ni(Ⅱ) in compound 1(A), coordination mode of ligand(B), stick view of 3D structure of compound 1 along the y-axis, showing the diamond windows in the xz plane(C) and topology of the four-fold interpenetration in compound 1(D) The hydrogen atoms are omitted for clarity.
2.2.2化合物2的晶体结构化合物2属于单斜晶系,P21/c空间群. 图2(A)为化合物2中Ni(Ⅱ)的配位环境图, 在其不对称结构单元中包含1个Ni(Ⅱ)离子、 2个L-配体和2个H2O分子. 每个Ni中心离子以六配位的模式形成了一个扭曲的八面体构型, 其中赤道轴方向的2个O来自于2个配体的羧酸基团, 每个配体的羧酸基团与金属镍离子单齿配位, 2个N来自于2个配体的咪唑环[配体的配位模式见图2(B)], 纵向的2个O来自于2个水分子. Ni—N和Ni—O键长分别为0.2091(3) nm和0.2084(2)~0.2096(3) nm, N—Ni—N键角为180.00(12)°, N—Ni—O键角为88.67(12)°~91.33(12)°, O—Ni—O键角为86.18(11)°~180.00(14)°, 与已报道的Ni化合物的键长和键角相似[30]. 如图2(C), 化合物2中存在绕着晶体学21螺旋轴无限增长的左右手螺旋链. 相邻的螺旋链通过共用金属离子作为顶点连接形成二维层, 由于层和层之间存在氢键, 最终形成了3D超分子结构[图2(D), (F)]. TOPOs 4.0[31]计算结果表明, 化合物2为Shubnikov tetragonal plane net(正方平面网格), Schläfli符号为{44;62}, 如图2(E)所示.

Fig.2 Coordination environment of Ni(Ⅱ) in compound 2(A), coordination mode of ligand(B), view of the left- and right- handed helical chains(C), view of the 2D layer structure constructed by the 1D helical chain(D), view of the topological structure of the 2D layer(E) and view of the 3D supramolecular structure constructed by the 2D layer via hydrogen-bond interactions(F) The hydrogen atoms are omitted for clarity.

Fig.3 Coordination environment of Ni(Ⅱ) in compound 3(A), coordination mode of ligand(B), view of the left- and right-handed helical chains(C) and view of the 2D layer structure constructed by the 1D helical chain(D)
2.2.3化合物3的晶体结构化合物3属于单斜晶系,P21/c空间群. 如图3(A)所示, 化合物3的不对称结构单元中包含1个Ni(Ⅱ)离子, 2个L-配体和2个CH3OH分子. 每个Ni中心离子以六配位的模式形成了1个扭曲的八面体构型, 其中赤道轴方向的2个O来自于2个配体的羧酸基团, 每个配体的羧酸基团与金属镍离子单齿配位, 2个N来自于2个配体的咪唑环[配体的配位模式见图3(B)], 纵向的2个O来自于2个甲醇基团. Ni—N和Ni—O键长分别为0.2078(2)和0.20451(18)~0.2094(2) nm, N—Ni—N键角为180.00°, N—Ni—O键角为89.16(8)°~91.77(8)°, O—Ni—O键角为90.00(8)°~180.00°, 与已报道的Ni化合物的键长和键角相似[30]. 如图3(C)和(D)所示, 化合物3是1个二维层状结构, 其中存在绕着晶体学21螺旋轴无限增长的左右手螺旋链, 相邻的螺旋链通过共用金属中心为顶点连接形成二维层. 图4为化合物3的简化图, 表示的是化合物的1个2D层. 通过TOPOs 4.0[31]计算, 化合物3的拓扑类型为{44;62}的Shubnikov tetragonal plane net.

Fig.4 View of the topological structure of the 2D layer of compound 3
在化合物2和3的结构中, 由于参与配位的溶剂分子不同, 最终形成的结构也有所差异. 首先, 化合物2和3都是层状结构, 但在化合物2中水分子的氢与配体中去质子化的羧基氧之间存在氢键相互作用, 使得层与层之间相互连接构筑成三维的超分子结构. 其次, 化合物2和3中都有左右手螺旋链, 但在化合物2中左右手螺旋链的螺距为0.7451 nm, 化合物3中左右手螺旋链的螺距为1.3660 nm. 比较化合物2和3的简化图可知, 虽然它们的拓扑类型一样, 但其简化得到的菱形的形状并不相同.
2.3化合物1~3的粉末XRD谱和热稳定性
化合物1~3的粉末XRD谱图与模拟谱图衍射峰的位置基本相同, 表明合成的3个化合物均为纯相, 而衍射峰的强度不同则是由于粉末晶体样品的择优取向不同(图S1~S3, 见本文支持信息).
化合物1~3的热重曲线在空气气氛下测定, 从室温到800 ℃, 以10 ℃/min的速率升温. 化合物1第一步失重发生在100~234 ℃区间, 失重约14.17%(理论值14.44%), 归属于1个DMF分子的失去; 第二步明显的失重发生在380~445 ℃区间, 失重约为53.05%, 归属于化合物骨架坍塌, 部分配体的失去; 445 ℃以后失重仍继续. 化合物2第一步失重发生在200~270 ℃区间, 失重约7.90%(理论值7.68%), 归属于2个水分子的失去; 第二步失重发生在329~397 ℃区间, 失重约55.58%, 归属于部分配体的失去; 397 ℃之后失重仍继续. 化合物3在121~212 ℃区间完成了第一步失重, 失重约12.59%(理论值12.47%); 第二步失重发生在362~458 ℃区间, 失重约71.56%(理论值71.42%), 归属于配体的失去(图S4, 见本文支持信息).
2.4化合物1~3的磁性

Fig.5 Temperature dependence of χmT and 1/χm for compound 1 The solid line shows the fitting result.
化合物1~3的变温磁化率在2~300 K、 8×104A/m的场强下测定. 由图5可见, 化合物1在300 K时,χmT的值为1.77 cm3·K·mol-1, 比单个Ni(Ⅱ)的理论值1.05 cm3·K·mol-1(S=1)大.χmT在94~300 K范围内随温度的降低而缓慢降低, 94 K时降至1.66 cm3·K·mol-1; 随着温度的继续降低,χmT的值开始急剧增大, 16 K时达到最大值8.25 cm3·K·mol-1, 随后又急剧减小, 在2 K时达到最小值0.52 cm3·K·mol-1. 在106~300 K的温度范围内, 化合物1的1/χm值严格遵守居里-外斯定律χm=Cm/(T-θ), 拟合实验数据得到居里常数C=1.85 cm3·K·mol-1, 外斯常数θ=-16.67 K. 外斯常数为负值说明在磁性中心Ni(Ⅱ)离子之间存在反铁磁相互作用.
化合物2在300 K时,χmT的值为1.59 cm3·K·mol-1. 随着温度的升高,χm值急剧减小, 表明在磁性中心Ni(Ⅱ)离子之间存在反铁磁相互作用(图S5, 见本文支持信息).
化合物3在300 K时, 每个Ni(Ⅱ)的χmT= 1.78 cm3·K·mol-1,χmT在45~300 K范围内随着温度的降低而缓慢减小, 45 K时达到1.43 cm3·K·mol-1, 随着温度的继续降低, χmT的值急剧增大, 10 K时达到最大值2.0 cm3·K·mol-1, 接着又急剧减小, 在2 K时达到最小值0.7 cm3·K·mol-1. 随着温度的升高,χm的值急剧减小, 表明Ni(Ⅱ)之间具有反铁磁相互作用. 化合物3在温度150~300 K时, 1/χm严格遵守居里-外斯定律χm=Cm/(T-θ), 拟合实验数据得到居里常数C=2.10 cm3·K·mol-1, 外斯常数θ=-54.52 K, 负的外斯常数也说明在磁性中心Ni(Ⅱ)离子之间存在反铁磁相互作用(图S6, 见本文支持信息).
2.5化合物1~3的电化学性质
化合物1~3的CV曲线如图6所示. 化合物1在0~900 mV扫描电势范围出现了1对明显的氧化还原峰, 且峰电势E1/2=(Epa+Epc)/2(其中E1/2为半峰电位,Epa为阳极峰电位,Epc为阴极峰电位)为445 mV; 化合物2在-200~1000 mV扫描电势范围内有1对明显的氧化还原峰, 且峰电势E1/2=445 mV. 化合物3在1000~-600 mV扫描电势范围内也有1对明显的氧化还原峰, 且峰电势E1/2= 450 mV. 化合物1~3的半峰电位与文献[32]中报道的Ni(Ⅱ)/Ni(Ⅲ)的氧化-还原峰的半峰电位值接近, 同时在这些电位范围内, 空白碳糊电极没有氧化-还原峰, 因此该峰应归属于Ni(Ⅱ)/Ni(Ⅲ)的氧化-还原.
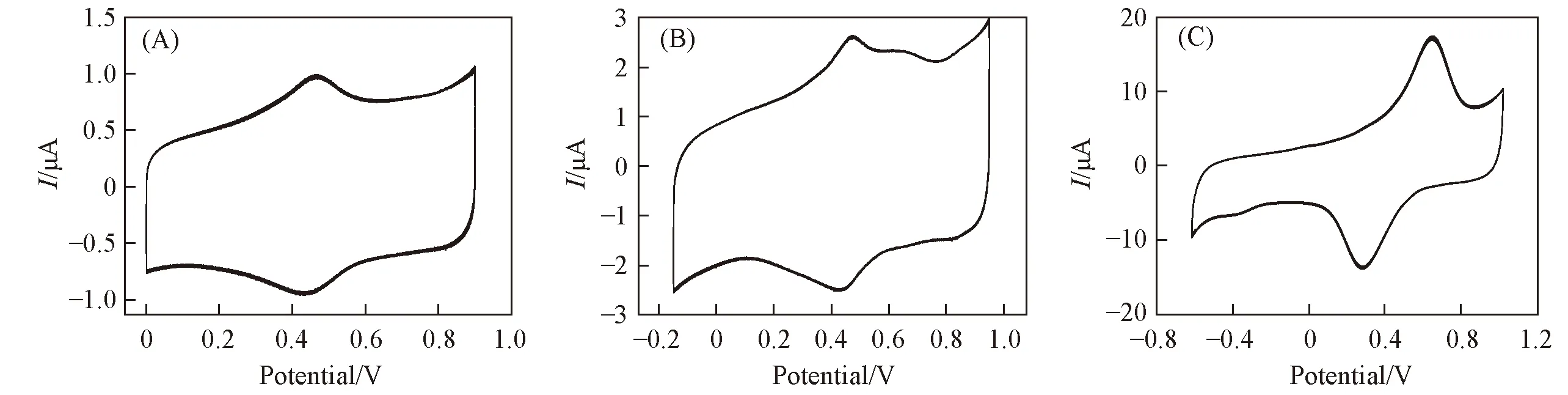
Fig.6 Cyclic voltammograms of compounds 1(A), 2(B) and 3(C)
3 结 论
在溶剂热条件下, 通过4-咪唑-1-基-苯甲酸与乙酸镍自组装得到了3个新的金属有机骨架化合物[Ni(L)2]n·DMF(1), Ni(H2O)2(L)2(2)和Ni(L)2(CH3OH)2(3), 并对化合物的结构、 电化学和磁学性质进行了测试. 结果表明, 溶剂的选择对晶体的结构具有至关重要的作用; 化合物1~3中相邻的镍离子之间具有反铁磁相互作用; 化合物1~3在一定的电势范围内出现1对明显的Ni(Ⅱ)/Ni(Ⅲ)氧化还原峰.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20160289.
[1]Paz F. A. A., Klinowski J., Vilela S. M. F., Tomé J. P. C., Cavaleiro J. A. S., Rocha J.,Chem.Soc.Rev., 2012, 41(3), 1088—1110
[2]Qiu S. L., Xue M., Zhu G. S.,Chem.Soc.Rev., 2014, 43(16), 6116—6140
[3]Schneemann A., Bon V., Schwedler I., Senkovska I., Kaskel S., Fischer R. A.,Chem.Soc.Rev., 2014, 43(16), 6062—6096
[4]Yamada T., Otsubo K., Makiura R., Kitagawa H.,Chem.Soc.Rev., 2013, 42(16), 6655—6669
[5]Song Z., Li G. H., Yu Y., Shi Z., Feng S. H.,Chem.Res.ChineseUniversities, 2009, 25(1), 1—4
[6]Singh D., Nagaraja C. M.,Cryst.GrowthDes., 2015, 15(7), 3356—3365
[7]Fan L. M., Fan W. L., Song W. K., Liu G. Z., Zhang X. T., Zhao X.,Cryst.Eng.Comm., 2014, 16(39), 9191—9197
[8]Yan Z. H., Zhang X. W., Pang H. D., Zhang Y. H., Sun D. F., Wang L.,RSCAdv., 2014, 4(96), 53608—53616
[9]Ezugwu C. I., Kabir N. A., Yusubov M., Verpoort F.,Coord.Chem.Rev., 2016, 307, 188—210
[10]Chang Z., Yang D. H., Xu J., Hu T. L., Bu X. H.,Adv.Mater., 2015, 27(36), 5432—5441
[11]Li C. P., Du M.,Chem.Commun., 2011, 47(21), 5958—5972
[12]Manna B., Desai A. V., Kumar N., Karmakar A., Ghosh S. K.,Cryst.Eng.Comm., 2015, 17(46), 8796—8800
[13]Weaver M. J., McNis G. E.,Acc.Chem.Res., 1990, 23(9), 294—300
[14]Barbara P. F., Jarzeba W.,Acc.Chem.Res., 1988, 21(5), 195—199
[15]Wang X. Y., Wang L., Wang Z. M., Gao S.,J.Am.Chem.Soc., 2006, 128(3), 674—675
[16]Ma L. Q., Lin W. B.,J.Am.Chem.Soc., 2008, 130(42), 13834—13835
[17]Pachfule P., Das R., Poddar P., Banerjee R.,Cryst.GrowthDes., 2011, 11(4), 1215—1222
[18]Tynan E., Jensen P., Kruger P. E., Lees A. C.,Chem.Commun., 2004, (7), 776—777
[19]Wu Y., Yang G. P., Zhao Y., Wu W. P., Liu B., Wang Y. Y.,DaltonTrans., 2015, 44(7), 3271—3277
[20]Liu C., Zhuo X., Cheng H., Liu C., Liu X. H.,Chem.J.ChineseUniversities, 2015, 36(5), 831—837(刘超, 卓馨, 成慧, 刘闯, 刘新华. 高等学校化学学报, 2015, 36(5), 831—837)
[21]Huang C. T., Wu X. F., Li G. H., Gao L., Feng S. H.,Chem.J.ChineseUniversities, 2015, 36(9), 1661—1666(黄楚婷, 吴小峰, 李光华, 高路, 冯守华. 高等学校化学学报, 2015, 36(9), 1661—1666)
[22]Li Y., Zhang S. S., Song D. T.,Angew.Chem.Int.Ed., 2013, 52(2), 710—713
[23]Zhang Y., Niu Y. B., Liu T., Li Y. T., Wang M. Q., Hou J., Xu M.,Mater.Lett., 2015, 161, 712—715
[24]Li J. R., Yu Q., Tao Y., Bu X. H., Ribas J., Batten S. R.,Chem.Commun., 2007, (22), 2290—2292
[25]Wang K., Zou H. H., Chen Z. L., Zhang Z., Sun W. Y., Liang F. P.,DaltonTrans., 2014, 43(34), 12989—12995
[26]Tian C. B., Chen R. P., He C., Li W. J., Wei Q., Zhang X. D., Du S. W.,Chem.Commun., 2014, 50(15), 1915—1917
[27]Zhao J. P., Han S. D., Zhao R., Yang Q., Chang Z., Bu X. H.,Inorg.Chem., 2013, 52(6), 2862—2869
[28]Liu Q., Yu L. L., Wang Y., Ji Y. Z., Horvat J., Cheng M. L., Jia X. Y., Wang G. X.,Inorg.Chem., 2013, 52(6), 2817—2822
[29]Mao J. J., Yang L. F., Yu P., Wei X. W., Mao L. Q.,Electrochem.Commun., 2012, 19, 29—31
[30]Wang H. L., Zhang D. P., Jiang J. Z.,Cryst.Eng.Comm., 2010, 12(4), 1096—1102
[31]Blatov V.A., Peaskov M.V.,ActaCrystallogr.Sect.B:Struct.Sci., 2006, 62, 457—466
[32]Fatma K., Bulent D., Sabriye P. O., Eser K.,DyesPigments, 2010, 84(1), 14—18
(Ed.:S, Z, M)
† Supported by the National Natural Science Foundation of China(Nos.21171065, 21201077).
Influence of Solvent on Structure of Ni(Ⅱ) Metal-organic Frameworks†
GAO Lijuan, WANG Li, WANG Shengyan, JING Shubo*
(College of Chemistry, Jilin University, Changchun 130012, China)
Solvent is an important influence factor in the self-assembly process of metal-organic framworks. In this article, using the semi-rigid 4-imidazol-1-yl-benzoic acid organic ligand(HL) and Ni(OAc)2·4H2O, three novel metal organic frameworks, [Ni(L)2]n·DMF(1), Ni(H2O)2(L)2(2) and Ni(OCH3)2(HL)2(3), were synthesized in different solvents. When the solvent wasN,N-dimethyl formamide, compound 1 was synthesized, showing a 3D framework with one dimensional diamond channels. Using DMF/H2O as the solvent, compound 2 was prepared, it exhibits a 2D layer structure with water molecules as terminal ligands, the adjacent layers are linked through hydrogen bonding interactions to form a 3D supramolecular structure. Compound 3 was synthesized in CH3OH, showing a 2D layer structure. Compounds 1—3 display antiferromagnetic property and exhibit a couple of obvious redox peaks in a certain range of potential, respectively.
Metal-organic framework; Magnetism; Cyclic voltammetry; Solvent effect
10.7503/cjcu20160289
2016-04-26. 网络出版日期:2016-08-26.
国家自然科学基金(批准号:21171065, 21201077)资助.
O614
A
联系人简介:井淑波, 女, 博士, 副教授, 主要从事金属有机骨架的合成及性质研究. E-mail:jingsb@jlu.edu.cn
