乳中miRNA的研究进展
2016-11-01林德麟谢梅英习欠云孙加节张永亮
林德麟,陈 婷,黎 梦,谢梅英,习欠云,孙加节,张永亮
(华南农业大学动物科学学院,国家生猪种业工程技术研究中心,广州 510642)
乳中miRNA的研究进展
林德麟,陈婷,黎梦,谢梅英,习欠云,孙加节,张永亮*
(华南农业大学动物科学学院,国家生猪种业工程技术研究中心,广州 510642)
外泌体(Exosome)存在于动物的各种体液中,如乳汁、血液、尿液等,其中包含的蛋白质、mRNAs、micro-RNAs、脂类等物质,可进入受体细胞而发挥生理作用。近几年有不少关于动物体内各种miRNA的研究,而针对乳exosome中miRNA的研究却相对较少。本文通过对一些已有报道的收集整理,从整体上证实了乳汁中存在miRNA且富集于exosome中,并对比不同动物乳中高表达的miRNA的异同,重点关注exosome中高表达的miRNA,并得出一般性结论。此外,本文还分析了乳中miRNA的其他存在形式,并讨论miRNA在不同动物乳中的保守性及其可能的生理学作用。
乳;exosome;miRNA
乳汁是哺乳动物出生后的第一种且是最主要的营养物质来源,乳汁中包含复杂的营养成分,能促进个体的生长和发育,特别是初乳中的免疫球蛋白对新生儿更具生理意义,而对乳的研究在食品学和营养学中已经相当丰富。Exosome(外泌体)最早是由R.M.Johnstone等[1]在研究网织红细胞向成熟红细胞转变过程中在体外培养的羊网织红细胞上清液中分离出来的一种30~100 nm的膜性小囊泡,这种小囊泡可以包裹mRNA、microRNA、脂质、蛋白质等物质并通过胞吞、融合等方式把内容物释放到受体细胞内发挥生理作用。Exosome作为细胞间通讯的媒介之一,有着巨大的生物价值,体现在在医学上可作为某些疾病[2-3]或癌症[4-5]的生物标记;其还能作为基因的载体,在治疗效果、靶向能力、免疫反应、安全性上都优于传统基因治疗的候补载体,如病毒载体、PEI纳米颗粒和脂质体等[6]。
microRNA(以下简称miRNA)是一类由18~24个核苷酸组成的具有调控功能的内源性非编码RNA,其广泛存在于真核生物中。编码miRNA的基因最初产生一个长的pri-RNA分子,这种初期分子必须被剪切成约70~90个碱基大小、具发夹结构单链RNA前体(pre-miRNA),并经过Dicer酶加工后生成成熟的miRNA。miRNA通过与靶标基因不完全或完全互补结合,进而抑制翻译或降解靶标mRNA而发挥作用。关于不同的miRNA在同一器官、组织中或同一miRNA在不同器官、组织中所起的作用已进行了较多的研究,而在不同器官、组织中某些miRNA与相关生理功能的关系已经清晰;miRNA对基因表达的调控几乎涉及到人类健康和疾病的所有方面[7-8]。但目前对于不同动物乳中miRNA的报道相对较少,而针对乳exosome中miRNA的研究则更少。本文在已有资料基础上,对比不同动物乳中的miRNA,着重对比乳exosome中的miRNA,揭示在miRNA水平上不同动物之间的异同。
1 乳中存在miRNA
现已证实miRNA存在于各种体液中,如血清、血浆、尿液、唾液、胸腔积液等,其功能可能与周围组织相关。J.A.Weber等[9]检测到人体的12种体液中都存在miRNA,其中乳的总RNA浓度最高,所检测到的miRNA数量也较高,相对于血液,乳中是富含miRNA的。其他报道也证实了乳中存在miRNA。T.Hata等[10]发现牛乳来源的微囊泡中含有mRNA和miRNA。Q.Zhou等[11]通过测序技术,确认了人乳exosome中存在452种pre-miRNAs,共可产生602种成熟miRNAs。X.Chen等[12]在牛乳中检测到245种miRNAs,并通过对牛乳样品的Solexa测序,发现其中有213种已知的miRNAs存在于常乳中,230种存在于初乳中,证实了初乳与常乳之间的miRNAs存在一定差异;且检测结果显示,虽然miRNAs在种类上血清多于乳汁,但qRT-PCR结果表明,7种能作为潜在的生物标记的miRNAs(miR-26a、miR-26b、miR-200c、miR-21、miR-30d、miR-99a、miR-148a)在牛乳中的表达量显著高于在血清中,推测血液中部分miRNAs可能富集于乳中。N.Kosaka等[13]通过芯片分析,检测出人乳中含有人已知的723种miRNAs中的281种,并证实在哺乳期内基因的表达相关性较高,与免疫相关的miRNAs在哺乳期前6个月中表达量较高,且高于哺乳期后6个月;部分miRNAs在exosome中的表达量约为对照组的1.5倍,推测miRNAs可能富集于乳exosome中。Y.Gu等[14]报道了猪乳exosome中含有超过180种pre-miRNAs,其中包括140个已知的和40个新的pre-miRNAs,并报道了猪6个泌乳阶段中乳exosome的miRNAs表达谱。T.Chen等[15]通过对猪初乳样品的Solexa测序,发现了491种miRNAs,包括176种已知的miRNAs以及315种新的成熟miRNAs。H.Izumi等[16]报道了鼠的3个泌乳阶段中乳清miRNAs表达谱,发现鼠的388种已知的miRNAs中有161种可以在乳清中检测出来。A.C.Title等[17]在鼠胃乳凝块样品中发现有超过635种miRNAs,每个样品平均含有506种miRNAs。
miRNA能存在于乳汁中,说明其必然有一种存在形式可防止被RNA酶所降解。有试验证明,内源性miRNA可以抵抗RNA酶、低pH和反复冻融所导致的降解,但对去污剂Triton X-100不耐受,可能是由于miRNA包裹于exosome里的原因[13,17-19]。miRNA除了通过细胞内分选系统打包进入exosome这种方式外,有报道证实在血浆、血清中miRNA还能以与Ago2蛋白形成复合物的形式存在[20]。
2 不同动物乳exosome中高表达的miRNAs
乳汁通过2 000×g离心10 min后,能形成乳脂—上清液—沉淀3个分层;除去乳脂层和下层沉淀后,上清液通过12 000×g离心30 min可以沉淀细胞碎片;除去沉淀后,上清液通过100 000×g超速离心2 h,再用PBS洗涤2次,最后经过100 000×g超速离心2 h,可得到exosome沉淀[13]。通过用Trizol或试剂盒对exosome进行miRNA的抽提,得到的总RNA可进行芯片分析或Solexa测序;或是将总RNA利用茎环引物或加尾试剂进行反转录,获得cDNA,最后进行qPCR等后续检测。
T.Chen等[15]对测序结果进行分析,发现猪初乳exosome中有73种miRNAs的Count值超过100,有264种miRNAs的Count值低于100,并列出表达量最高的10种miRNAs(ssc-miR-193a-3p、ssc-miR-423-5p、ssc-miR-320、ssc-miR-181a、ssc-miR-30a-3p、ssc-miR-378、ssc-miR-191、ssc-let-7a、ssc-let-7f 和 ssc-let-7c),这10种miRNAs在猪乳exosome中的表达量占总miRNAs的74.5%。Y.Gu等[14]列出了猪乳exosome中不同时期表达量最高的10种miRNAs,对应猪的6个泌乳阶段中的13种miRNAs(miR-148a-3p、miR-30a-5p、miR-25-3p、miR-182-5p、miR-30d-5p、miR-574-3p、miR-200c-3p、miR-30c-2-5p(-1-5p)、miR-191-5p、miR-375-3p、miR-27b-3p、miR-21-5p、ssc-let-7a-l-5p),而每个阶段表达量最高的10种miRNAs占全部234种miRNAs的比例从0 d的87.25%逐渐上升至28 d的93.46%,说明这10种高表达的miRNAs相当稳定;其中,miR-148a-3p、miR-182-5p、miR-200c-3p、miR-25-3p、miR-30a-5p、miR-30d-5p和 miR-574-3p这7个miRNAs在6个阶段中都位于前10位;miR-148a的表达量在6个阶段都为最高,且随着时间的增加而增加,从0 d的61.52%上升至28 d的78.99%,超过总量的一半,而其他9种的表达量百分比基本保持稳定。Q.Zhou等[11]报道人乳exosome里表达量最高的10种miRNAs,分别是miR-148a-3p、miR-30b-5p、let-7f-1-5p(-2-5p)、miR-146b-5p、miR-29a-3p、let-7a-2-5p(-3-5p)、miR-141-3p、miR-182-5p、miR-200a-3p、miR-378-3p,这10种miRNAs占总量的62.3%,其中表达量最高的miR-148a占总量的约35.45%。X.Chen等[12]在牛乳中也有类似的报道。V.Modepalli等[21]以同属哺乳纲而与人、猪、牛、鼠等属不同亚纲的袋鼠为研究对象,证实了在不同的哺乳阶段miR-148表达量也相对较高,且为乳特有的。H.Izumi等[22]列出了在牛乳exosome中表达量最高的50种miRNAs,其中通过芯片分析信号强度超过10的有11种,分别是miR-2478、miR-1777b、miR-1777a、let-7b、miR-1224、miR-2412、miR-2305、let-7a、miR-200c、miR-141和miR-2881,而miR-148a的信号强度也接近10,是第14个高表达的miRNA。
由以上信息推测miR-148家族中的miR-148a可能是所有哺乳动物母乳中含量较高的一种miRNA,这种高表达可能预示着其对于初生儿有着重要的生理功能。有报道认为,miR-148a因在哺乳期内高且稳定地表达,可作为牛乳[12]和人乳[11]品质控制的一种潜在生物标志物。通过生物信息学分析,miR-148a与免疫和胃肠道健康有关,但具体作用机制尚不清楚。据研究报道,miR-148a可以负调控先天性免疫反应和树突状细胞的抗原提呈功能[23]。此外,miR-148家族与正常组织的生长和发育、疾病的发生和发展有关,并且可以参与靶基因的调控,如基因的增殖、分化、凋亡[24-25]。miR-148a可作为胃癌中的肿瘤转移抑制因子[26];miR-148a的异位表达在结肠直肠癌细胞中可诱导细胞凋亡以及沉默Bcl-2[27];在肠细胞分化过程中起上调作用[28];靶向DNA甲基转移酶3b[29];通过靶向转录产物的蛋白编码区直接下调DNA甲基转移酶1,由此促进细胞的甲基化[30]。
3 不同动物之间乳exosome中miRNAs的对比
通过比较猪乳、人乳、牛乳exosome中表达量最高的10种miRNAs,发现三者miRNAs的种类组成相差较大(表1)。其中miR-148a在猪乳、人乳exosome中表达量都为最高,而在牛乳中则排在第14位;let-7a在猪乳、人乳、牛乳中都在前10,通过在miRBase 21.0里比对,发现虽然三者的前体序列不同,但成熟序列相同;miR-182-5p、miR-378、let-7f在猪乳、人乳中都在前10;miR-200c在猪乳、牛乳中都在前10;miR-141在人乳、牛乳中都在前10;let-7c在猪乳、牛乳中表达量都较高。此外,通过比较发现来源不同的猪乳样品,其exosome中表达量最高的10种miRNAs 不完全相同(表1),这可能与母猪品种、饲养水平、检测方式等有关。而其中miR-191-5p都在前10内。
通过对比发现,猪乳和牛乳两者之间各种miRNAs的表达差别较大,这可能因为:(1)食性不同,猪为杂食动物,牛为草食动物;(2)消化方式不同,猪为单胃动物,牛为复胃动物。而对比两种来源不同的猪乳中exosome里各自表达量最高的50种miRNAs,发现相同的有19种;再以牛乳exosome所含miRNAs与这19种miRNAs进行比较,发现在牛乳exosome里表达量最高的79种miRNAs中有11种对应的miRNAs,数据如表2所示。表3罗列出牛乳exosome中表达量最高的50种miRNAs,再以两种来源不同的猪乳exosome的miRNAs与其进行比较,发现在猪乳exosome(1)中能找到20种对应的miRNA,且在排序上最高为第2位(ssc-miR-423-5p),最低为第252位(ssc-miR-664-5p);而在猪乳exosome(2)中能找到有23种对应的miRNA,且在排序上最高是第1位(ssc-miR-148a-3p),最低为第139位(ssc-miR-103-3p)。猪乳的两组数据显示两者的miRNAs分布相似但在排序上有差异,说明在猪乳中miRNAs在种类上差异不大,但由于品种、饲养水平等的不同导致了表达量有一定的差异。其中在牛乳exosome里表达量最高的50种miRNAs中有14种是牛特有的[22]。
表1猪乳、人乳、牛乳exosome中表达量最高的10种miRNAs之间的对比
Table 1The comparison among top 10 most highly expressed miRNAs in porcine milk,human milk and bovine milk exosome
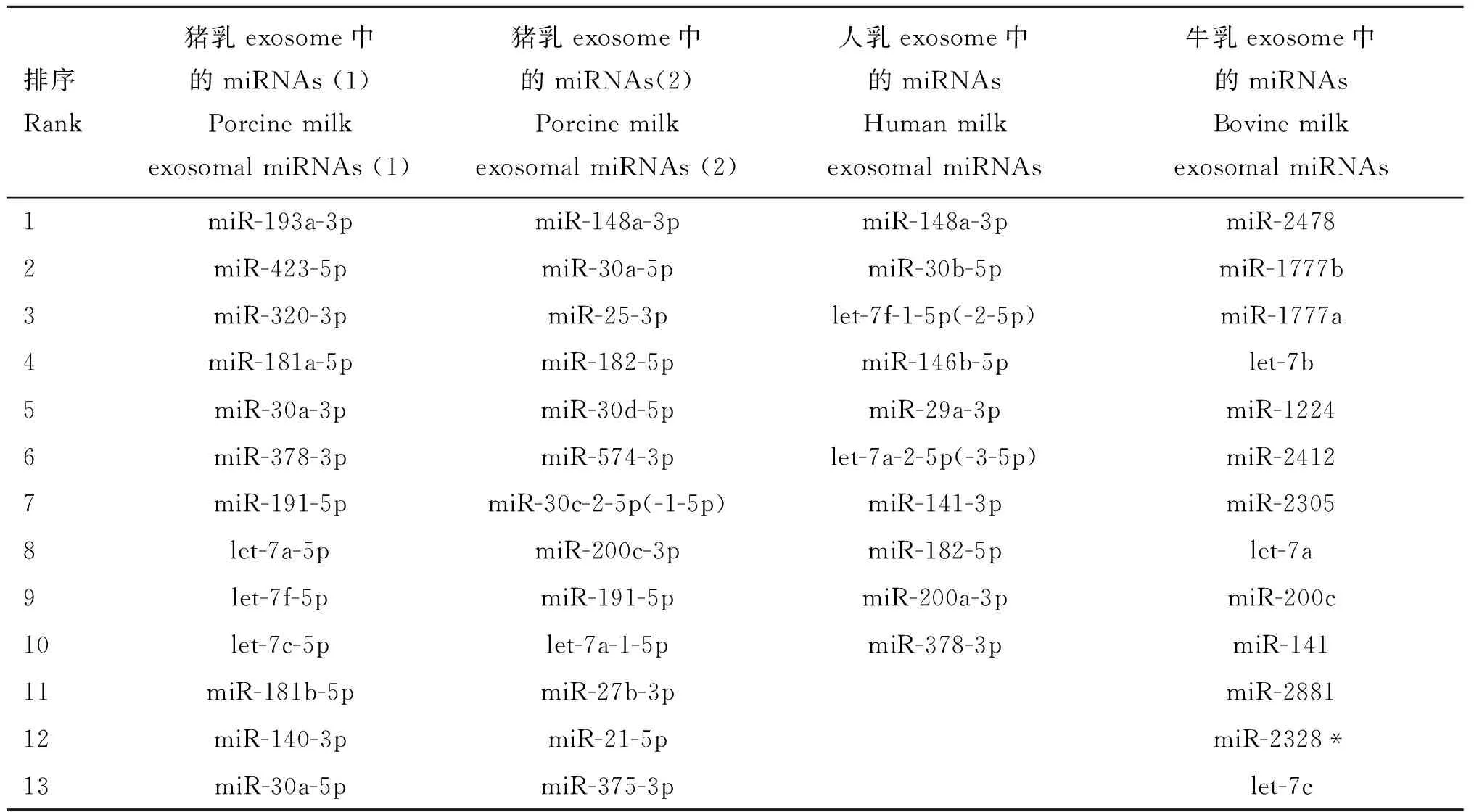
排序Rank猪乳exosome中的miRNAs(1)PorcinemilkexosomalmiRNAs(1)猪乳exosome中的miRNAs(2)PorcinemilkexosomalmiRNAs(2)人乳exosome中的miRNAsHumanmilkexosomalmiRNAs牛乳exosome中的miRNAsBovinemilkexosomalmiRNAs1miR-193a-3pmiR-148a-3pmiR-148a-3pmiR-24782miR-423-5pmiR-30a-5pmiR-30b-5pmiR-1777b3miR-320-3pmiR-25-3plet-7f-1-5p(-2-5p)miR-1777a4miR-181a-5pmiR-182-5pmiR-146b-5plet-7b5miR-30a-3pmiR-30d-5pmiR-29a-3pmiR-12246miR-378-3pmiR-574-3plet-7a-2-5p(-3-5p)miR-24127miR-191-5pmiR-30c-2-5p(-1-5p)miR-141-3pmiR-23058let-7a-5pmiR-200c-3pmiR-182-5plet-7a9let-7f-5pmiR-191-5pmiR-200a-3pmiR-200c10let-7c-5plet-7a-1-5pmiR-378-3pmiR-14111miR-181b-5pmiR-27b-3pmiR-288112miR-140-3pmiR-21-5pmiR-2328*13miR-30a-5pmiR-375-3plet-7c
(2)中miRNAs(除miR-148a-3p)的排序会因哺乳阶段的不同而不同,表中列出第0天猪乳exosome中的miRNA的排序
The rank of miRNAs in (2) (except for miR-148a-3p) will be different at different stages of lactation,and the rank of exosomal miRNAs in 0 day porcine milk were listed in the table
表2牛乳exosome所含miRNAs与两组猪乳exosome中表达量同为前50的miRNAs的对比
Table 2The comparison between bovine milk exosomal miRNAs and both top 50 most highly expressed miRNAs in 2 groups of porcine milk exosome

猪乳exosome中高表达的miRNAsPorcinemilkexosomalhighlyexpressedmiRNAs对应的牛乳exosome的miRNAsCorrespondingbovinemilkexosomalmiRNAsTop79中的排序Rankintop79猪乳exosome中高表达的miRNAsPorcinemilkexosomalhighlyexpressedmiRNAs对应的牛乳exosome的miRNAsCorrespondingbovinemilkexosomalmiRNAsTop79中的排序Rankintop79ssc-let-7a-5pbta-let-7a8ssc-let-7i-5pbta-let-7i74ssc-let-7c-5pbta-let-7c13ssc-miR-191-5pbta-miR-191-ssc-miR-148a-3pbta-miR-148a14ssc-miR-21bta-miR-21-ssc-miR-30d-5pbta-miR-30d24ssc-miR-423-3pbta-miR-423-3p-ssc-miR-30a-5pbta-miR-30a-5p30ssc-miR-425-5pbta-miR-425-5p-ssc-miR-125b-5pbta-miR-125b32ssc-miR-125a-5pbta-miR-125a-ssc-miR-24-3pbta-miR-24-3p36ssc-miR-205-5pbta-miR-205-ssc-miR-423-5pbta-miR-423-5p38ssc-miR-186-5pbta-miR-186-ssc-miR-27b-3pbta-miR-27b59ssc-miR-30a-3p--ssc-miR-23a-3pbta-miR-23a66
牛乳exosome中信号值为“0”的miRNAs不参与排序
The bovine milk exosomal miRNAs with “0” normalized signal intensity are not involved in ranking
表3两组猪乳exosome中miRNAs与牛乳exosome中表达量最高的50种miRNAs之间的对比
Table 3The comparison between 2 groups of porcine milk exosomal miRNAs and top 50 most highly expressed miRNAs in bovine milk exosome

排序Rank牛乳exosome中表达量最高的50种miRNAsTop50mosthighlyexpressedmiRNAsinbovinemilkexosome对应的猪乳exosome中的miRNAs(1)CorrespondingmiRNAsinporcinemilkexosome(1)(1)中的排序Rankin(1)对应的猪乳exosome中的miRNAs(2)CorrespondingmiRNAsinporcinemilkexosome(2)(2)中排序Rankin(2)1bta-miR-24782bta-miR-1777b3bta-miR-1777a4bta-let-7b5bta-miR-12246bta-miR-24127bta-miR-23058bta-let-7assc-let-7a-5p8ssc-let-7a-l-5p149bta-miR-200chsa,mmu,rno-miR-200c-3p910bta-miR-141hsa,mmu,rno-miR-141-3p6511bta-miR-288112bta-miR-2328*13bta-let-7cssc-let-7c-5p10ssc-let-7c-5p1314bta-miR-148assc-miR-148a-3p33ssc-miR-148a-3p115bta-miR-320ssc-miR-320-3p3ssc-miR-320-3p6916bta-miR-288817bta-let-7fssc-let-7f-5p9ssc-let-7f-5p5718bta-miR-200bhsa,mmu,rno-miR-200b-3p1919bta-miR-158420bta-miR-26assc-miR-26a-5p6121bta-miR-20ahsa,mmu,rno-miR-20a-5p10322bta-miR-103ssc-miR-103-3p15ssc-miR-103-2-3p,ssc-miR-103-1-3p13923bta-miR-29cssc-miR-29c-3p94ssc-miR-29c-3p8224bta-miR-30dssc-miR-30d-5p48ssc-miR-30d-5p525bta-miR-92ssc-miR-92a-3p14ssc-miR-92a-2-3pssc-miR-92a-1-3p758326bta-miR-230427bta-miR-375hsa,mmu,rno-miR-375-3p828bta-miR-239129bta-let-7gssc-let-7g-5p37ssc-let-7g-5p55

表3(续)
通过对袋鼠不同哺乳阶段乳中miRNA进行检测,发现有16种miRNAs表达量较高,其中9种(miR-191、miR-375、miR-148、miR-30a、miR-181a、let-7f、let-7a、miR-21、miR-141)同时属于猪乳、人乳、牛乳exosome中表达量最高的10种miRNAs之中,推测这些miRNAs可能在哺乳动物乳汁中是保守并且高表达的。此外,不同的miRNAs在袋鼠哺乳期的表达规律有所差异,个别(miR-375、miR-30a、miR-22、let-7b、miR-130a)的表达量随日龄的增加而逐渐上升,个别(miR-184、let-7f、miR-101、miR-182)的表达量则逐渐降低,数据如表4所示。
综上表明,不同动物乳中miRNA的种类组成相似但表达量存在差异。需要指出的是,上述结果是在有限的资料基础上比较而来,更加准确的情况需要更多的试验数据支持。
表4不同哺乳阶段袋鼠乳中miRNAs的表达量
Table 4The expression of miRNAs in kangaroo milk at different lactation stages

microRNA第35天D35第75天D75第120天D120第175天D175第250天D250miR-19140.42928.02243.8289.65715.471miR-18417.61124.8368.5621.4480.133miR-3752.4052.6328.2259.78225.778miR-1485.37110.5588.32014.6139.308miR-30a1.0953.4573.35613.66914.953miR-181c(-181a)6.7427.5345.0185.6995.827let-7f7.6886.4455.3716.0401.672miR-220.6710.7941.1363.1818.639let-7a3.8902.3862.6413.6461.190miR-10b2.9101.5203.4213.7561.146miR-1410.3441.7410.6844.9624.166miR-1430.8651.3851.1445.0673.117miR-923.2191.2392.5040.8490.984let-7i1.7180.7570.6702.1180.525miR-210.4380.2870.2143.0350.559miR-260.4661.4520.8360.6920.306
表中的数值为各自乳样中miRNAs表达量归一化的read值;表中只列出至少有一个阶段read值大于1的miRNAs
The values in the table are normalized miRNAs expression of mapped reads in respective milk samples;The only miRNAs with more than 1 read value at least one stage are listed in the Table 4
4 乳中miRNA的其他存在形式
乳中的miRNA并非全部以包被于exosome中的形式出现。H.Izumi等[22]报道miRNAs同时存在于不含exosome的乳清中。乳清(乳汁除去乳脂、细胞、碎片、酪蛋白等剩下的液体部分)通过超速离心后可以得到exosome沉淀和上清液,小心收集上清液可得到无exosome的乳清。芯片结果显示,有79种miRNAs存在于exosome中,91种miRNAs存在于上清液中,其中两者共有的miRNAs为39种。Exosome中表达量最高的50种miRNAs与无exosome上清液中表达量最高的50种miRNAs之间的对比如表5所示,其中miR-2478、miR-1777b、miR-1777a、miR-1224、miR-2412、miR-2305这6种miRNAs都排在前10位,而在exosome中表达量较高的let-7家族成员却没有一个位于上清液前50位中,说明let-7家族成员富集于exosome中。此外,在乳清中约70%的RNA集中于exosome里,其余分布在上清液中,验证了exosome的富集作用以及其作为细胞间通讯媒介的物质基础。但exosome中只有约27%的小RNA为miRNA,上清液中约64%的小RNA为miRNA。
专门比较经超速离心后所得到的exosome沉淀和上清液中所含miRNA区别的报道较少。对乳汁miRNA进行抽提的方式大致分成3类:一种是对只除去乳脂、细胞、碎片等剩下的液体部分进行抽提,得到上清(Supernatant)的miRNA,如X.Chen等[12]和V.Modepalli等[21]都以此方法处理样品并抽提总RNA做Solexa测序和qPCR;N.Kosaka等[13]以此方法处理样品并抽提总RNA做芯片分析和qPCR。第2种是对除去乳脂、细胞、碎片以及含量丰富的酪蛋白等剩下的液体部分进行抽提,得到乳清(Whey)的miRNA,如H.Izumi等[16,18]以此方法处理样品并抽提总RNA做芯片分析和qPCR。第3种方式是收集胃乳进行检测,如A.C.Title等[17]以此方法收集不同时期幼鼠体内变性的胃乳以检测其中的miRNA。表6、表7列出不同幼鼠在哺乳早期、中期、后期的胃乳中各阶段表达量最高的10种miRNAs,可以看出在不同阶段miRNAs的种类组成相似,而且3个阶段中表达量最高的10种miRNAs中相同的有6种(mmu-miR-148a、mmu-miR-181a、mmu-miR-22、mmu-miR-27b、mmu-miR-30a、mmu-let-7f),推测在整个哺乳期间miRNAs的分泌都相对稳定。其中miR-148a-3p的表达量为最高,这与猪乳和人乳exosome中miR-148a-3p表达量最高相吻合;miR-30a-5p、miR-27b-3p、miR-181a-5p、let-7f同样属于猪乳exosome中表达量最高的前10种miRNAs内,而let-7f也属于人乳exosome中表达量最高的前10种miRNAs内。
表5牛乳exosome与无exosome上清液中高表达的10种miRNAs之间的对比Table 5The comparison between top 10 most highly expressed miRNAs in bovine milk exosome and those in exosome-free supernatant
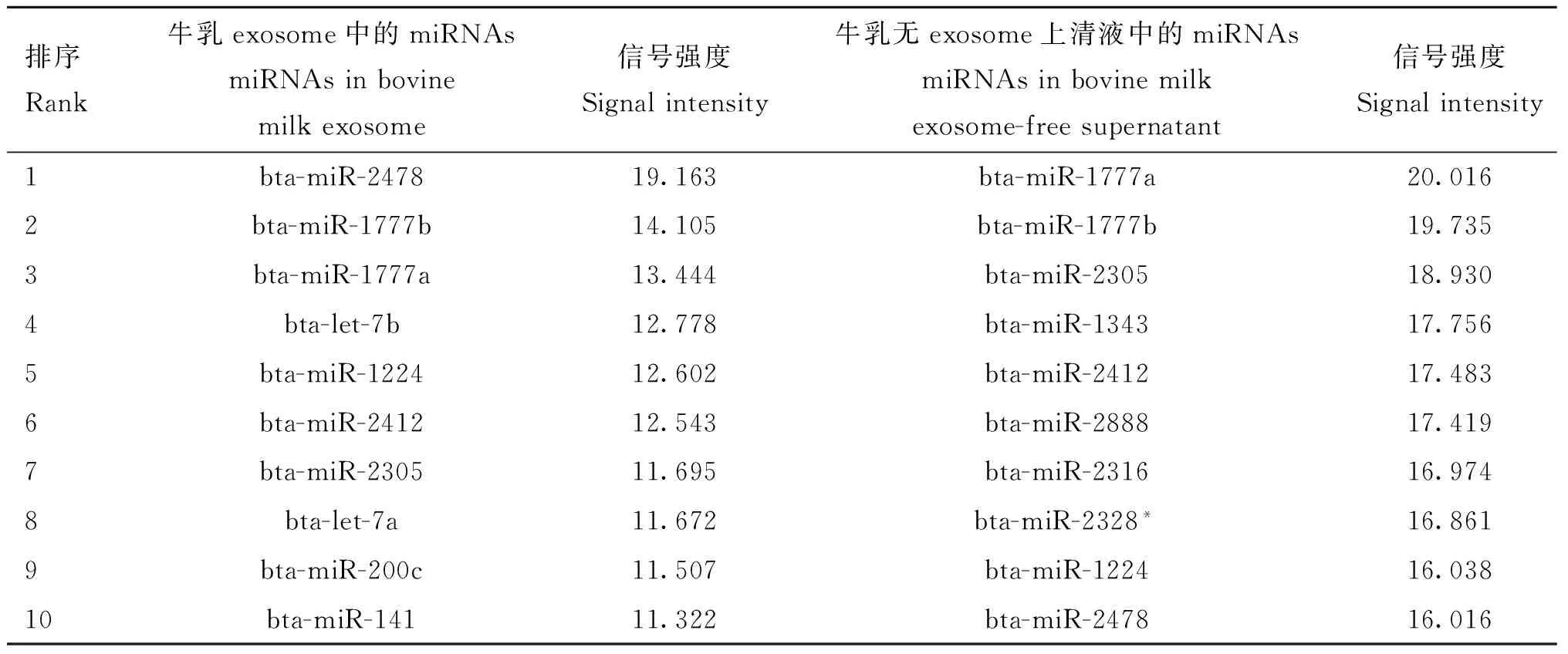
排序Rank牛乳exosome中的miRNAsmiRNAsinbovinemilkexosome信号强度Signalintensity牛乳无exosome上清液中的miRNAsmiRNAsinbovinemilkexosome-freesupernatant信号强度Signalintensity1bta-miR-247819.163bta-miR-1777a20.0162bta-miR-1777b14.105bta-miR-1777b19.7353bta-miR-1777a13.444bta-miR-230518.9304bta-let-7b12.778bta-miR-134317.7565bta-miR-122412.602bta-miR-241217.4836bta-miR-241212.543bta-miR-288817.4197bta-miR-230511.695bta-miR-231616.9748bta-let-7a11.672bta-miR-2328*16.8619bta-miR-200c11.507bta-miR-122416.03810bta-miR-14111.322bta-miR-247816.016
信号强度指归一化的信号强度
Signal intensity means normalized signal intensity
由上述可知,miRNA同时存在于乳清的exosome和上清液中,但有报道推测miRNA存在于上清液中是由于制备exosome沉淀需要经过超速离心,而exosome是一种直径约30~100 nm的纳米量级的膜性小囊泡,超速离心可能不能把直径小的exosome沉淀下来,导致这部分exosome还游离于上清液中,因此在上清液中能检测出少量的miRNAs[22]。然而为什么通过芯片检测发现存在上清(Supernatant)或乳清(Whey)特有的miRNAs[22,31],这还需要进一步的探索。
表6哺乳早期(D2)、中期(D8)、后期(D14)幼鼠胃乳中高表达的10种miRNAs(1)
Table 6Top 10 most highly expressed miRNAs in newborn mice at early (D2),mid (D8) and late (D14) lactation stages(1)
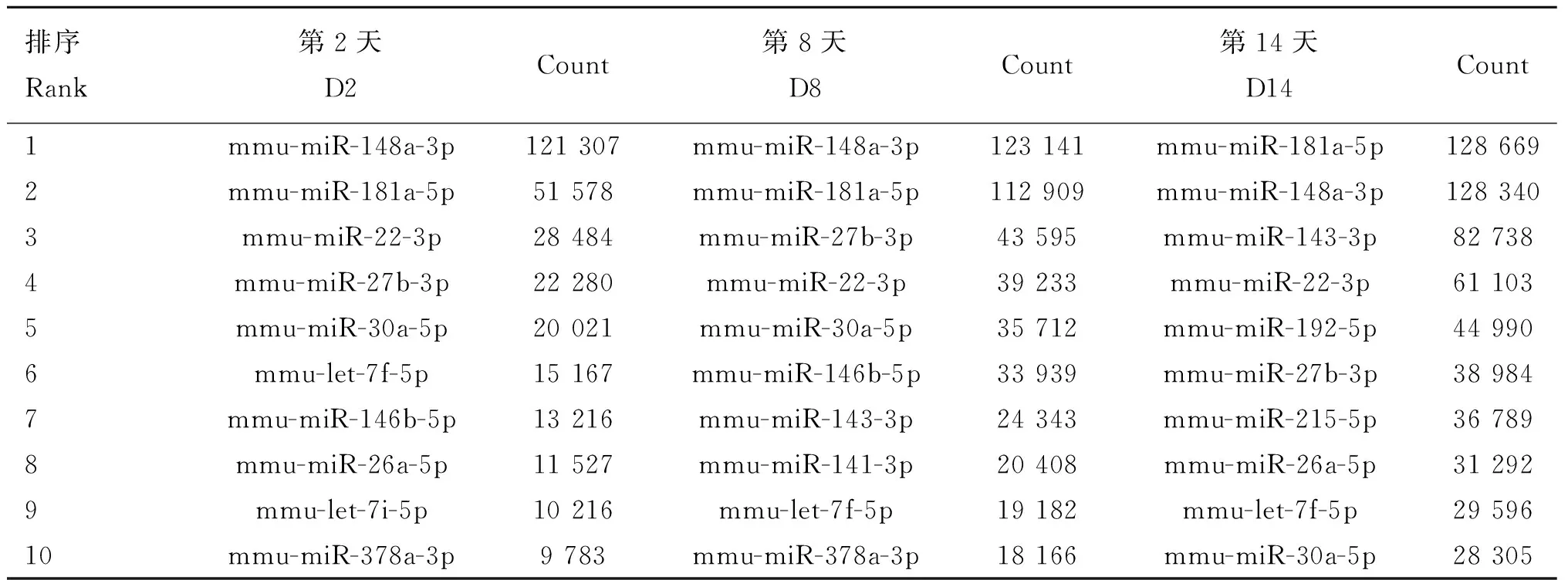
排序Rank第2天D2Count第8天D8Count第14天D14Count1mmu-miR-148a-3p121307mmu-miR-148a-3p123141mmu-miR-181a-5p1286692mmu-miR-181a-5p51578mmu-miR-181a-5p112909mmu-miR-148a-3p1283403mmu-miR-22-3p28484mmu-miR-27b-3p43595mmu-miR-143-3p827384mmu-miR-27b-3p22280mmu-miR-22-3p39233mmu-miR-22-3p611035mmu-miR-30a-5p20021mmu-miR-30a-5p35712mmu-miR-192-5p449906mmu-let-7f-5p15167mmu-miR-146b-5p33939mmu-miR-27b-3p389847mmu-miR-146b-5p13216mmu-miR-143-3p24343mmu-miR-215-5p367898mmu-miR-26a-5p11527mmu-miR-141-3p20408mmu-miR-26a-5p312929mmu-let-7i-5p10216mmu-let-7f-5p19182mmu-let-7f-5p2959610mmu-miR-378a-3p9783mmu-miR-378a-3p18166mmu-miR-30a-5p28305
数据来源于试验幼鼠1
Data comes from the experimental newborn mice 1
表7哺乳早期(D2)、中期(D8)、后期(D14)幼鼠胃乳中高表达的10种miRNAs(2)
Table 7Top 10 most highly expressed miRNAs in newborn mice at early (D2),mid (D8) and late (D14) lactation stages(2)

排序Rank第2天D2Count第8天D8Count第14天D14Count1mmu-miR-148a-3p96003mmu-miR-148a-3p368038mmu-miR-148a-3p616282mmu-miR-181a-5p39355mmu-miR-181a-5p310394mmu-miR-181a-5p613133mmu-miR-22-3p22133mmu-miR-22-3p117528mmu-miR-22-3p248214mmu-miR-27b-3p16676mmu-miR-27b-3p111474mmu-miR-27b-3p177655mmu-miR-30a-5p16250mmu-miR-30a-5p80423mmu-miR-143-3p164956mmu-miR-146b-5p15132mmu-miR-143-3p66200mmu-miR-30a-5p164017mmu-let-7f-5p11204mmu-miR-26a-5p62362mmu-miR-215-5p138758mmu-miR-378a-3p8749mmu-let-7f-5p54063mmu-miR-141-3p107649mmu-let-7i-5p8512mmu-miR-141-3p49141mmu-miR-192-5p971810mmu-miR-26a-5p8147mmu-miR-378a-3p46642mmu-let-7f-5p9670
数据来源于试验幼鼠2
Data comes from the experimental newborn mice 2
5 其 他
通过对比不同动物乳中的miRNAs,发现有部分miRNAs的表达量都相对较高,如miR-148a、let-7家族、miR-182-5p、miR-378、miR-141、miR-30a-5p、miR-27b-3p、miR-146b-5p、miR-26a等在多数动物乳中都是高表达的,说明这些miRNAs在物种进化上的保守性,而这种保守性也预示着它们具有某种生物学功能。
乳中的miRNA与免疫、生长发育、细胞、组织、神经、代谢等相关,如牛乳中miR-101、miR-125b、miR-150、miR-21、miR-24-1、miR-93、miR-181a、miR-142-5p、miR-146a、miR-17-5p等与免疫相关;miR-15b、miR-106b、miR-155、miR-223、miR-27b、miR-34a、miR-130a等与免疫和发育相关;miR-122、miR-183、miR-96、miR-1、miR-206、miR-184、miR-451、miR-9等与组织相关。人们更倾向于对乳中与新生儿免疫、发育相关的miRNA的研究,如let-7a、let-7c、let-7f、miR-181b、miR-30a-3p、miR-320、miR-423-5p、miR-378等与IgA免疫网络密切相关。
此外,已有报道证实包裹于人乳exosome中的miRNA能抵抗胃肠道的消化,并能被肠上皮细胞所吸收[32],甚至牛乳中的miRNA能通过饮食跨物种转移到人、鼠肠细胞中[7]。这些体外试验的证据共同表明乳中的miRNA是可以被子代吸收的。然而,最新的研究发现母乳中的miRNA在胃肠道里会快速降解,而且证实了miRNA并不能通过肠道,因此不能被子代所吸收从而发挥作用。该研究作者推测造成试验结果不统一是因为以往的研究不能完全模拟真正的肠道环境(如酶活,胆酸等),单因素分析结果可信度不高[17]。综上所述,miRNA能否被子代吸收利用如今存在争议。若能证实乳中miRNA能被吸收利用,那这些功能相关的miRNA必将对初生子代各组织、器官、系统发育产生影响,而这些影响可能贯穿个体整个发育过程乃至生命周期。
目前人们对乳中miRNA的种类已进行了分析,但不同动物乳中miRNA的差异还需要更多资料的证实。另外,乳中miRNA的功能分析刚刚起步,将是乳营养理论的下一个研究热点。
[1]JOHNSTONE R M,ADAM M,HAMMOND J R,et al.Vesicle formation during reticulocyte maturation.Association of plasma membrane activities with released vesicles (exosomes)[J].JBiolChem,1987,262(19):9412-9420.
[2]VAN BALKOM B W,PISITKUN T,VERHAAR M C,et al.Exosomes and the kidney:prospects for diagnosis and therapy of renal diseases[J].KidneyInt,2011,80(11):1138-1145.
[3]ZHOU H,CHERUVANKY A,HU X,et al.Urinary exosomal transcription factors,a new class of biomarkers for renal disease[J].KidneyInt,2008,74(5):613-621.
[4]DUIJVESZ D,LUIDER T,BANGMA C H,et al.Exosomes as biomarker treasure chests for prostate cancer[J].EurUrol,2011,59(5):823-831.
[5]NILSSON J,SKOG J,NORDSTRAND A,et al.Prostate cancer-derived urine exosomes:a novel approach to biomarkers for prostate cancer[J].BrJCancer,2009,100(10):1603-1607.
[6]VAN DEN BOORN J G,SCHLEE M,COCH C,et al.SiRNA delivery with exosome nanoparticles[J].NatBiotechnol,2011,29(4):325-326.
[7]WOLF T,BAIER S R,ZEMPLENI J.the Intestinal transport of bovine milk exosomes is mediated by endocytosis in human colon carcinoma caco-2 cells and rat small intestinal IEC-6 cells[J].JNutr,2015,145(10):2201-2206.
[8]HOWARD K M,JATI KUSUMA R,BAIER S R,et al.Loss of miRNAs during processing and storage of cow’s (Bostaurus) milk[J].JAgricFoodChem,2015,63(2):588-592.
[9]WEBER J A,BAXTER D H,ZHANG S,et al.The microRNA spectrum in 12 body fluids[J].ClinChem,2010,56(11):1733-1741.
[10]HATA T,MURAKAMI K,NAKATANI H,et al.Isolation of bovine milk-derived microvesicles carrying mRNAs and microRNAs[J].BiochemBiophysResCommun,2010,396(2):528-533.
[11]ZHOU Q,LI M,WANG X,et al.Immune-related microRNAs are abundant in breast milk exosomes[J].IntJBiolSci,2012,8(1):118-123.
[12]CHEN X,GAO C,LI H,et al.Identification and characterization of microRNAs in raw milk during different periods of lactation,commercial fluid,and powdered milk products[J].CellRes,2010,20(10):1128-1137.
[13]KOSAKA N,IZUMI H,SEKINE K,et al.microRNA as a new immune-regulatory agent in breast milk[J].Silence,2010,1(1):7.
[14]GU Y,LI M,WANG T,et al.Lactation-related microRNA expression profiles of porcine breast milk exosomes[J].PLoSOne,2012,7(8):e43691.
[15]CHEN T,XI Q Y,YE R S,et al.Exploration of microRNAs in porcine milk exosomes[J].BMCGenomics,2014,15:100.
[16]IZUMI H,KOSAKA N,SHIMIZU T,et al.Time-dependent expression profiles of microRNAs and mRNAs in rat milk whey[J].PLoSOne,2014,9(2):e88843.
[17]TITLE A C,DENZLER R,STOFFEL M.Uptake and function studies of maternal milk-derived microRNAs[J].JBiolChem,2015,290(39):23680-23691.
[18]IZUMI H,KOSAKA N,SHIMIZU T,et al.Bovine milk contains microRNA and messenger RNA that are stable under degradative conditions[J].JDairySci,2012,95(9):4831-4841.
[19]IZUMI H,KOSAKA N,SHIMIZU T,et al.Purification of RNA from milk whey[J],MethodsMolBiol,2013:191-201.
[20]ARROYO J D,CHEVILLET J R,KROH E M,et al.Argonaute2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma[J].ProcNatlAcadSciUSA,2011,108(12):5003-5008.
[21]MODEPALLI V,KUMAR A,HINDS L A,et al.Differential temporal expression of milk miRNA during the lactation cycle of the marsupial tammar wallaby (Macropuseugenii)[J].BMCGenomics,2014,15(1):1012.
[22]IZUMI H,TSUDA M,SATO Y,et al.Bovine milk exosomes contain microRNA and mRNA and are taken up by human macrophages[J].JDairySci,2015,98(5):2920-2933.
[23]LIU X,ZHAN Z,XU L,et al.MicroRNA-148/152 impair innate response and antigen presentation of TLR-triggered dendritic cells by targeting CaMKIIalpha[J].JImmunol,2010,185(12):7244-7251.
[24]GUO S L,PENG Z,YANG X,et al.miR-148a promoted cell proliferation by targeting p27 in gastric cancer cells[J].IntJBiolSci,2011,7(5):567-574.
[25]CHEN Y,SONG Y X,WANG Z N.The microRNA-148/152 family:multi-faceted players[J].MolCancer,2013,12(1):43.
[26]ZHENG B,LIANG L,WANG C,et al.MicroRNA-148a suppresses tumor cell invasion and metastasis by downregulating ROCK1 in gastric cancer[J].ClinCancerRes,2011,17(24):7574-7583.
[27]ZHANG H,LI Y,HUANG Q,et al.MiR-148a promotes apoptosis by targeting Bcl-2 in colorectal cancer[J].CellDeathDiffer,2011,18(11):1702-1710.
[28]HINO K,TSUCHIYA K,FUKAO T,et al.Inducible expression of microRNA-194 is regulated by HNF-1alpha during intestinal epithelial cell differentiation[J].RNA,2008,14(7):1433-1442.
[29]SATO F,TSUCHIYA S,MELTZER S J,et al.MicroRNAs and epigenetics[J].FEBSJ,2011,278(10):1598-1609.
[30]PAN W,ZHU S,YUAN M,et al.MicroRNA-21 and microRNA-148a contribute to DNA hypomethylation in lupus CD4+T cells by directly and indirectly targeting DNA methyltransferase 1[J].JImmunol,2010,184(12):6773-6781.
[31]REINHARDT T A,SACCO R E,NONNECKE B J,et al.Bovine milk proteome:quantitative changes in normal milk exosomes,milk fat globule membranes and whey proteomes resulting from Staphylococcus aureus mastitis[J].JProteomics,2013,82:141-154.
[32]LONNERDAL B,DU X,LIAO Y,et al.Human milk exosomes resist digestioninvitroand are internalized by human intestinal cells[J].FASEBJ,2015,29(1 Supplement):121.3.
(编辑郭云雁)
Research Progress of miRNA in Milk
LIN De-lin,CHEN Ting,LI Meng,XIE Mei-ying,XI Qian-yun,SUN Jia-jie,ZHANG Yong-liang*
(NationalEngineeringResearchCenterForBreedingSwineIndustry,CollegeofAnimalScience,SouthChinaAgriculturalUniversity,Guangzhou510642,China)
Exosome exist in various kinds of body fluid,including milk,serum,urea,etc.It was reported that proteins,mRNAs,microRNAs,lipids,etc in exosome are transferred into receptor cells to play some physiological roles.In recent years,although there are a number of researchs on miRNA in animals,relatively a few studies illustrated miRNAs in milk.In this review,by collecting and collating some reports published,we confirmed the presence of miRNAs in the milk and they enriched in exosome,then compared the similarities and differences of miRNAs with high expression in different animal milk.We also concentrated on miRNAs highly expressed in exosome,and then drew some general conclusions.Moreover,we analyzed the other miRNAs binding forms in milk,then discussed the conservation of miRNAs in different animal milk and possible physiological function of miRNAs.
milk;exosome;miRNA
10.11843/j.issn.0366-6964.2016.09.001
2015-12-02
国家自然科学基金 (31472163);农业部转基因重大专项(2014ZX08009-048B);广东省科技计划项目(S2013020012766)
林德麟(1990-),男,广东佛山人,硕士生,主要从事microRNA的研究,E-mail:al469223174@163.com
张永亮,教授,E-mail:zhangyl@scau.edu.cn
S813.3
A
0366-6964(2016)09-1739-10
