后期酰基转移酶编码基因lpxL对禽致病性大肠杆菌菌株E058致病性的影响
2016-11-01许慧卿穆晓惠高清清凌洁露
许慧卿,高 璐,穆晓惠,高清清,凌洁露,高 崧
(1.扬州大学旅游烹饪(食品科学)学院,扬州 225127;2.扬州大学兽医学院,扬州 225009)
后期酰基转移酶编码基因lpxL对禽致病性大肠杆菌菌株E058致病性的影响
许慧卿1*,高璐1,穆晓惠2,高清清2,凌洁露2,高崧2
(1.扬州大学旅游烹饪(食品科学)学院,扬州 225127;2.扬州大学兽医学院,扬州 225009)
本研究旨在探讨禽致病性大肠杆菌后期酰基转移酶编码基因lpxL对其细胞膜结构、生物学特性的影响,揭示大肠杆菌的致病机制。通过构建大肠杆菌lpxL基因突变株,比较其与野生株的结构、生物学特性及致病性的差异。结果显示lpxL基因突变株的细胞表面结构较平滑,生长速度、内毒素含量与野生株相比明显下降;相应的LPS刺激HD11细胞后,细胞产生的NO及细胞因子表达量也较野生株LPS处理组有不同程度的下降;感染试验显示突变株对SPF鸡的脏器损伤明显减弱。综上所述,后期酰基转移酶编码基因lpxL对禽大肠杆菌的生物学特性及致病性十分重要。
后期酰基转移酶;lpxL;禽致病性大肠杆菌;致病性
禽致病性大肠杆菌(avian pathogenicEscherichiacoli,APEC)能引起禽类局部或全身性感染[1]。自1894年首次报道以来,大肠杆菌病成为危害养禽业的重要疾病之一,且无论是在发病动物还是在发病时间以及发病率和发病严重程度上,其上升趋势越来越明显[2]。禽大肠杆菌病给养禽业造成了严重的经济损失,已成为危害最严重的细菌性传染病之一。
致病性大肠杆菌相关毒力因子分为外毒素和内毒素两大类。内毒素(或称为脂多糖,lipopolysaccharide,LPS)是所有革兰阴性细菌细胞壁外膜上的主要结构成分,对细菌生长和活力十分重要,且是革兰阴性细菌的主要致病因子[3]。越来越多的研究表明:LPS分子中真正具有内毒素活性的基团是类脂A(Lipid A),类脂A的结构与其致病能力密切相关[4]。目前已有一些团队开始研究通过改变LPS结构来降低其毒性,从而构建减毒细菌疫苗或疫苗载体[5]。但是,有许多相反的结果值得我们思考,比如,Neisseriaspp.产生六酰的类脂A,但其入侵黏膜下免疫系统却没有引发任何的局部炎症;某些非六酰基类脂A的致病菌能延长在巨噬细胞内的生存时间。因此,关于LPS与天然免疫的机制还有不清楚的地方。
大肠杆菌中类脂A的合成和转运途径是美国科学家C.R.H.Raetz等于2002年提出的,共有10步反应,涉及到几十个基因,最后2 步是由后期酰基转移酶LpxL和LpxM分别在兼性分子DSMP上加了月桂酸和肉豆蔻酸,从而形成完整的lipid A[6-8]。关于缺失后期酰基转移酶LpxL后禽大肠杆菌致病性的变化目前尚无报道。作者通过构建禽高致病性大肠杆菌后期酰基转移酶LpxL的编码基因lpxL缺失突变株,研究其生物学特性及致病性,来探讨酶LpxL对致病性的影响。
1 材料与方法
1.1材料
禽致病性大肠杆菌O2分离株E058由作者实验室保存,TaqDNA聚合酶,T4 DNA 连接酶和DNA Ladder Mix marker购自Fermentas公司,RNAiso Plus,PrimeScript RT-PCR Kit和DNA Marker购自大连TaKaRa公司,DMEM细胞培养基和胎牛血清购自Gibco公司,其他试剂均为国药产品(分析纯)。
筛选用培养基中抗生素的质量浓度:氨苄青霉素为60 mg·L-1,氯霉素为170 mg·L-1。
1.2方法
1.2.1lpxL基因的扩增及克隆载体的构建根据GenBank公布的序列,设计扩增lpxL基因的特异性引物LLA/LLB(表1),引物由上海生物工程技术服务有限公司合成。
表1试验所用PCR引物
Table 1PCR primers used in this study

名称Name引物序列(5'-3')Primersquence(5'-3')长度/bpSize(bp)LLACTCTCTAGATGGTGCCATCATGATGCA27LLBCTCGAGCTCATTGTGCATCGCAACCTG27LLCCTCGAATTCCGGTCGAGCATCGATTTA27LLDCTCGATATCGCACCGGATCATGATTAC27LLECCAGTTTATAGGGGTGTC18LLFGGTTGTGTAACACTGGCA18CFEVCTCGATATCTTGTGTAGGCTGGAGCTGCT27CRVICTCGAATTCATGGGAATTAGCCATGGTCC27IL-1AGCTCTACATGTCGTGTGTGATGAG24IL-1BTGTCGATGTCCCGCATGA18IL-6AAGGACGAGATGTGCAAGAAGTTC23IL-6BTTGGGCAGGTTGAGGTTGTT20IL-8ACTGCTCTGTCGCAAGGTAG19IL-8BTGAATGGATTTAGGGTGGAT20
用全菌裂解法进行细菌DNA模板的制备[9],用普通PCR方法扩增lpxL基因,产物经0.7% 琼脂糖凝胶电泳鉴定正确后用Agarose Gel DNA纯化试剂盒纯化回收DNA片段,-20 ℃保存。
1.2.2重组质粒pCRlpxLcat的构建将纯化回收的lpxL基因片段与克隆载体pMD®18-T Simple Vector进行双酶切连接,经测序鉴定正确的即为重组质粒pCRlpxL。以重组质粒pCRlpxL为模板,用引物LLC/LLD(表1)反向扩增;以pKD3质粒为模板,用引物CFEV/CRVI(表1)扩增氯霉素抗性基因。分别将上述片段双酶切后用T4连接酶连接,鉴定正确的即为重组质粒pCRlpxLcat。
1.2.3E058株lpxL基因缺失突变株的构建按Q.Q.GAO等的方法[10],用λ-Red重组系统构建E058株lpxL基因突变株。将质粒pKD46电转入E058以表达重组酶,以重组质粒pCRlpxLcat为模板,用引物LLA/LLB(表1)扩增相应片段,然后将上述片段电转入E058。挑取含氨苄青霉素和氯霉素双重抗性的菌落,在42 ℃下去除pKD46,得到有氯霉素抗性的E058株lpxL基因缺失突变株,命名为E058ΔlpxL。1.2.4突变株表面结构的电镜观察将新鲜的细菌培养液离心,去上清,然后用PBS重悬,调整菌液至适当的浓度,制作超薄切片,用透射电镜观察[11]。1.2.5SDS-PAGE分析将所有待测菌株的新鲜培养物用PBS调节浓度至OD540 nm=1.0,取1 mL此菌液浓缩3倍,此时菌液的蛋白质质量浓度约为1 mg·L-1。SDS-PAGE按S.GAO等的方法进行[12]。
1.2.6细菌生长曲线的测定将待测菌株初始浓度调节OD600 nm=0.05,在30 ℃恒温摇床中,以220 r·min-1摇振培养。连续4 h,每隔0.5 h测定培养物的OD600 nm值,并绘制细菌的生长曲线,比较野生株与突变株的生长速度。
1.2.7鲎变形细胞溶解物(LAL)试验用鲎试剂通过终点显色法测定待测菌株的内毒素含量[12]。
1.2.8脂多糖的提取采用热酚法提取E058及其突变株E058ΔlpxL的LPS[12]。
1.2.9鸡巨噬细胞HD11 NO含量测定采用Griess分析法[13]。吸取100 μL巨噬细胞HD11(分别用5 000 mg·L-1提取的LPS刺激)培养上清液,然后加入等体积的Griess试剂,室温反应20 min,540 nm处测定吸光度。同时按试剂盒说明书要求绘制标准曲线,并进行计算。每份样品重复3次,取数据平均值。
1.2.10巨噬细胞细胞因子测定将LPS刺激过的巨噬细胞HD11按说明书方法提取的RNA,并反转录成 cDNA,按试剂盒要求,对巨噬细胞细胞因子进行用相对定量法进行荧光定量分析。相对定量的结果采用2-ΔΔct方法[13]进行处理。
1.2.11组织病理学观察取30只21日龄的SPF鸡(山东家禽所SPF种蛋,自行孵化后于隔离器内饲养),随机分为2组,每组15只,分别于左胸气囊接种0.1 mL的E058野生株(攻毒量为1×107CFU)和突变株(攻毒量为1×1011CFU),24 h后每组随机选3只剖杀,取心、肝、脾、肺和肾于13 %的中性福尔马林溶液中固定,石蜡包埋后制备5 μm厚的切片,用苏木精和伊红染色,用显微镜进行组织病理学观察。
2 结 果
2.1突变株E058ΔlpxL的构建
根据GenBank公布的APEC O1的基因序列,分析启动子和开放性阅读框,结果显示基因lpxL(htrB)拥有独立的单个开放阅读框,含有921 bp的碱基对。
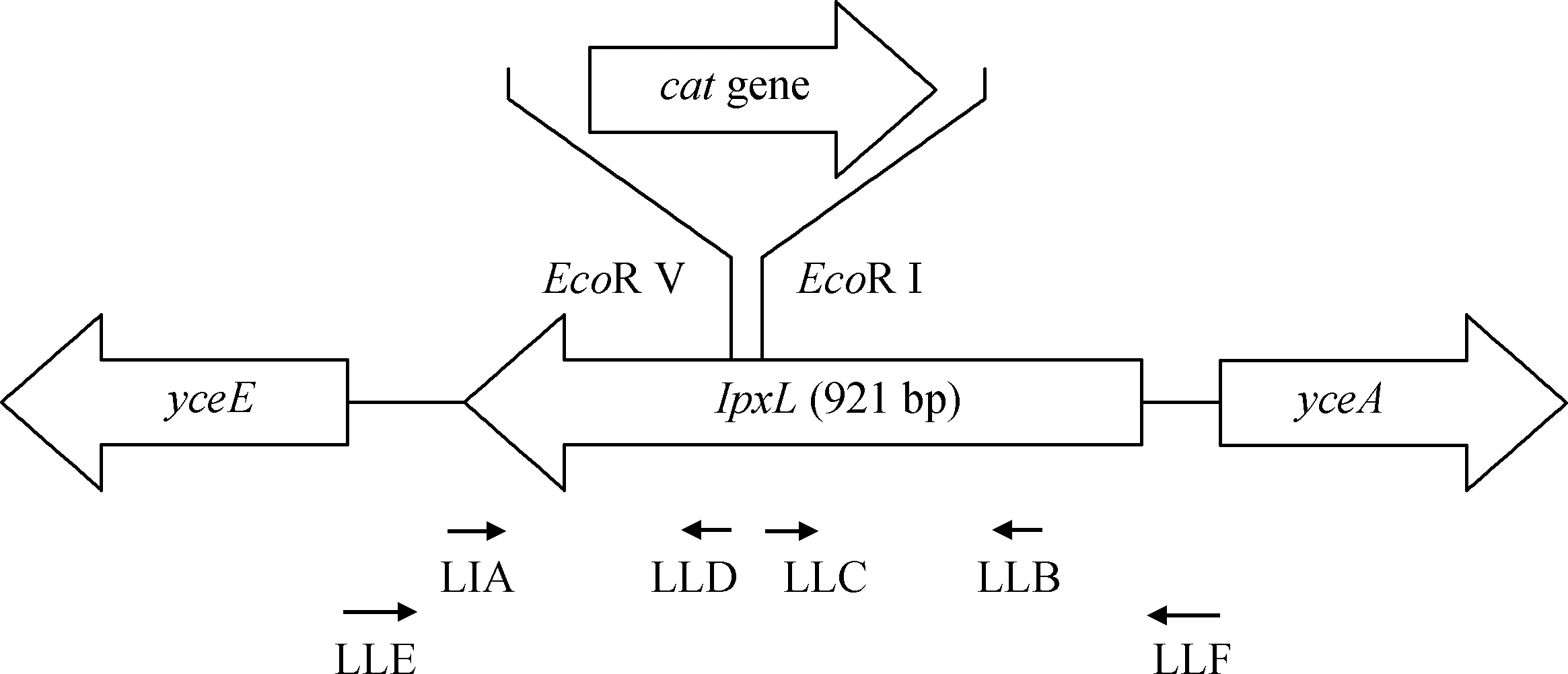
图1 lpxL在 E.coli E058基因组中的位置及突变的位点Fig.1 The location of gene lpxL and the location of deletion in lpxL replaced by a cat gene loci in E.coli E058 genome
按图1所示得到重组质粒pCRlpxPcat,测序结果显示,插入片段大小为1 676 bp,与预期相符。将筛选到的lpxL基因缺失突变株与野生株用LLE/LLF扩增后分别得到2 363和1 371 bp的单一条带(图2),说明氯霉素抗性基因已插入lpxL阅读框,即成功构建突变株E058ΔlpxL。
2.2突变株表面结构的电镜观察及脂多糖的SDS-PAGE鉴定
在透射电镜下,野生株E058细胞表面遍布细小突起(图3A),而E058ΔlpxL表面相对光滑,几乎看不到突起(图3B)。
E058及其突变株的粗提脂多糖经SDS-PAGE电泳,银染结果如图3C所示。所有菌株的LPS均分布于17~26 ku。野生株E058的LPS为三条带,且17 ku附近的条带染色结果呈黑色;而E058ΔlpxL只剩下17 ku附近浅棕色条带,其他两个条带均消失。
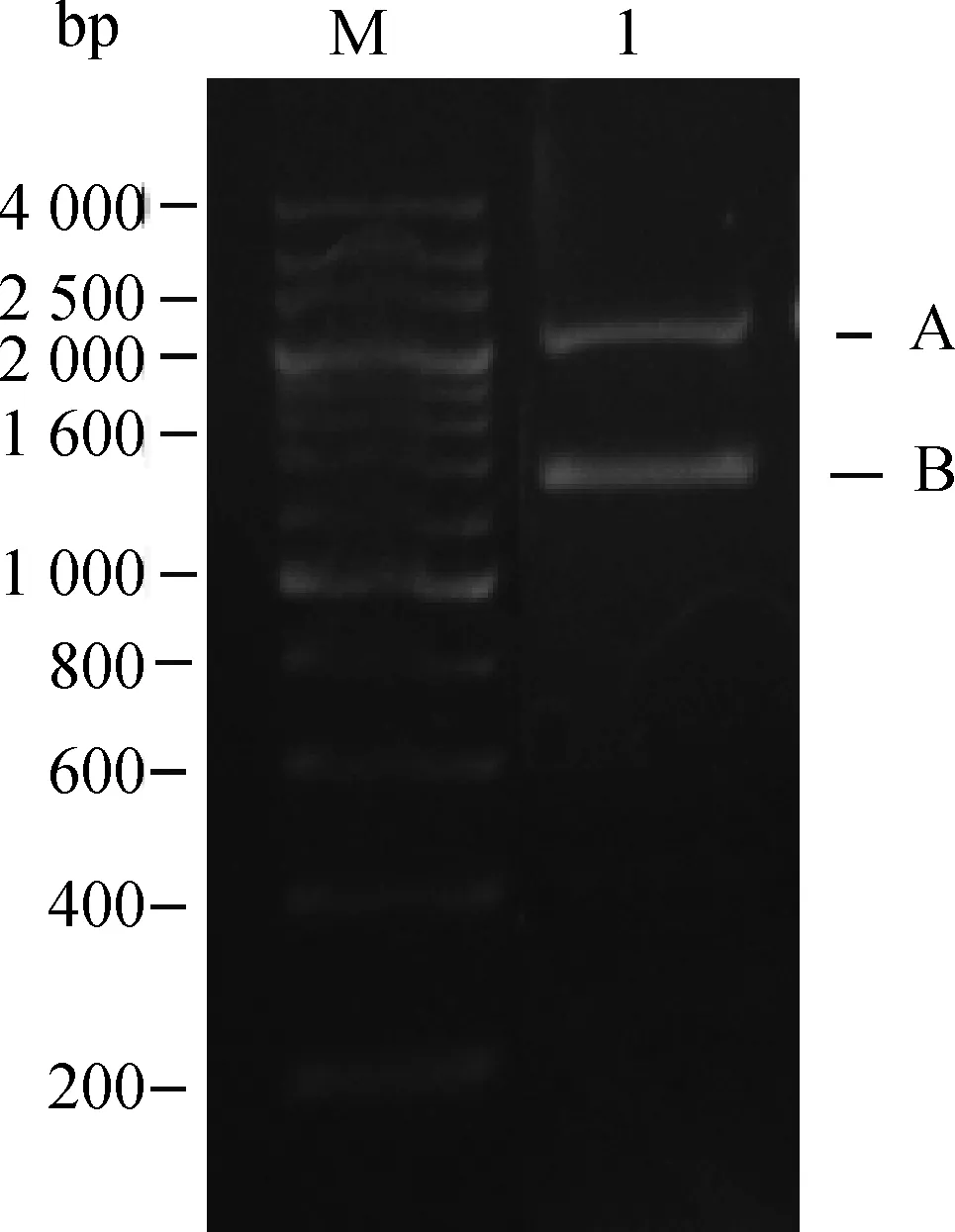
M.200 bp DNA相对分子质量标准;1.突变株和野生株lpxL扩增片段;A.突变株的lpxL基因片段;B.野生株lpxL基因片段M.200 bp DNA marker;1.The amplified fragment of gene lpxL by primer LLE/LLF;A.The lpxL fragment of E058ΔlpxL;B.The lpxL fragment of E058图2 基因lpxL缺失突变株的鉴定Fig.2 Identification of E058 lpxL gene by PCR
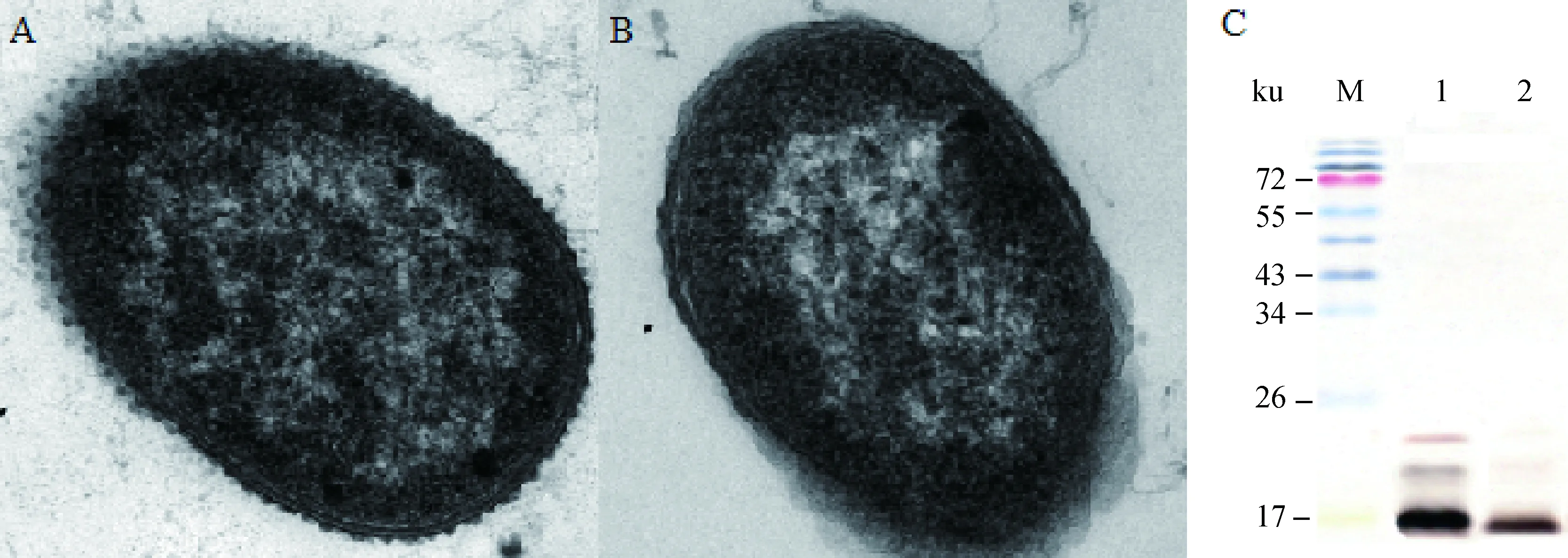
A.野生株E058;B.突变株E058ΔlpxL;C.E058及其突变株E058ΔlpxL脂多糖的SDS-PAGE(1.E058的脂多糖;2.E058ΔlpxL的脂多糖)A.Morphous of E058;B.Morphous of E058ΔlpxL;C.SDS-PAGE of LPS from E058 and E058ΔlpxL (1.LPS of E058;2.LPS of E058ΔlpxL)图3 E058及其突变株E058ΔlpxL电镜观察和SDS-PAGE分析Fig.3 Morphous of E058 and E058ΔlpxL by electron microscope and SDS-PAGE
2.3生长曲线及LAL试验结果分析
LAL试验结果显示,当细菌浓度为OD600 nm=0.1时,E058ΔlpxL(5.59×103EU·mL-1)与野生株(6.02×103EU·mL-1)之间的内毒素含量差异显著(P<0.05)。
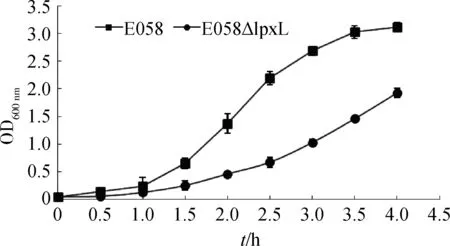
图4 大肠杆菌野生株E058和突变株E058ΔlpxL的生长曲线分析Fig.4 Growth curves of wild type strain E058 and mutant E058ΔlpxL
2.4一氧化氮与细胞因子产量分析
LPS刺激后导致NO产量的变化如图5所示。对照组与试验组产生的NO产量均随着刺激时间的推移而不断地增加。但与对照组相比,试验组产生的NO量在6 h(P<0.05)和8 h(P<0.01)显著减少。
LPS刺激细胞免疫系统后可以产生多种致炎性和抗炎性的细胞因子,这些炎性因子在炎症反应过程中起着重要的作用。如图5所示,LPS刺激HD11以后,HD11产生各种炎性细胞因子,包括IL-1β、IL-6和IL-8等白细胞介素。本研究结果显示,试验组及对照组的IL-1β和IL-6 mRNA转录量均在2 h左右达到最大,然后逐渐下降,但到达峰值时对照组的表达量显著高于试验组(P<0.01)。对照组的IL-8 mRNA转录量在1 h时上升,然后逐渐下降,但随后又上升,到8 h时到达高峰,而试验组从1 h以后IL-8转录量就逐渐下降。野生株E058来源的LPS刺激细胞产生炎性因子的能力显著高于突变株E058ΔlpxL来源的LPS,其mRNA转录量在峰值时差异极显著(P<0.01)。
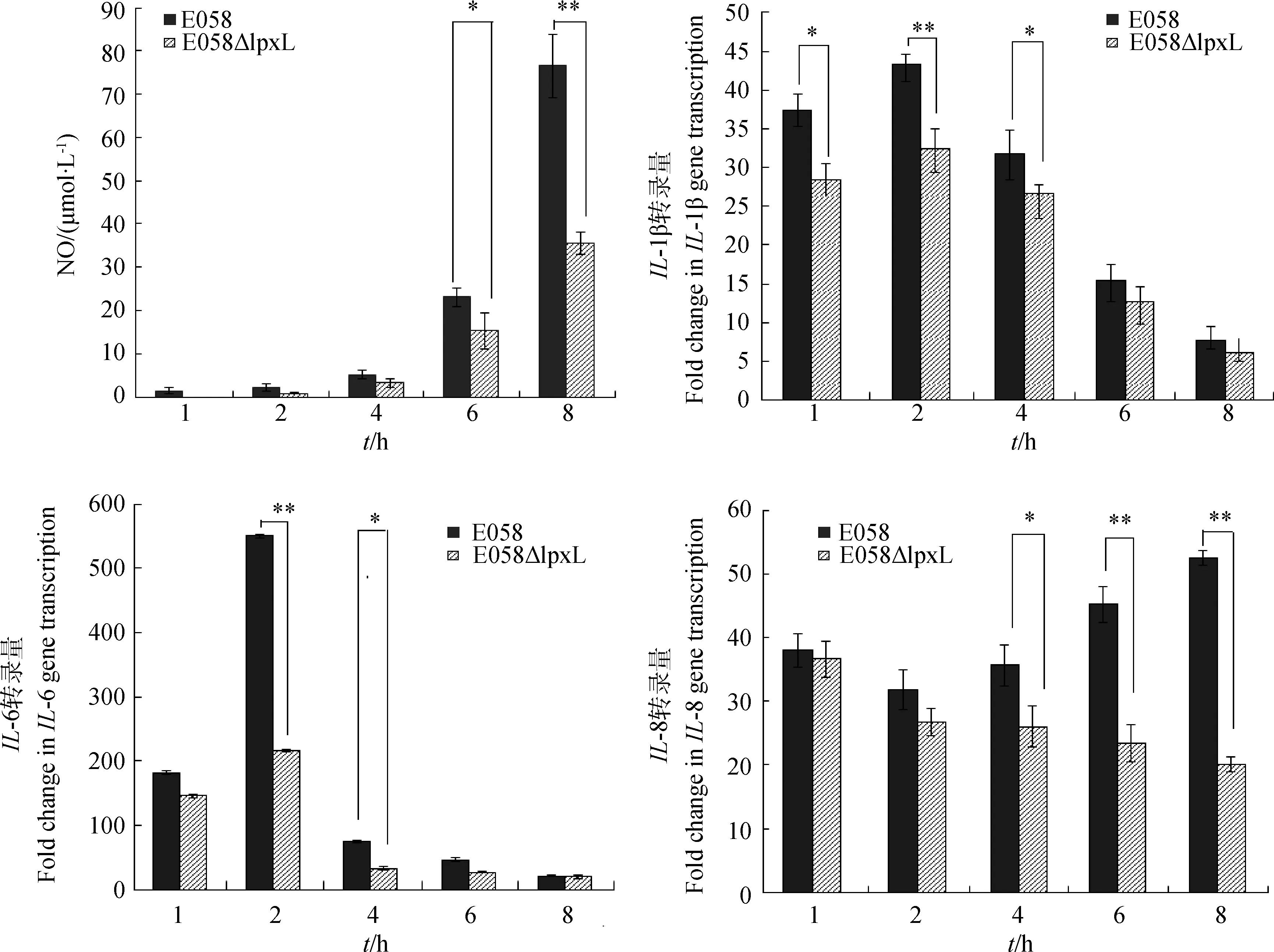
A.NO含量;B.IL-1β转录量变化;C.IL-6转录量变化;D.IL-8转录量变化;DH11分别用E058和E058ΔlpxL来源的LPS刺激,*表示 P<0.05,**表示P<0.01A.Nitric oxide production;B.mRNA transcription of cytokines IL-1β;C.mRNA transcription of cytokines IL-6;D.mRNA transcription of cytokines IL-8.The DH11 cells were treated by LPS from E058 and E058ΔlpxL,respectively.Significant differences between mutant and parental strain are indicated with asterisks;*.P<0.05;**.P<0.01)图5 LPS诱导HD11产生NO和白细胞介素量Fig.5 LPS-induced nitric oxide and interleukin productionin the HD11 cell line
2.5组织病理学观察
对照组(E058感染)SPF鸡出现明显的心包膜增厚,肝部分有较厚的黄色纤维素膜包裹,且表面有散在的白色坏死点(图6),而试验组(E085ΔlpxL感染)未发现明显变化。
经试用,该导航能在选定导航路线的时候提示该路线上的天气影响情况以及目的地的能见度、温度、风速等。但功能比较简单,缺少使用说明,信息的预报准确度有待验证。
E058及其突变株对SPF鸡各脏器的病理学损伤如图7所示。E058感染组SPF鸡出现中度心包炎,肝周炎,脾淋巴细胞变性、坏死,肺间质内可见少量异嗜性粒细胞浸润,肾小管上皮细胞核发生浓缩、碎裂和溶解;而试验组仅出现轻微的肝周炎。结果提示禽大肠杆菌E058的lpxL基因与其对SPF鸡的致病力有关。
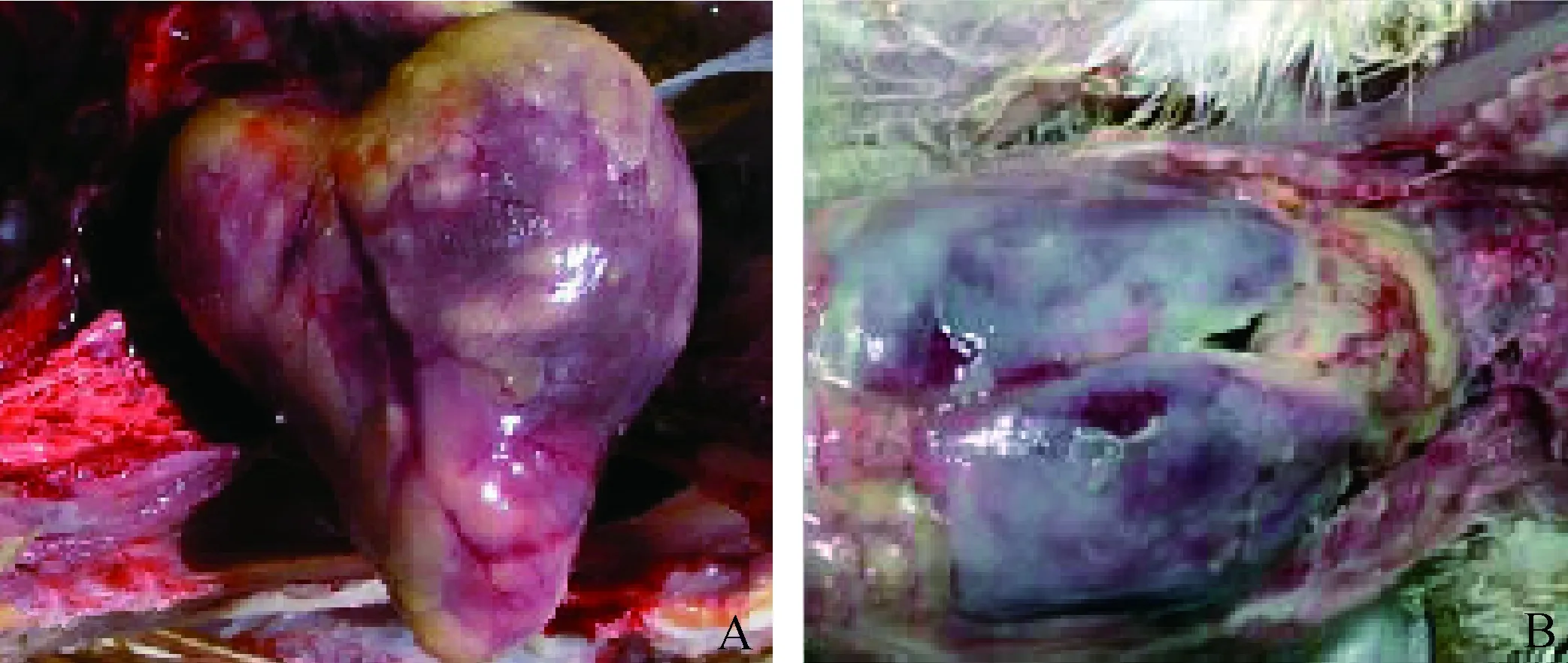
图6 E058感染SPF鸡后心(A)和肝(B)的病理变化Fig.6 Heart sections (A) and liver sections (B) pathological change from chickens infected with the virulent wild-type strain E058
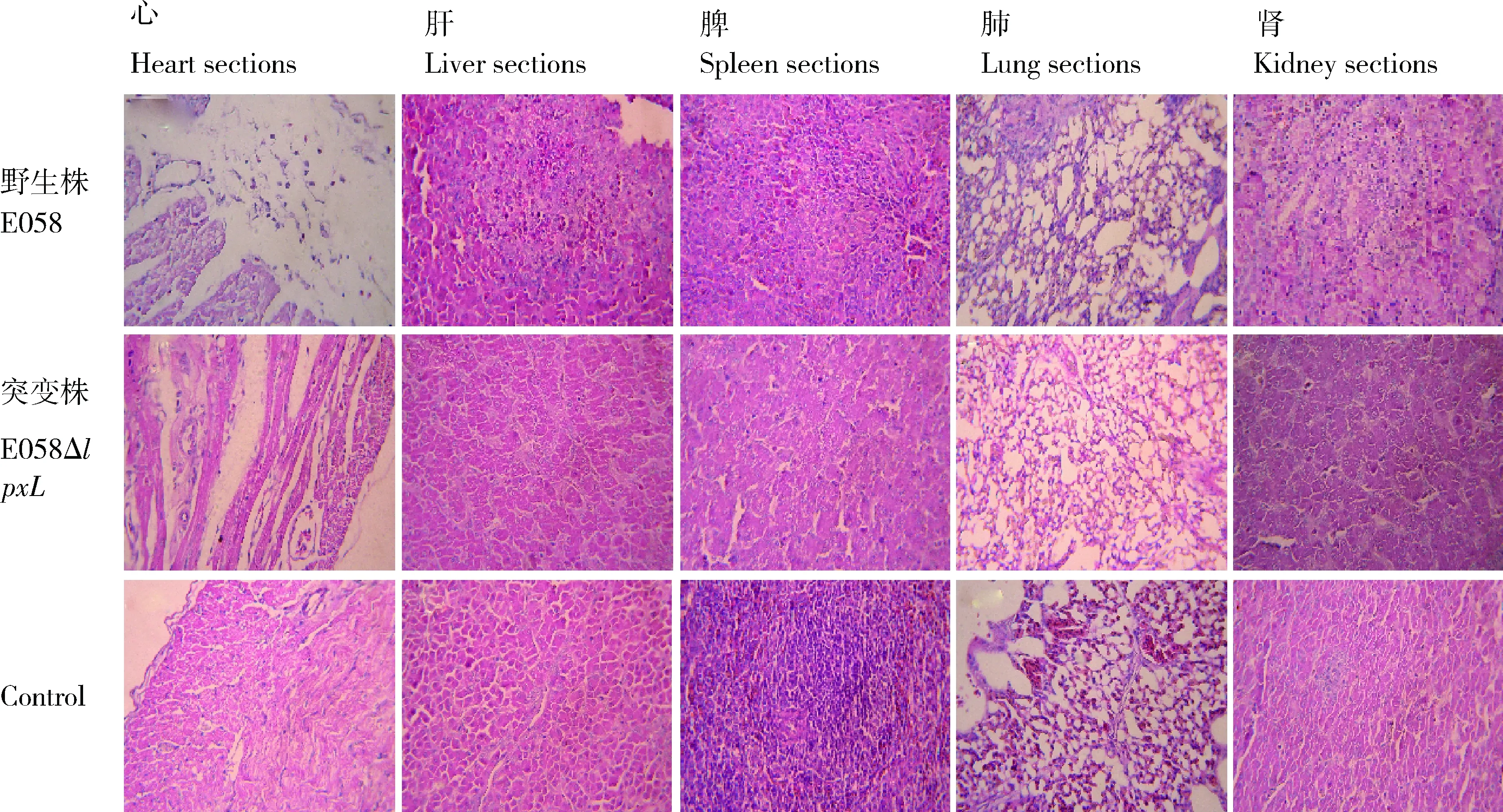
图7 E058及其突变株E058ΔlpxL感染SPF鸡后各脏器病理损伤Fig.7 Organ sections from chickens infected via air sac inoculation with the virulent wild-type strain or the mutant E058ΔlpxL
3 讨 论
作为高致病性的革兰阴性菌,禽致病性大肠杆菌优势血清型O2∶K1分离株E058外膜上的LPS对其致病性和感染能力具有重要的作用。其中,lipid A是LPS的疏水基团,同时也是细菌外膜外层的主要组成部分。对后期酰基转移酶LpxM及糖基转移酶WaaL等LPS合成相关酶的研究显示,lipid A的完整性影响大肠杆菌的一系列生物学特性,如生长速度、内毒素含量、对某些疏水试剂的敏感性以及对宿主的致病性等[13-15]。然而关于后期酰基转移酶LpxL对致病性的影响研究较少。
本研究结果显示lpxL基因编码的后期酰基转移酶LpxL同样影响大肠杆菌细胞表面结构,同时lpxL基因缺失突变株的一些生物学特性与野生株相比,也有显著差异,提示与lpxM基因类似,lpxL基因同样对大肠杆菌细胞膜结构的完整性,及与此相关的一系列生物学特性密切相关。
M.K.Vorachek-Warren等认为lpxL基因缺失会影响高温下大肠杆菌在丰富培养基中的生长[14]。在本研究中,突变株E058ΔlpxL能在30 ℃ LB培养基中缓慢地生长。生长速度的变化和LAL试验结果提示lpxL基因与革兰阴性菌生物学特性及致病性密切相关,这与S.Gao等对莫拉菌的研究结果一致[12],但LAL作用究竟是对lipid A的核心部位还是次级链,需要进一步研究。基因突变后生长速度与内毒素含量的变化也提示细菌中存在多种调控机制调节菌体的生命活动以适应不断变化的外界环境。与无毒菌株或低毒菌株相比,一些高致病性的病原细菌,它们往往通过调节毒力基因的表达和毒力蛋白的作用来适应生存环境的变化。
单核巨噬细胞是天然免疫系统的主要效应细胞,它可以通过分泌多种细胞因子来调节机体对入侵病原体的炎症反应[16]。LPS作为革兰阴性菌细胞外膜的重要组成部分,在诱导天然免疫反应的过程中起着关键作用,其致病机制主要是LPS通过持续刺激机体单核巨噬细胞系统,被巨噬细胞的模式受体TLR4识别,使巨噬细胞产生大量的细胞因子、活性氧、溶酶体酶、NO等活性物质,引起细胞损伤和凋亡,最终导致失控性炎症反应[17]。因此被LPS感染后机体死亡率较高。
类脂A是LPS的主要成分,研究表明类脂A的致病性及诱导产生的细胞因子种类和数量取决于受体对类脂A结构的识别[18-19]。E.V.Voloshina等研究发现,非六酰基的LPS不能被人类黏膜内皮细胞识别,因而含非六酰基LPS这类菌大多为非致病性的[20]。比如,鼠疫杆菌(Yersiniapestis)在跳蚤体内(21~27 ℃)合成含有6 个脂肪酸链的类脂A,而在人体内(37 ℃)却合成含有4个脂肪酸链的类脂A。带6个脂肪酸链的类脂A能够通过TLR4激活人体的免疫系统,而带4个脂肪酸链的类脂A却不能[21]。最新研究显示,lipid A后期酰基转移酶的位置特异性决定了宿主细胞对相应LPS的识别及免疫反应[22]。本研究中,在对表面模式受体分子TLR4及一系列下游分子的活化过程中,由于E058ΔlpxL来源的类脂A酰基链的缺失使TLR4对其识别能力降低,导致下游一系列分子的活化程度在mRNA水平均低于野生株,最后导致部分白细胞介素及NO的产量也明显降低。在哺乳动物中,这些白细胞外介素对于激活天然免疫反应和合成急性期蛋白是必需的,也是对LPS刺激所诱导的天然免疫反应所必需的[23]。本研究结果进一步证明了缺失了次级酰基链的禽致病性大肠杆菌LPS在刺激天然免疫能力上明显弱于野生株的六酰基LPS。但也有研究发现,酰基链减少后,LPS对黏膜免疫免疫系统的刺激能力削弱了,不利于机体的免疫保护[24]。因此关于天然免疫系统如何辨别不同数量和不同来源的脂肪酸链以及对于非六酰基的LPS,宿主天然免疫系统的工作机制还有许多不清楚的地方。
涂健等究发现大肠杆菌内毒素可诱发鸡多脏器损伤以及能引起肝TLR4表达水平变化[25]。LPS(0.1、1 μg·mL-1)可诱导猪小肠上皮细胞TLR4及其信号通路相关基因(CD14、MyD88,TNF-α、IL-Iβ和IFN-α)转录量上调[26]。作者研究发现,对于突变株E058ΔlpxL,基因lpxL的缺失导致类脂A次级酰基链的缺失,从而使突变株对宿主脏器损伤程度明显下降,仅对肝有轻微的病理性损伤,这一结果提示lpxL基因缺失会导致突变株致病力的缺失,这种现象与沙门菌类似。次级酰基链缺失的沙门菌LPS对SPF鸡的致病力也明显下降[27],且TLR4在不同组织中有不同的表达量,差异与所用的鸡的品种有关[28-29]。这些结果提示脂质A的次级酰基链对APEC对动物的致病力有重要的作用,而类脂A结构的变化影响APEC的致病力。
4 结 论
禽致病性大肠杆菌后期酰基转移酶编码基因lpxL的缺失会导致大肠杆菌表面突起减少,生长速度减慢,内毒素含量显著减少,一氧化氮、细胞因子的表达量明显降低,致病性明显减弱。这些结果说明lpxL基因对禽致病性大肠杆菌的生物学物性和致病性有明显影响。
[1]KAPER J B,NATARO J P,MOBLEY H L T.PathogenicEscherichiacoli[J].NatRevMicrobiol,2004,2(2):123-140.
[2]郝葆青,严丹红,农向,等.鸡大肠杆菌病致病因素及其研究进展[J].西南民族大学学报:自然科学版,2005,31(6):924-928.
HAO B Q,YAN D H,NONG X,et al.Research progress on pathogenic factors of chickenEscherichiacoli[J].JournalofSouthwestUniversityforNationalities(NatrualScienceEdition),2005,31(6):924-928.(in Chinese)
[3]NIKAIDO H.Molecular basis of bacterial outer membrane permeability revisited[J].MicrobiolMolBiolRev,2003,67(4):593-656.
[4]TRIANTAFILOU M,TRIANTAFILOU K.Receptor cluster formation during activation by bacterial products[J].JEndotoxinRes,2003,9(5):331-335.
[5]LEITNER D R,FEICHTER S,SCHILD-PRÜFERT K,et al.Lipopolysaccharide modifications of a cholera vaccine candidate based on outer membrane vesicles reduce endotoxicity and reveal the major protective antigen[J].InfectImmun,2013,81(7):2379-2393.
[6]RAETZ C R H,WHITFIELD C.Lipopolysaccharide endotoxins[J].AnnuRevBiochem,2002,71:635-700
[7]POURBAKHSH S A,BOULIANNE M,MARTINEAU-DOIZÉ B,et al.Virulence mechanisms of avian fimbriatedEscherichiacoliin experimentally inoculated chickens[J].VetMicrobiol,1997,58(2-4):195-213.
[8]POURBAKHSH S A,DHO-MOULIN M,BRéE A,et al.Localization of theinvivoexpression of P and F1 fimbriae in chickens experimentally inoculated with pathogenicEscherichiacoli[J].MicrobPathogenesis,1997,22(6):331-341.
[9]SAMBROOK J,RUSSELL D W.Molecular Cloning:A Laboratory Manual[M].3rd ed.Cold Spring Harbor,NY:Cold Spring Harbor Laboratory Press,2001.
[10]GAO Q Q,XU H Q,WANG X B,et al.RfaH promotes the ability of the avian pathogenicEscherichiacoliO2 strain E058 to cause avian colibacillosis[J].JBacteriol,2013,195(11):2474-2480.
[11]许慧卿.禽致病性大肠杆菌E058株lpxL、lpxM和lpxP基因突变株构建及致病性、免疫特性研究[D].扬州:扬州大学,2013.
XU H Q.Construction,pathogenicity and immune characterization oflpxL、lpxMandlpxPmutants of avian pathogenicEscherichiacoliE058[D].Yangzhou:Yangzhou University,2013.(in Chinese)
[12]GAO S,PENG D X,ZHANG W H,et al.Identification of two late acyltransferase genes responsible for lipid A biosynthesis inMoraxellacatarrhalis[J].FEBSJ,2008,275(20):5201-5214.
[13]XU H Q,LING J L,GAO Q Q,et al.Role of thelpxMlipid A biosynthesis pathway gene in pathogenicity of avian pathogenicEscherichiacolistrain E058 in a chicken infection model[J].VetMicrobiol,2013,166(3-4):516-526.
[14]VORACHEK-WARREN M K,RAMIREZ S,COTTER R J,et al.A triple mutant ofEscherichiacolilacking secondary acyl chains on lipid A[J].JBiolChem,2002,277(16):14194-14205.
[15]HAN Y,HAN X G,WANG S H,et al.The waal gene is involved in lipopolysaccharide synthesis and plays a role on the bacterial pathogenesis of avian pathogenicEscherichiacoli[J].VetMicrobiol,2014,172(3-4):486-491.
[16]STASCHKE K A,DONG S C,SAHA J,et al.IRAK4 kinase activity is required for Th17 differentiation and Th17-mediated disease[J].JImmun,2009,183(1):568-577.
[17]CIRACI C,TUGGLE C K,WANNEMUEHLER M J,et al.Unique genome-wide transcriptome profiles of chicken macrophages exposed toSalmonella-derived endotoxin[J].BMCGenomics,2010,11:545.
[18]LEFEVRE P,WITHAM J,LACROIX C E,et al.The LPS-induced transcriptional upregulation of the chicken lysozyme locus involves CTCF eviction and noncoding RNA transcription[J].MolCell,2008,32(1):129-139.
[19]LI Y Y,WANG Z,CHEN J Z,et al.Influence of lipid A acylation pattern on membrane permeability and innate immune stimulation[J].MarDrugs,2013,11(9):3197-3208.
[20]VOLOSHINA E V,SERGIEVICH L A,KARNAUKHOVA N A,et al.The effect of lipopolysaccharide structure on the synthetic activity of human lymphocytes[J].DoklBiochemBiophys,2011,441(1):258-260.
[21]LIAN L,CIRACI C,CHANG G B,et al.NLRC5 knockdown in chicken macrophages alters response to LPS and poly (I:C) stimulation[J].BMCVetRes,2012,8:23.
[22]HITTLE L E,POWELL D A,JONES J W,et al.Site-specific activity of the acyltransferases HtrB1 and HtrB2 inPseudomonasaeruginosalipid A biosynthesis[J/OL].PathogDis,2015,73(8).[2016-7-14].http://femspd.oxfordjournals.org/content/73/8/ftv053.long.
[23]CHIANG H I,BERGHMAN L R,ZHOU H.Inhibition of NF-kB 1 (NF-kBp50) by RNA interference in chicken macrophage HD11 cell line challenged withSalmonellaenteritidis[J].GenetMolBiol,2009,32(3):507-515.
[24]MUNFORD R S.Sensing gram-negative bacterial lipopolysaccharides:a human disease determinant?[J].InfectImmun,2008,76(2):454-465.
[25]涂健,王艳萍,彭开松,等.内毒素诱发鸡多脏器损伤及其对肝TLR4 mRNA表达影响[J].生物学杂志,2007,24(6):13-15.
TU J,WANG Y P,PENG K S,et al.Effect on TLR4 mRNA expression and injury of multitude organs after challenged with lipopolysaccharide in chickens[J].JournalofBiology,2007,24(6):13-15.(in Chinese)
[26]孙丽,夏日炜,殷学梅,等.LPS诱导条件下猪小肠上皮细胞TLR4及其信号通路基因表达变化分析[J].畜牧兽医学报,2015,46(7):1095-1101.
SUN L,XIA R W,YIN X M,et al.Analysis of differential expression ofTLR4 Singaling pathway genes under lipopolysaccharide-induced pig intestinal epithelial cells[J].ActaVeterinariaetZootechnicaSinca,2015,46(7):1095-1101.
[27]LOW K B,ITTENSOHN M,LE T,et al.Lipid A mutantSalmonellawith suppressed virulence and TNFα induction retain tumor-targeting in vivo[J].NatBiotechnol,1999,17:37-41.
[28]盛中伟.鸡NLRC5信号通路相关基因的转录与抗性关联的研究[D].扬州:扬州大学,2012.
SHENG Z W.Correlations between expression of genes in NLRC5 signal pathway and immune performance in chickens[D].Yangzhou:Yangzhou University,2012.(in Chinese)
[29]周作勇.鸡Toll样受体对Eimeriatenella的识别及信号通路研究[D].重庆:西南大学,2012.
ZHOU Z Y.Recognization of chicken toll like receptors onEimeriaTenellaand signaling pathway[D].Chongqing:Xinan University,2012.(in Chinese)
(编辑白永平)
Effect of thelpxLLipid A Biosynthesis Pathway Gene on Pathogenicity of Avian PathogenicEscherichiacoliStrain E058 to Chicken
XU Hui-qing1*,GAO Lu1,MU Xiao-hui2,GAO Qing-qing2,LING Jie-lu2,GAO Song2
(1.CollegeofTourismandCulinaryScinece(FoodScienceandEngineering),YangzhouUniversity,Yangzhou225127,China;2.CollegeofVeterinaryMedicine,YangzhouUniversity,Yangzhou225009,China)
The contribution of the genelpxLto cell membrane structures and bionomics of avian pathogenicEscherichiacoli(APEC) was studied to reveal the pathogenic mechanism of APEC to avian.An isogeniclpxLmutant was constructed from APEC O2 strain E058,and then compared its structure,biological characteristics,and pathogenicity with E058.The results showed that compared with E058,thelpxLmutant had a smoother surface,slower growth rate and reduction of endotoxin.Nitric oxide production reduction and cytokine gene transcription downregulation also were observed in HD11 treated with mutant-derived LPS relative to that in cells treated with E058-derived LPS at different times.The histopathological lesions in visceral organs of birds challenged with the wild-type strain were more severe than in birds infected with the mutant.These results indicated that thelpxLgene is important for the pathogenicity and biological activity of APEC strain E058.
late acyltransferases;lpxL;avian pathogenicEscherichiacoli;pathogenicity
10.11843/j.issn.0366-6964.2016.09.018
2016-03-22
国家自然科学基金(31101305);江苏省自然科学基金(BK2010319)
许慧卿(1972-),江苏太仓人,主要从事动物性食品安全研究,Tel:86-0514-87978133; E-mail:yzuxhq@126.com
许慧卿
S852.612
A
0366-6964(2016)09-1888-09
