猪圆环病毒2型交叉引物恒温扩增检测方法的建立
2016-11-01袁旦一金亚南李晓琪孙志勇
袁旦一,金亚南,李 玲,何 谦,胡 林,李晓琪,孙志勇
(1.四川纳比生物科技有限公司,成都 610041;2.杭州优思达生物技术有限公司,杭州 310053)
猪圆环病毒2型交叉引物恒温扩增检测方法的建立
袁旦一1,金亚南2,李玲1,何谦1,胡林2,李晓琪1,孙志勇1
(1.四川纳比生物科技有限公司,成都 610041;2.杭州优思达生物技术有限公司,杭州 310053)
拟建立一种简便、快速、准确的现场快速分子检测方法,为猪圆环病毒2型(PCV2)疾病的生物安全防控提供技术支撑。采用交叉引物恒温扩增技术原理,根据PCV2Cap基因设计一组交叉扩增引物,用构建的Cap基因重组质粒作为标准DNA模板,对反应体系的引物浓度、Betaine、MgSO4、dNTP、Bst酶、反应温度和时间进行优化,并结合核酸试纸条技术,建立可视化检测PCV2的交叉引物恒温扩增检测方法(PCV2-CPA)。用建立的CPA检测方法、常规PCR和ELISA方法检测经IFA方法标定的127份临床样品,比较这些方法的敏感性、特异性和符合率。结果显示,最佳反应体系为引物F3、B3各 0.5 μmol·L-1,CPR 1 μmol·L-1,DF5F 0.7 μmol·L-1、DF5B 0.9 μmol·L-1,Betaine 0.075 mol·L-1,MgSO43 mol·L-1,dNTPs 0.4 mmol·L-1,BstDNA 聚合酶9.6 U。建立的检测方法58 ℃ 扩增50 min,检测限可达7.6 拷贝·μL-1,灵敏度是常规PCR的10倍;与PCV1、PRV、CSFV、PRRSV、PEDV、TGEV和RV无交叉反应。三种检测方法的敏感性分别为78.08%~94.52%,特异性为87.03%~92.59%,符合率为84.25%~91.34%,ROC曲线图显示三种检测方法中,CPA检测方法效能最优。建立的猪圆环病毒2型交叉引物恒温扩增检测方法不需要PCR仪,仅一台水浴锅或金属浴即可完成病毒DNA的扩增,密闭的核酸检测试纸条使结果判定直观、客观,且可有效避免气溶胶污染,可应用于猪圆环病毒2型的现场快速检测。
猪圆环病毒2型;交叉引物;恒温扩增;检测;气溶胶污染;生物安全防控
猪圆环病毒(porcine circovirus,PCV)属于圆环病毒科、圆环病毒属,为单股负链环状DNA病毒,是已知的最小动物病毒之一。分为PCV1和PCV2两个血清型,其中PCV2致病,是引起断奶仔猪多系统衰竭综合症(postweaning multisystemic wasting syndrome,PMWS)等疾病的主要病原[1]。自1991年加拿大首次报道PMWS以来,以后世界多国相继报道了该病的发生[2-3]。2000年郎洪武等首次报道了我国PCV2的存在,此后的报道也证明PCV2感染在我国猪群中广泛存在[4],由PCV2引发的PMWS等各种疾病持久和广泛蔓延,已给养猪业造成严重威胁。PCV2致病的主要原因是使感染的个体产生免疫抑制,感染猪体免疫细胞受到不同程度的损伤[5],有“猪类艾滋病”之称,目前该病以诊断、预防为主,建立一种简便、快速、准确的检测方法对于及早发现并采取有效方法控制本病显得极为重要。
传统的PCV2检测方法有病毒分离、酶联免疫吸附、免疫组化等,这些方法耗时长,且灵敏度和准确性差;PCR、荧光定量PCR等分子生物学检测方法以其灵敏度高、特异性好、可鉴别亚型得到了广泛的应用[6],但这类方法对仪器设备要求较高,不利于基层单位使用;LAMP[7]检测方法虽对仪器设备要求不高,但却极易造成气溶胶污染而出现假阳性结果。作者利用交叉引物恒温扩增技术原理(cross priming amplification,CPA)[8],针对PCV2 的Cap基因高度保守区域作为靶序列设计引物,构建阳性质粒,对反应条件进行优化,建立了可快速、灵敏、特异地检测PCV2的CPA检测方法,仅需一台水浴锅或金属浴即可完成核酸扩增,其扩增产物用密闭的核酸检测试纸条进行结果判定,检测结果肉眼可见,且可有效避免气溶胶污染,旨在将分子生物学快速检测技术推广至基层实验室甚至养殖场现场,为养殖场生物安全防控提供技术支持。
1 材料与方法
1.1试验材料与试剂
PCV1、PCV2、PRV、CSFV、PRRSV细胞毒为中国农业科学院特产研究所馈赠;FMDV、PEDV、TGEV、RV活疫苗购自哈尔滨维科生物技术开发公司;PCV2质粒为四川纳比生物科技有限公司自己构建;BstDNA 聚合酶、10×ThermoPol®Reaction Buffer及MgSO4为NEB公司产品;Betaine为Sigma产品,dNTPs和无核酸酶水为上海生工产品;核酸试纸条检测装置(及配套缓冲液)由四川纳比生物科技有限公司自主生产;圆环病毒2型ELISA抗原检测试剂盒购自齐一生物科技(上海)有限公司。
1.2主要仪器
恒温金属浴为杭州博日科技有限公司产品,PCR仪来自美国Bio-Rad(PTC02000型),电泳仪为北京六一仪器厂产品(DYY-11型),凝胶成像系统来自英国UVITEC(UVIdoc型),酶标仪来自美国Bio-Rad(iMark680型)。
1.3引物设计和及合成
根据GenBank中PCV2Cap基因序列,利用Primer Premier 5.0软件进行分析并设计5条特异性引物F3、B3、CPR、DF5F、DF5B(表1),其中F3、B3也作为常规PCR的引物,送交生工生物工程(上海)股份有限公司合成,稀释为20 μmol·L-1备用。
表1PCV2-CPA扩增引物设计
Table 1PCV2 cross priming amplification primers design
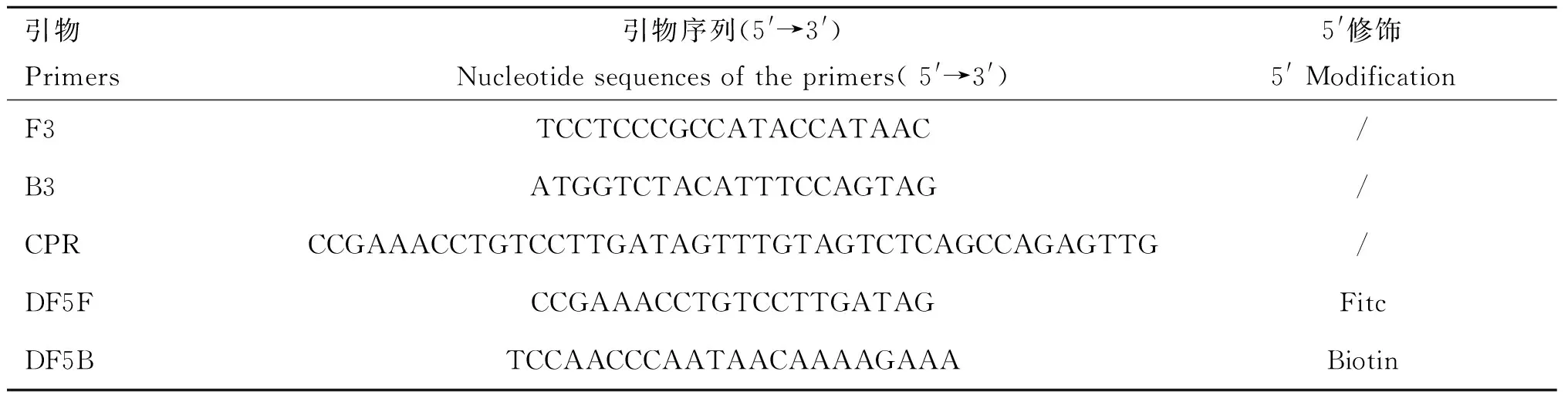
引物Primers引物序列(5'→3')Nucleotidesequencesoftheprimers(5'→3')5'修饰5'ModificationF3TCCTCCCGCCATACCATAAC/B3ATGGTCTACATTTCCAGTAG/CPRCCGAAACCTGTCCTTGATAGTTTGTAGTCTCAGCCAGAGTTG/DF5FCCGAAACCTGTCCTTGATAGFitcDF5BTCCAACCCAATAACAAAAGAAABiotin
1.4猪圆环病毒2型质粒DNA模板的制备
提取PCV2质粒DNA,测定浓度并计算质粒拷贝数。然后将该质粒DNA进行梯度稀释,作为后续试验的DNA 模板及阳性对照。
1.5PCV2-CPA基础扩增体系的建立和反应体系的优化
参考交叉引物恒温扩增文献[8],设置PCV2-CPA 的基础反应体系(表2),用无核酸酶水作为阴性对照,7.6×105拷贝·μL-1的质粒DNA作为阳性模板,在63 ℃下恒温扩增45 min。反应产物用3%琼脂糖凝胶电泳进行检测。若阴、阳性结果成立,则该基础反应体系可用于后续优化。在此基础之上,按照表3对不同浓度引物组合进行优化,其他试剂工作浓度不变,每个组合均设阴性对照。选取最优浓度引物组合,采用控制变量法,对扩增体系中的MgSO4、dNTPs、Betaine、Bst酶、扩增温度和扩增时间进行优化[8],确定最佳反应体系和条件。
表2PCV2-CPA基础反应体系
Table 2The basic reaction system of PCV2-CPA
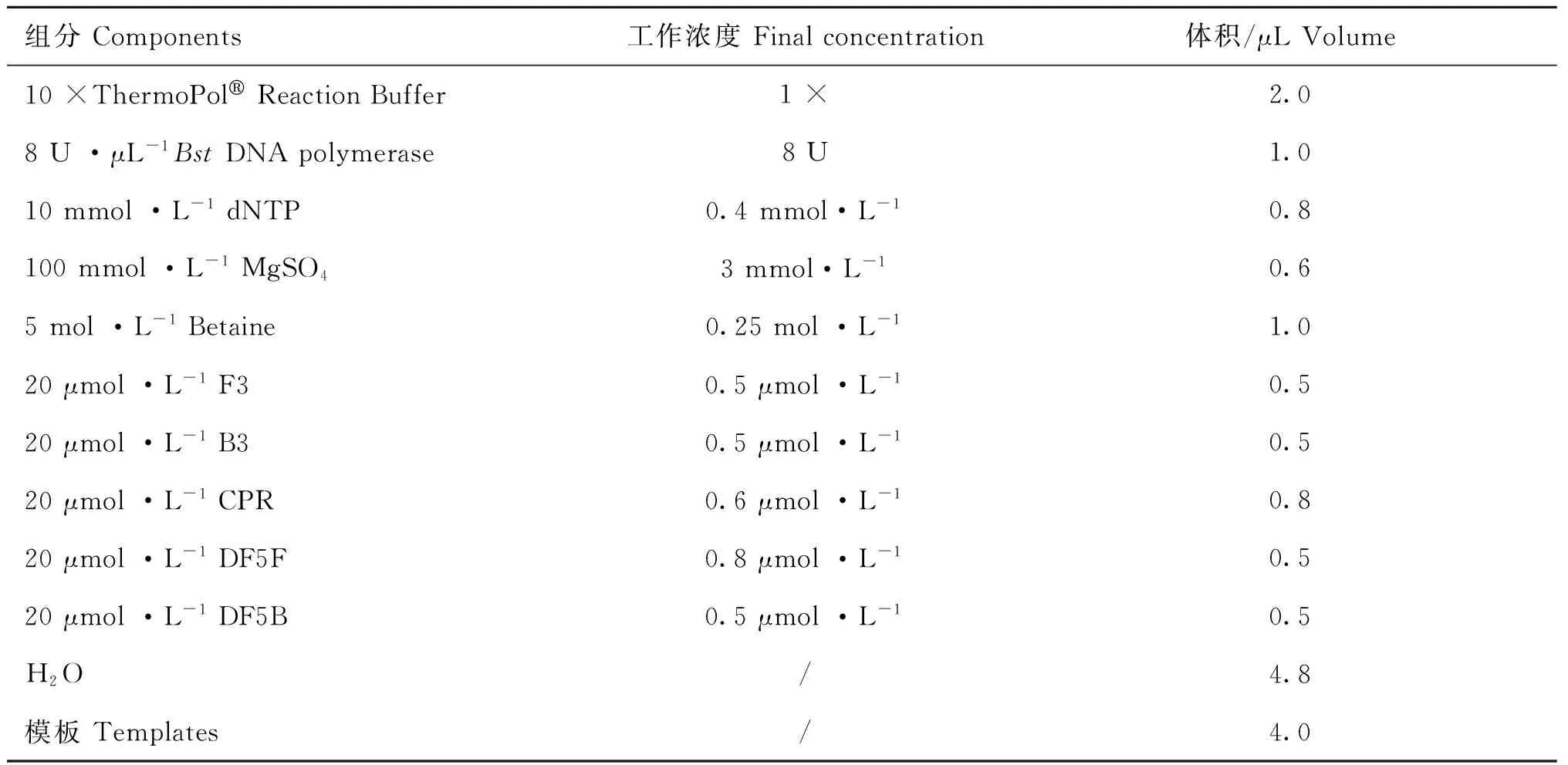
组分Components工作浓度Finalconcentration体积/μLVolume10×ThermoPolReactionBuffer1×2.08U·μL-1BstDNApolymerase8U1.010mmol·L-1dNTP0.4mmol·L-10.8100mmol·L-1MgSO43mmol·L-10.65mol·L-1Betaine0.25mol·L-11.020μmol·L-1F30.5μmol·L-10.520μmol·L-1B30.5μmol·L-10.520μmol·L-1CPR0.6μmol·L-10.820μmol·L-1DF5F0.8μmol·L-10.520μmol·L-1DF5B0.5μmol·L-10.5H2O/4.8模板Templates/4.0
1.6PCV2-CPA方法的交叉反应检测
提取猪常见病毒病病毒株(PCV1、PCV2质粒、PCV2、PRV、CSFV、PRRSV、FMDV、PEDV、TGEV、RV)核酸,用建立的PCV2-CPA检测方法用上述核酸作为模板进行交叉试验。
1.7PCV2-CPA方法与常规PCR法灵敏度比较
用无核酸酶水调整质粒DNA浓度为7.6×1010、7.6×109、7.6×108、7.6×107、7.6×106、7.6×105、7.6×104、7.6×103、7.6×102、7.6×101、7.6×100、7.6×10-1、7.6×10-2拷贝·μL-1,用建立的PCV2-CPA 检测方法和常规PCR方法对上述不同浓度质粒DNA进行扩增,比较灵敏度差异。常规PCR的反应条件:95 ℃ 3 min;95 ℃ 30 s、55 ℃ 40 s、72 ℃ 50 s;35个循环;72 ℃ 10 min。
表3不同浓度引物组合
Table 3Different concentration combinations of primers
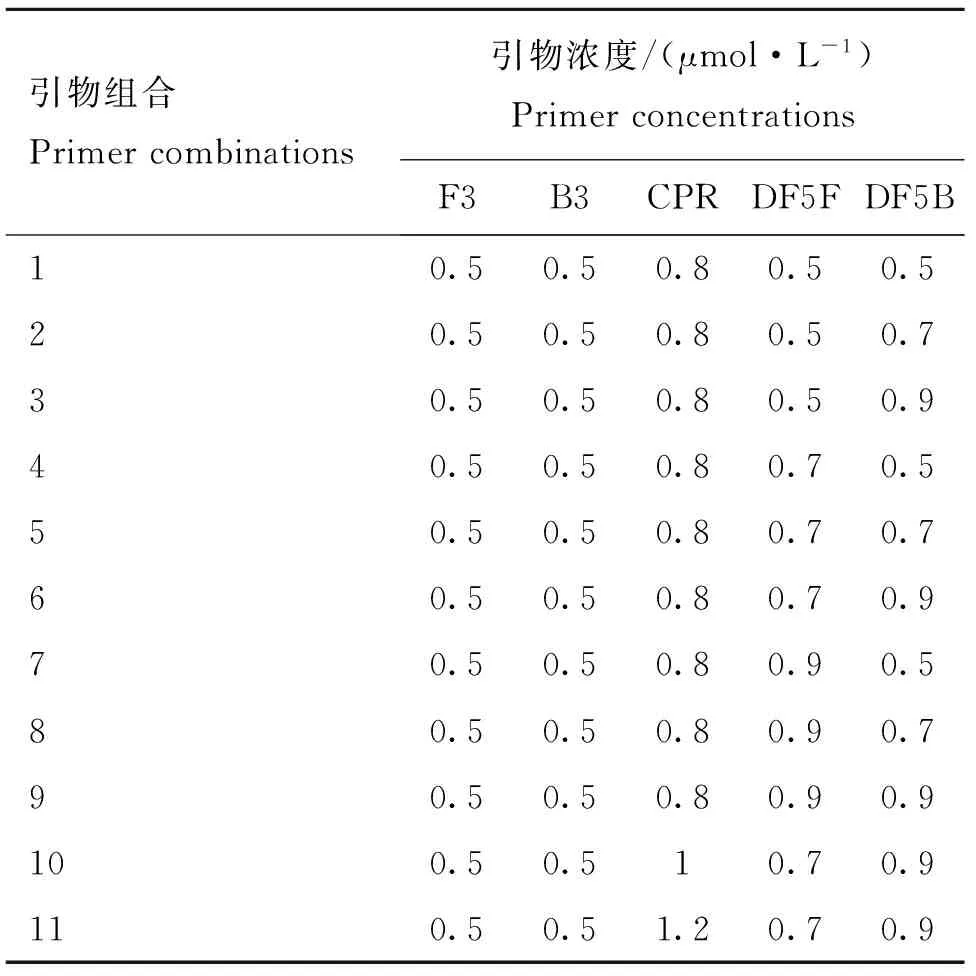
引物组合Primercombinations引物浓度/(μmol·L-1)PrimerconcentrationsF3B3CPRDF5FDF5B10.50.50.80.50.520.50.50.80.50.730.50.50.80.50.940.50.50.80.70.550.50.50.80.70.760.50.50.80.70.970.50.50.80.90.580.50.50.80.90.790.50.50.80.90.9100.50.510.70.9110.50.51.20.70.9
1.8PCV2-CPA的可视化试纸条检测
将“1.6、1.7”中PCV2-CPA法的扩增产物放入核酸试纸条检测装置中,3~5 min后肉眼判读结果。当试纸条T、C线处均出现红色条带时判定为阳性,仅C线处出现红色条带时判定为阴性。
1.9不同方法临床样品检测的敏感性、特异性、符合率比较
用建立的CPA方法、常规PCR方法和ELISA方法检测评价经金标准法(IFA方法)标定的127份临床样品(73份阳性,54份阴性)。按下公式计算三种不同检测方法的敏感性、特异性和符合率:敏感性=(检测真阳性样品数/标准阳性样品总数)×100%;特异性=(检测真阴性样品数/标准阴性样品总数)×100%;符合率=(检测真阳性样品数+检测真阴性样品数)/检测样本品总数×100%。用SPSS 21软件做ROC曲线图,综合分析评定不同方法的检测效能。
2 结 果
2.1质粒DNA拷贝数计算结果
提取的质粒DNA经测定质量浓度为259.1 μg·mL-1,质粒长度为3 122 bp,经计算,该质粒浓度为7.6×1010拷贝·μL-1。
2.2PCV2-CPA基础扩增体系的建立
反应产物经电泳后紫外灯下观察,质粒DNA阳性模板有梯形条带产生,阴性对照无梯形条带(图1)。结果表明,PCV2-CPA基础反应体系可对PCV2进行有效的扩增。
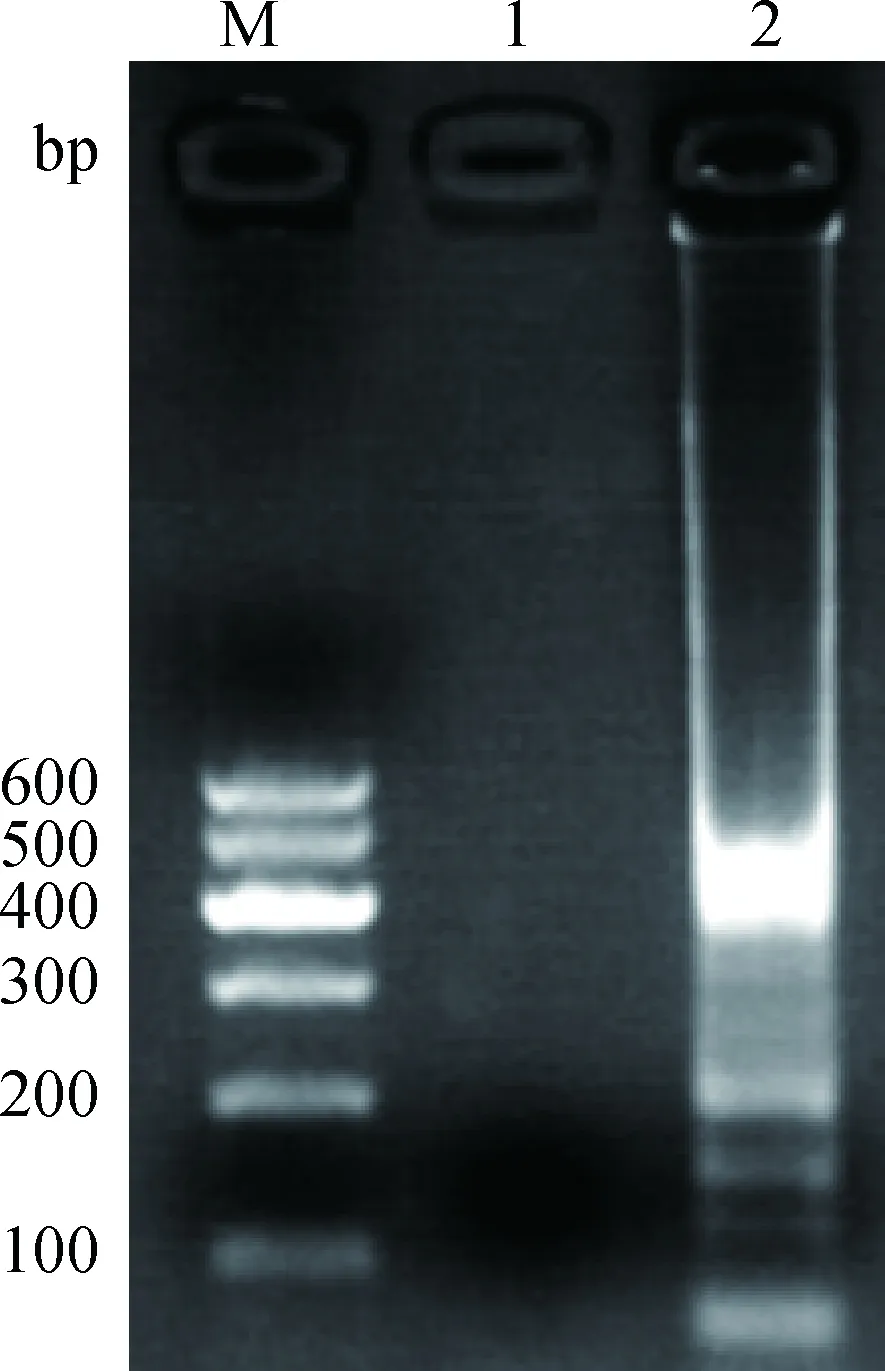
M.DNA相对分子质量标准 Marker Ⅰ;1.阴性对照;2.阳性模板M.DNA marker Ⅰ;1.Negative control;2.Positive control图1 PCV2-CPA基础扩增体系电泳结果Fig.1 PCV2-CPA products in 3.0% agarose gel
2.3PCV2-CPA反应体系的优化结果
引物浓度优化结果显示:浓度组合10(引物F3 和B3各0.5 μmol·L-1,引物CPR 1 μmol·L-1,引物DF5F 0.7 μmol·L-1,引物DF5B 0.9 μmol·L-1)的扩增产物量多,条带较清晰,为最佳浓度组合(图2) 。
对反应体系中的MgSO4、dNTPs、Betaine、Bst酶进行优化,结果显示:0~0.4 mol·L-1范围内Betaine最佳工作浓度为0.075 mol·L-1;0~5 mmol·L-1范围内选择MgSO4最佳工作浓度为3 mmol·L-1;0.1~0.6 mmol·L-1范围内dNTPs最佳工作浓度为0.4 mmol·L-1;Bst酶的最适添加量为9.6 U。
2.4PCV2-CPA反应条件的优化结果
在56~65 ℃间选取最适反应温度,30~90 min选取最适扩增时间,结果显示:最适反应条件为58 ℃扩增50 min,详见图3、图4。
综合上述试验结果,确定最佳反应体系:1×ThermoPol®Reaction Buffer,Betaine 0.075 mol·L-1,MgSO43 mmol·L-1,dNTPs 0.4 mmol·L-1,BstDNA 聚合酶9.6 U,F3 0.5 μmol·L-1,B3 0.5 μmol·L-1,CPR 1 μmol·L-1,DF5F 0.7 μmol·L-1,DF5B 0.9 μmol·L-1,模板DNA 4 μL,无核酸酶水补足至20 μL。最佳反应条件为58 ℃下恒温扩增50 min。
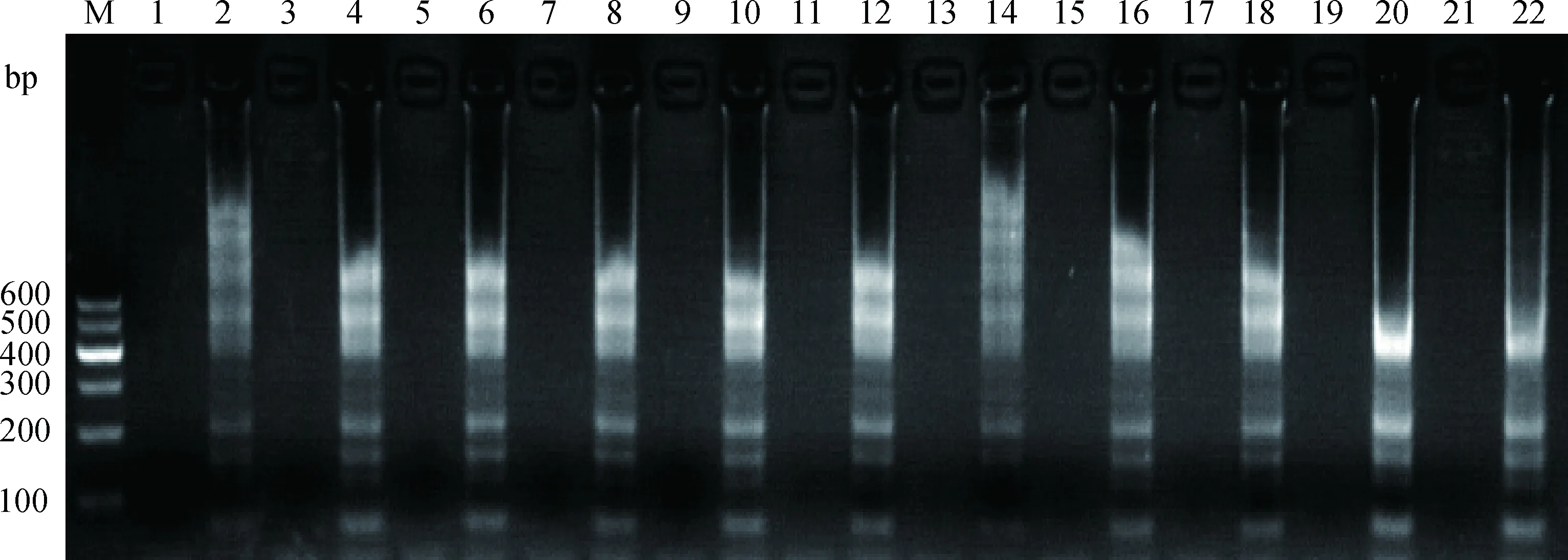
M.DNA相对分子质量标准 Marker Ⅰ;泳道1、3、5、7、9、11、13、15、17、19、21分别为引物浓度组合1~11的阴性对照;泳道2、4、6、8、10、12、14、16、18、20、22分别为引物浓度组合1~11的阳性模板扩增结果M.DNA marker Ⅰ;Lane 1,3,5,7,9,11,13,15,17,19,21.Negative control of different concentration combinations of primers 1-11,respectively;Lane 2,4,6,8,10,12,14,16,18,20,22.Positive control of different concentration combinations of primers 1-11,respectively图2 不同浓度引物及比例对扩增效果的影响Fig.2 The amplification effects of different primer concentrations and ratios
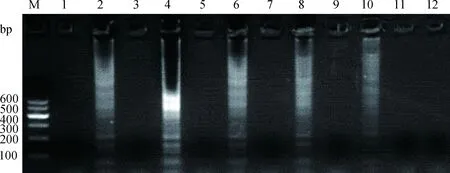
M.DNA相对分子质量标准 Marker Ⅰ;泳道1、3、5、7、9、11.分别为56、58、60、62、64、66 ℃的阴性对照扩增结果;泳道2、4、6、8、10、12.分别为56、58、60、62、64、66 ℃的阳性模板扩增结果M.DNA marker Ⅰ;Lane 1,3,5,7,9,11.Negative control of 56,58,60,62,64,66 ℃;Lane 2,4,6,8,10,12.Positive control of 56,58,60,62,64,66 ℃图3 不同温度对扩增效果的影响Fig.3 The amplification effects of different temperatures
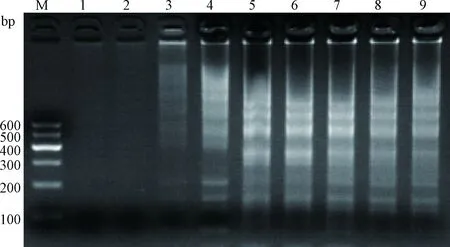
M.DNA相对分子质量标准 Marker Ⅰ;泳道1.阴性对照扩增90 min的电泳结果;泳道2~9.分别为阳性模板扩增15、30、45、50、55、60、75、90 min的电泳结果M.DNA marker Ⅰ;Lane 1.Negative control of 90 min;Lane 2-9.Positive control of 15,30,45,50,55,60,75,90 min图4 不同时间对扩增效果的影响Fig.4 The amplification effects of different time
2.5PCV2-CPA交叉反应检测结果
用PCV2-CPA最佳反应体系进行特异性试验结果显示:仅PCV2质粒DNA和病毒DNA出现典型的梯形扩增条带,而PCV1、PRV、CSFV、PRRSV、FMDV、PEDV、TGEV、RV和阴性对照扩增产物电泳后均未见明显的扩增条带(图5),表明建立的PCV2-CPA 检测技术特异性很好。
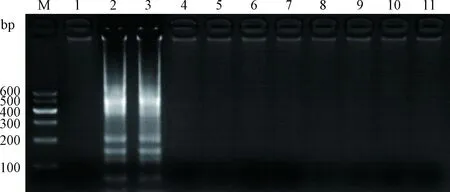
M.DNA相对分子质量标准 Marker Ⅰ;1.阴性对照;2~11.分别为PCV2质粒、PCV2病毒、PCV1、PRV、CSFV、PRRSV、FMDV、PEDV、TGEV和RV的CPA扩增产物M.DNA marker Ⅰ;1.Negative control;2-11.Amplification products of PCV2 plasmid,PCV2,PCV1,PRV,CSFV,PRRSV,FMDV,PEDV,TGEV and RV,respectively图5 PCV2-CPA特异性检测Fig.5 The specificity of PCV2-CPA detection
2.6PCV2-CPA方法与常规PCR法灵敏度比较结果
用PCV2-CPA最佳反应体系进行灵敏度检测结果显示:7.6×100~7.6×1010拷贝·μL-1均有大量扩增,7.6×10-1、7.6×10-2拷贝·μL-1和阴性对照无扩增 (图6),即建立的CPA方法最低检出限为7.6 拷贝·μL-1。常规PCR 扩增结果显示,仅7.6×101~7.6×1010拷贝·μL-1扩增有目的条带 (图7),即常规PCR法的最低检出限为76 拷贝·μL-1。
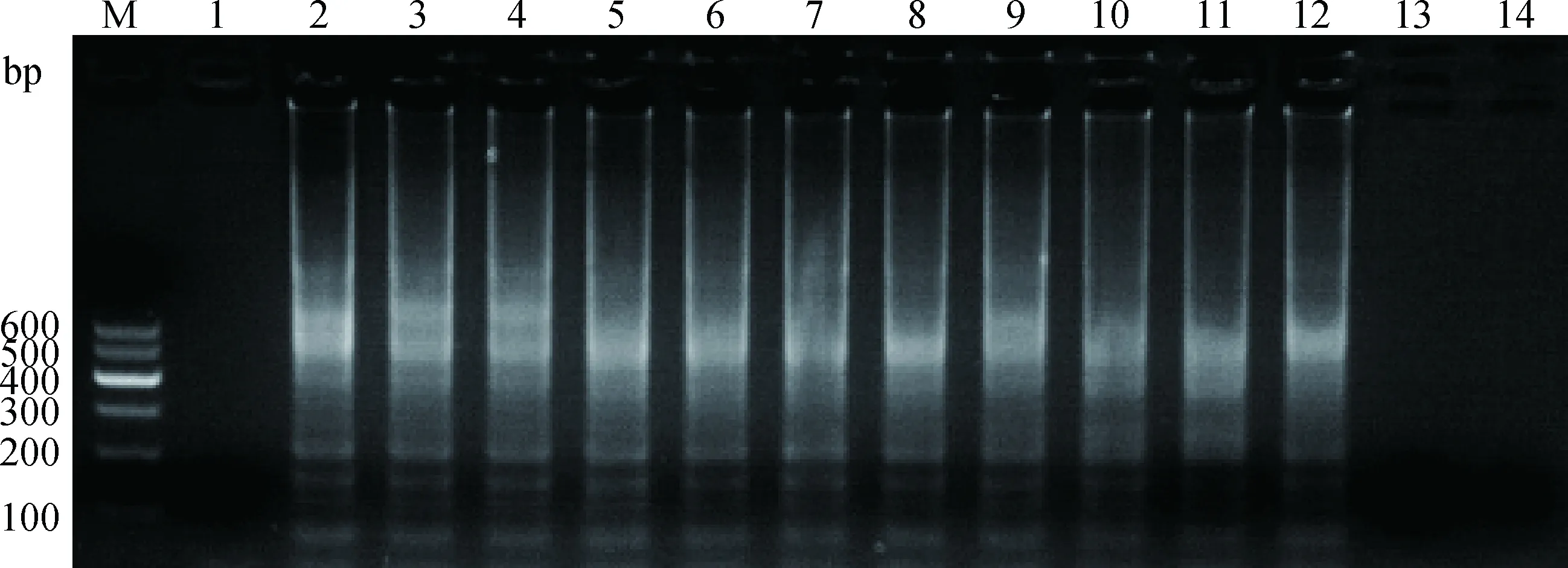
M.DNA相对分子质量标准 Marker Ⅰ;1.阴性对照;2~14.分别为7.6×1010~7.6×10-2 拷贝·μL-1的CPA扩增产物M.MarkerⅠ;1.Negative control;2-14.Amplification products of 7.6×1010 -7.6×10-2 copies·μL-1,respectively图6 PCV2-CPA灵敏性检测Fig.6 The sensitivity of PCV2-CPA detection
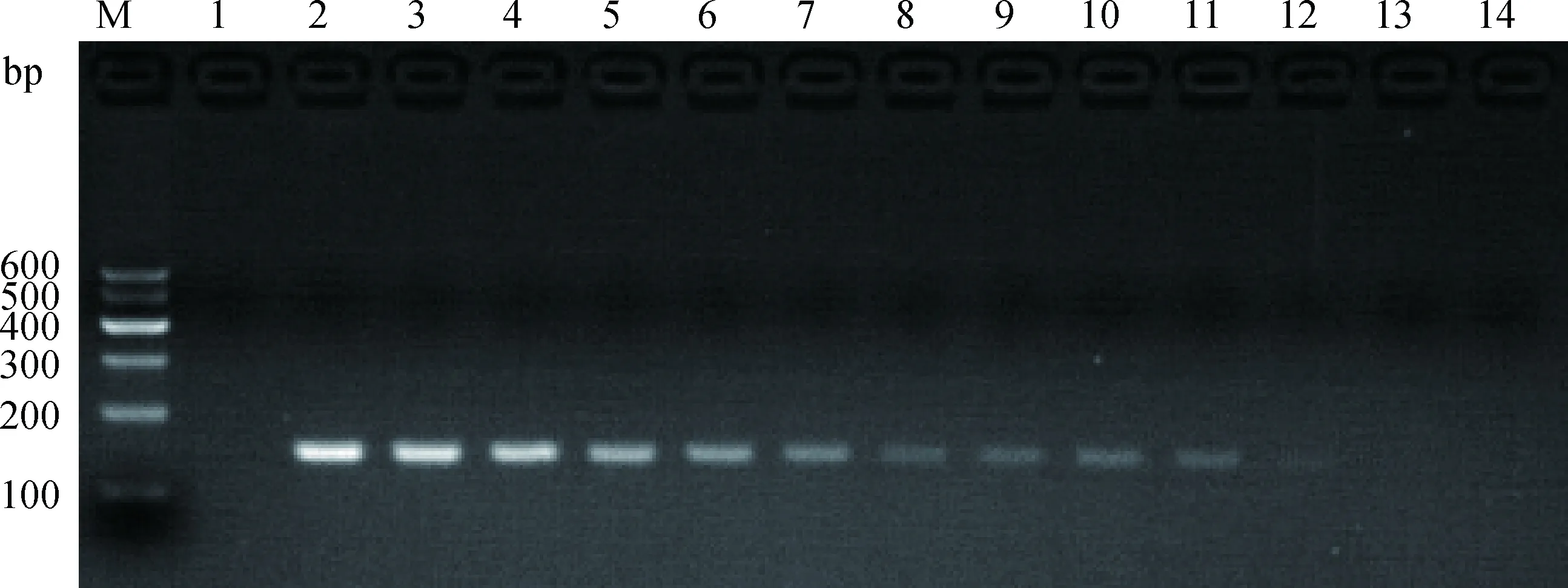
M.DNA相对分子质量标准 Marker Ⅰ;1.阴性对照;2~14.分别为7.6×1010~7.6×10-2 拷贝·μL-1的PCR扩增产物M.DNA marker Ⅰ;1.Negative control;2-14.PCR amplification products of 7.6×1010-7.6×10-2 copies·μL-1,respectively图7 PCV2常规PCR方法灵敏性检测Fig.7 The sensitivity of conven tional PCR detection
2.7PCV2-CPA的可视化试纸条检测
应用核酸试纸条检测装置对“2.5、2.6”中CPA方法的各扩增产物进行检测,特异性扩增产物检测结果显示,仅PCV2病毒DNA和质粒DNA阳性对照为阳性,其他均为阴性结果,该结果与琼脂糖凝胶电泳结果一致(图8),灵敏度扩增产物检测结果也与其琼脂糖凝胶电泳结果一致(图9)。
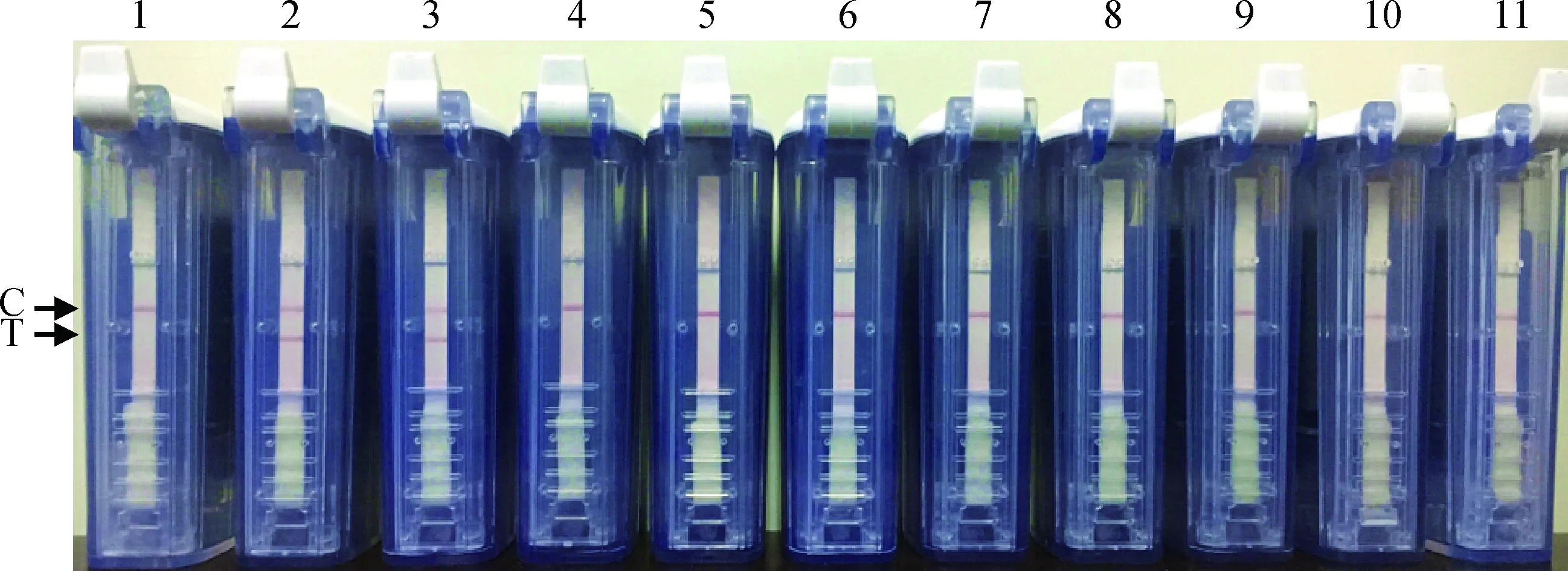
1.阴性对照;2~11.分别为PCV2质粒、PCV2病毒、PCV1、PRV、CSFV、PRRSV、FMDV、PEDV、TGEV和RV的CPA扩增产物核酸试纸条检测结果1.Negative control;2-11.Amplification products of PCV2 plasmid,PCV2,PCV1,PRV,CSFV,PRRSV,FMDV,PEDV,TGEV and RV,respectively图8 核酸试纸条检测装置对PCV2-CPA特异性检测Fig.8 Results of the specificity test of PCV2-CPA detected by nucleic acid test strip

1.阴性对照;2~14.分别为7.6×1010~7.6×10-2 拷贝·μL-1的CPA扩增产物核酸试纸条检测结果1.Negative control;2-14,amplification products of 7.6×1010-7.6×10-2 copies·μL-1,respectively图9 核酸试纸条检测装置对PCV 2-CPA灵敏性检测Fig.9 Results of the sensitivity test of PCV 2-CPA detected by nucleic acid test strip
2.8不同方法临床样品检测的敏感性、特异性、符合率比较结果
用建立的CPA方法、常规PCR方法和ELISA方法对标准样品进行检测,73份标准阳性样品中,CPA、PCR和ELISA检测出的真阳性样品数分别为69、66和57份,54份标准阴性样品中,检测出的真阴性样品数分别为47、49和50份,三种方法的敏感性、特异性和符合率详见表4。
采用SPSS 21统计软件,得到ROC曲线图(图10)。曲线下面积大小显示各方法的诊断性能,综合评定为CPA>PCR>ELISA。
3 讨 论
IFA是实验室检测猪圆环病毒的经典方法,但由于PCV 1和PCV 2存在抗原交叉反应[9],抗原检
表43种检测方法的敏感性、特异性和符合率比较
Table 4Comparison for sensitivity,specificity and consistency of three kinds of methods %
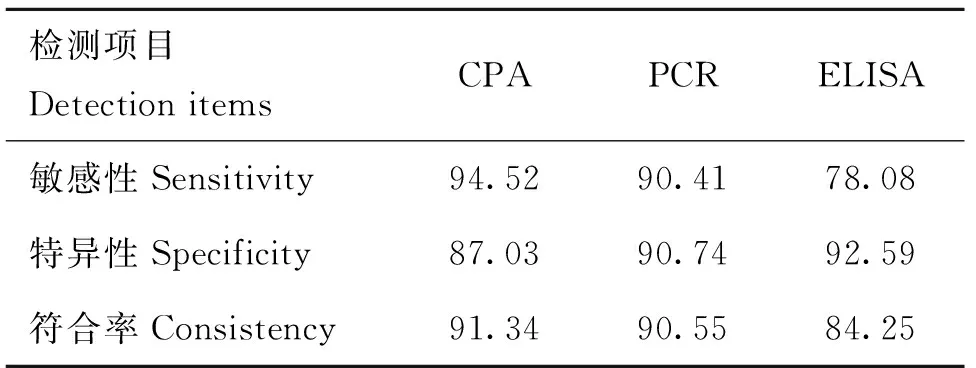
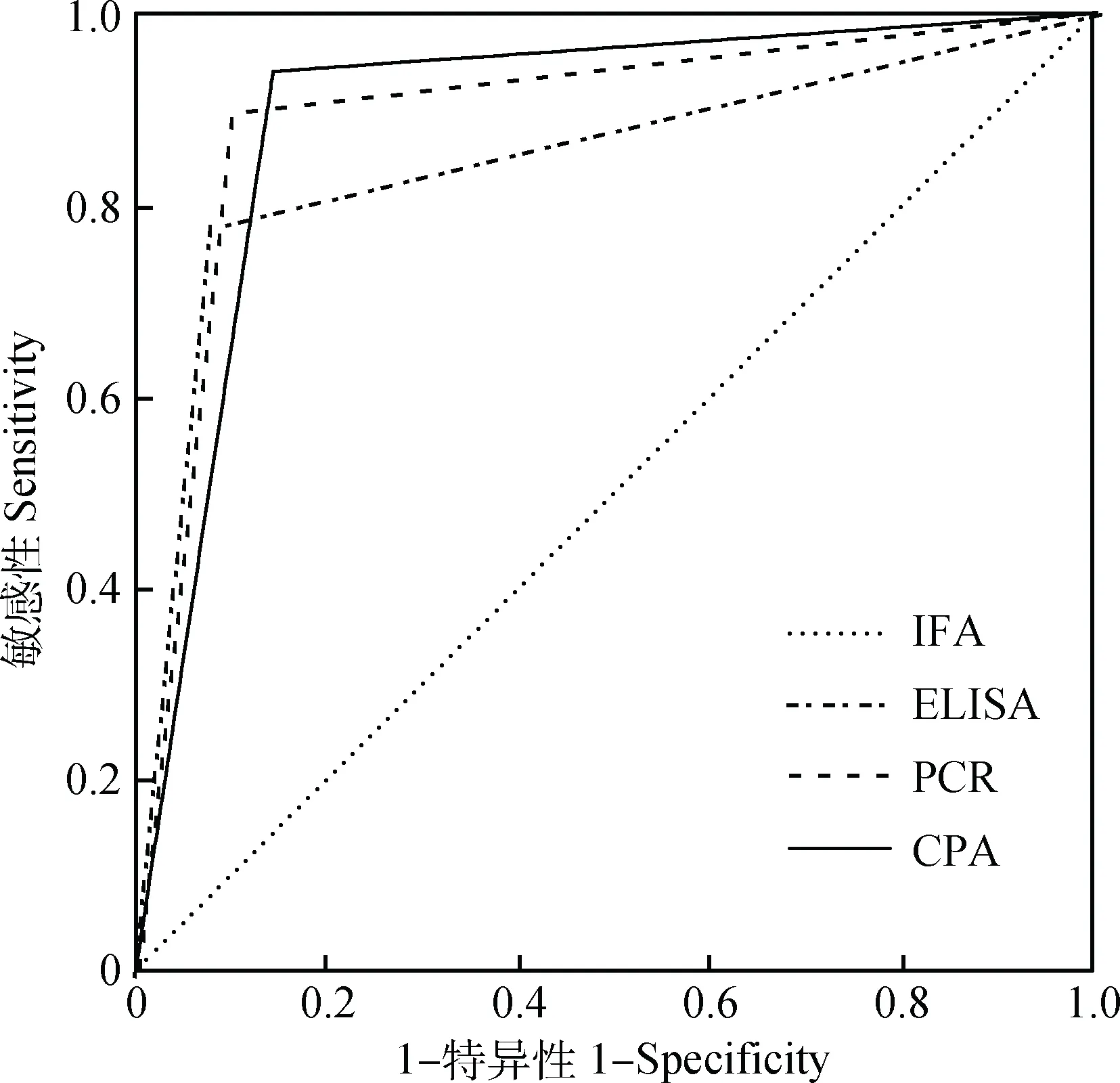
图10 ROC曲线图Fig.10 Receiver operating characteristic curve
测受制备的PCV2 抗体特异性影响很大。本试验中采用美国VMRD公司的抗PCV2特异性猪血清,此血清只能与PCV2发生特异性反应,而不与PCV1发生反应,保证了金标准法检测结果的真实可靠。然而,IFA方法费时、费力,只能在实验室操作,且存在潜在散毒危险,不适用于临床快速诊断。ELISA方法是一种可用于临床快速诊断的检测方法,本试验结果显示ELISA方法相对于其他分子诊断方法敏感性不高。ELISA方法操作要经过多次洗板,孵育温度、孵育时间及严格避光这些因素任何一步操作失误都将影响结果。又因ELISA方法信号只经过了酶联放大,而分子诊断通过对目标片段的指数式扩增,在较短时间内可将目的基因扩增放大几百万倍,因而,ELISA方法的敏感性自然很难达到分子诊断方法的敏感性。现有的PCV2分子检测方法主要是PCR及其衍生技术,这些检测技术依赖于昂贵的仪器设备和专业技术人员,虽效果较好,但只适用于实验室的病原检测。PMWS的快速早期诊断是疾病防控的重要前提,本研究建立的猪圆环病毒2型交叉引物扩增检测方法,只需简单的恒温设备(水浴锅或金属浴)即可于现场对病原进行检测,结果判定快速、客观,扩增产物不会造成气溶胶污染,整个过程1 h左右即可完成。
PCV有ORF 1和ORF 2两个主要的阅读框,ORF 1编码与病毒复制相关的Rep蛋白,是PCV1和PCV2产生抗原交叉性的主要原因;ORF 2编码病毒的主要结构蛋白Cap,是分子水平上诊断区分PCV1和PCV2的理想靶基因。本试验中以Cap为靶基因,设计一套CPA检测引物,其中对引物DF5F和DF5B的5′端分别标记FITC和Biotin,以便使用一次性核酸检测装置对PCV2扩增产物进行可视化检测。CPA检测特异性和灵敏性与反应体系中的各组分浓度有很大关系,其中引物自身的序列结构和浓度比例对扩增起决定性作用[10]。因此,在引物设计时对部分碱基进行了更改以减少错配和引物间的互配,进而提高其特异性,然后对引物浓度比例、MgSO4浓度、dNTPs浓度、Bst酶量、反应温度和时间进行了优化,最终确立了CPA最佳反应体系和反应条件。
本试验中各引物(CPR、DF5F、DF5B、F3、B3)的比例为1∶0.7∶0.6∶0.5∶0.5,与翟聪聪等[11]的结果相似(1∶0.6∶0.6∶0.2∶0.2),外引物F3和B3需要量最少,探针DF5F和DF5B其次,交叉引物CPR量最多,这与引物工作原理相符。Betaine对试验结果影响很大,少量Betaine存在时,有特异性扩增,超过0.4 mol·L-1时无扩增;但当体系中不添加Betaine时,有非特异性扩增,这可能是因为体系中一定量的Betaine能提高对目的基因的选择性,降低非目的基因对核酸扩增的干扰[12]。Mg2+能与Bst聚合酶上的活性位点相结合[13],当Mg2+浓度过低时,对Bst聚合酶几乎没有催化作用,酶的活性降低,此反应中不添加硫酸镁也有扩增,可能是因为Buffer中有Mg2+存在;随着Mg2+浓度的增加,其催化作用增强扩增产物逐渐增多,但Mg2+浓度过高时,又会抑制Bst聚合酶的活性而导致扩增产物减少,这与王璐璐[8]的报道一致。扩增温度也会影响Bst聚合酶的活性[14],本试验中,体系在56~62 ℃范围内均能较好扩增,其中58 ℃时扩增效果最好,64 ℃时扩增效率明显降低,66 ℃时无扩增,此扩增温度比已报道的其他CPA扩增温度和PCV2-LAMP的扩增温度都低,这可能与选择的引物位置有关系。扩增时间也是影响扩增效率的一大因素,当扩增时间低于30 min时几乎无扩增,45 min时有明显扩增,50 min时达到最大扩增,此后延长扩增时间灵敏度不变,因此建议扩增时间为50 min。
环介导等温扩增(LAMP)是另外一种恒温扩增技术,与CPA一样不需要PCR仪、扩增效率比PCR高。已有学者将LAMP技术应用到PCV2的检测中,胡瑞丽等[15]建立的猪圆环病毒2型LAMP检测方法在59 ℃扩增55 min可以检测到10 拷贝·μL-1的PCV2 病毒DNA,杨泽晓等[7]建立的PCV2-LAMP检测方法在64 ℃扩增45 min检测限可以达到10 拷贝·μL-1,扩增结果通过核酸琼脂糖凝胶电泳、反应液浑浊度变化和荧光染料判读。作者建立的CPA检测体系58 ℃扩增50 min检测限为7.6 拷贝·μL-1,灵敏度比常规PCR高10倍,与荧光定量PCR检测方法和已建立的LAMP检测方法相近[6],且检测方法引入可视化核酸检测试纸条,对反应结果的判读更加直观、客观、快捷,且不开盖电泳,不会造成气溶胶污染。
4 结 论
建立的猪圆环病毒2型交叉引物恒温扩增(PCV2-CPA)可视化检测方法,是首次将交叉引物恒温扩增技术与核酸试纸条相结合应用于PCV2检测的研究。简便、快速、准确,结果直观。检测灵敏度是常规PCR的10倍,与荧光定量PCR和LAMP一致,与IFA符合率达到91.34%;1 h左右即可对提取的病原核酸是否含PCV2进行可视化观察,且与其他类似症状病原无交叉反应,可特异性检测PCV2,可应用于PCV2的现场快速检测。该检测方法的建立对猪圆环病毒2型养殖场现场快速诊断和生物安全防控提供了技术支撑。
[1]SEGALÉS J,SITJAR M,DOMINGO M,et al.First report of post -weaning multisystemic wasting syndrome in pigs in Spain[J].VetRec,1997,141(23):600-601.
[2]MANKERTZ A,DOMINGO M,FOLCH J M,et al.Characterisation of PCV-2 isolates from Spain,Germany and France[J].VirusRes,2000,66(1):65-77.
[3]GARKAVENKO O,ELLIOTT R B,CROXSON M C.Identification of pig circovirus type 2 in new zealand pigs[J].TransplantProc,2005,37:506-509.
[4]芦银华,谈国蕾,陈德胜,等.猪圆环病毒多重PCR检测方法的建立及初步应用[J].农业生物技术学报,2002,10(4):415-416.
LU Y H,TAN G L,CHEN D S,et al.The development and preliminary application of multiplex PCR for detection of PCV[J].ChineseJournalofAgriculturalBiotechnology,2002,10(4):415-416.(in Chinese)
[5]史利军,任林柱,李刚.猪圆环病毒2型免疫抑制激励研究进展[J].动物医学进展,2009,30(3):74-77.
SHI L J,REN L Z,LI G..Progress on immunosuppression mechanism of PCV 2[J].ProgressinVeterinaryMedicine,2009,30(3):74-77.(in Chinese)
[6]郝立沙,张璐,佟杰,等.猪圆环病毒Ⅱ型TaqMan荧光定量PCR检测方法的建立及应用[J].黑龙江畜牧兽医,2015,06:168-171.
HAO L S,ZHANG L,TONG J,et al.Establishment and application of TaqMan fluorescent probe-based quantitative PCR assay for detection of porcine circovirus type 2[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2015,06:168-171.(in Chinese)
[7]杨泽晓,侯义宏,曾辉,等.猪圆环病毒2型LAMP检测方法的建立与应用[J].中国兽医科学,2014,44(2):152-158.
YANG Z X,HOU Y H,ZENG H,et al.Development and application of LAMP method for detection of porcine circovirus type 2[J].ChineseVeterinaryScience,2014,44(2):152-158.(in Chinese)
[8]王璐璐.交叉引物扩增技术快速检测肠出血性大肠杆菌的研究[D].长春:吉林大学,2013.
WANG L L.Study on development of cross priming amplification method for rapid detection of EHEC[D].Changchun:Jilin University,2013.(in Chinese)
[9]MAHÉ D,BLANCHARD P,TRUONG C,et al.Differential recognition of ORF 2 protein from type 1 and type 2 porcine circoviruses and identification of immunorelevant epitopes[J].JGenVirol,2000,81(7):1815-1824.
[10]李聪慧,徐进,刘文枝,等.锦鲤疱疹病毒单交叉引物等温扩增检测方法的建立[J].水产学报,2015,39(9):1422-1431.
LI C H,XU J,LIU W Z,et al.Establishment of single cross priming isothermal amplification for Koi herpesvirus detection[J].JournalofFisheriesofChina,2015,39(9):1422-1431.(in Chinese)
[11]翟聪聪,黄新,朱水芳,等.一种交叉引物扩增技术检测转基因水稻品系Bt63方法的建立[J].植物检疫,2014,28(1):61-66.
ZHAI C C,HUANG X,ZHU S F,et al.Cross priming amplifi cation method for detection of the transgenic rice Bt 63[J].PlantQuarantine,2014,28(1):61-66.(in Chinese)
[12]MARSHALL P L,KING J L,BUDOWLE B,et al.Utility of amplification enhancers in low copy number DNA analysis[J].IntJLegalMed,2015,129(1):43-52.
[13]XU Y M,LIU X L,MA J.Simple,specific,sensitive and rapid loop-mediated method for detectingYersiniaenterocolitica[J].SoutheastAsianJTropMedPublicHealth,2014,45(3):670-679.
[14]Hwang J,Suh S S,Park M,et al.Detection of coat protein gene of nervous necrosis virus using loop-mediated isothermal amplification[J].AsianPacJTropMed,2016,9(3):235-240.
[15]胡瑞丽,倪建平,赵笑.猪圆环病毒2型LAMP可视化快速检测方法的研究[J].上海农业学报,2016,32(1):23-28.
HU R L,NI J P,ZHAO X.Visual rapid detection of porcine circovirus type 2 by a loop-mediated isothermal amplification assay[J].ActaAgriculturaeShanghai,2016,32(1):23-28.(in Chinese)
(编辑白永平)
Establishment of Cross Priming Isothermal Amplification for Porcine Circovirus 2 Detection
YUAN Dan-yi1,JIN Ya-nan2,LI Ling1,HE Qian1,HU Lin2,LI Xiao-qi1,SUN Zhi-yong1
(1.SichuanNaBiiBiologicalTechnologyCo.,Ltd.,Chengdu610041,China;2.UstarBiotechnologies(Hangzhou)Ltd.,Hangzhou310053,China)
This experiment was conducted to establish a simple,sensitive and rapid detection method for the biosecurity control of the porcine circovirus 2 (PCV2) diseases.TheCapgene of PCV2 was used as the signature sequence for cross amplification primers design and the constructedCapgene plasmid DNA was used as the standard template.Amplification temperature,time and constituents of the reaction,including concentration of primers,MgSO4,dNTP,Betaine andBstDNA polymerase were systematically optimized.Used the nucleic acid test strip detect the amplified products,compared the sensitivity,specificity and consistency of CPA,PCR and ELISA by 127 standard clinical samples.The detection results showed that the cross amplification could be realized at 58 ℃ within 50 min,could specifically detect PCV2 with a sensitivity that was about 10 times higher than conventional PCR method.The detection limit of recombinant plasmid was 7.6 copies·μL-1and the assay gave no amplification from PCV1,PRV,CSFV,PRRSV,PEDV,TGEV and RV.The final optimal CPA condition established for rapid detection of PCV2 was as follows:0.5 μmol·L-1each of F3 and B3,1.0 μmol·L-1of CPR,0.7 μmol·L-1of DF5F,0.9 μmol·L-1of DF5B,0.075 mol·L-1Betaine,3 mmol·L-1MgSO4, 0.4 mmol·L-1dNTPs,9.6 UBstDNA polymerase,2 μL 10×ThermoPol®Reaction Buffer,4 μL templates and sterilized double-distilled water in 20 μL volumes.The sensitivity,specificity and consistency were 78.08% to 94.52%,87.03% to 92.59% and 84.25% to 91.34% among the three methods,respectively.Receiver operating characteristic curve showed that CPA was the best detection method. PCV2 cross priming amplification method does not require expensive equipment and skilled technicians,the visual detection could provide an intuitive and objective decision for people,and could also effectively avoid the aerosol pollution,which could be used in the on-site diagnosis for effective prevention and control of porcine circovirus 2 diseases.
porcine circovirus 2;cross primer;isothermal amplification;detection;aerosol pollution;biosecurity control
10.11843/j.issn.0366-6964.2016.09.020
2016-03-03
2015年度勃林格中国猪圆环病毒病研究进步奖项目
袁旦一(1988-),女,四川成都人,硕士,主要从事动物疫病体外分子诊断的研究,E-mail: danielle.yuandanyi@scnabii.com
S852.659.2
A
0366-6964(2016)09-1905-09
作者简介:袁旦一
