清液回配对酒精发酵的影响研究
2023-11-23俞建良张俊奇蔡金亮王学领安丽娜李春燕
俞建良,张俊奇,蔡金亮,王学领,罗 菊,赵 丹,安丽娜,李春燕
(梅河口市阜康酒精有限责任公司,吉林梅河口 135000)
传统乙醇工艺采用谷物进行发酵并通过蒸馏的方式提取乙醇,此种方法会产生高浓度BOD 和COD 清液[1]。酒精企业通常采用生产高蛋白饲料原料(DDGS)、厌氧-好氧处理、回用拌料等方式对清液进行处理[2-4],近年来,也有部分企业尝试利用酒精发酵副产物进行复合肥、生物发酵饲料、益生菌的生产及色素、活性成分醇溶解蛋白的提取等[5-8]。目前,大多数酒精生产企业采用生产高蛋白饲料原料和回用拌料联合应用的方式进行清液处理。
清液作为酒精发酵的副产物,内部含有大量的氨基酸、可溶性糖、维生素等物质[9],用于酒精发酵用配料水,一方面可以为酵母生长提供营养,另一方面可降低一次水等生产用水成本[10]。清液内也存在乳酸、琥珀酸、乙酸、苹果酸等微生物发酵代谢产生的有机酸和K+、Ca2+等金属离子,这些物质会对酵母发酵产生不同程度的抑制作用[11-14]。分析清液对酒精发酵的影响,探索适宜酒精生产的清液回配比例,有利于在保证酒精生产企业稳定运行的同时,降低生产能耗,提升企业效益。
1 材料与方法
1.1 材料、试剂及仪器
原料和菌种:脱胚玉米粉,取自梅河口市阜康酒精有限责任公司;安琪浓醪酿酒高活性干酵母。
试剂及耗材:氨水(AR)、硫酸(AR)、氢氧化钠(AR)、葡萄糖(AR)、硫酸铜(AR)、酒石酸钾钠(AR);淀粉酶(260000 U/g),济南百斯杰生物工程有限公司;糖化酶(360000 U/g),苏州宏达制酶有限公司;蛋白酶(100000 U/g),山东隆科特酶制剂有限公司。
仪器设备:ZXFD-B56000 型烘箱,上海智城分析仪器制造有限公司;ML204T 型电子天平,梅特勒-托利多公司;JA5002 型电子天平,上海浦春计量仪器有限公司;SUB Aqua Pro 型电热恒温水浴锅,Grant;IKA RW20 型搅拌器,IKA;ZWY-2012C0型恒温摇床,上海智城分析仪器制造有限公司;FE20 型pH 计,梅特勒-托利多公司;1260 IntinityⅡ型高效液相色谱,安捷伦科技有限公司;X-15R 型高速离心机,贝克曼公司。
1.2 实验方法
1.2.1 液化试验
称取相应物料克数至恒重的反应器中,加入70 ℃的左右自来水,与物料混合均匀,总体系为1000 g。用pH 计调节至6.0(加入1 mL 的氨水,剩余部分通过20 %氢氧化钠和65 %硫酸进行调整),分别加入稀释后的液化酶1 mL(0.3 kg/t 酒),将烧杯放入温度维持在90 ℃的水浴锅内,调整搅拌速度为160 r/min,水浴10 min,调整搅拌速度为60 r/min,水浴170 min完成液化试验。

表1 不同清液回配比例实验配料方案
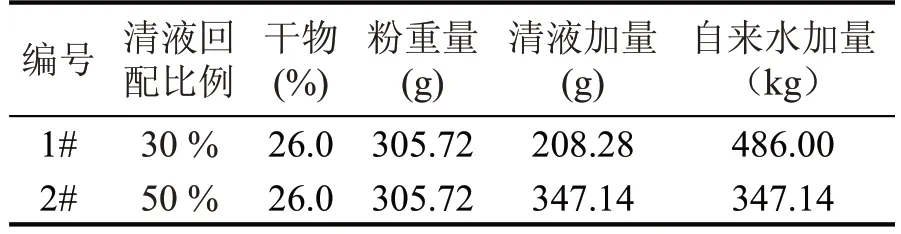
表2 不同浓度清液连续回配实验配料方案
1.2.2 发酵试验
将1.2.1 中液化醪降温至32 ℃,pH 调至4.0~4.2,取350 g液化醪加入1000 mL三角瓶中,称取两种酵母各2.5 g 加入100 mL 灭菌水中,35 ℃条件下活化20 min,取2.5 mL 活化液加入三角瓶中,再分别加入稀释后的糖化酶1 mL(1.0 kg/t 酒)及蛋白酶1 mL(0.2 kg/t 酒)于三角瓶中混合均匀,将三角瓶口用棉塞封堵,置于恒温摇床内,转速120 r/min,发酵温度控制为32 ℃,发酵时间为70 h,取样滴定全分析及HPLC乙醇分析检测。
1.2.3 清液制备
发酵完成后,取成熟醪液装入离心管内,放置于离心机中,在3000 r/min 转速下离心3 min,收集离心上清液,将收集好的离心上清液放入烧杯中,隔水(80 ℃)加热直至体积蒸发掉50 %,向蒸发后的清液中补充已蒸发体积的蒸馏水,制得清液。
1.2.4 分析检测
液化醪粘度测定:旋转粘度计法。
液化醪干物测定:烘箱法。
残糖测定:斐林试剂法[15]。
成熟醪的分析:采用1260 IntinityⅡ型安捷伦色谱进行测定,色谱柱:HPX-87H,300×7.8 mm;流动相:0.005 mol/L H2SO4;泵流:0.6 mL/min;柱温:65 ℃;RID 设置温度:50 ℃;进样量:15 μL;运行时间:50 min[16]。
1.2.5 计算公式
残淀粉、残糊精的计算方法[17]:
残淀粉=(残总糖-过滤总糖)×0.9;
残糊精=(过滤总糖-还原糖)×0.9。
2 结果与分析
2.1 不同清液回配比例影响分析
2.1.1 不同清液回配比例对液化的影响分析
通过对不同清液回配比例液化醪对比分析(见图1)可知,随着清液回配比例的增加,液化醪干物和粘度均明显增长,主要原因是清液内含有糖类、糊精、蛋白质等物质,随着回配比例的增加,固形物含量随之增高。清液回配增大了醪液的粘度,对醪液流动、换热,酵母扩散均存影响,会增大生产负荷。
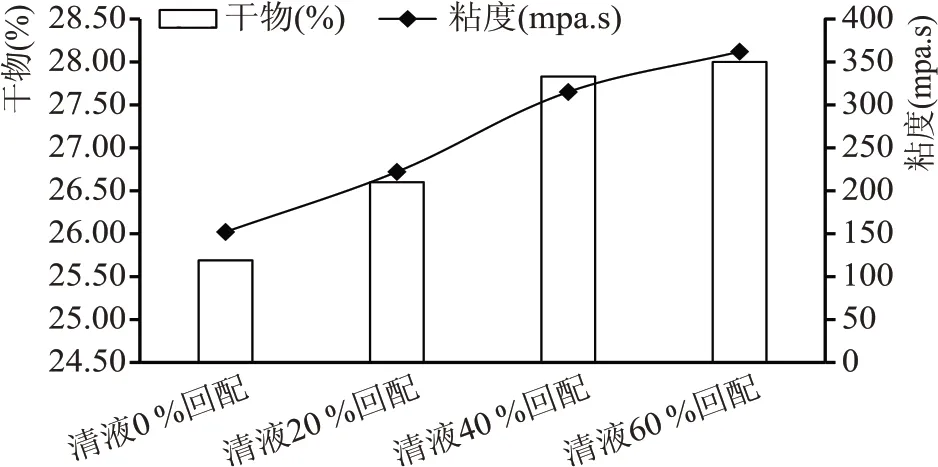
图1 不同清液回配比例实验液化醪干物及粘度对比
2.1.2 不同清液回配比例对发酵的影响分析
含氮化合物有3 种代谢途径:(1)直接用于生物合成;(2)间接用于生物合成;(3)通过转氨基作用降解,释放出游离态NH4+或结合氮,满足细胞代谢需求[18]。通过对不同清液回配比例发酵失重对比分析(见表3)可知,随着清液回配比例的增加,发酵醪失重量、失重速率均明显增加。其主要原因是在相同氮源条件下,清液内含有的酵母溶解物为酒精发酵提供了可直接利用的额外的氮源,提升了酵母的生长及反应速率,进一步促进了酒精发酵。

表3 不同清液回配比例实验发酵失重表
酵母溶解物中富含低分子肽以及氮、磷、钾等矿物质和生长因子,能够在补充酒精发酵中酵母所需的酶激活因子的同时,改善酒母繁殖、发酵能力,提高酒母出芽率,提高原料的利用率[19]。通过对不同清液回配比例发酵成熟醪酒精度及酵母死亡率对比(见图2)可知,随着清液回配比例的增加,成熟醪酒精度及酵母死亡率均随之增长,清液60 %回配实验组较清液0 %回配实验组成熟醪酒精度提高0.43 %vol,酵母死亡率增长26 %。主要原因是清液内含有的酵母溶解物促进了酵母生长,加快了发酵速率。
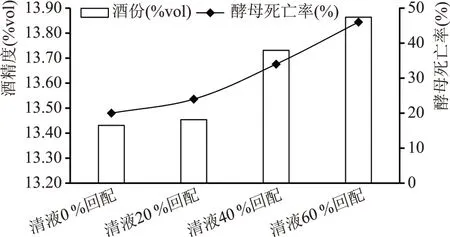
图2 成熟醪酒精度及酵母死亡率对比
无机离子对淀粉酶活性的影响机理很复杂,一般认为,无机离子是通过改变酶蛋白的构象影响酶活性的,其中Na+、K+、Mg2+在一定浓度范围内对淀粉酶具有激活作用,以K+激活作用最显著[20]。通过对不同清液回配比例发酵成熟醪残糖对比(见表4)可知,添加清液后,成熟醪残总糖在2.03 %~2.16%之间,远低于清液0%回配实验组的2.48%,而不同清液回配量实验组之间,残总糖的增加并不明显。主要原因是清液内含有少量游离的金属离子,促进了淀粉酶的作用,使得经淀粉酶作用后的液化醪更易被糖化酶分解;随着清液回配而少量增长的残总糖主要是由于清液携带所致。
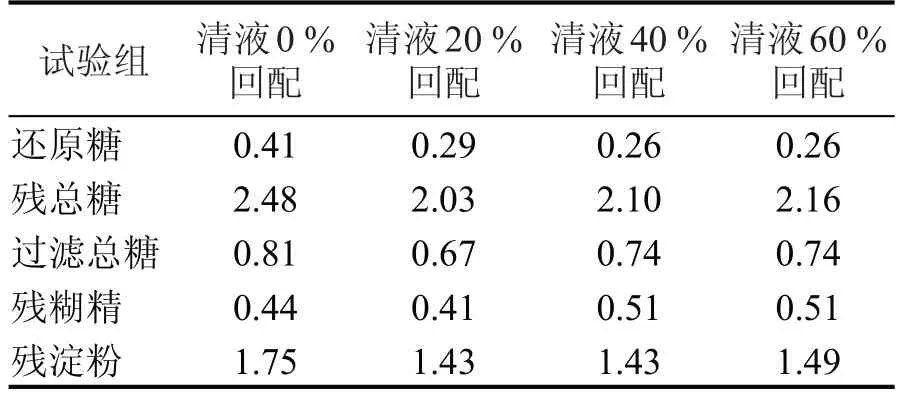
表4 不同清液回配比例实验发酵残糖数据 (%)
2.2 清液连续回配影响分析
2.2.1 清液连续回配对液化的影响分析
实验结果表明(见图3),随着回配实验轮次的增加,液化醪酸度呈逐步上升趋势,其中清液30%比例回配实验组五轮实验后,酸度上升了91.49%,清液50 %比例回配实验组五轮实验后,酸度上升了115.91%,酸度上升更为明显。液化醪酸度升高主要是由于发酵中产生的琥珀酸、乳酸、丙酸、柠檬酸等各种有机酸均为可溶物,在离心分离过程中被留在了清液中,清液回配过程中重新带入了系统。
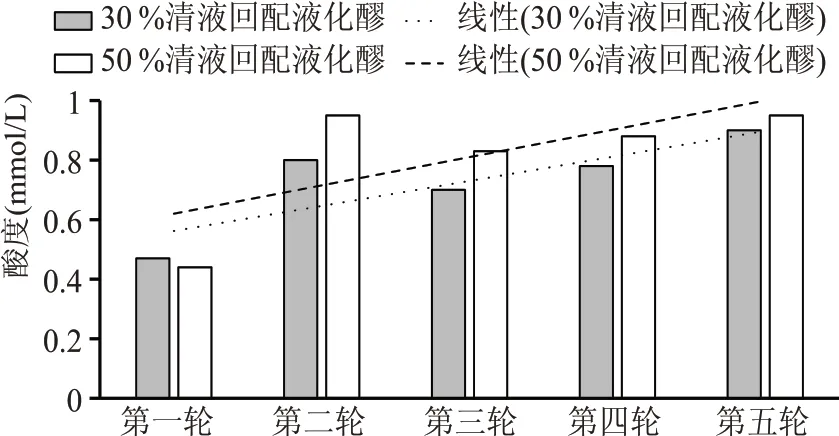
图3 清液连续回配实验液化醪酸度对比
2.2.2 清液连续回配对发酵的影响分析
清液中含有乙酸、丙酸、乳酸、柠檬酸等多种有机酸,从国内外众多学者的研究中发现,不同的有机酸在不同浓度下均会对酵母菌产生抑制作用[21-25]。实验结果表明(见表5、图4),五轮清液回配发酵后,清液30 %回配实验组成熟醪残总糖略微降低,酒精度含量略有增长,相反,清液50 %回配实验组成熟醪残总糖略微增长,酒精度含量略有降低。清液携带的有机酸在回配的过程中在醪液内不断积累,当回配浓度达到50%时,醪液内积累的有机酸超过了酵母菌产生抑制作用的临界浓度,导致成熟醪酒精度降低。
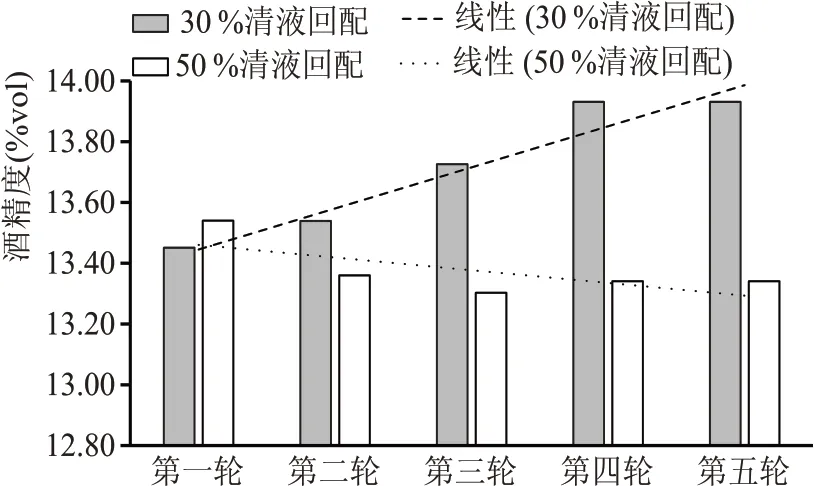
图4 清液连续回配实验发酵成熟醪酒精度对比

表5 清液连续回配实验发酵残总糖对比
3 结论
清液内含有低分子肽以及氮、磷、钾等矿物质和生长因子,有助于提升淀粉酶作用效果,改善了酒母繁殖、发酵能力,提高了原料的利用率;清液回配比例的增加会导致液化醪粘度升高,造成搅拌、输送、换热等设备负荷提高,增加生产能耗;清液内含有各类有机酸,在清液高比例连续回配的条件下,会大量积累有机酸导致酵母受抑制。因此,建议以30%的比例回配清液进行酒精发酵。
