3种有机磷农药对水生生物的乙酰胆碱酯酶抑制效应的物种敏感度分析初探
2016-10-27朱岩王飞飞张亚辉曹莹曾鸿鹄刘征涛
朱岩,王飞飞,张亚辉,曹莹,曾鸿鹄,刘征涛
1.桂林理工大学环境科学与工程学院,桂林541004
2.中国环境科学研究院环境基准与风险评估国家重点实验室国家环境保护化学品生态效应与风险评估重点实验室,北京100012
3种有机磷农药对水生生物的乙酰胆碱酯酶抑制效应的物种敏感度分析初探
朱岩1,2,王飞飞1,张亚辉2,*,曹莹2,曾鸿鹄1,刘征涛2
1.桂林理工大学环境科学与工程学院,桂林541004
2.中国环境科学研究院环境基准与风险评估国家重点实验室国家环境保护化学品生态效应与风险评估重点实验室,北京100012
通过筛选敌敌畏、马拉硫磷和对硫磷3种有机磷农药对水生生物的急性毒性数据和乙酰胆碱酯酶抑制效应数据,构建物种敏感度分布曲线进行了比较分析。结果表明,敌敌畏对水生生物的急性毒性和乙酰胆碱酯酶抑制效应的大小顺序为:酶体内抑制效应>酶体外抑制效应>急性毒性;马拉硫磷和对硫磷的乙酰胆碱酯酶抑制效应数据不足但趋势相似,顺序为:酶体内抑制效应>急性毒性>酶体外抑制效应。敌敌畏的急性毒性和酶体外抑制效应的5%危害浓度(HC5)分别为2.07 μg·L-1和1.53 μg·L-1,两者相差1.4倍。在水质基准推导中,乙酰胆碱酯酶抑制效应数据对有机磷农药的水生生物基准具有重要的参考价值。
有机磷农药;水生生物;乙酰胆碱酯酶;物种敏感度;水质基准
朱岩,王飞飞,张亚辉,等.3种有机磷农药对水生生物的乙酰胆碱酯酶抑制效应的物种敏感度分析初探[J].生态毒理学报,2016,11(3):211-218
Zhu Y,Wang F F,Zhang Y H,et al.A preliminary study on species sensitivity analysis of inhibition effect of three organophosphorus pesticides on acetylcholinesterase in aquatic organisms[J].Asian Journal of Ecotoxicology,2016,11(3):211-218(in Chinese)
水生生物基准作为水质基准(water quality criteria,WQC)的核心组成部分,用于保护水生态系统中水生生物的安全。推导污染物的水生生物基准的方法主要包括生物模型法、评估因子法、统计外推法等[1]。物种敏感度分布(species sensitivity distribution,SSD)[1]作为统计外推法于20世纪70年代提出,已经成为水质基准推导的主要方法之一[2]。SSD方法采用不同函数,例如对数-逻辑斯帝函数[3-4]、对数正态分布函数[5-6]和对数三角函数[7]等,将不同生物对同一物质的敏感度分布进行拟合,计算出保护一定比例[8]生物的污染物浓度作为水质基准值。目前,该方法主要针对生物个体水平的毒性数据进行统计分析。
长期以来,在推导水生生物基准中,大多采用水生生物毒性数据中存活、生长和繁殖等个体水平的“常规”毒性终点[9-10],而“非常规”的毒性终点,例如雌激素紊乱[11]、酶抑制效应、RNA或DNA[12]水平的变化被忽视。在美国的基准推导文件中,这些“非常规”的毒性终点数据往往归于“其他数据”,但这些毒性终点往往比“常规”毒性终点更加灵敏[13],这些指标通过个体/亚个体水平表现外来胁迫效应,指示环境中痕量污染物短期或长期暴露的毒性效应[14-15]。陈朗等[16]分析了溴氰菊酯的酶类、生物化学、细胞学、遗传学、基因及组织学等生物标记物指标的SSD曲线,指出这些指标可以作为慢性毒性数据的一种替代或补充引入到水质基准推导中,弥补“传统指标”的不足。闫振广等[17]采用基因表达效应分析了重金属的物种敏感度,结果发现铜的基因表达效应较为敏感,具有作为慢性水质基准数据的应用潜力,而锌与镉的基因表达效应与慢性毒性数据相比没有明显优势。
有机磷农药(organphosphorus pesticides,OPs)具有低成本、药效高、品种多等特点,是目前生产和使用最为广泛的一类农药[18]。有机磷农药伴随降雨和坡地漫流进入环境水体中,对水生生物和人体健康构成危害。乙酰胆碱酯酶(acetylcholinestetase, AChE)作为有机磷农药的靶标酶,已经积累了很多毒性数据。本文通过筛选敌敌畏、马拉硫磷和对硫磷3种有机磷农药对水生生物的急性毒性数据和AChE抑制效应数据,利用物种敏感度分布法比较分析3种有机磷农药的急性毒性数据与AChE抑制效应的敏感性,计算得到保护95%水生生物的有机磷农药浓度(HC5)。探讨了在水质基准推导中,有机磷农药对AChE抑制效应数据是否具有补充有机磷农药对水生生物急性毒性数据的潜力。
1 材料与方法(Materials and methods)
1.1 数据搜集与筛选
本文中3种有机磷农药对水生生物的毒性数据主要来自美国环保署(USEPA)[19]的毒性数据库ECOTOX(http://cfpub.epa.gov/ecotox),同时利用Web of Science、Sciencedirect、Wiley、Springer和中国知网等文献数据库搜索公开发表的中英文文献,并以所得文献的引用文献作为补充。广泛搜集了敌敌畏(dichlorvos)、对硫磷(parathion)和马拉硫磷(malathion)3种有机磷农药对水生生物的毒性数据。搜索所用关键词包括“敌敌畏”、“马拉硫磷”、“对硫磷”、“水生生物”、“乙酰胆碱酯酶”、“有机磷农药”、“水质基准”、“生态风险”、“风险评估”、“物种敏感度”等。
参考美国水生生物基准技术指南[16]的数据筛选原则,将搜集到的数据进行筛选,筛选标准为:数据的毒性终点为半数致死浓度(LC50)或半数效应浓度(EC50),暴露时间2~4 d,不同暴露时间的数据以时间较长的优先;同一文献中对同一种生物的多个毒性数据,当暴露时间相同时,选择最敏感的数据;同一物种不同生命阶段的毒性数据以敏感生命阶段的数据优先。
1.2 数据处理
将搜集且筛选过的数据按照浓度由小到大进行排序并编号,同一物种的多个同类毒性数据取几何平均值作为该物种的急性毒性值或AChE抑制效应数据。计算每个物种的累计概率:

式中,P为累积概率,i是物种排序的秩,N是样本数。将排序后的累积概率和浓度的对数转换值应用数据分析软件Origin 9.0,选用某一特定概率模型进行参数拟合构建物种敏感度分布曲线。当累积概率为0.05时,对应的浓度就是水生生物被危害的比例为5%时的污染物浓度(HC5)。采用对数-正态分布(公式2)和对数-逻辑斯蒂函数(公式3)对SSD曲线进行拟合,采用决定校正系数(Adj.R2)和加权卡方检验系数(Reduced Chi-Sqr)来判断模型的拟合优度,选择最佳拟合模型。

式中,y为累计概率,x为有机磷农药浓度对数转换值(μg·L-1),α、β、μ和σ均为曲线参数,erf()为误差函数。
2 结果(Results)
2.1 有机磷农药对AChE的抑制效应
敌敌畏、对硫磷和马拉硫磷3种典型有机磷农药对水生生物的急性数据,其中包括敌敌畏的69种生物的急性毒性数据,马拉硫磷的43种生物的急性毒性数据,对硫磷的11种生物的急性毒性数据(见附表1~3)。
本文搜集的AChE抑制效应数据明显少于急性毒性数据,共涉及26种水生生物,包括19种生物的敌敌畏毒性数据、8种生物的马拉硫磷毒性数据和5种生物的对硫磷毒性数据,其中以敌敌畏的AChE抑制效应数据最为丰富(见表1~2)。26种水生生物中,鱼类占19种。

表1 乙酰胆碱酯酶(AChE)体外暴露于3种有机磷农药的半数效应浓度/半数抑制浓度(EC50/IC50)值Table 1 The EC50/IC50values of AChE fromin vitroexposure to three organophosphorus pesticides(OPs)
26种水生生物的离体实验中,根据试验方法的不同分为体内染毒和体外染毒。有10篇文献中采用体外染毒的方法:提取生物体内的AChE与不同种类、浓度的有机磷农药混合,在一定条件下培养后,测定有机磷农药对AChE的抑制效应[20-22];有8篇文献中采用体内染毒的方法:将待测生物暴露在不同种类、浓度的有机磷农药中,经过一定时间后,提取并测定酶活,得到有机磷农药在不同暴露时间内对AChE的抑制效应[23-28]。现有的数据表明,在AChE的体外抑制中,敌敌畏的16种水生生物中,最敏感的是欧洲鱼衔,最不敏感的是鲫鱼,两者相差约350倍;马拉硫磷的4种水生生物中,最敏感的是黑头软口鲦,最不敏感的是鲢鱼,两者相差约10倍;对硫磷的2种淡水水生生物中,最敏感的是大型溞,最不敏感的是罗非鱼,两者相差5倍。在AChE的体内抑制中,敌敌畏毒性相关的3种淡水水生生物中,最敏感的是大型溞,最不敏感的是摇蚊幼虫,两者相差约35倍;马拉硫磷毒性相关的4种淡水水生生物中,最敏感的是侧边底鳉,最不敏感的是蓝鮎,两者相差1万倍;对硫磷毒性相关的4种淡水水生生物中,最敏感的是大型溞,最不敏感的是金头鲷,两者相差约110倍。另外,体外染毒方法中暴露时间也相差很大,最短为3 min(鲢鱼),最长为1 h(太平洋牡蛎)。
2.2 SSD最佳拟合函数

表2 乙酰胆碱酯酶(AChE)体内暴露于3种有机磷农药的半数效应浓度/半数抑制浓度(EC50/IC50)值Table 2 The EC50/IC50values of AChE fromin vivoexposure to three organophosphorus pesticides(OPs)
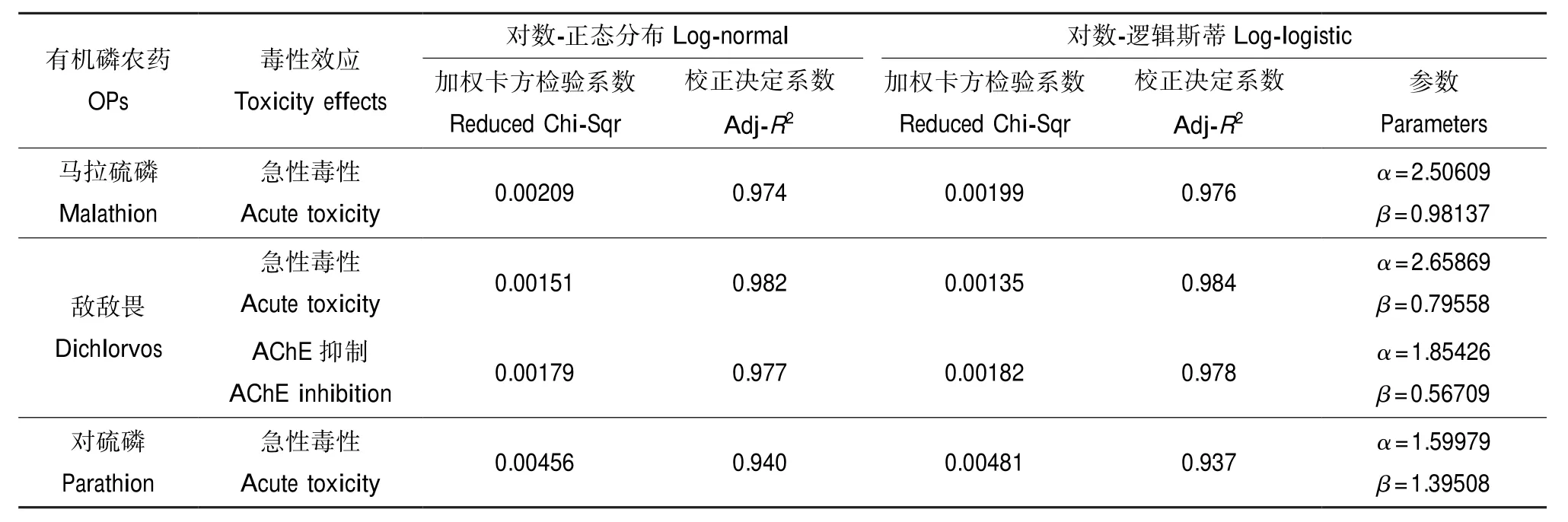
表3 2个数学函数对SSD曲线的统计参数Table 3 The statistics of two mathematical functions for SSD curves
通过对数-正态分布函数和对数-逻辑斯蒂函数拟合构建SSD曲线,2个函数拟合的统计参数(见表3)。整体而言,2个函数拟合的参数值比较接近,其校正决定系数均大于0.937,加权卡方检验系数均较小。对数-逻辑斯帝函数对敌敌畏和马拉硫磷毒性数据拟合的校正决定系数大于对数-正态分布函数拟合值,并且对数-逻辑斯帝函数拟合的加权卡方检验系数小于对数正态分布函数拟合值;对数-逻辑斯帝函数对对硫磷毒性数据拟合的矫正检验系数和加权卡方检验系数均小于对数-正态分布函数的拟合值。综上所述,本文中SSD曲线的拟合采用对数-逻辑斯蒂函数。

图1 马拉硫磷、敌敌畏和对硫磷对水生生物的急性和酶抑制效应数据的SSD曲线
2.3 急性毒性数据与AChE抑制效应数据的对比
为比较急性毒性数据和AChE抑制效应数据之间的敏感度差异,利用对数-逻辑斯蒂函数分别对有机磷农药敌敌畏、对硫磷和马拉硫磷的急性毒性和AChE抑制效应数据进行分布拟合,根据所获得的参数得到SSD曲线,它可以直观地表示不同水生生物对有机磷农药的敏感度分布情况(见图1)。其中马拉硫磷和对硫磷的AChE抑制效应数据太少(n< 10)仅在图中显示位置,没有构建SSD曲线[1]。由图1可以看出,在横坐标相同的情况下,对硫磷和马拉硫磷对水生生物急性毒性的SSD曲线斜率相对较小,而敌敌畏的SSD曲线斜率则较大,表明大部分水生生物对敌敌畏的敏感度相对接近,而不同种水生生物对于马拉硫磷和对硫磷的敏感度则差异较大。对于急性毒性和AChE抑制效应这2类数据的敏感度来说,不同的有机磷农药显示出差异性。敌敌畏的数据敏感度排序为“酶体内抑制效应>酶体外抑制效应>急性毒性效应”;在低浓度区间,对硫磷对AChE的体内抑制效应数据与急性毒性数据接近,马拉硫磷与敌敌畏类似;在高浓度区间,马拉硫磷对AChE的抑制效应数据与急性毒性数据接近;从趋势上看,3种有机磷农药的共同之处都是AChE的体内抑制效应比AChE的体外抑制效应更灵敏。
为便于对3种有机磷农药的急性毒性和AChE抑制效应数据进行量化对比,分别对能保护95%的水生生物的污染物浓度(HC5)进行计算,HC5是计算保护水生生物的水质基准的重要依据。由于欠缺马拉硫磷和对硫磷的AChE抑制效应数据,只有敌敌畏的数据比较丰富,可以进行拟合计算HC5。敌敌畏的急性毒性和AChE体外抑制效应的HC5分别为2.07 μg·L-1和1.53 μg·L-1,两者相差1.4倍。
3 讨论(Discussion)
总体而言,3种有机磷农药对AChE的体内抑制效应比体外抑制效应更灵敏。这可能是由于在体外染毒方法中没有考虑到有机磷农药在生物体内代谢作用的影响,使得测定农药对AChE的毒性数据与实际环境中同浓度农药对AChE的毒性数据有一定偏差。例如,对氧磷对AChE的毒性大于对硫磷,但由于对硫磷在生物体内可以转化为对氧磷,使得体内抑制所得到的IC50远远小于体外抑制所得到的IC50[45]。那么,几乎可以肯定对硫磷对水生生物的AChE抑制效应还存在更小的IC50值,即AChE抑制效应的敏感度还会提升。
本文选择了对确定水质基准具有重要参考价值的HC5对敏感度进行定量分析,对硫磷和马拉硫磷对水生生物体内的AChE抑制效应数据不足无法计算HC5。由于数据量的限制,仅将敌敌畏对水生生物体内AChE的抑制效应数据进行推算来比较数据灵敏度。敌敌畏的急性毒性和AChE体外抑制效应的HC5分别为2.07 μg·L-1和1.53 μg·L-1,两者相差1.4倍,比较接近。陈朗等[16]对于溴氰菊酯,采用酶类、生物化学、细胞、遗传、基因及组织学等生物标记物指标的最低可观测效应浓度(LOEC)的SSD曲线,计算得到HC5值为1.3 ng·L-1,与水生生物的基准连续浓度(CCC)值0.9 ng·L-1相近,与基准最大浓度(CMC)值7.5 ng·L-1,相差较大,因此作者指出这些生物标记物指标可以作为水生生物基准中慢性数据的替代或补充。因此,鉴于试验动物福利和AChE体外抑制试验数据的快速可获得性上来说,在推导水质基准中,AChE抑制效应数据可以作为有机磷农药的急性毒性数据的补充,具有重要的参考价值。
一般认为,在分子水平上的AChE对污染物胁迫发生应激响应要早于个体、种群或群落[46]。由于AChE的检测手段能更好地评价有机磷农药对水生生物的危害程度,但现阶段的数据量难以支持其在实际水环境中的应用。只有通过积累更多有机磷农药对水生生物的AChE抑制数据,才能正确评价AChE抑制效应指标在水质基准研究中的作用。因此有机磷农药对水生生物的AChE抑制效应在水质基准上具有广泛的研究前景。
(References):
[1] Posthuma L,Suter II G W,Traas T P.Species Sensitivity Distributions in Ecotoxicology[M].Boca Raton:CRC Press,2001
[2] Wheeler J,Grist E,Leung K,et al.Species sensitivity distributions:Data and model choice[J].Marine Pollution Bulletin,2002,45(1):192-202
[3] Aldenberg T,Slob W.Confidence limits for hazardous concentrations based on logistically distributed NOEC toxicity data[J].Ecotoxicology and Environmental Safety, 1993,25(1):48-63
[4] Awkerman J A,Raimondo S,Barron M G.Development of species sensitivity distributions for wildlife using interspecies toxicity correlation models[J].Environmental Science&Technology,2008,42(9):3447-3452
[5] Aldenberg T,Jaworska J S.Uncertainty of the hazardous concentration and fraction affected for normal species sensitivity distributions[J].Ecotoxicology and Environmental Safety,2000,46(1):1-18
[6] Maltby L,Brock T C,Brink P J.Fungicide risk assessment for aquatic ecosystems:Importance of interspecific variation,toxic mode of action,and exposure regime[J]. Environmental Science&Technology,2009,43(19): 7556-7563
[7] Stephen C E,Mount D I,Hansen D J,et al.Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms and their uses[R]. Washington DC:United States Environmental Protection Agency,Office of Research and Development,1985
[8] Klepper O,Bakker J,Traas T P,et al.Mapping the potentially affected fraction(PAF)of species as a basis for comparison of ecotoxicological risks between substances and regions[J].Journal of Hazardous Materials,1998,61 (1):337-344
[9] 闫振广,孟伟,刘征涛,等.我国淡水生物氨氮基准研究[J].环境科学,2011,32(6):1564-1570
Yan Z G,Meng W,Liu Z T,et al.Development of freshwater aquatic life criteria for ammonia in China[J].Environmental Science,2011,32(6):1564-1570(in Chinese)
[10] 闫振广,孟伟,刘征涛,等.我国典型流域镉水质基准研究[J].环境科学研究,2010(10):1221-1228
Yan Z G,Meng W,Liu Z T,et al.Development of aquatic criteria for cadmium for typical basins in China[J].Research of Environmental Sciences,2010(10):1221-1228 (in Chinese)
[11] 雷炳莉,金小伟,黄圣彪,等.太湖流域3种氯酚类化合物水质基准的探讨[J].生态毒理学报,2009,4(1):40-49
Lei B L,Jin X W,Huang S B,et al.Discussion of quality criteria for three chlorophenols in Taihu Lake[J].Asian Journal of Ecotoxicology,2009,4(1):40-49(in Chinese)
[12] Fedorenkova A,Vonk J A,Lenders H R,et al.Ecotoxicogenomics:Bridging the gap between genes and populations[J].Environmental Science&Technology,2010,44 (11):4328-4333
[13] Stephen C E,Mount D I,Hansen D J,et al.Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms and their uses[R]. Washington DC:United States Environmental Protection Agency,Office of Research and Development,1985
[14] Neumann N F,Galvez F.DNA microarrays and toxicogenomics:Applications for ecotoxicology[J].Biotechnology Advances,2002,20(5):391-419
[15] Zhang W,Song Y,Gong P,et al.Earthworm cytochrome p450 determination and application as a biomarker for diagnosing PAH exposure[J].Journal of Environmental Monitoring,2006,8(9):963-967
[16] 陈朗,宋玉芳,张伟东,等.基于多指标的中国淡水拟除虫菊酯水质基准[J].生态学杂志,2015,34(10):2879-2892
Chen L,Song Y F,Zhang W D,et al.Derivation of freshwater quality criteria by multi-index for pyrethroids in China[J].Chinese Journal of Ecology,2015,34(10): 2879-2892(in Chinese)
[17] 闫振广,杨霓云,王晓南,等.基于基因表达效应的物种敏感度分析初探[J].中国科学:地球科学(中文版), 2012,42(5):673-679
[18] 张一宾,孙晶.国内外有机磷农药的概况及对我国有机磷农药发展的看法[J].农药,1999,38(7):1-3
[19] US EPA.National Recommended Water Quality Criteria [EB/OL].(2012-08-02)[2015-11-30].http://water.epa.gov/ scitech/swguigance/standards/current/index.cfm
[20] Bruijn J D,Hermens J.Inhibition of acetylcholinesterase and acute toxicity of organophosphorous compounds to fish:A preliminary structure-activity analysis[J].Aquatic Toxicology,1993,24(3):257-274
[21] Sturm A,Assis H D S,Hansen P D.Cholinesterases of marine teleost fish:Enzymological characterization and potential use in the monitoring of neurotoxic contamination[J].Marine Environmental Research,1999,47(4): 389-398
[22] Galgani F,Bocquene G.In vitro inhibition of acetylcholinesterase from four marine species by organophosphates and carbamates[J].Bulletin of Environmental Contamination and Toxicology,1990,45(2):243-249
[23] McHenery J G,Saward D,Seaton D D.Lethal and sublethal effects of the salmon delousing agent dichlorvos on the larvae of the lobster(Homarus gammarusL.)and herring(Clupea harengusL.)[J].Aquaculture,1991,98(4): 331-347
[24] Karen D J,Klaine S J,Ross P E,et al.Further considerations of the skeletal system as a biomarker of episodic chlorpyrifos exposure[J].Aquatic Toxicology,2001,52 (3):285-296
[25] McHenery J,Francis C,Davies I,et al.Threshold toxicity and repeated exposure studies of dichlorvos to the larvae of the common lobster(Homarus gammarusL.)[J].A-quatic Toxicology,1996,34(3):237-251
[26] Henery J M,Adams L G,Moore D,et al.Experimental and field studies of effects of dichlorvos exposure on acetylcholinesterase activity in the gills of the mussel,Mytilus edulisL.[J].Aquatic Toxicology,1997,38(1):125-143
[27] Bris L H,Maffart P,Bocquené G,et al.Laboratory study on the effect of dichlorvos on two commercial bivalves [J].Aquaculture,1995,138(1):139-144
[28] Stien X,Percic P,Barelli G M,et al.Evaluation of biomarkers in caged fishes and mussels to assess the quality of waters in a bay of the NW mediterranean sea[J].Environmental Pollution,1998,99(3):339-345
[29] 丁运华,谭笑燕,何玉君,等.罗非鱼乙酰胆碱酯酶的组织分布动力学特性及农药敏感性分析[J].广东农业科学,2015,42(12):111-115
Ding Y H,Tan X Y,He Y J,et al.Tissue distribution,kinetic characters and sensitivity to insecticides of acetylcholinesterase inOreochromis aurea[J].Guangdong Agricultural Sciences,2015,42(12):111-115(in Chinese)
[30] 丁运华,严松溪,谢汝朋,等.几种淡水鱼肌肉乙酰胆碱酯酶的盐析提取及农药敏感性研究[J].热带农业科学,2011,31(6):21-23
Ding Y H,Yan S X,Xei R P,et al.Extraction and insecticides susceptibility of acetylcholinesterase from muscle tissues of fresh water fishes[J].Chinese Journal of Tropical Agriculture,2011,31(6):21-23(in Chinese)
[31] Olson D,Christensen G.Effects of water pollutants and other chemicals on fish acetylcholinesterase(in vitro)[J]. Environmental Research,1980,21(2):327-335
[32] 贾玉玲,彭惠民,彭方毅,等.鲫鱼脑AChE制备及对几种有机磷农药敏感性研究[J].环境科学与技术,2010, 33(6):23-27
Jia Y L,Peng H M,Peng F Y,et al.Preparation of acetylcholinesterase by crucian carp brain and its sensitivity to several organophosphorus pesticides[J].Environmental Science and Technology,2010,33(6):23-27(in Chinese)
[33] Assis C R D,Linhares A G,Oliveira V M,et al.Comparative effect of pesticides on brain acetylcholinesterase in tropical fish[J].Science of The Total Environment,2012, 441:141-150
[34] Chuiko G.Comparative study of acetylcholinesterase and butyrylcholinesterase in brain and serum of several freshwater fish:Specific activities and in vitro inhibition by DDVP,an organophosphorus pesticide[J].Comparative Biochemistry and Physiology Part C:Pharmacology,Toxicology and Endocrinology,2000,127(3):233-242
[35] Assis C R D,Castro P F,Amaral I P G,et al.Characterization of acetylcholinesterase from the brain of the amazonian tambaqui(Colossoma macropomum)and in vitro effect of organophosphorus and carbamate pesticides[J]. Environmental Toxicology and Chemistry,2010,29(10): 2243-2248
[36] Bocquené G,Bellanger C,Cadiou Y,et al.Joint action of combinations of pollutants on the acetylcholinesterase activity of several marine species[J].Ecotoxicology,1995,4 (4):266-279
[37] Sturm A,Wogram J,Segner H,et al.Different sensitivity to organophosphates of acetylcholinesterase and butyrylcholinesterase from three-spined stickleback(Gasterosteus aculeatus):Application in biomonitoring[J].Environmental Toxicology and Chemistry,2000,19(6):1607-1615
[38] Key P B,Fulton M H.Correlation between 96-h mortality and 24-h acetylcholinesterase inhibition in three grass shrimp larval life stages[J].Ecotoxicology and Environmental Safety,2006,63(3):389-392
[39] Aker W G,Hu X,Wang P,et al.Comparing the relative toxicity of malathion and malaoxon in blue catfishIctalurus furcatus[J].Environmental Toxicology,2008,23(4): 548-554
[40] Chen C,Wang Y,Zhao X,et al.The combined toxicity assessment of carp(Cyprinus carpio)acetylcholinesterase activity by binary mixtures of chlorpyrifos and four other insecticides[J].Ecotoxicology,2014,23(2):221-228
[41] Fulton M,Scott G.The effect of certain intrinsic and extrinsic variables on the acute toxicity of selected organophosphorus insecticides to the mummichog,Fundulus heteroclitus[J].Journal of Environmental Science&Health Part B,1991,26(5-6):459-478
[42] Sturm A,Hansen P D.Altered cholinesterase and monooxygenase levels inDaphnia magnaandChironomus ripariusexposed to environmental pollutants[J].Ecotoxicology and Environmental Safety,1999,42(1):9-15
[43] Arufe M I,Arellano J M,Albendín G,et al.Toxicity of parathion on embryo and yolk-sac larvae of gilthead seabream(Sparus aurataL.):Effects on survival,cholinesterase,and carboxylesterase activity[J].Environmental Toxicology,2010,25(6):601-607
[44] Ferrari A,Venturino A,de D’Angelo A M P.Time course of brain cholinesterase inhibition and recovery following acute and subacute azinphosmethyl,parathion and carbaryl exposure in the goldfish(Carassius auratus)[J]. Ecotoxicology and Environmental Safety,2004,57(3): 420-425
[45] Guilhermino L,Lopes M C,Carvalho A P,et al.Inhibition of acetylcholinesterase activity as effect criterion in acute tests with juvenileDaphnia magna[J].Chemosphere, 1996,32(4):727-738
[46] Markert B A,Breure A M,Zechmeister H G.Bioindicators and biomonitors:Principles,concepts,and applications[J].Amsterdam:Elsevier,2003◆
A Preliminary Study on Species Sensitivity Analysis of Inhibition Effect of Three Organophosphorus Pesticides on Acetylcholinesterase in Aquatic Organisms
Zhu Yan1,2,Wang Feifei1,Zhang Yahui2,*,Cao Ying2,Zeng Honghu1,Liu Zhengtao2
1.College of Environmental Science and Engineering,Guilin University of Technology,Guilin 541004,China
2.State Key Laboratory for Environmental Criteria and Risk Assessment,State Environmental Protection Key Laboratory of Ecological Effects and Risk Assessment of Chemicals,Chinese Research Academy of Environmental Sciences,Beijing 100012,China
30 November 2015 accepted 21 January 2016
The data of the acute toxicity and acetylcholinesterase(AChE)inhibition effect of aquatic organisms of three organophosphorus pesticides(OPs),including dichlorvos,parathion and malathion,were selected and analyzed by species sensitivity distribution.The results showed that the order of acute toxicity and AChE inhibition effect for dichlorvos wasin vivoAChE inhibition>in vitroAChE inhibition>acute toxicity.The trends of speciessensitivity distribution of malathion and parathion were similar based on their insufficient data.The orders of acute toxicity and AChE inhibition effect of malathion and parathion werein vivoAChE inhibition>actue toxicity>in vitroAChE inhibition.The 5%hazard concentration(HC5)of acute toxicity and inhibition effect of dichlorvos were 2.07 μg·L-1and 1.53 μg·L-1,respectively,which differs by 1.4 times from each other.The data of AChE inhibition effect of OPs could be of great reference value when deriving the water qulity criteria.
organophosphate pesticide;aquatic organism;acetylcholinesterase;species sensitivity;water quality criteria
2015-11-30 录用日期:2016-1-21
1673-5897(2016)3-211-08
X171.5
A
10.7524/AJE.1673-5897.20151130006
简介:张亚辉(1979—),女,副研究员,主要从事污染物联合毒性及毒性评估与预测研究,发表学术论文20余篇。
国家水体污染控制与治理科技重大专项(2012ZX07501-003);科技基础性工作专项(2014FY120600);国家自然科学基金(51268008,21407139)
朱岩(1990-),男,硕士研究生,研究方向为水处理理论与技术,E-mail:zhuyan_craes@foxmail.com;
*通讯作者(Corresponding author),E-mail:zhangyahui@craes.org.cn
