环甲基硅氧烷的环境分布、行为与效应研究进展
2016-10-27张松林吴丽华
张松林,吴丽华
西北师范大学地理与环境科学学院,兰州730070
环甲基硅氧烷的环境分布、行为与效应研究进展
张松林*,吴丽华
西北师范大学地理与环境科学学院,兰州730070
近年来,挥发性环甲基硅氧烷(cVMS)在生产和生活过程中的广泛使用导致其环境和人体暴露风险日益增加,由于其具有持久性、潜在的生物积累性和毒性而被受关注。目前,人们对cVMS在全球各种环境介质中的赋存、行为及效应有一定的了解。排入环境中的cVMS大部分进入大气,在水体、沉积物、土壤和生物体中也有一定的含量。研究表明,希腊室内空气降尘中总的环硅氧烷含量中位数最高(1 380 ng·g-1),其次为中国(362 ng·g-1);中国污水处理厂总的硅氧烷年人均通量(10 g·y-1)低于英国(D4 ~D6 48.3 g·y-1)和美国(D4~D6 93.5 g·y-1),其中大连市一家采用CWSBR工艺的污水处理厂进水中cVMS的总浓度(1.05 μg·L-1)普遍低于希腊(5.14 μg·L-1)、西班牙(9.2 μg·L-1)、加拿大(44 μg·L-1)和一些北欧国家(17 μg·L-1);我国大部分废水处理厂污泥中甲基硅氧烷的含量(0.1~l μg·g-1dw)比一些北欧国家(26 μg·g-1dw)、希腊(20 μg·g-1dw)和加拿大(64 μg·g-1dw)等要低得多。中国普通居民吸入+摄食D4~D6的PELs中位数(173 ng·d-1)远低于中国普通人群的皮肤暴露(中位数18.5 μg·d-1),更低于英国成人日暴露量(1.875 mg·d-1)和美国妇女对总硅氧烷的日暴露量(307 mg·d-1)。环境中cVMS的行为和效应取决于其理化性质和具体的环境条件。进入大气的cVMS会与·NO3、O3和·OH反应,而与·OH反应脱去甲基生成硅醇是其主要的消除机制。污水处理过程中,大部分cVMS被污泥吸附固定,D6吸附污泥的能力最强,其次为D5和D4。挥发、吸附和非生物降解是cVMS在土壤中主要的环境行为。D4和D5可能存在生物放大作用。评估cVMS的TMF(trophic magnification factor)研究结果相互矛盾,且与BCF、BMF和BSAF的评估结果相反。总之,国内外对污水处理过程中cVMS的赋存状态和迁移、转化行为的研究比较多,且以进、出水和剩余污泥为主,而对整个工艺流程中具体变化的细化研究很少,对其生物积累特征、降解机制和降解产物更缺乏深入研究。因此,今后需要补充对其他环境介质、尤其是和人们居住、工作密切相关环境中cVMS分布规律的研究,深入探索其在实际环境中的降解过程,包括其降解产物或中间产物的环境行为,进一步评估其生态环境效应和人类健康风险。
环甲基硅氧烷;环境分布;环境行为;环境效应
张松林,吴丽华.环甲基硅氧烷的环境分布、行为与效应研究进展[J].生态毒理学报,2016,11(3):72-85
Zhang S L,Wu L H.The research progress of environmental distribution,behavior and effects of cyclic methylsiloxanes[J].Asian Journal of Ecotoxicology,2016,11(3):72-85(in Chinese)
一般把含Si-C键的化合物通称为有机硅化合物(organosilicon compound)。但是,也常把通过氧、硫和氮等杂原子使有机基团与硅原子相连接的化合物当作有机硅化合物。由于性能优异,作为“工业味精”的有机硅化合物广泛应用于航天、航空、船舶、汽车、电子电气、轻工纺织、石油化工、建筑建材、农业(农药)、能源开发、医疗保健、炊具和美容护发等领域。中国2008年和2009年有机硅总产量和使用量分别为19.5万t、37.5万t和27万t、43万t,全球最大[1]。其中,以硅氧键(Si-O-Si)为骨架的有机硅氧烷(siloxane)是一类人工合成的高分子聚合物(与硅原子相连的有机基团为甲基、乙基或苯基等),因为其具有高蒸汽压、低水溶性、高表面活性和润滑性等特性而为数最多、研究最深和应用最广,商品化的产品包括硅油、硅橡胶和硅树脂等。
工业品和消费品中广泛应用的甲基硅氧烷(methylsiloxane,MS)按照结构分为线形甲基硅氧烷(linear methylsiloxane,lMS)和环状甲基硅氧烷(cyclic methylsiloxane,cMS)两类[2-4]。其中,挥发性甲基硅氧烷(volatile methylsiloxane,VMS)、聚二甲基硅氧烷(polydimethylsiloxane,PDMS)与聚醚甲基硅氧烷(polyethermethylsiloxane,PEMS)的环境载荷显著[2,4]。
VMS被广泛用于工业生产、日常生活、医疗和建筑等领域,为高产量(high production volume)的化学品[5-9]。其中,以八甲基环四硅氧烷(D4)、十甲基环五硅氧烷(D5)和十二甲基环六硅氧烷(D6)为主的环状挥发性甲基硅氧烷(cVMS)表面张力低、热稳定性高、无色无味、化学性质稳定,而疏水性、电绝缘性和润滑性都较强[5-6]。2008年全世界cVMS产量100多万t[7]。其中,D4主要用于合成有机硅,而D5和D6主要是芳香剂、护发素、洗面乳、除臭剂、止汗剂和指甲油等个人护理品的添加剂[4-5,10]。几种典型cVMS的理化性质如表1所示。
由于使用广泛,大量cVMS进入大气[3]、水体[12]、污水处理厂进出水和活性污泥[13-14]、土壤和城市污泥[15-16]等环境中。由于化学性质稳定,cVMS能够在环境中持久存在,如滞留在空气中并远距离运输,甚至到达极地地区[3,17];D4在大气中的漂移距离约为7 920 km[7]。水体中的cVMS难以被生物降解[18-19],加大了其在水生生物体内富集的可能性[20]。动物暴露实验发现,cVMS能导致内分泌紊乱、结缔组织疾病、不良免疫反应和致命的肝、肺损伤等[21-25]。为此,2008年加拿大环保部和卫生部提议把D4、D5和D6列入“实质消除”名单进行有效削减[7]。考虑到其持久性、潜在的生物积累性和毒性,欧洲也打算将cVMS列入相应的法规当中[26]。可见,近年来cVMS作为新的潜在生物积累和环境危害有机污染物[27-28]而广受关注。因此,本文着重综述其环境分布、环境行为和环境效应。
1 cVMS的环境分布(Environmental distribution of cVMS)
cVMS能够通过各种途径进入环境介质和包括人体在内的生物体中。譬如,市政固废和市政污水中硅氧烷的释放机制参见图1。
1.1 大气环境
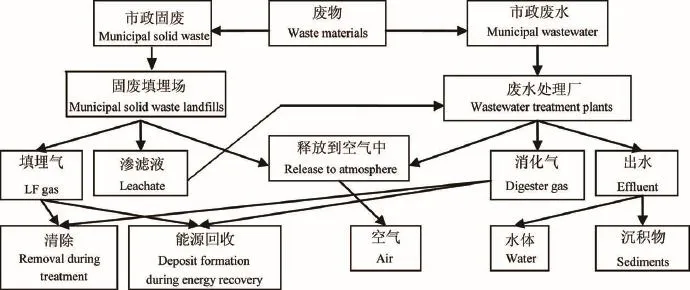
图1 废物中硅氧烷向环境的释放机制(参照文献11修改)

表1 D4、D5和D6的性质[2,6,11]Table 1 Property of D4,D5 and D6[2,6,11]
由于其水溶性极低、蒸汽压和亨利系数相对较高[2,6,15],所以大部分cVMS会在生产、使用过程中直接挥发进入大气。垃圾填埋气和沼气等生物气体也是大气中cVMS的重要来源[3,6,29]。而在污泥厌氧消解过程中,大部分cVMS易挥发进入生物气中[11]。Wang等[30]在中国珠江三角洲地区广州、澳门和南海的环境空气样品中均检出cVMS,D4最高浓度是20.5 μg·m-3。相比于郊区,广州工厂附近、垃圾填埋场及污水处理厂环境空气样品中的cVMS浓度较高。1993年,美国cVMS的环境负荷约为1.971× 107kg,其中90%以上释放到大气中[31]。
有关室内空气中硅氧烷的研究比较少。2010~ 2014年,Tran等[32]在12个国家的310个室内空气降尘样品中均检出D3~D7(表2)。其中,希腊室内空气降尘中总的环硅氧烷含量中位数最高,为1 380 ng·g-1,但各国之间差异不显著,可能与包括个人护理品在内的硅氧烷消费和使用模式不同有关。个人护理品、尤其是护肤品是(民居)室内空气中硅氧烷的主要来源(表3)[33]。

表2 12个国家室内降尘中总的环硅氧烷(D3~D7)的含量(ng·g-1)[32]Table 2 Concentrations of total cyclic siloxanes in indoor dust collected from 12 countries(ng·g-1)[32]

表3 欧洲个人护理品中典型cVMS的含量(mg·g-1)[33]Table 3 Concentrations of typical cVMS in European cosmetics and personal care products(mg·g-1)[33]
1.2 水环境
cVMS会随着工业废水与生活污水(主要源于化妆品和个人护理品)排入水处理设施[6,29,30,34]。由于具有挥发性,所以大气沉降对水体cVMS的贡献可以忽略不计,水体中的cVMS主要源自于直接排放,大部分和污水处理活动有关。水环境中cVMS的组成和含量见表4,相比之下,加拿大的废水中环甲基硅氧烷的浓度比较高,原因可能是由于各国的消费习惯差异。
希腊一家污水处理厂通过污水进入的硅氧烷通量为15.1 kg·d-1,进水中甲基硅氧烷的总含量为20 μg·L-1,通过废水排放进入环境的硅氧烷通量为2.67 kg·d-1,出水中为3.58 μg·L-1;环甲基硅氧烷的去除率大于80%[50]。英国一家污水处理厂服务人口的D5人均消费量为2.7 mg·cap-1d-1,显著低于英国环境署风险评价值(11.6 mg·cap-1d-1),cVMS的去除率高于98%[76]。北京一家污水处理厂的污水中普遍存在D3~D6,进水中D3、D4、D5和D6的年通量分别为78.2、387.7、462.1和347.5 kg,D4、D5和D6的年人均通量分别为4.8 g、5.7 g和4.3 g(中国总的硅氧烷年人均通量10 g,英国D4、D5和D6的年人均通量分别为1.4 g、42 g和4.9 g,美国D4、D5和D6的年人均通量分别为0.4 g、85 g和8.1 g),进水中总的甲基硅氧烷含量为8.93 μg·L-1,出水中为0.29 μg·L-1,去除率为96.75%[34,77]。可见,北京市D4的人均年排放量较高、D6相当,而D5低得多。
大连市8个市政污水处理厂进水和出水中甲基硅氧烷的含量分别为0.0714~0.2652 μg·L-1和0.0489~0.1540 μg·L-1,D4~D7的去除率分别为16.0%、55.6%、41.9%和31.5%;其中,采用循环式活性污泥法(CAST)的污水处理厂对有机硅的消除率为90.4%,采用恒水位序批式工艺(CWSBR)的污水处理厂对有机硅的消除率为87%[78]。大连市一家采用CWSBR工艺的污水处理厂进水中硅氧烷的平均总质量为52 g·d-1,排放至环境中的出水硅氧烷平均总质量为15 g·d-1,水中D4、D5和D6的去除率分别为55%、70%和78%[79]。大连市某采用CWSBR工艺的市政污水处理厂每日人均总VMS质量负荷平均约195 mg·d-1每1 000人,明显低于英国(5 000 mg·d-1每1 000人)[76]、加拿大2 700 mg· d-1每1 000人)[35]和希腊(1 036 mg·d-1每1 000人)[50];沉砂池和CWSBR反应池进水中cVMS的总浓度平均值为1.05 μg·L-1,普遍低于希腊(5.14 μg·L-1)[50]、西班牙(9.2 μg·L-1)[13]、一些北欧国家(17 μg·L-1)[8]和加拿大(44 μg·L-1)[35];cVMS的出水总浓度平均值为0.34 μg·L-1,平均去除率为67.4%,而D4、D5和D6的平均去除率分别为74%、60%和70%[80]。

表4 水环境中典型cVMS的组成与含量(μg·L-1)Table 4 The concentrations of typical cVMS in water environment(μg·L-1)
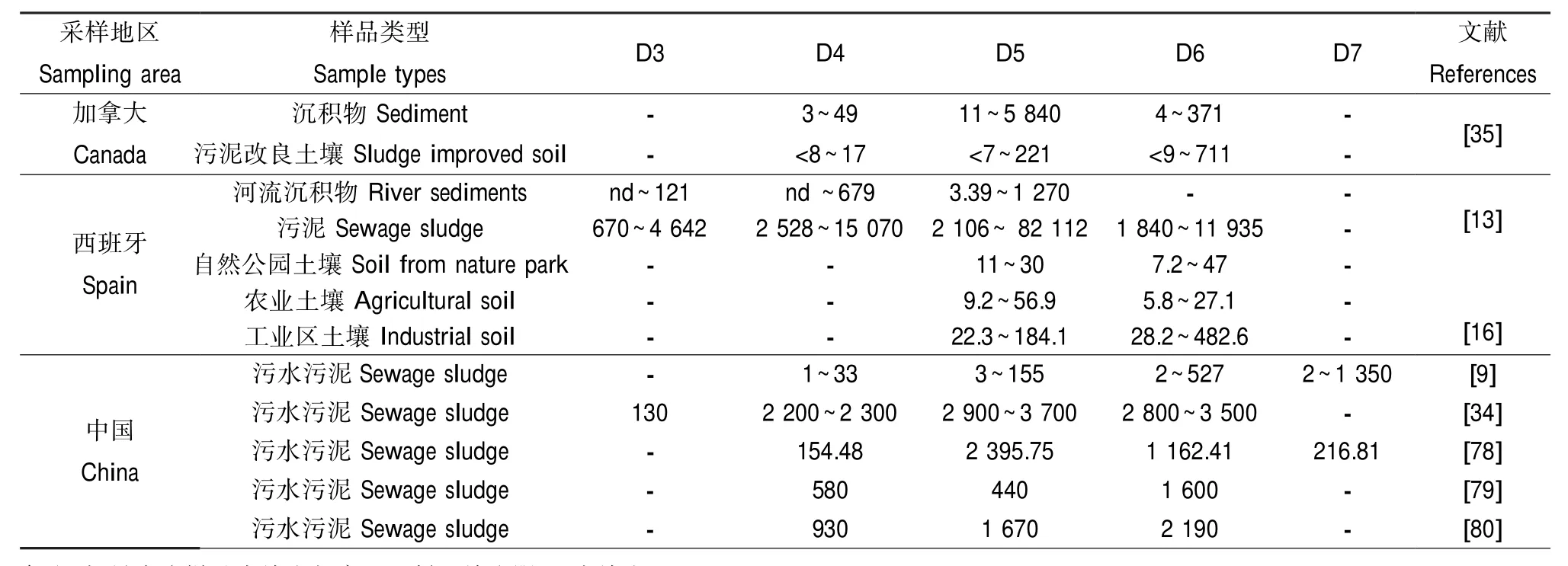
表5 污泥/土壤/沉积物环境中典型cVMS的组成与含量(ng·g-1dw)Table 5 The concentrations of typical cVMS in sewage sludge,soil and sediment environments(ng·g-1dw)
吴倩认为,进水流速、剩余污泥流量、MLSS浓度和出水TSS浓度都是影响VMS排放的因素,其中出水TSS浓度是最大的影响因素,TSS浓度増高,出水VMS浓度就升高;TSS浓度降低,VMS浓度也随之降低,意味着可通过优化TSS的去除机制来降低排放到水生环境中的VMS[80]。
1.3 污泥/土壤/沉积物环境
由于cVMS在水中难溶解、难降解且吸附能力强,少部分随固体颗粒物排入周围水环境、积存在沉积物中[9],而绝大多数吸附于活性污泥上、通过土地利用直接进入土壤[11,36]。溢漏和垃圾填埋也是cVMS进入土壤的主要途径[37]。污泥、土壤和沉积物中典型cVMS的组成与含量见表5。
西班牙不同地点、8个农业土样和7个工业土样中均含有D5和D6,但是只有一个工业土样中含有D4,含量为58.6 ng·g-1dw;农业土壤中总的环甲基硅氧烷含量为15.0~84.0 ng·g-1dw,D5和D6的含量分别为9.2~56.9 ng·g-1dw和5.8~27.1 ng·g-1dw;工业土壤中总的环甲基硅氧烷含量为56.0~ 610.6 ng·g-1dw,D5和D6的含量分别为22.3~ 184.1和28.2~482.6 ng·g-1dw[15]。
希腊污水处理厂污水污泥中总的甲基硅氧烷含量为7 500 ng·g-1[50]。Zhang等[9]首次报道了中国松花江沉积物和污泥中有机硅氧烷的组成和含量,发现D7和D5是沉积物和污水污泥中都存在的主要环状硅氧烷,出水排入松花江的污水处理厂污泥中D4~D7浓度为602~2 360 ng·g-1dw。北京市污水处理厂污水污泥中总的甲基硅氧烷含量为8 730 ng ·g-1[77]。大连市污水处理厂污水污泥中总的甲基硅氧烷含量为5 500 ng·g-1[78]。吴倩[80]研究发现,大连市一家采用CWSBR工艺的剩余污泥样中各cVMS的平均浓度(1.6 μg·g-1dw)与我国大部分废水处理厂的数值相近(0.1~l μg·g-1dw),但与一些北欧国家(26 μg·g-1dw)[8]、希腊(20 μg·g-1dw)[50]和加拿大(64 μg·g-1dw)[35]等国家相比要低得多。相比之下,中国和西班牙污水污泥中的甲基硅氧烷含量比较高。
1.4 生物体
McGoldrick等[38]发现,加拿大伊利湖浮游生物中D4的浓度低于检出限(<2 ng·g-1),钻穴蜉蝣Hexagenia7.0 ng·g-1(ww),鱼类9~13 ng·g-1(ww);浮游生物中D5的浓度为5.2 ng·g-1(ww),蜉蝣11 ng· g-1(ww),鱼类15~36 ng·g-1(ww);生物体中D6的浓度为类似于D4,浮游生物中低于检出限,蜉蝣5.7 ng·g-1(ww),鱼类7~14 ng·g-1(表4)。占据最高营养级的食鱼性鱼类中cVMS的含量最高。
1.5 人体
皮肤暴露是人对VMS的主要暴露途径,然而吸入暴露也有贡献。英国儿童的日暴露量最大(3 188 μg·d-1)、其次是英国成人(1 875 μg·d-1)、再次是意大利成人(1 563 μg·d-1)和意大利儿童(1 261 μg ·d-1);英国50%以上的暴露发生于职业环境中,而意大利60%的发生于卧室中[40]。美国妇女对总的硅氧烷的日暴露率为307 mg·d-1[41],中国成人日暴露率为15.9 ng·d-1[42]。
中国普通人群血浆中D4、D5和D6的含量分别为1.10~5.95 ng·mL-1(中位数2.50)、1.98~6.22 ng ·mL-1(中位数3.44)和1.85~7.50 ng·mL-1(中位4.40),7家工业区工人血浆中D4、D5和D6的含量分别为2.50~25.5 ng·mL-1、3.44~38.0 ng·mL-1和4.40~10.1 ng·mL-1,为普通人群的1.2~10倍[43]。相比之下,在挪威绝经后妇女血浆中检出D4、D5和D6的频率较高(85%、18%和5%),但是其含量也较低(D4、D5和D6含量分别为2.93~12.7 ng·mL-1、1.44~3.94 ng ·mL-1和2.67~3.17 ng·mL-1)[43]。
中国普通居民吸入和摄食D4~D6的PELs (pseudo-exposure level,PEL)中位数为173 ng·d-1,远低于中国普通人群的皮肤暴露(中位数18.5 μg· d-1)。7个工业区总的D4~D6(吸入+摄食)的PELs为56.3~720 μg·d-1。总之,吸入是环甲基硅氧烷主要的暴露途径(99.8%~99.9%)[43]。
2 cVMS的环境行为(Environmental behavior of cVMS)
从人类生产、生活过程中排放到环境中的cVMS会在不同介质中迁移、转化(参见图2和图3),并可能最终进入生物和人体内,表现为各种类型的环境行为。
2.1 大气环境中的cVMS
进入大气的cVMS会与·NO3、O3和·OH反应;而与·OH反应脱去甲基生成硅醇是其主要的消除机制,每个-CH3被·OH替代的几率同等[44-45]。基于全球·OH的平均浓度,这一反应的半衰期长达1~2周,足以使其在空气中广泛分布并远距离运输[16,45-46]。而主要产物硅醇不稳定,溶解度高、蒸汽压低,能被湿沉降有效地从大气中去除[44]。因此,大气·OH能有效清除进入大气的cVMS。
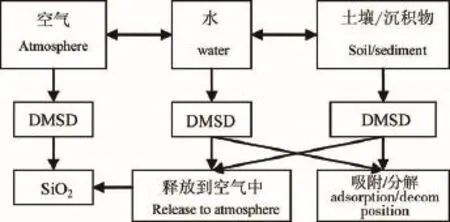
图2 不同介质中硅氧烷的分解反应产物(参照文献11修改)

图3 不同介质中D4和D5达到0.009 μg·L-1的持续时间(参照文献11修改)
同位素标记实验表明,空气样品储存过程中D5和D6可以由于发生转化而减少;其中,40%的转化D5成为D4,而转化为D3的数量比D4低一个量级。在合适的条件下,一个cVMS可以开环、脱去一个硅氧烷单元,再闭环,形成新的cVMS。相比而言,D4是最稳定的cVMS[3]。但是,自然环境中是否普遍存在这种反应形式还有待进一步地研究。
2.2 水环境中的cVMS
cVMS在水环境中的行为主要取决于其水溶性和蒸汽压。由于挥发性较强和亨利系数较高(表1),当液态cVMS进入水相后会迅速分配到大气中,因此水和沉积物中cVMS的浓度较低[9,30]。
有研究者探讨了污水处理厂中硅氧烷的环境行为,但对其去除机制的报道还不多。Zhang等[9]和申凯[79]发现,当地污水处理厂中甲基硅氧烷的去除方式主要为挥发、吸附和生物降解。由于具有高挥发性(表1),大部分D4和D5在污水消解过程中进入沼气里[11]。由于辛醇水分配系数高(表1),甲基环硅氧烷易被吸附在水环境中的污泥或者沉积物上。污泥中的有机物质具有较强的吸附能力,能大量吸附VMS。污水处理过程中,cVMS尽管有挥发但以吸附作用为主,大部分cVMS被污泥吸附固定[35-36],成为污水中主要的去除机制[47-49]。高鹏园[78]也发现,大连市8个市政污水处理厂的8种甲基硅氧烷大部分被活性污泥所吸附。

表6 生物体中典型cVMS的含量(ng·g-1)Table 6 Concentrations of typical cVMS in biota(ng·g-1)
Bletsou等[50]研究发现,希腊一家污水处理厂环甲基硅氧烷的去除途径主要有污泥吸附、生物降解和/或挥发。进水和出水中D5百分比的差异最显著,分别为13%和大约50%,表明其在水环境中的持留时间长;而D6从进水的约9%降低到出水的不足1%,表明其被从水环境中去除的比例相对高;相反,D4从进水的不足1%增加到出水的大约4%,表明其在水环境处理过程中略有浓缩。这主要是由于不同的cVMS的理化性质有比较明显的差异。cVMS中D6吸附污泥的能力最强,其次为D5和D4,logKd(固-液相分配系数):D6(4.13)>D5(3.83)>D4 (3.67)),因此污水中的D6主要是通过吸附被去除的[79]。Egmond等[76]也认为,吸附和挥发是cVMS从污水中去除的主要步骤,尤其是D6大部分以吸附形式进入活性污泥中。
申凯[79]研究表明,大连一家采用CWSBR工艺的污水处理厂中D4、D5和D6主要是通过3个途径消除:污泥吸附、挥发和出水(表7)。其中,污泥吸附是主要的途径,而挥发和出水则相对较小;特别是污泥吸附量随着分子疏水性增大而升高,从D4的54.52%到D6的82.09%,挥发量随着分子量的增大而减少,从D4的33.62%到D6的2.07%;主要原因是污泥/水吸附系数增加比例要大于空气/水分配系数的增加比例,因此VMS还是倾向于吸附至污泥而不是挥发到大气中。吴倩[80]的研究结果略有不同,表面挥发是污水中D4去除的主要方式;曝气方式分别去除了39.05%、13.81%和5.17%的D4、D5和D6,而纯表面挥发则去除了30.06%、10.6%和3.96%的D4、D5和D6,这表明曝气方式是表面挥发损失的一个重要形式(表7)。最终排出水中的D4、D5和D6分别占WWTP进水含量的虽有差异(表7),但是VMS分子量越大越容易通过保留在水相中而排放至水环境中。总之,随着VMS分子量的增大,其表面挥发性显著降低而更容易通过污泥吸附排出水体的途径来去除。

表7 大连市一家采用CWSBR工艺的污水处理厂中D4、D5和D6各去除途径的百分比Table 7 The percentages of different removal ways of the D4,D5 and D6 from wastewaters in a WWTPs with CWSBR,Dalian City
Xu等[34]首次综合研究了北京市政废水处理厂A2/O工艺中cVMS的去除机制。传统的A2/O工艺中由于污泥吸附导致的D3、D4、D5和D6质量损失分别为8.3%、29.4%、38.1%和53.0%,而逆向的A2/ O工艺中由于污泥吸附导致的D3、D4、D5和D6质量损失分别为9.8%、19.0%、32.0%和40.2%。传统的A2/O工艺厌氧池中D3~D6的质量损失相对比例分别为44.4%~84.3%,而缺氧池、需氧池和二沉池中的去除比例合计为6.3%~7.4%;逆向的A2/O工艺厌氧池中D3~D6的质量损失相对比例为45.8%~77.1%,其他单元合计为12.7%~22.9%;这表明,2种工艺过程中环硅氧烷主要被厌氧池消除。活性污泥中,D3和D6几乎不被生物降解(60 h后降解3.0%~18.1%),而D4和D5易被活性污泥降解(60 h后降解44.4%~62.8%)。活性污泥中发现有环甲基硅氧烷水解产物之一的二甲基硅二醇(Me2Si(OH)2)。60 h后,大约21.4%~30.6%的D4和D5降解为二甲基硅二醇。此外,硅氧烷的水解产物还有二甲基硅氧烷-α,ω-二醇(HO(Me2SiO)nH, n=1~5),推测微生物催化水解是厌氧池中环硅氧烷主要的降解途径之一。二级处理过程中挥发和降解也可能导致挥发性硅氧烷的去除。D4和D5在厌氧单元中可被挥发和降解作用去除。挥发性硅氧烷在好氧水环境中几乎不降解,在好氧池和二沉池中主要以挥发方式去除。传统的A2/O工艺缺氧池中D3~D6的质量损失比较少(1.1%~2.2%),表明其缺氧生物降解比较弱;逆向的A2/O工艺缺氧池中D3 ~D6的质量损失也较少(3.5%~19.9%),表明其缺氧生物降解也比较弱,但高于传统的A2/O工艺缺氧池。据估计,逆向的A2/O工艺中,30%的一级处理污水首先进入缺氧池,被搅拌作用挥发。污泥吸附之外,在传统的和逆向的A2/O工艺厌氧单元中,D3~D6主要被挥发和降解去除(主要是D4和D5)。微生物催化水解被认为是厌氧单元中D4和D5的主要降解方式。D3和D6在厌氧池中主要通过挥发作用被去除,D4和D5在厌氧池中主要通过微生物的水解作用被去除。总之,北京市政废水处理厂不同工艺过程中4种环甲基硅氧烷主要被厌氧单元清除(去除率为44.4%~84.3%),其中D3和D6主要通过挥发去除,而D4和D5可以被挥发和降解2种方式去除。而且,微生物催化水解是厌氧单元中D4和D5的主要去除方式之一。厌氧池中D6的降解率低可能是由于空间位阻效应所致。
cVMS虽然在水中难以被生物降解,却可以被水解[51-52],尽管水解速度较缓慢[53-54]。D4和D5在淡水(pH=7,12℃)中的水解反应半衰期是~16.7 d和315 d,其速率会随pH和温度的变化而变化,在pH 8、9℃的海水中半衰期分别是2.9 d和64 d。
2.3 土壤、沉积物中的cVMS
土壤也是环境中cVMS重要的受纳体,挥发、吸附和非生物降解是cVMS在土壤中主要的环境行为[37,55]。研究发现,cVMS的降解是一个多级过程,先进行开环、水解,生成线型低聚硅氧烷二醇,再进一步水解为二甲基硅二醇单体(dimethylsilanediol, DMSD,(CH3)2Si(OH)2)[37]。而沉积物中cVMS降解为DMSD的过程也是其主要的环境行为[56]。以D4为例,其降解过程为:
D4+H2O↔L4
L4+H2O↔L3+DMSD L4+H2O↔2L2
L3+H2O↔L2+DMSD
L2+H2O↔2MSD
D5尤其是D6较D4的水解速率更为缓慢。在与相对湿度50%~90%的空气相平衡的干燥温带土壤中,D4、D5和D6降解的半衰期分别约为4.1~5.3 d、9.7~12.5 d和158~202 d[57]。不稳定的低聚硅氧烷二醇最终水解为DMSD的速率取决于土壤湿度。当达到含水饱和度时,一部分中间产物继续水解为DMSD,而另一部分重新转化为cVMS挥发到大气中[37]。
2.4 人体中的cVMS
一般来说,普通人群血浆中甲基硅氧烷的含量不高,因为缺乏职业暴露和血浆消除速度快。由于血浆中甲基硅氧烷很快就能够达到平衡,所以不存在工作年限的显著差异。女性腹部脂肪中总的硅氧烷含量(D4~D6,L8~L10)(中位数83.5 ng·g-1)显著高于男性(中位数45.0 ng·g-1),原因如下:(1)中国女性消费绝大多数个人护理品(~92%);(2)女性脂肪组织更多、对甲基硅氧烷的代谢更慢。Xu等研究表明,D4~D6在脂肪和血浆之间的分配比为5.3~241 mL·g-1。由于log Kow值大,甲基硅氧烷趋向于从血浆转移到脂肪/组织中[43]。
脂肪中的D4~D6可被交换进入血液中,然后很快通过呼气消除。另外,这些化合物可转移到肝脏中,之后被快速地代谢(氧化和开环)为二甲基硅烷二醇和甲基硅烷三醇等等,通常血液中D4~D6的半衰期很短(约几十个小时)[43]。
3 cVMS的环境效应(Environmental effect of cVMS)
环境中的cVMS大部分进入大气,但是在水体、沉积物和土壤中也有一定的含量。所以,有必要探讨cVMS的可能环境效应。
3.1 对水环境的生态效应
3.1.1 毒性
实验表明,低浓度D4就会危害部分水生生物。D4对蚊虫类(Midges)无影响[58],但对虹鳟鱼有影响[59]。对于小型虹鳟鱼(≤1 g),其急性实验的半数死亡浓度(LC50)是10 μg·L-1,最大无影响浓度(NOEC)和最低不良效应浓度(LOAEC)分别是4.4 μg· L-1和6.9 μg·L-1;慢性实验的NOEC同样也是4.4 μg·L-1。根据欧洲委员会对海洋或淡水生物NOEC小于10 μg·L-1的毒性标准[60],D4对敏感性的水生生物毒性较大。
不同浓度D5对虹鳟幼鱼的暴露实验未发现有死亡率的显著变化[61]。以从胚胎到幼年的黑头呆鱼测试不同浓度D5的毒性,均未发现其对卵孵化、生存和生长有不利影响[62]。这表明,D5对鱼类可能没有明显的毒性。接近水溶性极限5.0 μg·L-1的4.6 μg·L-1D6对黑头呆鱼也无显著效应[63]表明,D6对鱼类的影响也不大。
在21 d的对大型溞的测试实验中,当浓度达到10 μg·L-1时开始出现死亡现象,NOEC大约为7.9 μg·L-1,LOAEC为15 μg·L-1。糠虾的急性NOEC为9.1 μg·L-1,红鲈鱼的急性毒理实验NOEC为6.3 μg·L-1[81]。
3.1.2 生物积累性
生物浓缩系数(bioconcentration factor,BCF)是评价化学物质在环境与生物体之间平衡分配的关键参数。以黑头呆鱼估算的D4和D5的BCF数值大部分大于2 000 L·kg-1[62,64-66],如在最小的D5环境相关浓度下黑头呆鱼对D5的生物浓缩因子为4 450,说明鱼类对D5有一定的生物积累[62]。而虹鳟鱼和黑头呆鱼对D4、D5和D6的“可能吸收(attainable uptake)”分别是200、20和2 mg·L-1,对D8的吸收低于300 μg·L-1[64]。可见,对鱼类D6的生物积累性相对较低[63-64]。
Woodburn等[67]通过先喂食污染食物、再饲喂洁净食物的虹鳟鱼饲喂实验研究了D4和D5的生物放大作用,估算了生物放大因子(biomagnification factor,BMF),得到的静态BMFS和动态BMFK分别是0.28和1.7、0.32和1.3。BMFK均大于1,说明D4和D5可能存在生物放大作用。
评估cVMS的TMF(trophic magnification factor)已出版文献只有美国和挪威的4个水体。Lake Pepin或者Oslo fjord的食物网中cVMS的TMF估算值小于1;而Lakes Mjøssa和Randsfjorden中D5和D6的TMF估计值大于1,表明存在沿着营养级的生物放大作用。4个研究结果相互矛盾,可能是由于生态系统差异、暴露途径和TMF评估的不确定性所致。加拿大伊利湖包含所有的物种的食物网中D4、D5和D6的Bootstrapped平均TMF值都<1,观测TMF>1的概率小于15%。浮游生物占据最低营养级的食物网中不太可能发生D4、D5和D6沿着的营养级放大作用,与Lake Pepin和Oslo Fjord的研究结果一致[38]。
加拿大伊利湖西部盆地5种食物网中只有一种对D4和D5的TMF>1,而所有的食物网对D6的TMF都小于1。对cVMS的TMF估计值依赖于食物网的结构和浮游与底栖生物的食物网途径。鉴于本研究中低营养级生物的代表性差和底层食物网的显著重要性,对cVMS的TMF的未来研究应该包括底栖生物和浮游无脊椎动物更广泛的代表性,以cVMS在食物网中向鱼类的转移过程。cVMS的脂类分配行为不同于具有生物放大作用的PCBs。鉴于TMF基于脂质归一化的污染物浓度和营养级水平之间的关系,一般的脂质归一化方法可能不适合于cVMS。cVMS在生物体内的组织分配和及其对TMF估算值的影响还需要有目的的和详细的评估[38]。
吴倩[80]计算了大连某采用CWSBR工艺的废水处理厂排出水中D4、D5和D6的生态风险商,发现它们均处于相对安全的区间,未对周围水生生态系统构成危害,但仍需要进行不定期动态监测,以减少高危害、高风险发生的几率。
3.2 对沉积物、土壤的生态效应
3.2.1毒性
Krueger等[68]将蚊虫类(Midges)暴露于D4浓度为6.5~355 μg·L-1的沉积物中进行长期的沉积物毒性研究发现,在最高浓度下其数量明显减少,NOEC和LOAEC分别为131 μg·L-1和355 μg·L-1;同样,以蚊虫(Midges)为对象,慢性实验得到D5的NOEC和LOAEC分别是69 μg·L-1和180 μg·L-1[69]。
有关D6对沉积物栖息生物的毒性研究结果不可靠。然而,鉴于D6的生物利用度较低(更大的吸附性,吸附于有机质),预计D6在沉积物中可能会出现相比于D5更低的毒性[6]。
Velicogna等[70]研究了D5对陆生生物的毒性。陆生动物跳虫(Folsomia candida(springtail))和植物大麦(Hordeum vulgare(barley))最敏感,D5对跳虫幼体繁殖和大麦根干质量的半数抑制反应(IC50)最低浓度分别为767 mg·kg-1dw和209 mg·kg-1dw。
3.2.2 生物积累性
BSAF(biota-sediment accumulation factor,kg organic carbon/kg lipid)能够评价沉积物生物积累性。有研究表明[71],许多淡水湖物种特别是底栖无脊椎动物对D4、D5和D6的BSAF>1,说明其对沉积物中cVMS有一定的积累。
Kierkegaard等[72]以mmBAF(multimedia bioaccumulation factor)为评价标准、以沙蚕(Hediste diversicolor)和比目鱼(flounder)为测试对象评估cVMS的生物积累性。与生物积累性极强的多氯联苯(PCB-180)相比,两者对D4的平均mmBAF分别是PCB-180的6倍和14倍,对D5都约是2倍,而对D6低5~10倍。这说明,D4和D5可能会通过沉积物在生物体内蓄积。
Powell等[71,73]测定了淡水和海洋食物网中不同营养级的cVMS浓度,发现随着营养级升高物种内cVMS的浓度降低;基于营养级放大因子(TMF),主食物链TMF小于0.1说明无生物放大作用,这与BCF、BMF和BSAF的评估结果相反。有学者提出[74],实际环境中应将TMF作为评价生物蓄积性的首要标准。又有研究者认为,cVMS在高营养级无显著生物积累,但低营养级时有潜在积累性[72]。因此,应通过各营养级的生物体反映其潜在的生物积累能力。
加拿大环境与健康部门评估发现,D4和D5而非D6向环境中的释放使其对生态环境具有潜在风险。审核委员会认为,D5对环境没有危害,因为它未超过持久性和生物积累的阈值、不通过食物网发生生物放大和在环境浓度下没有毒性[75]。
4 结论与展望(Conclusion and prospect)
综上所述,由于在诸多领域中大量生产和使用cVMS,导致其在全球环境中分布广泛。目前,科学家们对其在各种环境介质中的赋存、行为及环境效应有一定的了解,但是有关其生物积累特征及降解机制和降解产物仍缺乏深入研究。因此,今后需要进一步评估cVMS的生态环境效应和人类健康风险,深入探索其在实际环境中的降解过程,包括其降解产物或中间产物的行为。
当前,国内外对污水处理过程中cVMS的赋存状态和迁移转化行为的研究以进、出水和剩余污泥居多,而对整个工艺流程中的细化研究很少。Xu等[34]对北京市污水处理厂厌氧环境中环硅氧烷消除机制研究是这方面的范例。另外,国内外对环境中cVMS生物毒性效应的研究比较多,但是对环境中和生物体内cVMS的迁移、转化机制研究比较欠缺;建议深入开展对环境中挥发性甲基硅氧烷生物降解机制的探究,为实现硅氧烷的生物降解提供理论基础。
我国对环境中cVMS的赋存状态研究以污水处理居多,对其他环境中的研究比较少,需要进一步补充对土壤、沉积物、生物体、大气和天然水环境的研究,尤其是需要加强对和人们居住、工作密切相关环境的研究。
(References):
[1] Annual Report of China Polysiloxane Market in 2009: Report of China Silicon Industry[R].CRCSI,2010
[2] 周川琪,袁涛.挥发性甲基硅氧烷的环境分布与行为归趋研究进展[J].环境化学,2014,33(3):386-396
Zhou C Q,Yuan T.The environmental occurrences and behaviors of volatile methylsiloxanes:A review[J].Environmental Chemistry,2014,33(3):386-396(in Chinese)
[3] Kierkegaard A,McLachlan M.Codetermination of linear and cyclic volatile methylsiloxanes in air at a regional background site in Sweden[J].Atmospheric Environment, 2013,80:322-329
[4] Wang R,Moody R P,Koniecki D,et al.Low molecular weight cyclic volatile methylsiloxanes in cosmetic products sold in Canada:Implication for dermal exposure[J]. Environment International,2009,35(6):900-904
[5] Horii Y,Kannan K.Survey of organosilicone compounds, including cyclic and linear siloxanes in personal-care and household products[J].Archives of Environmental Contamination and Toxicology,2008,55(4):701-710
[6] Wang D G,Norwood W,Alaee M,et al.Review of recent advances in research on the toxicity,detection,occurrence and fate of cyclic volatile methyl siloxanes in the environment[J].Chemosphere,2013,93:711-725
[7] 王秀兰.三大有机硅中间体在加拿大受限[N].中国化工报,2008-08-29005
Wang X L.The three organic silicon intermediates were limited in Canada[N].China Chemical Industry News, 2008-08-29005(in Chinese)
[8] Liu N N,Shi Y L,Li W H,et al.Concentrations and distribution of synthetic musks and siloxanes in sewage sludge of wastewater treatment plants in China[J].Science of the Total Environment,2014,476-477:65-72
[9] Zhang Z F,Qi H,Ren N Q,et al.Survey of cyclic and linear siloxanes in sediment from the Songhua River and in sewage sludge from wastewater treatment plants, Northeastern China[J].Archives of Environmental Contamination and Toxicology,2011,60(2):204-211
[10] Gouin T,Van Egmond R,Sparham C,et al.Simulated use and wash-off release of decamethylcyclopentasiloxane used in antiperspirant[J].Chemosphere,2013,93(5):726-734
[11] Surita S C,Tansel B.Emergence and fate of cyclic volatile polydimethylsiloxanes(D4,D5)in municipal waste streams:Release mechanisms,partitioning and persistence in air,water,soil and sediments[J].Science of the Total Environment,2014,468-469:46-52
[12] Sparham C,Van Egmond R,O’Connor S,et al.Determination of decamethylcyclopentasiloxane in river water and final effluent by headspace gas chromatography/mass spectrometry[J].Chromatography A,2008,1212(1-2): 124-129
[13] Sanchís J,Martínez E,Ginebreda A,et al.Occurrence of linear and cyclic volatile methylsiloxanes in wastewater, surface water and sediments from Catalonia[J].Science of the Total Environment,2013,443:530-538
[14] Lee S,Moon H B,Song G J,et al.A nationwide survey and emission estimates of cyclic and linear siloxanesthrough sludge from wastewater treatment plants in Korea [J].Science of the Total Environment,2014,497-498: 106-112
[15] Sánchez-Brunete C,Miguel E,Albero B,et al.Determination of cyclic and linear siloxanes in soil samples by ultrasonic-assisted extraction and gas chromatography-mass spectrometry[J].Chromatography A,2010,1217(45): 7024-7030
[16] Companioni-Damas E Y,Santos F J,Galceran M T.Analysis of linear and cyclic methylsiloxanes in sewage sludges and urban soils by concurrent solvent recondensationlarge volume injection-gas chromatography-mass spectrometry[J].Chromatography A,2012,1268:150-156
[17] McLachlan M S,Kierkegaard A,Hansen K M,et al.Concentrations and fate of decamethylcyclopentasiloxane(D5) in the atmosphere[J].Environmental Science and Toxicology,2010,4(14):5365-5370
[18] Whelan M J,Sanders D,Van Egmond R.Effect of Aldrich humic acid on water-atmosphere transfer of decamethylcyclopentasiloxane[J].Chemosphere,2009,74(8): 1111-1116
[19] Environment Canada and Health Canada.Screening Assessment for the Challenge Decamethylcyclopentasiloxane (D5)[R].Canada,2008
[20] Kierkegaard A,Van Egmond R,McLachlan M S.Cyclic volatile methylsiloxane bioaccumulation in flounder and ragworm in the Humber Estuary[J].Environmental Science and Technology,2011,45(14):5936-5942
[21] Hayden J F,Barlow S A.Structure-activity relationships of organosiloxanes and the female reproductive system [J].Toxicology and Applied Pharmacology,1972,21(1): 68-79
[22] Granchi D,Cavedagna D,Ciapetti G,et al.Silicone breast implants:The role of immune-system on capsular contracture formation[J].Biomedical Materials Research,1995, 29:197-202
[23] Lieberman M W,Lykissa E D,Barrios R,et al.Cyclosiloxanes produce fatal liver and lung damage in mice[J]. Environmental Health Perspectives,1999,107(2):161-165
[24] He B,Rhodes-Brower S,Miller M R,et al.Octamethylcyclotetrasiloxane exhibits estrogenic activity in mice via ER alpha[J].Toxicology and Applied Pharmacology, 2003,192:54-261
[25] Quinn A L,Regan J M,Tobin J,et al.In vitro and in vivo evaluation of the estrogenic,androgenic,and progestagenic potential of two cyclic siloxanes[J].Toxicological Sciences,2007,96(1):145-153
[26] Genualdi S,Harner T,Yu C,et.al.Global distribution of linear and cyclic volatile methyl siloxanes in air[J].Environmental Science and Technology,2011,45:3349-3354
[27] Muir D C G,Howard P H.Are there other persistent organic pollutants?A challenge for environmental chemists [J].Environmental Science and Technology,2006,40(23): 7157-7166
[28] Howard P H,Muir D C G.Identifying new persistent and bioaccumulative organics among chemicals in commerce [J].Environmental Science and Technology,2010,44(7): 2277-2285
[29] 杨尚源,李鑫,杨佳,等.二甲基硅油的环境行为与生态效应研究进展[J].应用生态学报,2012,23(8):2319-2324
Yang S Y,Li X,Yang J,et al.Environmental behavior and ecological effect of polydimethylsiloxane:A review [J].Chinese Journal of Applied Ecology,2012,23(8): 2319-2324(in Chinese)
[30] Wang X M,Lee S C,Sheng G Y,et al.Cyclic organosilicon compounds in ambient air in Guangzhou,Macau and Nanhai,Pearl River Delta[J].Applied Geochemistry, 2001,16:1447-1454
[31] Allen R B,Kochs P,Chandra G.The Handbook of Environmental Chemistry,Part H:Organosilicon Materials, vol.3[M].Berlin:Springer-Verlag,1997:1-25
[32] Tran T M,Abualnaja K O,Asimakopoulos A G,et al.A survey of cyclic and linear siloxanes in indoor dust and their implications for human exposures in twelve countries[J].Environment International,2015,78:39-44
[33] Dudzina T,Goetz N V,Bogdal C,et al.Concentrations of cyclic volatile methylsiloxanes in European cosmetics and personal care products:Prerequisite for human and environmental exposure assessment[J].Environment International,2014,62:86-94
[34] Xu L,Shi Y L,Cai Y Q.Occurrence and fate of volatile siloxanes in a municipal Wastewater Treatment Plant of Beijing,China[J].Water Research,2013,47(2):715-724
[35] Wang D G,Steer H,Tait T,et al.Concentrations of cyclic volatile methylsiloxanes in biosolid amended soil,influent,effluent,receiving water,and sediment of wastewater treatment plants in Canada[J].Chemosphere,2013,93(5): 766-773
[36] Griessbach E F,Lehmann R G.Degradation of polydimethylsiloxane fluids in the environment--A review[J]. Chemosphere,1999,38(6):1461-1468
[37] Xu S.Fate of cyclic methylsiloxanes in soils.1.The degradation pathway[J].Environmental Science and Technology,1999,33:603-608
[38] McGoldrick D J,Chan C,Drouillard K G,et al.Concen-trations and trophic magnification of cyclic siloxanes in aquatic biota from the Western Basin of Lake Erie,Canada [J].Environmental Pollution,2014,86:141-148
[39] Kierkegaard A,Bignert A,McLachlan M S.Cyclic volatile methylsiloxanes in fish from the Baltic Sea[J].Chemosphere,2013,93(5):774-778
[40] Pieri F,Katsoyiannis A,Martellini T,et al.Occurrence of linear and cyclic volatile methyl siloxanes in indoor air samples(UK and Italy)and their isotopic characterization [J].Environment International,2013,59:363-371
[41] Lu Y,Yuan T,Yun S H,et al.Occurrence of synthetic musks in indoor dust from China and implications for human exposure[J].Archives of Environmental Contamination and Toxicology,2011,60(1):182-189
[42] Lu Y,Yuan T,Yun S H,et al.Occurrence of cyclic and linear siloxanes in indoor dust from China,and implications for human exposures[J].Environmental Science and Toxicology,2010,44(16):6081-6087
[43] Xu L,Shi Y L,Liu N N,et al.Methyl siloxanes in environmental matrices and human plasma/fat from both general industries and residential areas in China[J].Science of the Total Environment,2015,505:454-463
[44] Whelan M J,Estrada E,Van Egmond R.A modeling assessment of the atmospheric fate of volatile methyl siloxanes and their reaction products[J].Chemosphere,2004, 57:1427-1437
[45] Atkinson R.Kinetics of the gas phase reactions of a series of organosilicon compounds with OH and NO3radicals and O3at 297±2K[J].Environmental Science and Toxicology,1991,25:863-866
[46] Xu S H,Wania F.Chemical fate,latitudinal distribution and long-range transport of cyclic volatile methylsiloxanes in the global environment:A modeling assessment[J]. Chemosphere,2013,93:835-843
[47] Wang D G,Aggarwal M,Tait T,et al.Fate of anthropogenic cyclic volatile methylsiloxanes in a wastewater treatment plant[J].Water Research,2015,72:209-217
[48] Whelan M J,Sanders D,Van Egmond R.Effect of Aldrich humic acid on water-atmosphere transfer of decamethylcyclopentasiloxane[J].Chemosphere,2009,74(8): 1111-1116
[49] David M D,Fendinger N J,Hand V C.Determination of Henry's law constants for organosilicones in actual and simulated wastewater[J].Environmental Science and Technology,2000,34(21):4554-4559
[50] Bletsou A,Asimakopoulos A,Stasinakis A,et al.Mass loading and fate of linear and cyclic siloxanes in a wastewater treatment plant in Greece[J].Environmental Science and Technology,2013,47:1824-1832
[51] Society of Environmental Toxicology and Chemistry.Kinetics and mechanism of the abiotic hydrolysis reactions of permethylated cyclosiloxanes in aqueous solution:Report of SETAC Northern America 27th Annual Meeting [R].Montreal,Quebec,Canada:SETAC,2009
[52] Whelan M J,Van Egmond R,Gore D,et al.Dynamic multi-phase partitioning of decamethylcyclopentasiloxane (D5)in river water[J].Water Research,2010,44(12): 3679-3686
[53] Silicones Environment,Health and Safety Council.Hydrolysis of Octamethylcyclotetrasiloxane(D4):Report of the Assessment for D4 by Environment Canada and Health Canada[R].Canada:SEHSC,2005a
[54] Silicones Environment,Health and Safety Council.Hydrolysis of Octamethylcyclotetrasiloxane(D5):Report of the Assessment for D5 by Environment Canada and Health Canada[R].Canada:SEHSC,2006
[55] Xu S,Chandra G.Fate of cyclic methylsiloxanes in soils. 2.Rates of degradation and volatilization[J].Environmental Science and Technology,1999,33:4034-4039
[56] Silicones Environment,Health and Safety Council.Hydrolysis of Octamethylcyclotetrasiloxane(D4):Report of the Assessment for D4 by Environment Canada and Health Canada[R].Canada:SEHSC,2005b
[57] Health and Environmental Sciences,Dow Corning Corporation.Estimation of degradation rates of cVMS in soils [R].HES,2007
[58] Kent D J,McNamara P C,Putt A E,et al.Octamethylcyclotetrasiloxane in aquatic sediments:Toxicity and risk assessment[J].Ecotoxicology and Environmental Safety, 1994,29(3):372-389
[59] Sousa J V,McNamara P C,Putt A E,et al.Effects of octamethylcyclotetrasiloxane(OMCTS)on freshwater and marine organisms[J].Environmental Toxicology and Chemistry,1995,14:1639-1647
[60] European Commission.Amending Regulation(EC)No 1907/2006 of the European Parliament and of the Council on the Registration,Evaluation,Authorisation and Restriction of Chemicals(REACH)as Regards Annex XIII[S]. 2010
[61] Silicones Environment,Health and Safety Council.Decamethylcyclopentasiloxane-14-day prolonged acute toxicity to rainbow trout(Oncorhynchus mykiss)under flowthrough conditions:Report of the Assessment for D5 by Environment Canada and Health Canada[R].Canada:SEHSC,2000
[62] Parrott J,Alaee M,Wang D,et al.Fathead minnow(Pimephales promelas)egg-to-juvenile exposure to decamethylcyclopentasiloxane(D5)[J].Chemosphere,2013, 93(5):813-818
[63] Dow Corning Corporation,Silicones Environment,Health and Safety Council.Drottar K R.14C-Dodecamethylcyclohexasiloxane(14C-D6):Bioconcentration in the fathead minnow(Pimephales promelas)under flow-through test conditions:Report of the Assessment for D6 by Environment Canada and Health Canada[R].Canada:SEHSC, 2005b
[64] Annelin R B,Frye C L.The piscine bioconcentration characteristics of cyclic and linear oligomeric permethylsiloxanes[J].The Science of the Total Environment,1989, 83(1-2):1-11
[65] Fackler P H,Dionne E,Hartley D A,et al.Bioconcentration by fish of a highly volatile silicone compound in a totally enclosed aquatic exposure system[J].Environmental Toxicology and Chemistry,1995,14:1649-1656
[66] Dow Corning Corporation,Silicones Environment,Health and Safety Council.Drottar K R.14C-Decamethyl-cyclopentasiloxane(14C-D5):Bioconcentration in the fathead minnow(Pimphales promelas)under flow-through test conditions:Report of the Assessment for D5 by Environment Canada and Health Canada[R].Canada:SEHSC, 2005a
[67] Woodburn K,Drottar K,Domoradzki J Y,et al.Determination of the dietary biomagnification of octamethylcyclotetrasiloxane and decamethylcyclopentasiloxane with the rainbow trout(Oncorhynchus mykiss)[J].Chemosphere, 2013,93(5):779-788
[68] Silicones Environmental,Health and Safety Council.A prolonged sediment toxicity test withChironomus riparius using spiked sediment.Wildlife International,LTD:Report of the Assessment for D4 by Environment Canada and Health Canada[R].Canada:SEHSC,2008
[69] Silicones Environment,Health and Safety Council.Decamethylcyclopentasiloxane(D5)-the full life-cycle toxicity to Midge(Chironomous riparius)under static conditions: Report of the Assessment for D5 by Environment Canada and Health Canada[R].Canada:SEHSC,2003
[70] Velicogna J,Ritchie E,Princz J,et al.Ecotoxicity of siloxane D5 in soil[J].Chemosphere,2012,87(1):77-83
[71] Health and Environmental Sciences.Trophic dilution of cyclic volatile methylsiloxane(cVMS)materials in a temperate freshwater lake:Report of Centre Européen des Sililcones[R].HES,2009
[72] Kierkegaard A,Van Egmond R,McLachlan M S.Cyclic volatile methylsiloxane bioaccumulation in flounder and ragworm in the Humber Estuary[J].Environmental Science and Technology,2011,45(14):5936-5942
[73] Health and Environmental Sciences.Bioaccumulation and trophic transfer of cyclic volatile methylsiloxane(cVMS) materials in the aquatic marine food webs of the Inner and Outer Oslofjord,Norway:Report of Centre Européen des Sililcones[R].HES,2010
[74] Gobas F A P C,De Wolf W,Burkhard L P,et al.Revisiting bioaccumulation criteria for POPs and PBT assessments[J].Integrated Environmental Assessment and Management,2009,5:624-637
[75] Siloxane D5 Board of Review:Report of the Board of Review for Decamethylcyclopentasiloxane(D5)[R].Ottawa,ON,Canada,2011
[76] Van Egmond R,Sparham C,Hastie C,et al.Monitoring and modelling of siloxanes in a sewage treatment plant in the UK[J].Chemosphere,2013,93:757-765
[77] 王艺,陈川,张子峰,等.甲基硅氧烷在污水处理厂中的环境行为[J].化工学报,2016,67(1):83-88
Wang Y,Chen C,Zhang Z F,et al.Environmental behavior of siloxane in wastewater treatment plants[J].CIESC Journal,2016,67(1):83-88(in Chinese)
[78] 高鹏园.市政污水中甲基硅氧烷赋存形态的研究[D].大连:大连海事大学,2013
Gao P Y.Occurrence of siloxanes in municipal wastewater treatment plant[D].Dalian:Dalian Maritime University, 2013(in Chinese)
[79] 申凯.有机硅氧烷在市政废水处理厂的归趋研究[D].大连:大连海事大学,2014
Shen K.Fate of volatile methylsiloxanes in a wastewater treatment plant[D].Dalian:Dalian Maritime University, 2014(in Chinese)
[80] 吴倩.挥发性硅氧烷在恒水位序批式活性污泥法市政废水处理厂的归趋及生态风险评估[D].大连:大连海事大学,2015
Wu Q.Fate and ecological risk assessment of volatile methylsiloxanes in a wastewater treatment plant using the process of constant water level sequencing batch reactors [D].Dalian:Dalian Maritime University,2015(in Chinese)
[81] Sousa J V,McNamara P C,Putt A E,et al.Effects of octamethylcyclotetrasiloxane(OMCTS)on freshwater and marine organisms[J].Environmental Toxicology and Chemistry,1995,14(10):1640-1647◆
The Research Progress of Environmental Distribution,Behavior and Effects of Cyclic Methylsiloxanes
Zhang Songlin1,*,Wu Lihua
Institute of Geography and Environmental Sciences,Northwest Normal University,Lanzhou 730070,China
16 February 2015 accepted 22 April 2016
In recent years,the cyclic volatile methyl siloxanes(cVMS)are widely used in the process of production and people’s daily life because of their excellent performance,meanwhile leading to increasing environmental andhuman exposure risks and receiving dramatic concerns because of their persistence,potential biological accumulation and toxicity.At present,researchers have a certain understanding about the occurrence,behavior and effects of cVMS in various environmental media all over the world.Most cVMS were discharged into the atmosphere,and some cVMS were found in water,sediment,soil and organism.Many studies have shown that the highest median of the total cyclic siloxane of indoor air dust was from Greek(1 380 ng·g-1),and followed by China(362 ng·g-1). The total siloxane flux per capita for sewage treatment plant in China(10 g·y-1)was much lower than that of UK (48.3 g·y-1for D4-D6)and the United States(93.5 g·y-1for D4-D6).The total cVMS concentration(1.05 μg·L-1) from a sewage treatment plant with CWSBR in Dalian was generally lower than that of Greece(5.14 μg·L-1), Spain(9.2 μg·L-1),Canada(44 μg·L-1)and some of the Nordic countries(17 μg·L-1).In the aspect of the methyl siloxane of sewage sludge from wastewater treatment plant,China(0.1-l μg·g-1dw)was also much lower than some of the Nordic countries(26 μg·g-1dw),Greece(20 μg·g-1dw)and Canada(64 μg·g-1dw).The PEL(pseudo-exposure level)median(173 ng·d-1)of D4-D6 by inhaling and feeding for ordinary residents was much lower than the average median(18.5 μg·d-1)by skin exposure in China,and much lower than the exposure level(1.875 mg·d-1)for adult in the UK and for women(307 mg·d-1)exposed to the total siloxane in the United States.Generally,the behavior and the effect of cVMS discharged into environment depend on the physical and chemical properties and the specific environmental condition.The cVMS into the air will react with·NO3,O3,·OH,and demethylating reaction with·OH to form silanol is its main end mechanism.Most of the cVMS was fixed by the sewage sludge during the sewage treatment process,and their adsorption capacity for D6 was the strongest,followed by D4 and D5.Volatilization,adsorption and biodegradation were the major environmental behaviors for cVMS in the soil.The biological amplification effect for D4 and D5 was possible.The TMF(trophic magnification factor)results of cVMS were inconsistent with each other,and were even contrary to those by BCF(bioconcentration factor), BMF(biomagnification factor)and BSAF(biota-sediment accumulation factor).Conclusively,most of the research of cVMS was on its occurrence,migration,transformation,and behavior in the process of wastewater treatment at home and abroad;furthermore,the research priority was given to the influent,effluent and remaining sludge,while the specific change in the whole process,the characteristics of its biological accumulation,degradation mechanism and degradation products were scarcely studied.Therefore,it needs effort to complement the cVMS distribution in other kinds of environmental media in the future,particularly in living and working environment.Besides,exploring degradation process in real environment,including the environmental behavior of degradation products and intermediate products,and further evaluating eco-environment effect and human health risks are the guidelines of cVMS research in the future.
cyclic volatile methylsiloxanes;environmental distribution;environmental behavior;environmental effect
2016-2-16 录用日期:2016-4-22
1673-5897(2016)3-072-14
X171.5
A
10.7524/AJE.1673-5897.20160216001
简介:张松林(1965-),男,博士,教授,主要研究方向环境化学和固废资源化,发表学术论文70余篇。
国家自然科学基金(51068025);甘肃省油气资源研究重点实验室开放课题基金(SZDKFJJ20150606)
张松林(1965-),男,山东青岛人,博士,教授,研究方向为环境化学和固废资源化,E-mail:zhangsonling65@163.com
