基于毒性效应的间隙水致毒物质鉴别技术进展
2016-10-27王玉婷于红霞张效伟史薇
王玉婷,于红霞,张效伟,史薇
污染控制与资源化研究国家重点实验室,南京大学环境学院,南京210023
基于毒性效应的间隙水致毒物质鉴别技术进展
王玉婷,于红霞,张效伟,史薇*
污染控制与资源化研究国家重点实验室,南京大学环境学院,南京210023
沉积物作为污染物迁移转化过程中重要的“源”和“汇”,与整个生态系统及人类健康有着密切联系。间隙水很大程度上反映了水体沉积物的污染状况,同时可以真实反映生物的实际暴露情况,间隙水中关键致毒物质的鉴别是科学准确地评价间隙水及沉积物毒性与风险的重要基础。毒性鉴别评估(Toxicity Identification Evaluation,TIE)和效应引导的污染物识别(Effect Directed Analysis,EDA)技术作为致毒物质识别的主要方法,已在沉积物和间隙水的致毒物筛选中得到了初步的应用。本文介绍并比较了常用的间隙水提取方法,总结了TIE和EDA在间隙水致毒物质异位及原位鉴别方面的应用与发展,及鉴别过程中使用到的基本毒性量化方法与其适用条件。在当前间隙水关键致毒物质识别研究的基础上,指出了异位分析难以避免毒性损失和有机污染物鉴别方面的局限等问题,并提出应推广原位毒性试验技术且进一步发展有机物的精细分离技术和质谱识别技术等发展方向。
间隙水;关键致毒物;毒性鉴别评估;效应引导的污染物识别;原位
王玉婷,于红霞,张效伟,等.基于毒性效应的间隙水致毒物质鉴别技术进展[J].生态毒理学报,2016,11(3):11-25
Wang Y T,Yu H X,Zhang X W,et al.Development of identification of key toxicants in the pore water[J].Asian Journal of Ecotoxicology,2016,11(3): 11-25(in Chinese)
沉积物间隙水是指沉积物颗粒之间及岩石颗粒之间孔隙的水溶液,包括强结合水、弱结合水、毛细管水和自由水。它是地球水圈的一部分,反映了沉积过程中及沉积后发生的各种变化历程。在沉积物体系中,污染物在间隙水与沉积物间存在着吸附-解吸平衡,如图1所示。
沉积物中富集了大量由人类活动产生,并通过直接或间接过程释放到自然环境中的污染物质。在一定条件下,沉积物中的污染物质又可重新释放到水体中,产生二次污染[2]。水体沉积物与其间隙水在化学物质的迁移转化过程起到了至关重要的作用,与整个生态环境和人类健康有着密切联系[3]。Ankley、Adams和Di Toro等学者[4-6]的研究表明,沉积物和间隙水中铜、镉和非离子有机物的浓度存在较好的相关性,间隙水的成分特征可以综合反映沉积物的污染水平。
污染物在沉积物中可能有很高的检测浓度,但大部分污染物附着在固相颗粒上,表现出缓慢的释放速率与较低的生物可利用性[7]。污染物只有吸附在无定型的或水可浸润的有机物表面及亲水矿物表面才可参与吸附-解吸过程,因其与固相沉积物结合能较低,所以易于解吸到间隙水中[1]。
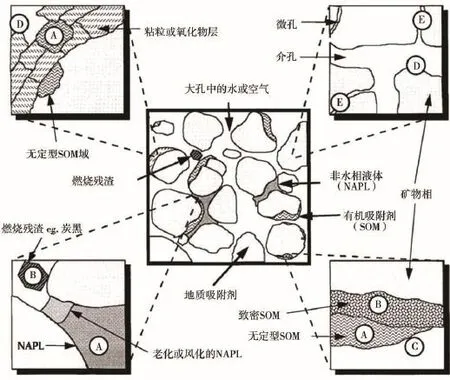
图1 污染物在沉积物中的吸附概念模型[1]
在沉积物体系中,通常认为可被生物直接接触的物质才是生物可利用的,主要包括溶解在间隙水中或能够快速解吸的化合物,所以间隙水更加真实地反映水生生物的实际暴露情况。已有研究证明底栖动物受到的毒性胁迫程度,与污染物在孔隙水中的浓度有着直接关系。Whiteman等学者[8-9]分别进行了加标沉积物和间隙水的对摇蚊、钩虾等底栖生物的暴露试验,发现在相同水体浓度下,氨氮的毒性效果相近,说明沉积物中氨的生物可利用性和毒性可以通过间隙水准确预测。此外,水位波动或沉积物扰动会使间隙水大量进入到地表水造成短暂的脉冲,直接威胁了生活在地表水中的生物[10]。科学准确地对间隙水进行毒性评估,能很大程度上反映沉积物的污染水平和潜在风险。
间隙水一方面可以很大程度上反映沉积物的污染状况,另一方面对水生生物产生着直接的影响,是水生生态系统的重要组成。对间隙水进行主要致毒物质的鉴别是风险评价和污染控制的基础,对生态系统和人体健康都有着十分重要的意义。本文综合比较了沉积物间隙水的提取方法,并详细综述了已有的间隙水致毒物质分类及鉴别的方法及具体应用实例,同时探讨了存在的问题及发展方向,为我国间隙水关键致毒物质鉴别方法体系的建立提供借鉴。
1 间隙水的提取方法
间隙水的提取是完成间隙水毒性评估与毒物鉴别的首要步骤也是关键步骤,提取过程对间隙水中污染物的组成、性质及毒性有着直接影响。常用的间隙水提取方法有离心法、压榨法、真空抽取法和渗析法等。其中,离心法和压榨法主要通过对沉积物的挤压作用获取间隙水,属于非原位提取;真空抽取法和渗析法属于原位提取,这类方法不改变间隙溶液的原始氧化还原状态和温度条件,对沉积物结构的破坏性小。沉积物中存在一些对氧化还原、吸附解吸及沉淀溶解过程敏感的组分,如硫化物、疏水性有机物及铁、锰还原态金属等,间隙水的提取方法对其中污染物质的浓度和形态都至关重要。到目前,间隙水的提取已发展了多种方法,它们有着不同的机理和适用范围。下面分别介绍和比较一些常见的间隙水提取方法。
1.1 离心法
离心法是将采集来的沉积物,放入离心管中,以某一转速离心一段时间,取上清液,制得间隙水[11]。离心法是一种获取生物测试所需大量间隙水的简捷方法,因此目前间隙水研究中多采用离心法。由于离心力的挤压作用,沉积物颗粒上的吸附态成分易进入间隙水中,所以离心条件(温度、离心力、离心时间)的选择对于间隙水化学组成存在较大影响。经济合作与发展组织(Organization for Economic Cooperation and Development,OECD)建议采用“温和”的离心方式,即在4℃或生物测试的温度下以2 000 g到10 000 g速度离心30 min,但相关文献中报道的离心条件各不相同[12-15],尚无统一标准。Carignan等[16]比较了5 000 r·min-1和11 000 r·min-1离心所得到间隙水,发现二者Cr、Co和Ni的浓度近似,而5 000 r·min-1离心的间隙水中含有更高浓度的Cu、Zn和有机碳。Ankley等[17]分别采用2 500 g和10 000 g离心沉积物。其中,2 500 g离心法取得的间隙水中的金属(Cu、Pb、Zn)浓度相对高于10 000 g离心水,毒性当量却没有成比例增加,暗示着2 500 g离心水中金属的生物可利用性较低。间隙水前处理过程中的离心条件是影响其中污染物组成及毒性的重要因素,离心速率仍需进一步的研究与归纳。
1.2 压榨法
压榨法是将沉积物装入铺有数层滤膜或细筛网的柱筒中,通过活塞加压,挤压出沉积物中的间隙水[18]。该方法操作简单、速度快,特别适用于孔隙水大规模的提取。压榨法的原理与离心法近似,但由于压力作用,影响固-液界面间的交互,所得到的间隙水样品中溶解组分的浓度往往大于自然状态下实际孔隙自由水中的浓度,且浓度大小与施加的压力直接相关。所以,榨取间隙水时通常采取较低的压力(<10 bar)[19-20],以减小所得样品相对于实际环境中孔隙溶液的偏差。Hensen等学者[21]采用压榨法采集分层后的柱状沉积物中的间隙水,测定了不同深度的海底沉积物中SO2-4含量,发现其浓度变化趋势与海底甲烷厌氧氧化活动(AOM)的强度呈负相关,从而说明了AOM是海洋沉积物固定硫元素的一种重要方式。von der Wiesche等[22]采取压榨法用于兰河(莱茵河支流)沉积物间隙水的提取,装置中使用了0.2 μm醋酸纤维素滤膜实现泥水分离,发现间隙水中亚硝酸盐浓度与温度变化显著相关。
1.3 真空抽取法
真空抽取法采用一种直径为2.4 mm的多孔聚酯管,尾部与注射器相连,取样时,可原位直接将聚酯管插入沉积物中,用注射器负压抽取溶液样品[23]。该方法操作方便,样品不与大气直接接触,防止了间隙水的氧化,且不改变采样点沉积物的结构和物理化学性质,能一定程度上反映天然沉积物的真实情况。但该装置仅能采集少量样品,否则采样深度难以控制,还有可能混入上覆水,所以该方法难以应用到常规的毒性测试中[17]。相似原理的提取方法还包括吸气引液法,该方法的装置主要由真空泵、吸滤器和收集瓶3部分组成,使用时把吸滤器插入沉积物中,通过真空泵的抽力原位提取间隙水[24]。近年来,Burton等[25]在此基础上进行改进:将锥形采水装置与树脂吸附和生物暴露部分组合为一体,锥形头内部填有玻璃棉过滤细颗粒泥沙,使用时将采样头插入沉积物中,装置顶端接有硅胶软管,并通过蠕动泵持续抽取间隙水,并原位进行生物测试。这种装置较注射器抽取更为方便,但使用时仍要注意控制低流速(约25 mL·h-1)且不宜抽取过多间隙水。
1.4 渗析法
间隙水渗析装置是由有机玻璃板制成,其中包含垂直分布的一系列腔体,腔体上面覆有一层渗透膜,保证水中离子可自由通过。采样时将腔体内充满去离子水,随后把装置垂直插入沉积物中,待测离子通过扩散作用进入腔体中,平衡后取出即可用于后续分析[26]。这种方法设备十分简单,操作方便,与离心法和压榨法相比,该方法不破坏沉积物自身结构,同时大大降低了对氧化还原电位(Eh)的影响程度[27]。现已有商品化的采样器——peeper应用在沉积物和孔隙水的研究中[28]。peeper上有26个小室并行排列,间隔1 cm,每一小室体积约为25 mL,小室上覆盖孔径为0.45 μm具生物惰性的渗析膜,使用时用双面夹板固定于采样器主体板上即可[29]。Lewandowski等学者[30]利用peeper渗析装置发现摇蚊幼虫的活动能显著减少间隙水中磷酸盐、铵根离子和铁离子的浓度。但由于渗透膜及腔体的限制,该设备采样量小且仅能应用于间隙水中各种阴离子的分析检测,而未能有更广泛的运用范围。
以上4种常用的提取技术各有利弊。可以依据不同的研究对象和研究目选用不同的方法。Ankley等学者[17]对2个位点采用4种方法提取间隙水:离心法、压榨法、真空抽取法和渗析法,指出了仅离心法是可提取足够生物测试需要的水量的较方便的方法,其余3种方法过于费时费力。Ozretich等[31]分别测定了原位渗析法(peeper)和离心-过滤法所得间隙水中几种组分的含量,发现2种样品中氯化物和溴化物的浓度近似,而离心水中的氨氮和溶解性磷酸盐浓度明显高于渗析水,从而指出离心过程中对沉积物的挤压作用可能破坏了氨氮和磷酸盐的吸附解吸平衡。Winger等[32]针对4个采样点对比了3种间隙水提取方法(渗析法、离心法、真空抽取法)对金属离子浓度的影响。发现对于常量金属(K、Ca、Na、Mg等),3种方法所得到的浓度近似;但渗析法和真空抽取法所得到的间隙水中Cu和Pb的浓度显著小于离心法,说明离心过程的挤压作用明显大于渗析法和真空抽取法,所得水样混入了更多毛细管水,导致微量金属的浓度显著增加,常量金属由于本底值较大所以变化不明显。综上所述,离心法和压榨法适用于提取毒性试验所需要的大量间隙水,而真空抽取法和渗析法所采集的水样与实际沉积物中的间隙水更接近。
此外,不同的保存方式也会影响间隙水样品的性质。Otero等学者[33]发现,同时将沉积物样品和间隙水样品冷冻保存一个月后,以沉积物方式保存的样品提取出来的间隙水荧光特征发生了明显变化,而以间隙水方式保存的样品变化不大。Carr等[20]的工作也证明了,随着时间的推移,保存于4℃的沉积物中提取的间隙水的毒性也发生了很大变化。这些问题说明,样品的保存方法对于间隙水的毒性测试和分析检测都至关重要,直接保存间隙水是一种较为科学的方法。
2 间隙水的毒性鉴别评估方法
间隙水样品的毒性往往是多种污染物及各种复杂中间产物的复合作用的结果,选定特征污染物的毒性并不能准确代表间隙水的毒性,所以传统基于特征污染物(或优先污染物)的毒性评价方法无法全面反映间隙水的毒性水平。而生物毒性试验的方法虽然反映了间隙水的整体毒性,但对于产生毒性的真正原因未能做出判定,无法服务于后期的管理需求[34]。
美国环境保护局(Environmental Protection A-gency,EPA)在原有废水毒性鉴别评估方法的基础上,推出了水体沉积物毒性鉴别评价程序[35],它利用样品中化合物不同的理化特征实现不同类型致毒物的分离,并结合毒性测试,鉴别致毒物质类型。该程序现已成为制定环境质量基准、进行生态风险评价和管理的关键步骤。水体沉积物毒性鉴别评估(Toxicity Identification Evaluation,TIE)分为全沉积物TIE和间隙水TIE。全沉积物TIE以沉积物作为试验相。沉积物是一种非均匀的介质,生活在其表面或内部的底栖生物通过上覆水、孔隙水、或直接接触沉积物等多种方式接触并吸收有害化学物质[36],因此全沉积物毒性试验是一种能较全面反映受试生物受到污染沉积物的损害的方法。但全沉积物TIE试验周期长、操作繁琐,且底栖生物大多敏感性较差,所以已有研究较少。相对于全沉积物TIE,间隙水TIE的发展更为完善。

图2 间隙水毒性鉴别评估流程
间隙水TIE与废水TIE类似,一般包括3个阶段:毒性表征、毒性鉴别和毒性确认(图2)。在毒性表征阶段,通过运用适当的物理化学方法,目标性地去除或屏蔽某一类物质,结合处理前后的生物毒性试验,初步判断引起毒性的大致污染物类型。处理方式包括:pH梯度调节试验用于表征毒性依赖pH变化的物质,曝气试验用于去除挥发性或易被氧化的物质,C18固相萃取去除非极性有机物,乙二胺四乙酸(EDTA)螯合试验屏蔽重金属,沸石/石莼吸附处理去除氨氮等[35]。因为第一阶段“毒性表征”主要针对4类污染物:氨氮、重金属、非极性有机物和硫化物,所以第二阶段“毒性鉴别”过程主要从这4个方面展开。针对氨氮,采用离子选择性电极或纳氏试剂比色法即可直接测定浓度。同样,对于重金属,则直接使用火焰原子吸收或电感耦合等离子体质谱进行定量测定,此外,还可以使用阳离子交换树脂,对比吸附前后毒性变化以验证第一阶段的结果,然后洗脱树脂,用于金属浓度进行分析和进一步的毒性测试。由于非极性有机物成分复杂,所以需要采用分级分离的方法来降低有机致毒物的复杂性从而有助于锁定目标污染物。常用的策略是固相萃取富集样品后,采用不同极性的溶剂洗脱分成若干组分,并使用高效液相色谱(HPLC)、液相色谱-质谱联用(LC-MS)、气相色谱-质谱联用(GC-MS)等,鉴别和测定各组分中的可能致毒的有机物。此外,在缺氧沉积物中,由于微生物的活动易产生大量硫化物,间隙水中溶解态的硫化物对水生生物存在毒性效应。硫化物的毒性和挥发性都随pH下降而升高,所以依据毒性表征阶段的pH调节试验可以初步判断。在毒性鉴别阶段可以采用比色法或离子选择电极法对硫化物进行测定。第三阶段毒性确认是为了确定化合物在总效应中的贡献率。主要的方法有相关分析法、可疑致毒物质添加法、不同物种的敏感度比较、症状观察、生物标志物法和添加增效剂/拮抗剂的方法等[35]。适用于间隙水TIE的受试生物有网纹溞(Ceriodaphnia dubia)、蚤状溞(Daphnia pulex)、大型溞(Daphnia magna)、带丝蚓(Lumbriculus variegatus)、呆鲦鱼幼鱼(Pimphlales promelas)、糠虾(Americamysis bahia mysidshrimp)和端足类(Ampelisca abdita,Hyalella azteca)等。但有一些生物如钩虾(Hyalella azteca)和摇蚊幼虫(Chironomussp.)不能适应完全的水体暴露,试验时需要加入一层很薄的洁净石英砂作为基质。
TIE方法最初发源于北美,用于市政及工业废水中致毒物质的鉴定。1991年美国环境保护局德鲁斯环境研究实验室将废水TIE方法进行了修改,并应用于沉积物的间隙水中[37]。之后Schubauer-Berigan等[15]、Wenholz等[38]、Gupta等[39]、Karuppiah等[40]科学家将TIE方法广泛应用于不同污染类型的池塘、河流、海湾等点位的间隙水中,验证了该方法的实用性,并推动了TIE的普及与发展。2007年,该实验室又进行了进一步的改进和完善,总结出了更为详细的间隙水TIE方法文件[35]。迄今为止,间隙水TIE已经在海洋和淡水沉积物中得到了较为广泛的应用,并成功鉴别出了包括重金属、S2-、氨氮、有机氯农药和拟除虫菊酯类农药等多种类型的关键致毒物质(见表1)。
3 基于毒性效应的间隙水有机毒物鉴别方法
传统的TIE过程可有效测定重金属、氨氮和硫化物,但鉴别有机致毒物质的能力仍十分有限。过去20年的TIE研究结果表明,约有70%的沉积物和间隙水的毒性效应与非极性有机物有关[46],如图3所示。环境样品中污染物成分复杂,可能存在着成百上千种有机化学物质,这对主要毒性贡献物质的鉴别造成很大的基质干扰。污染物识别(Effect Directed Analysis,EDA)方法将有机污染物精细分离与毒性测试结合起来,是一种可有效降低样品复杂性从而锁定目标污染物的策略。
从环境样品中提取出来的有机物首先要经过分级分离分配为若干组分,分离过程可以基于分析物的多种物理化学性质(极性、疏水性、分子大小、平面性和特定官能团等)来实现[47],分离手段包括:固相萃取分离、正/反相液相色谱、凝胶排阻色谱、薄层色谱等[34],接着对每个组分进行生物试验来评估毒性大小,并舍去无毒组分从而达到降低有机提取物的复杂性的目的。经过反复上述过程,最终确定下来的毒性组分用于关键致毒物质识别。化合物的筛选与识别主要借助质谱对毒性组分的全扫描和化学品标准谱库两大工具实现,有时也会配合核磁共振和紫外/红外吸收光谱等鉴定手段[48]。EDA中适用的毒性测试方法较TIE更为广泛,主要分为整体生物测试和体外毒性测试。整体生物测试基于蚤类、甲壳类及鱼类等个体生物的毒性试验方法,以死亡、生长、繁殖等指标作为毒性终点。体外毒性测试主要采用离体的细胞、菌株等,测试某一特定的毒性效应,目前发展较成熟的包括遗传毒性效应、芳烃受体效应和内分泌干扰效应等[49]。基于个体水平的测试方法可反映污染物质对生态系统的影响,而体外毒性测试可表征致毒物质的作用机制。

图3 水体沉积物和间隙水中各类污染物毒性贡献分配情况

表1 间隙水TIE 应用实例Table 1 Applications of interstitial water TIE methods

续表1
由于间隙水通常较难获取,而精细分离过程往往对样品的需求量很大,所以针对间隙水的有机致毒物质识别的研究还不多见[49]。Kosian等学者[50]最初进行了这方面的尝试,他们采集了美国苏比利尔一个炼油厂排放口附近的小溪中的沉积物,并采用4℃下10 000 g离心30 min的方式提取了5 L间隙水,利用带丝蚓测试出其间隙水存在紫外光诱导的毒性,随后使用固相萃取富集了间隙水中的有机物,并用HPLC将有机提取物分离为20个组分并分别进行了毒性测试,筛选出的致毒组分通过GCMS全扫描并结合经验毒性数据和预测模型来识别主要致毒物质,最终鉴别出一些取代的多环芳烃和杂原子的多环芳烃可能是造成光诱导毒性的主要贡献物。Fang等学者[51]将非致死的毒性指标运用到间隙水EDA中,从而提高了毒性终点的敏感性,大大减少了间隙水的用量。他们采用絮凝和2 500 g离心的方式收集到了320 mL美国伊丽莎白河道中沉积物间隙水,并以斑马鱼为受试生物测试了间隙水的毒性,发现其中的溶解态物质可导致斑马鱼急性毒性和心脏畸形。随后将间隙水中有机物富集后采用尺寸排阻色谱和正相色谱进行分级分离,并以心包囊肿作为生物测试的毒性终点锁定致毒组分,致毒物的鉴别采用了电子电离源的气相-质谱联用(GC/EI-MS)并结合NIST数据库与质谱数据进行匹配,最终识别出芳烃受体(AhR)激动剂(1,2-苯并芴、1,2-苯并蒽、苯并[a]芘、茚并[1,2,3-cd]芘)和细胞色素P450A1抑制剂(二苯并噻吩、荧蒽)是主要毒性贡献物质。
由此可见,TIE方法主要用于确认致毒物质的类型,基于有机污染物精细分离鉴别的EDA可有效弥补传统TIE在有机致毒物鉴别方面的不足,是环境样品致毒物鉴别的有力工具。首先对样品进行毒性表征确定基本致毒物类型,若为有机物质,则进行EDA的精细分离与高通量筛查,最后将识别出具体化合物应用于毒性确认[49]。间隙水作为沉积物的重要组成,可以在很大程度上反映沉积物的污染状况,是一种较优的试验相,间隙水中溶解的物质可被生物体直接接触或摄入,且EDA实验过程中可以采用与传统TIE相同的试验相,使2个过程得到较好的衔接,从而试验结果更有说服力。
除此之外,沉积物EDA还可以结合一些其他体现生物可利用性的提取或暴露方式与间隙水TIE衔接。提取方式包括丁醇萃取、超临界流体萃取、TENAX树脂仿生提取和环糊精提取等。其中丁醇萃取和超临界流体萃取属于温和溶剂提取,利用提取溶剂对有机物质适当的溶解力,仿生萃取沉积物中的有机物,时间是提取量主要控制因素。丁醇仿生萃取是将15 mL正丁醇加入到5~10 g沉积物中,振荡5 s后分离出正丁醇,其中溶解的组分便认为是生物有效性的[52]。Hawthorne等学者[53]曾采用200个大气压和50℃的超临界CO2,以4 mL·min-1的流速对8 g土壤进行了40 min的提取,萃取出了生物可利用的PAHs。TENAX树脂提取与环糊精提取有着相似的机理,即建立沉积物-水-吸附剂三相体系,吸附在沉积物中的物质由于附着力的不同,导致其溶解到水中速率有快有慢,而吸附剂可快速吸附水中有机物质,于是可以通过控制萃取时间实现沉积物中易解吸物质的提取[54]。Puglisi等[55]采用1 g干沉积物与10 mL 50 mmol·L-1环糊精混合振荡14 h的方式提取了生物可利用的二噁英、PAH和PCB类等疏水性有机物。Cornelissen等学者[56]将1.5 g TENAX树脂与1 g干沉积物加入70 mL去离子水中,分别进行了6 h与30 h的振荡萃取,发现30 h提取的氯苯(chlorobenzenes,CBs)、PCBs、PAHs仅为6 h提取的2.8倍,说明30 h的TENAX提取已包含了沉积物中非快速解吸的成分。暴露方式主要依据分配平衡原理,采用主动暴露方法,即将处理后的沉积物提取物滴加到固体吸附剂上来模拟沉积物对受试生物进行水暴露,该方法往往要求固体吸附剂与沉积物有着相似的吸附能力,且与水溶液能达到快速平衡。常用的材料包括半透膜装置(semipermeable membrane devices,SPMD)和硅胶棒、硅胶环等。将低密度的聚乙烯薄膜制成2.5 cm宽100 μm厚条形袋,内部填有溶解在三油酸甘油酯中的沉积物提取物,即制成半透膜装置(semipermeable membrane devices,SPMD),使用时将薄膜缠在支架上便可用于仿生暴露[57]。将硅胶作为平衡给样材料时,通常将沉积物的提取液负载到硅胶上,缓慢氮吹干后即可用于水体暴露。为了配合不同的暴露生物和容器,可将硅胶吸附剂制成不同的形状,如Bandow等[58]选择硅胶棒用于小试管中的绿藻暴露,Smith等[59]选择硅胶环用于24孔板的细胞暴露等。
4 原位间隙水毒物鉴别
目前绝大多数间隙水中致毒物质的鉴别工作是在实验室中完成的。然而,当从自然水体中采集水样及沉积物样品时,采样过程对沉积物结构的破坏,储存和运输过程温度、光照、氧化还原等环境条件的变化,及器壁对疏水性有机物的吸附作用,都有可能导致样品的物理化学性质发生变化进而直接影响污染物的总量、存在形式和生物可利用性等。因此人为操作越少,对实际环境污染水平及风险的评价就越准确。
基于这些原因,Burton等[25,60]设计了原位的间隙水TIE装置。该装置借鉴了吸气引液法抽取间隙水的原理,采用自制的采水头抽取间隙水。采水头由有机玻璃制成从而减少对有机物质的吸附,内部填有玻璃棉起到过滤作用。间隙水被抽出后流入填有不同吸附材料的吸附柱内。参照EPA中对间隙水TIE的描述,针对氨氮、重金属和非极性有机物3种主要致毒物质选择了特异性的吸附材料:采用沸石吸附氨氮,以亚氨基二乙酸为官能团的螯合树脂(Chelex 100)吸附重金属,采用大孔树脂(Ambersorb 563)吸附有机物。经过选择性吸附的间隙水进入生物暴露部分,选用大型溞作为测试生物,并在暴露室中插入一根透气的硅胶管用于充氧。暴露室顶部接有泵管,由蠕动泵提供动力持续将间隙水抽出并使其依次流经吸附材料和暴露室。
运用此装置对含有氨、镉、荧蒽的加标水样和泥样的预实验结果表明,3种吸附材料可以选择性地吸附目标物,沸石和螯合树脂对氨和镉的吸附稍有重叠。随后应用到已知有PAHs和PCBs污染的3条河流中,进过24 h的毒性暴露,原位TIE结果表明间隙水中的主要致毒物质为非极性有机物,而实验室TIE中有2条河流样品并未观察到明显毒性。说明原位的间隙水TIE方法大大减少了实验操作从而能够减少致毒物质的损失,比实验室TIE方法更灵敏且更能反映实际环境的污染状况。
对于间隙水TIE,原位试验方法可以减小间隙水采集及处理过程中的工作量,且采集间隙水对沉积物破坏小,能更真实地反映沉积物中自由水的毒性状况。同时,原位间隙水TIE中使用的吸附材料还可以在实验室洗脱,用于后续的致毒物鉴别和确认等。但由于环境复杂,仍存在着较多不可控因素,如温度、光照强度、溶解氧、微生物活性等,这些因素可能会影响试验生物对污染物的响应或直接对试验生物产生抑制[61],从而干扰原位TIE的毒性结果。若原位毒性试验采用大型溞为受试生物,则要求暴露水体中一定的溶解氧含量,但自然状态下的间隙水多为还原态,曝气过程也会改变间隙水的氧化还原电位,并改变部分化合物的形态和毒性。此外,原位间隙水TIE还存在对试验设备要求高,毒性结果重复性差,精确度差等问题。因此作为实验室TIE的补充,原位TIE尚不能完全替代实验室TIE且有待进一步发展。
5 间隙水毒物鉴别的当量计算
毒物鉴别过程中,毒性结果的量化对于评估化合物的毒性贡献和环境样品可能的生态风险都十分重要。过去对毒性的描述多采用EC50(半数效应浓度)等来表示,此方法计算简单,但不能将环境样品和化合物的毒性结果有效的结合。所以近年来许多毒性评价方法被提出和发展起来,比较常见的有毒性单位法(Toxic Unit,TU)和毒性当量法(Toxic E-quivalent Quantity,TEQ)。
毒性单位法主要适用于评价以发光细菌、藻类、多毛类和甲壳类等个体生物为受试生物的急性毒性试验结果[62],环境样品毒性单位(TUs)的计算公式如下。

公式中IC50(或EC50)为受测生物半数出现毒性效应(死亡,发光抑制或生长抑制等)时,环境样品的稀释倍数或浓缩倍数。
环境样品中化合物的毒性单位的计算公式如下。

公式中IC50(或EC50)为受测生物半数出现毒性效应(死亡,发光抑制或生长抑制等)时待测化合物的浓度。
环境样品的TU值越大,说明环境样品的危害就越大,环境中检测到的化合物的TU值越大,则该环境样品中此化合物的毒性贡献越大。
毒性当量法是EDA中应用广泛的毒性评价方法之一,最初被应用于类二噁英物质的毒性评价中。计算毒性当量时,引入了相对影响因子(Relative Potency,REP)的概念,即在评价毒性时,需选定公认的效应最强的化合物作为标准物质。如在评价类二噁英毒性时,一般采用2,3,7,8-四氯代二苯-并-对二噁英(2,3,7,8-TCDD)作为标准物质[63],评价雌激素活性时一般采用17β-雌二醇(E2)[64],评价雄激素活性时一般采用双氢睾酮(DHT)[65]。化合物的相对影响因子计算公式如下:

环境中检测到的所有化合物的总相对影响因子计算公式如下:

评估环境样品毒性大小时,则需要计算环境样品的毒性当量(TEQ),计算方法如下:
一般通过比较环境样品的TEQ和化合物的REP来评估环境样品中主要毒性贡献物:TEQ等于∑REP时,说明所测化合物恰好完全解释毒性的来源,是毒性的主要贡献者;当TEQ大于∑REP时,说明所检测到的化合物不能完全解释毒性的来源,还有未检测到的化合物对环境样品的毒性有贡献或者检测到的化合物之间存在协同作用;当TEQ小于∑REP时,说明测得的各化合物之间可能存在拮抗作用。
毒性单位法和毒性当量法简单易懂,实用性强,已被许多国家和单位应用在废水、沉积物、活性污泥等的毒性评价与管理中[66]。同时,该方法也是致毒物鉴别研究中的常用方法,Phillips等[67]在加利福尼亚海湾沉积物及间隙水的TIE研究中,采用毒性单位法确定了有机物为主要的致毒物类。Shi等[68]学者采用毒性当量法鉴别出江苏地区饮用水中甲状腺激素效应的主要贡献物为邻苯二甲酸二丁酯。
采用毒性单位法和毒性当量法有3个基本假设:(1)采用的毒性终点的剂量-效应曲线应为单调函数;(2)各毒性贡献物对被试生物有着相似的作用方式(mode of action,MOA),毒性作用可直接相加;(3)各化合物与样品的剂量-效应曲线都是平行的,从而选取任意效应水平的点计算,其最终毒性贡献比例不变[71]。这些条件大大缩小了毒性当量与毒性单位计算的应用范围,在大部分情况下,3个假设很难同时满足,所以采用毒性单位法或毒性当量法可能会给实验结论带来较大的误差。一般情况下剂量-效应曲线为单调的S型曲线,但酶活测试中可能会出现倒U形曲线,如虹鳟鱼肝细胞中的EROD (ethoxyresorufin-O-deethylase)酶,卤代芳烃的低浓度暴露时会诱导EROD酶,高浓度时则引起细胞毒性抑制酶的产生,从而酶活性受2种因素控制,无法用于毒性贡献计算[72]。Walter等[71]挑选了11种结构差异较大拥有不同MOA的优先控制污染物用于绿藻急性毒性试验,基于不同的毒性水平计算,发现单纯将各化合物TU加和会导致毒性高估1.6~5.0倍。Grote等[72]曾对瑞典西海岸的沉积物进行EDA分析,鉴定出了造成绿藻毒性的芳香类物质,随后基于沉积物提取液及各化学品的剂量-效应曲线,比较了不同效应水平上提取液TU与各化学品TU加和的比值,记为确认质量指数(index of confirmation quality,ICQ),最终发现基于EC90比基于EC20所计算的ICQ高10倍,效应水平的选择对于毒性贡献的计算影响巨大。基于此,Villeneuve等[73]提出了采用REP20-80的描述方式,即在分析毒性结果时,同时考虑到EC20、EC50、EC80三个效应水平的点,以减小各化合物与样品间剂量-效应曲线斜率不一致所带来的误差。虽然REP20-80的描述方法较单效应点的表征方法更为全面,但较适用于样品间的比较,在计算毒性当量的贡献时则描述过于笼统。Shi等学者[74]利用蒙特卡罗模型,拟合了邻苯二甲酸酯类物质的抗甲状腺激素活性当量的REP的概率密度分布曲线,发现最大概率的效应区间为7%~25%而非50%,并基于化合物的最大概率效应水平计算了各自的REP。相对于根据EC50效应计算造成毒性效应的低估,该方法更能准确反映实际毒性贡献情况。尽管已进行了初步尝试,如何更加准确全面地量化和比较毒性数据结果,仍需要不断的发展与完善。
6 展望
间隙水TIE与EDA分析方法是间隙水中关键致毒物鉴别的强有力工具,已在一些污染区域的致毒物鉴别和风险评估的应用中发挥了重要作用。但间隙水中致毒物的鉴别方法仍需要一些发展与完善:(1)间隙水TIE虽然能够鉴定出造成毒性的具体污染物种类,但是以间隙水为试验相会忽略其他的暴露途径(摄食过程、直接接触固相沉积物等),从而容易高估无机物的毒性并低估难溶于水的持久性有机物的毒性,使其仍然不能完全表征沉积物的潜在风险。所以为了全面地表征沉积物毒性与风险,应同时对间隙水和沉积物的致毒物质进行鉴别,并相互对比印证得出结论。(2)将传统TIE与基于有机污染物精细分离鉴别的EDA结合起来的基本条件是毒性终点一致,而EDA中分离技术复杂,这将直接导致鉴别过程往往需要大量间隙水以达到毒性测试要求。所以我们一方面需要开发用于大量采集间隙水的方法,另一方面应该引入更为灵敏的生物效应终点,以便间隙水致毒物鉴别更广泛的应用。(3)目前,按照氨氮、重金属和有机污染物分类的致毒因子鉴别方法相对比较成熟,但是这种分类方法将大量性质完全不同的有机污染物归为一类是不科学的,而有机致毒物鉴别方面仍然存在诸多问题(成分复杂、基质干扰高、同分异构体广泛存在、数据库资源不足、理论基础匮乏等)。所以在未来的研究中应进一步发展有机物的精细分离技术和质谱识别技术,建立一套科学完整的鉴别流程。(4)由于运输、保存和微生物活动等问题,实验室中鉴别出的致毒物质能否外推到实际环境中仍有待进一步验证。这就需要我们扩大和推广原位毒性试验技术,积累丰富的实验案例,在更高层次上归纳和理解原位与异位试验的异同。
间隙水毒性测试和致毒因子鉴别是沉积物生态环境风险评价的关键基础,对保证水体生态环境安全具有重要意义。随着我国经济快速发展,沉积物正在遭受着各类化学品的严重污染,但目前我国尚未提出间隙水相关的国家标准,而沉积物标准仅包括针对底栖生物的毒性测试和少数污染物质的检测方法,这将导致对沉积物体系的潜在风险的描述过于片面,且难以指导污染控制和修复实践。所以制定符合我国实际情况的间隙水提取方法标准及间隙水致毒物质鉴别方法是风险评价领域重要的研究方向。
(References):
[1] Luthy R G,Aiken G R,Brusseau M L,et al.Sequestration of hydrophobic organic contaminants by geosorbents [J].Environmental Science&Technology,1997,31(12): 3341-3347
[2] 王子健,骆坚平,查金苗.水体沉积物毒性鉴别与评价研究进展[J].环境污染与防治,2015(12):57-63
Wang Z J,Luo J P,Zha J M.A review on progress of sediment toxicity identification and evaluation[J].Environmental Pollution and Control,2015(12):57-63(in Chinese)
[3] Connor M S.Fish/sediment concentration ratios for organic compounds[J].Environmental Science&Technology,1984,18(1):31-35
[4] Ankley G T,Mattson V R,Leonard E N,et al.Predicting the acute toxicity of copper in freshwater sediments:Evaluation of the role of acid-volatile sulfide[J].Environmental Toxicology and Chemistry,1993,12(2):315-320
[5] Di Toro D M,Mahony J D,Hansen D J,et al.Toxicity of cadmium in sediments:The role of acid volatile sulfide [J].Environmental Toxicology and Chemistry,1990,9 (12):1487-1502
[6] Adams W J,Kimerle R A,Mosher R G.Aquatic safety assessment of chemicals sorbed to sediments[C]//Aquatic Toxicology and Hazard Assessment:Seventh Symposium. STP,1985,854:429-453
[7] Ball W P,Roberts P V.Long-term sorption of halogenated organic chemicals by aquifer material.2.Intraparticle diffusion[J].Environmental Science&Technology,1991,25 (7):1237-1249
[8] Ankley G T,Katko A,Arthur J W.Identification of ammonia as an important sediment-associated toxicant in the lower fox River and green bay,Wisconsin[J].Environmental Toxicology and Chemistry,1990,9(3):313-322
[9] Whiteman F W,Kahl M D,Rau D M,et al.Evaluation of interstitial water as a route of exposure for ammonia in sediment tests with benthic macroinvertebrates[J].Environmental Toxicology and Chemistry,1996,15(5):794-801
[10] Kinsman-Costello L E,O'Brien J M,Hamilton S K.Natural stressors in uncontaminated sediments of shallow freshwaters:The prevalence of sulfide,ammonia,and reduced iron[J].Environmental Toxicology and Chemistry, 2015,34(3):467-479
[11] Elderfield H,McCaffrey R J,Luedtke N,et al.Chemical diagenesis in Narragansett Bay sediments[J].American Journal of Science,1981,281(8):1021-1055
[12] Picone M,Bergamin M,Volpato E,et al.Sequential toxicity identification evaluation(TIE)for characterizing toxicity of Venice Lagoon sediments:Comparison of two different approaches[J].Ecotoxicology and Environmental Safety,2009,72(2):538-545
[13] Kay D P,Newsted J L,BenKinney M T,et al.Passaic river sediment interstitial water phase I toxicity identification evaluation[J].Chemosphere,2008,70(10):1737-1747
[14] Anderson B S,Phillips B M,Hunt J W,et al.Evidence of pesticide impacts in the Santa Maria River watershed, California,USA[J].Environmental Toxicology and Chemistry,2006,25(4):1160-1170
[15] Schubauer-Berigan M K,Amato J R,Ankley G T,et al. The behavior and identification of toxic metals in complex mixtures:Examples from effluent and sediment pore water toxicity identification evaluations[J].Archives of Environmental Contamination and Toxicology,1993,24(3): 298-306
[16] Carignan R,Rapin F,Tessier A.Sediment porewater sampling for metal analysis:A comparison of techniques[J].Geochimica et Cosmochimica Acta,1985,49(11):2493-2497
[17] Ankley G T,Schubauer-Berigan M K.Comparison of techniques for the isolation of sediment pore water for toxicity testing[J].Archives of Environmental Contamination and Toxicology,1994,27(4):507-512
[18] Bender M,Martin W,Hess J,et al.A whole-core squeezer for interfacial pore-water sampling[J].Limnology and O-ceanography,1987,32(6):1214-1225
[19] Niewöhner C,Hensen C,Kasten S,et al.Deep sulfate reduction completely mediated by anaerobic methane oxidation in sediments of the upwelling area off Namibia[J]. Geochimica et Cosmochimica Acta,1998,62(3):455-464
[20] Carr R S,Chapman D C.Comparison of methods for conducting marine and estuarine sediment porewater toxicity tests—Extraction,storage,and handling techniques [J].Archives of Environmental Contamination and Toxicology,1995,28(1):69-77
[21] Hensen C,Zabel M,Pfeifer K,et al.Control of sulfate pore-water profiles by sedimentary events and the significance of anaerobic oxidation of methane for the burial of sulfur in marine sediments[J].Geochimica et Cosmochimica Acta,2003,67(14):2631-2647
[22] von der Wiesche M,Wetzel A.Temporal and spatial dynamics of nitrite accumulation in the River Lahn[J].Water Research,1998,32(5):1653-1661
[23] Seeberg-Elverfeldt J,Schlüter M,Feseker T,et al.Rhizon sampling of porewaters near the sediment-water interface of aquatic systems[J].Limnology and Oceanography: Methods,2005,3(8):361-371
[24] Sacchi E,Michelot J L,Pitsch H,et al.Extraction of water and solutes from argillaceous rocks for geochemical characterisation:Methods,processes and current understanding[J].Hydrogeology Journal,2001,9(1):17-33
[25] Burton G A,Nordstrom J F.An in situ toxicity identification evaluation method part I:Laboratory validation[J]. Environmental Toxicology and Chemistry,2004,23(12): 2844-2850
[26] Hesslein R H.An in situ sampler for close interval pore water studies[J].Limnology and Oceanography,1976,21 (6):912-914
[27] 刘素美,张经.沉积物间隙水的几种制备方法[J].海洋环境科学,1999,18(2):66-71 Liu S M,Zhang J.Sediment pore water sampling techniques[J].Marine Environmental Science,1999,18(2): 66-71(in Chinese)
[28] Serbst J R,Burgess R M,Kuhn A,et al.Precision of dialysis(peeper)sampling of cadmium in marine sediment interstitial water[J].Archives of Environmental Contamination and Toxicology,2003,45(3):297-305
[29] Johnston S G,Burton E D,Keene A F,et al.Pore water sampling in acid sulfate soils:A new peeper method[J]. Journal of Environmental Quality,2009,38(6):2474-2477
[30] Lewandowski J,Laskov C,Hupfer M.The relationship betweenChironomus plumosusburrows and the spatial distribution of pore-water phosphate,iron and ammonium in lake sediments[J].Freshwater Biology,2007,52(2): 331-343
[31] Angelidis T N.Comparison of sediment pore water sampling for specific parameters using two techniques[J]. Water,Air,and Soil Pollution,1997,99(1-4):179-185
[32] Winger P V,Lasier P J,Jackson B P.The influence of extraction procedure on ion concentrations in sediment pore water[J].Archives of Environmental Contamination and Toxicology,1998,35(1):8-13
[33] Otero M,Mendonça A,Válega M,et al.Fluorescenc e and DOC contents of estuarine pore waters from colonized and non-colonized sediments:Effects of sampling preservation[J].Chemosphere,2007,67(2):211-220
[34] 邓东阳,于红霞,张效伟,等.基于毒性效应的非目标化学品鉴别技术进展[J].生态毒理学报,2015,10(2): 13-25 Deng D Y,Yu H X,Zhang X W,et al.Development and application of nontargeted analysis in effect directed analysis[J].Asian Journal of Ecotoxicology,2015,10(2):13-25(in Chinese)
[35] Ho K T,Burgess R M,Mount D R,et al.Sediment toxicity identification evaluation(TIE):Phases I,II,and III guidance document[R].Washington DC:EPA,2007
[36] Burgess R M,Konovets I M,Kipnis L S,et al.Distribution,magnitude and characterization of the toxicity of U-krainian estuarine sediments[J].Marine Pollution Bulletin,2011,62(11):2442-2462
[37] Ankley G T.Sediment Toxicity Identification Evaluation: Phase I(Characterization),Phase II(Identification)and Phase III(Confirmation)Modifications of Effluent Procedures[M].Duluth,MN:US Environmental Protection A-gency,1991
[38] Wenholz M,Crunkilton R.Use of toxicity identification evaluation procedures in the assessment of sediment pore water toxicity from an urban stormwater retention pond in Madison,Wisconsin[J].Bulletin of Environmental Contamination and Toxicology,1995,54(5):676-682
[39] Gupta G,Karuppiah M.Toxicity identification of Pocomoke River porewater[J].Chemosphere,1996,33(5): 939-960
[40] Karuppiah M,Gupta G.Impact of point and nonpoint source pollution on pore waters of two Chesapeake Bay tributaries[J].Ecotoxicology and Environmental Safety, 1996,35(1):81-85
[41] Carr R S,Nipper M,Biedenbach J M,et al.Sediment toxicity identification evaluation(TIE)studies at marine sites suspected of ordnance contamination[J].Archives of Environmental Contamination and Toxicology,2001,41(3): 298-307
[42] Stronkhorst J,Schot M E,Dubbeldam M C,et al.A toxicity identification evaluation of silty marine harbor sediments to characterize persistent and non-persistent constituents[J].Marine Pollution Bulletin,2003,46(1):56-64
[43] Kwok Y C,Hsieh D P H,Wong P K.Toxicity identification evaluation(TIE)of pore water of contaminated marine sediments collected from Hong Kong waters[J].Marine Pollution Bulletin,2005,51(8):1085-1091
[44] Araújo R,Botta-Paschoal C M R,Silvério P F,et al.Application of toxicity identification evaluation to sediment in a highly contaminated water reservoir in southeastern Brazil[J].Environmental Toxicology and Chemistry, 2006,25(2):581-588
[45] Phillips B M,Anderson B S,Voorhees J P,et al.The contribution of pyrethroid pesticides to sediment toxicity in four urban creeks in California,USA[J].Journal of Pesticide Science,2010,35(3):302-309
[46] Ho K T,Burgess R M.What's causing toxicity in sediments?Results of 20 years of toxicity identification and evaluations[J].Environmental Toxicology and Chemistry, 2013,32(11):2424-2432
[47] Brack W,Kind T,Hollert H,et al.Sequential fractionation procedure for the identification of potentially cytochrome P4501A-inducing compounds[J].Journal of Chromatography A,2003,986(1):55-66
[48] 曲广波,史建波,江桂斌.效应引导的污染物分析与识别方法[J].化学进展,2011,23(11):2389-2398 Qu G B,Shi J B,Jiang G B.Development and application of effect-directed analysis in environment research[J]. Progress in Chemistry,2011,23(11):2389-2398(in chinese)
[49] Burgess R M,Ho K T,Brack W,et al.Effects-directed analysis(EDA)and toxicity identification evaluation(TIE): Complementary but different approaches for diagnosing causes of environmental toxicity[J].Environmental Toxicology and Chemistry,2013,32(9):1935-1945
[50] Kosian P A,Makynen E A,Monson P D,et al.Application of toxicity-based fractionation techniques and structure-activity relationship models for the identification of phototoxic polycyclic aromatic hydrocarbons in sediment pore water[J].Environmental Toxicology and Chemistry, 1998,17(6):1021-1033
[51] Fang M L,Getzinger G J,Cooper E M,et al.Effect-directed analysis of Elizabeth River porewater:Developmental toxicity in zebrafish(Danio rerio)[J].Environmental Toxicology and Chemistry,2014,33(12):2767-2774
[52] Liste H H,Alexander M.Butanol extraction to predict bioavailability of PAHs in soil[J].Chemosphere,2002,46 (7):1011-1017
[53] Hawthorne S B,Lanno R,Kreitinger J P.Reduction in acute toxicity of soils to terrestrial oligochaetes following the removal of bioavailable polycyclic aromatic hydrocarbons with mild supercritical carbon dioxide extraction[J]. Environmental Toxicology and Chemistry,2005,24(8): 1893-1895
[54] Brack W.Effect-directed Analysis of Complex Environmental Contamination[M].Springer Science&Business Media,2011
[55] Puglisi E,Murk A J,Van den Berg H J,et al.Extraction and bioanalysis of the ecotoxicologically relevant fraction of contaminants in sediments[J].Environmental Toxicology and Chemistry,2007,26(10):2122-2128
[56] Cornelissen G,Rigterink H,Hulscher D E M T,et al.A simple Tenax®extraction method to determine the availability of sediment-sorbed organic compounds[J].Environmental Toxicology and Chemistry,2001,20(4):706-711
[57] Heinis L J,Highland T L,Mount D R.Method for testing the aquatic toxicity of sediment extracts for use in identifying organic toxicants in sediments[J].Environmental Science&Technology,2004,38(23):6256-6262
[58] Bandow N,Altenburger R,Streck G,et al.Effect-directed analysis of contaminated sediments with partition-based dosing using green algae cell multiplication inhibition[J]. Environmental Science&Technology,2009,43(19): 7343-7349
[59] Smith K E C,Oostingh G J,Mayer P.Passive dosing for producing defined and constant exposure of hydrophobic organic compounds during in vitro toxicity tests[J]. Chemical Research in Toxicology,2009,23(1):55-65
[60] Burton G A,Nordstrom J F.An in situ toxicity identification evaluation method part II:Field validation[J].Environmental Toxicology and Chemistry,2004,23(12):2851-2855
[61] Crane M,Burton G A,Culp J M,et al.Review of aquatic in situ approaches for stressor and effect diagnosis[J].In-tegrated Environmental Assessment and Management, 2007,3(2):234-245
[62] US EPA.Technical support document for water qualitybased toxics control.EPA/505/2-90-001.[R].Washington DC:US EPA,1991
[63] Safe S.Polychlorinated biphenyls(PCBs),dibenzo-pdioxins(PCDDs),dibenzofurans(PCDFs),and related compounds:Environmental and mechanistic considerations which support the development of toxic equivalency factors(TEFs)[J].CRC Critical Reviews in Toxicology, 1990,21(1):51-88
[64] Zacharewski T R,Berhane K,Gillesby B E,et al.Detection of estrogen-and dioxin-like activity in pulp and paper mill black liquor and effluent using in vitro recombinant receptor/reporter gene assays[J].Environmental Science &Technology,1995,29(8):2140-2146
[65] Weiss J M,Hamers T,Thomas K V,et al.Masking effect of anti-androgens on androgenic activity in European river sediment unveiled by effect-directed analysis[J].Analytical and Bioanalytical Chemistry,2009,394(5):1385-1397
[66] Mount D I,Anderson-Carnahan L.Methods for aquatic toxicity-identification evaluations.Phase 1 toxicity characterization procedures[R].Duluth,MN:Environmental Protection Agency(USA),Environmental Research Lab, 1988
[67] Phillips B M,Anderson B S,Hunt J W,et al.Causes of sediment toxicity toMytilus galloprovincialisin San Francisco Bay,California[J].Archives of Environmental Contamination and Toxicology,2003,45(4):492-497
[68] Shi W,Hu X,Zhang F,et al.Occurrence of thyroid hormone activities in drinking water from eastern China: Contributions of phthalate esters[J].Environmental Science&Technology,2012,46(3):1811-1818
[69] Brack W,Schmitt-Jansen M,Machala M,et al.How to confirm identified toxicants in effect-directed analysis[J]. Analytical and Bioanalytical Chemistry,2008,390(8): 1959-1973
[70] Brack W,Schirmer K,Kind T,et al.Effect-directed fractionation and identification of cytochrome P4501A-inducing halogenated aromatic hydrocarbons in a contaminated sediment[J].Environmental Toxicology and Chemistry,2002,21(12):2654-2662
[71] Walter H,Consolaro F,Gramatica P,et al.Mixture toxicity of priority pollutants at no observed effect concentrations(NOECs)[J].Ecotoxicology,2002,11(5):299-310
[72] Grote M,Brack W,Walter H A,et al.Confirmation of cause-effect relationships using effect-directed analysis for complex environmental samples[J].Environmental Toxicology and Chemistry,2005,24(6):1420-1427
[73] Villeneuve D L,Blankenship A L,Giesy J P.Derivation and application of relative potency estimates based on in vitro bioassay results[J].Environmental Toxicology and Chemistry,2000,19(11):2835-2843
[74] Shi W,Wei S,Hu X,et al.Identification of thyroid receptor ant/agonists in water sources using mass balance analysis and Monte Carlo Simulation[J].Plos One,2013,8 (10):e73883◆
Development of Identification of Key Toxicants in the Pore Water
Wang Yuting,Yu Hongxia,Zhang Xiaowei,Shi Wei*
State Key Laboratory of Pollution Control and Resource Reuse,School of the Environment,Nanjing University,Nanjing 210023,China
6 December 2015 accepted 21 January 2016
Sediments act both as a sink and as a long-term source of toxicants,and are associated with potential ecological and human health risks closely.However,the pore water acts as a bridge for toxicants from sediment to biota,and only the freely dissolved molecules and rapidly desorbing molecules from sediments are bioavailable, Therefore,the identification of key toxicants in the pore water is necessary to risk assessment and comprehensive treatment of the pore water and sediment.Toxicity Identification Evaluation(TIE)and Effect Directed Analysis (EDA)have been successfully applied in toxicants screening and identification.In this paper,the extraction methods for the pore water were reviewed and compared.Application and development of TIE and EDA in identification of toxicants in the pore water are summarized,and the toxicity quantification methods with their restrictions were also proposed.On the basis of current studies,limitations and prospect of toxicants identification in the porewater were discussed,the loss of toxicity in ex situ bioassays and the challenge in identification of organic toxicants were also highlighted.
interstitial water;key toxicants;TIE;EDA;in situ
2015-12-06 录用日期:2016-01-21
1673-5897(2016)3-011-15
X171.5
A
10.7524/AJE.1673-5897.20151206001
简介:史薇(1984—),女,环境科学博士,副教授,主要研究方向为复合污染介质中有机毒物分级鉴别与风险评估,发表学术论文20余篇。
国家自然科学基金(21577058;21307054);江苏省自然科学基金青年项目(BK20130551);国家高技术研究发展计划(863计划) (2013AA06A309);国家环保部公益性行业科研专项(201409040);国家水体污染控制与治理重大专项专题研究(2012ZX07101-003);国家自然科学基金国际合作交流项目(21411120337)
王玉婷(1991-),女,硕士研究生,研究方向为有机污染化学分析,E-mail:yutingwang_nju@163.com
*通讯作者(Corresponding author),E-mail:njushiwei@nju.edu.cn
